CAPÍTULO IV
PATOLOGÍA DE LA CÓRNEA. EDEMA CORNEAL
B. Pazos González, M.T. Rodríguez Ares, M. Sánchez Salorio
I. ALTERACIONES DE LA TRANSPARENCIA Y DEL ESPESOR DE LA CÓRNEA.
EDEMA CORNEAL
- I.1. Semiología bioultrasónica de las alteraciones de la transparencia y del espesor de la córnea. Edema corneal.
- I.2. Paquimetría Bioultrasónica.
II. PATOLOGÍA RELACIONADA CON EL EDEMA CORNEAL. SEMIOLOGÍA ULTRASÓNICA
- II.1. Distrofias corneales. Córnea guttata. Distrofia de Fuchs.
- II.2. Edema postquirúrgico. Cirugía de la catarata.
- II.3. Queratoplastia. Rechazo del injerto.
- III. Degeneraciones ectásicas de la córnea. Degeneración pelúcida. Queratocono
La patología corneal puede explorarse generalmente de modo preciso mediante la biomicroscopia óptica. La BMU, sin embargo, nos aporta una información diferente a la obtenida mediante la observación directa. Esta información es de interés fundamentalmente cuando existen alteraciones en la transparencia de la córnea.
I. Alteraciones de la transparencia y del espesor de la
córnea.
Edema corneal
La transparencia y el espesor normales de la córnea son el resultado del compromiso que se establece entre la capacidad de atraer agua (presión de imbibición) propia de los proteoglicanos contenidos en el estroma y la resistencia que oponen a la entrada de fluido el epitelio y el endotelio. El epitelio funciona como una barrera gracias a la íntima unión que se establece entre sus células basales y el endotelio actúa además como una bomba que extrae agua del estroma hacia la cámara anterior. Cualquier alteración en las barreras es seguida automáticamente de un aumento de fluido en el estroma constituyéndose así el edema corneal, incluso con las barreras intactas puede aparecer un edema corneal cuando se produce un aumento brusco e importante de la presión intraocular1.
Desde el punto de vista de su etiopatogenia el edema corneal puede clasificarse del modo siguiente:
1) Edema corneal producido por defecto endotelial primario (distrofia de Fuchs, distrofia endotelial hereditaria congénita, distrofia polimorfa posterior). El edema aparece desde el principio en el estroma, progresa y es irreversible.
2) Edema corneal producido por defecto endotelial secundario a patologías diversas (inflamación, trauma, cirugía, hipoxia). Aparece desde el principio en el estroma, puede ser focal o difuso, agudo o crónico y ser reversible cuando la causa desaparece antes de haber causado daño irreparable. Cuando el edema del estroma se hace crónico puede afectar al epitelio dando lugar a la queratopatía bullosa.
3) Edema corneal con endotelio normal producido por aumento de la presión intraocular. El edema aparece de forma aguda afectando al epitelio en el que origina microquistes.
4) Edema corneal por alteración epitelial (erosiones, traumatismos). El edema aparece en las capas anteriores del estroma de forma aguda, localizado en la proximidad de la lesión epitelial.
En este capítulo estudiaremos la aportación de la BMU a la clínica del edema corneal y al conocimiento de las distintas causas que pueden producirlo.
I.1. Semiología bioultrasónica de las alteraciones de la transparencia y del
espesor
de la córnea. Edema corneal
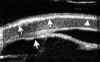
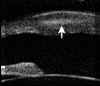
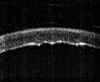
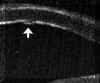
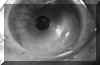
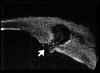
La exploración cuidadosa con BMU permite diferenciar cuatro capas corneales tal como se muestra en la FIG 4.1: Dos líneas altamente ecogénicas que corresponden al epitelio y a la membrana de Bowman, la zona estromal de baja ecogenicidad y una línea de eco brillante debido a la interfase membrana de Descemet-endotelio con el Humor Acuoso. Esta imagen es la referencia que debemos retener para interpretar las alteraciones que se producen en los diferentes procesos patológicos que afectan a la córnea.
FIGURA 4.1: Imagen de BMU de una córnea normal. Dos líneas altamente ecogénicas que corresponden al epitelio y a la capa de Bowman, la zona estromal de baja ecogenicidad y una línea de eco brillante debido a la interfase membrana de Descemet-endotelio con el Humor acuoso. (I.N.G.O.)
Los cambios secundarios al edema se reflejan en la imagen bioultrasónica de la córnea2.
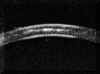
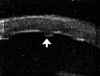
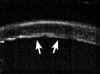
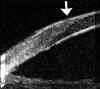
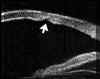
A nivel epitelial, en los estadios más incipientes la línea altamente ecogénica del epitelio, normalmente fina y uniforme, se engruesa y se hace irregular. Puede también verse un aumento del espacio entre los ecos del epitelio y de la Bowman (FIG 4.2). En un estado mas avanzado se pueden detectar microquistes e incluso bullas, como una separación localizada de la línea hiperecogénica epitelial de la que corresponde a la membrana de Bowman (FIGS 4.3 y 4.4). Cuando se resuelve el proceso, tras casos severos, es posible observar una zona de engrosamiento hiperecogénico correspondiente al pannus fibrovascular subepitelial (FIG 4.5).
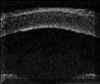
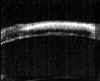
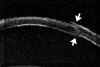
FIGURA 4.2: Edema corneal incipiente. Línea ecogénica del epitelio engrosada e irregular. Aumento del espacio entre el eco del epitelio y el eco de la membrana de Bowman. Discreto aumento de reflectividad estromal. (I.N.G.O.) FIGURA 4.3: Microbulla epitelial (flecha). Separación puntual de la línea hiperecogénica del epitelio del eco de la membrana de Bowman. Engrosamiento de la línea ecogénica posterior (endotelio-m. de Descemet). (I.N.G.O.) FIGURA 4.4: Bulla epitelial (flecha). (I.N.G.O.) FIGURA 4.5: Irregularidad de línea epitelial y banda hiperreflectiva subepitelial debida a pannus fibrovascular (flechas superiores). Córnea engrosada. Iris atrófico sinequiado a cara posterior de córnea (flecha inferior). (I.N.G.O.)A nivel estromal, en estados muy incipientes se evidencia un ligero engrosamiento, incluso con córnea clara, difícil de percibir en la exploración con lámpara de hendidura (FIG 4.2). A medida que se agrava el edema se hace más patente el engrosamiento estromal (a veces incluso más del doble del espesor normal) y se produce un incremento homogéneo de su ecogenicidad (FIGS 4.6 y 4.7). Este cambio en la reflectividad es secundario al acúmulo de fluido entre las lamelas del estroma. Tras la resolución de los procesos graves de edema corneal se produce un leucoma estromal el cual se refleja ultrasonográficamente en una aumento importante de la reflectividad de la córnea, localizado o generalizado, dependiendo del tipo de edema previo (FIGS 4.8, 4.9 y 4.10). En ocasiones, se produce incluso una degeneración lipídica o calcárea de la córnea. Esta última se caracteriza por su elevada reflectividad y por una sombra ecogénica posterior (FIG 4.11).
FIGURA 4.6: Edema estromal. Aumento del espesor y de la reflectividad estromal. Irregularidad y engrosamiento de líneas ecogénicas epiteliales y endotelio-Descemet. (I.N.G.O.) FIGURA 4.7: Edema estromal. El grosor del estroma es más del doble de lo normal. Importante aumento de su reflectividad. LIO en cámara anterior. (I.N.G.O.) FIGURA 4.8: Pequeño leucoma estromal (línea hiperreflectiva). El epitelio está localmente alterado a ese nivel (irregularidad en su línea ecogénica). (I.N.G.O.) FIGURA 4.9: Edema corneal. Aumento del espesor estromal. En la zona media comienza a formarse un área leucomatosa (flecha). (I.N.G.O.) FIGURA 4.10: Leucoma lineal en la zona media del estroma (banda hiperreflectiva). (I.N.G.O.) FIGURAS 4.11a y 11b: Degeneración calcárea de la córnea: Banda altamente reflectiva en la mitad anterior del estroma y sombra ecogénica posterior. (I.N.G.O.)A nivel del endotelio y de la membrana de Descemet se pueden observar algunas veces las alteraciones secundarias a los procesos desencadenantes del edema. En la exploración mediante lámpara de hendidura el hallazgo más frecuente es la presencia de unas pequeñas elevaciones en la membrana de Descemet que indican la existencia de una córnea guttata. Desde el punto de vista de la exploración ultrasónica estos depósitos se visualizan como pequeñas irregularidades a nivel del eco endotelial. Los precipitados en el endotelio sugieren una causa inflamatoria del edema y también pueden ser visualizados (FIG 4.12). En estados más avanzados del edema corneal es posible detectar la presencia de un engrosamiento de la línea correspondiente al plano endotelio-Descemet (FIGS 4.4, 4.6 y 4.7), de irregularidades (FIG. 4.13), y de la existencia de pliegues que se aprecian como una pérdida en la continuidad y un abombamiento puntual de la línea hiperecogénica posterior corneal (endotelio-Descemet) (FIG 4.14). En ocasiones se puede ver la separación de esta línea del estroma adyacente (FIG 4.15). En edemas importantes se pierde la línea ecogénica del endotelio y se advierte un abombamiento posterior de la superficie corneal posterior (FIG 4.16).
FIGURA 4.12: Edema corneal secundario a uveitis. Engrosamiento y aumento de reflectividad estromal. Irregularidad de la línea ecogénica del endotelio con puntos localizados de hiperreflectividad que se corresponden con depósitos endoteliales. (I.N.G.O.) FIGURA 4.13: Edema corneal moderado. Borrosidad de la línea ecogénica del epitelio. Engrosamiento discreto del estroma. Engrosamiento e irregularidad de línea ecogénica corneal posterior (endotelio - Descemet). (I.N.G.O.) FIGURA 4.14: Edema corneal secundario a uveítis. Engrosamiento estromal y pliegues endoteliales que se visualizan como abombamientos puntuales (flecha) de la línea hiperecogénica posterior de la córnea. (I.N.G.O.) FIGURA 4.15: Edema corneal. Engrosamiento moderado del estroma. La línea ecogénica posterior (endotelio-Descemet) está separada del estroma adyacente (flechas). (I.N.G.O.) FIGURA 4.16: Edema corneal severo. Irregularidad de la línea ecogénica anterior (epitelio). Engrosamiento y aumento de reflectividad estromal. Abombamiento de la superficie corneal posterior con pérdida de la línea ecogénica posterior (endotelio - Descemet) a ese nivel. (I.N.G.O.)
I.2. Paquimetría Bioultrasónica
El engrosamiento corneal está linealmente relacionado con la alteración de la función del endotelio y con el contenido de agua de la córnea y por tanto la paquimetría cuantifica exactamente el grado de hidratación de la córnea y nos puede dar información sobre el estado del endotelio incluso cuando el estroma está transparente. Cuando el espesor corneal es mayor de 0,62 mm hay que sospechar un edema subclínico (FIG 4.2). Mediante BMU se puede medir con exactitud el grosor corneal incluso en los casos en los que la estimación mediante lámpara de hendidura o el cálculo de estos valores con paquimetría es difícil (FIG 4.17). La mayoría de los paquímetros ultrasónicos trabajan con frecuencias de 20 MHz y consiguen una resolución de ±95µm. La BMU, al emplear frecuencias más altas y tener más resolución permite en principio medir con mayor precisión el espesor corneal en la localización deseada, y tomar medidas de la diferentes capas de la córnea. La BMU tiene la ventaja adicional de ser aplicable incluso en los casos en los que la paquimetría ultrasónica convencional es irrealizable por la irregularidad de la córnea y permite calcular el grosor corneal utilizando una lente de contacto terapéutica3,4.
FIGURA 4.17: Edema corneal moderado (estroma engrosado) y zona de adelgazamiento corneal importante. La BMU permite medir exactamente el grosor de la córnea en la zona de máximo adelgazamiento. (I.N.G.O.)
II. PatologÍa relacionada con el edema corneal
Las condiciones clínicas que producen edema y opacificación corneal son muy diversas. La BMU aporta en muchos casos una interesante información sobre el origen del daño corneal. Entre las causas más comunes de edema corneal se encuentran:
II.1. Distrofias corneales.
Córnea guttata. Distrofia de Fuchs
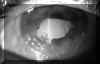
En distrofias endoteliales como la de Fuchs, en los estados incipientes, se detectan alteraciones en la reflectividad y uniformidad del endotelio (guttata) (FIG 4.13). En estados mas avanzados se pueden visualizar bullas subepiteliales o endoteliales (FIGS 4.18 a, b, c). En las distrofias corneales como la granular la BMU puede visualizar los gránulos de material hialino como puntos localizados de hiperreflectividad en el estroma anterior de la córnea5.
FIGURA 4.18a: Aspecto clínico de córnea con distrofia de Fuchs. Ampollas subepiteliales y alteraciones a nivel del endotelio. (I.N.G.O.)FIGURA 4.18b: Edema epitelial (engrosamiento e irregularidad de línea ecogénica anterior y aumento discreto del espacio hipoecogénico entre el eco del epitelio y el de la membrana de Bowman). Bullas subepiteliales (aumento puntual de la separación entre la línea ecogénica del epitelio y el de la membrana de Bowman). Edema estromal moderado e irregularidad y engrosamiento del eco endotelial. (I.N.G.O.)
FIGURA 4.18c: El mismo caso. Bulla endotelial. (I.N.G.O.)
II.2. Edema postquirúrgico. Cirugía de la catarata
Debido al elevado número de este tipo de intervenciones la cirugía de la catarata es una causa frecuente de edema corneal. Este puede expresarse clínicamente en el postoperatorio inmediato cuando se han producido complicaciones intraoperatorias, o hacerlo muy tardíamente en casos no complicados como consecuencia de la pérdida progresiva de células endoteliales que origina por sí misma la cirugía. La BMU ayuda en numerosas ocasiones a determinar la causa del edema.
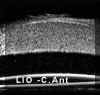
El edema postquirúrgico puede ser consecuencia de factores preoperatorios predisponentes como la existencia de patología endotelial previa (disminución del número de céluas endoteliales, guttata, distrofia de Fuchs, ...), o bien de factores intraoperatorios inherentes a la técnica como el trauma secundario a las soluciones de irrigación, los ultrasonidos o las maniobras de extracción del cristalino o implante de la lente intraocular. En estos casos la BMU nos permite descartar posiciones inadecuadas de la LIO, la existencia de restos de masas, fragmentos de núcleo o presencia de vítreo en cámara anterior no detectadas ópticamente. En las FIGS 4.19a, b se muestra un caso de edema corneal posquirúgico, en el que la BMU permite ver que la posición intrasacular de la lente intraocular es correcta.
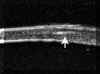
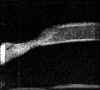
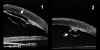
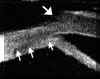
FIGURA 4.19a: Edema corneal posquirúrgico tras EEC e implante de LIO en saco capsular. (I.N.G.O.) FIGURA 4.19b: Edema corneal postquirúrgico. La línea anterior de alta reflectividad se corresponde a una lente de contacto terapéutica utilizada para la exploración. La córnea está engrosada y su línea hiperecogénica posterior (endotelio - Descemet) es irregular. A nivel de la zona de incisión corneal, se observa un pequeño escalón posterior (flecha). La BMU visualiza la correcta posición de la lente intraocular dentro del saco capsular. (I.N.G.O.)En muchas otras ocasiones, el edema es secundario a una cirugía complicada. La información obtenida mediante BMU en estos casos es de gran utilidad6. La BMU visualiza con nitidez la presencia de desprendimientos de la membrana de Descemet frecuentemente ocultos a la exploración con biomicroscopia óptica debido al edema estromal y epitelial que le acompañan. En la imagen bioultrasónica, se observa como la línea hiperecogénica correspondiente al endotelio y la membrana de Descemet se rompe en un punto y se descuelga de la cara posterior de la córnea hacia la cámara anterior (FIGS 4.20, 4.21, 4.22 y 4.23b). Esta técnica también demostró ser una buena herramienta para la monotorización intraoperatoia de la reparación de desprendimientos de gran tamaño (FIGS 4.23a-d) y para controlar su reposicionamiento7,8 (FIGS 4.23e,f).
FIGURA 4.20: Edema corneal postquirúrgico. Corte radial (1). Se observa la LIO tras el iris situada a nivel del surcus. Aumento de la reflectividad y grosor del estroma e irregularidad de la línea ecogénica epitelial anterior secundario al edema. La línea ecogénica posterior de la córnea (endotelio - Descemet) se desprende del estroma (flecha). Corte tangencial (2). Se observa el enrollamiento de la membrana de Descemet desprendida (flecha). (I.N.G.O.) FIGURA 4.21: Edema corneal postquirúrgico. Se observa un pequeño desprendimiento de la membrana de Descemet. La línea hiperecogénica posterior de la córnea se rompe en un punto y se descuelga hacia la cámara anterior. (I.N.G.O.) FIGURA 4.22: Edema corneal postquirúrgico. Exploración realizada con L.C. terapéutica (línea de alta reflectividad anterior a la córnea). Se observa una LIO de cámara anterior. Córnea edematosa. Bajo la zona de máximo edema se localizó un desprendimiento plano de la membrana de Descemet (flecha). (I.N.G.O.) FIGURA 4.23a: Edema corneal postquirúrgico (E.E.C. e implante de LIO). Edema estromal localizado. A ese nivel se intuye una membrana tras la superficie corneal posterior. (I.N.G.O.) FIGURA 4.23b: La imagen de BMU coincide con el aspecto clínico. Corte radial (1): Edema epitelial discreto (borrosidad de línea ecogénica anterior) y estromal (aumento de grosor). Desprendimiento de la membrana de Descemet [Rotura de la línea ecogénica corneal posterior (endoltelio-Descemet) que se descuelga hacia cámara anterior y presenta un pequeño enrrollamiento en su borde]. LIO tras iris situada en surcus. Corte tangencial (2): Se observa la magnitud del desprendimiento de la membrana de Descemet (flecha). (I.N.G.O.)FIGURA 4.23c: Se realizó reposicionamiento quirúrgico de la membrana de Descemet: Manipulación con viscoelástico para desenrollar la membrana, inyección intracamerular de gas para su reposicionamiento y colocación de suturas de Nylon (10-0) para fijar su posición. Se hizo monotorización intraquirúrgica con BMU para controlar el reposicionamiento. En la imagen se observa el desenrrollamiento de la membrana tras inyectar viscoelástico. (I.N.G.O.)
FIGURA 4.23d: Control intraoperatorio. Tras la inyección de gas se comprobó con BMU el reposicionamiento de la membrana en la superficie posterior de la córnea. (I.N.G.O.) FIGURA 4.23e: En el control postoperatorio con BMU (composición de imágenes), se observa la mejoría del edema corneal y se comprueba el reposicionamiento de la membrana. La sutura se ve como un área de hiperreflectividad en cámara anterior en contacto con la superficie corneal posterior (flecha). (I.N.G.O.) FIGURA 4.23f: Tras la intervención mejoró el aspecto clínico de la córnea. (I.N.G.O.)En otras ocasiones, el origen del edema postquirúrgico está en una posición inadecuada de la lente intraocular. En estos casos la BMU localiza con precisión la situación de la lente y nos informa del estado de las estructuras adyacentes (FIGS 4.24, 4.25, 4.26, 4.27 y 4.28).
FIGURA 4.24: LIO en cámara anterior. El háptico superior de la LIO aparece encarcelado en la incisión tunelizada (flechas). Importante edema corneal. (I.N.G.O.) FIGURA 4.25: LIO en cámara anterior. La parte inferior de la incisión tunelizada (E) es desplazada hacia la superficie anterior del iris (I) por el háptico superior de la LIO (flechas blancas). En la esclera se observa la ausencia de tejido formando un escalón similar a la trabeculectomía (fechas negras). (I.N.G.O.) FIGURA 4.26: LIO en cámara anterior. Ruptura de la hialoides anterior. Adherencia de vítreo a la incisión corneal (flecha). (I.N.G.O.) FIGURA 4.27: LIO en cámara anterior. Cápsula cristaliniana adherida a la superficie posterior de la córnea. Edema corneal estromal importante. (I.N.G.O.) FIGURA 4.28: LIO en cámara anterior. El háptico desplaza la raíz y se incarcera en el cuerpo ciliar (flecha blanca). La flecha negra señala la posición del espolón escleral. (I.N.G.O.)La BMU detecta nítidamente la existencia de goniosinequias, de bloqueo pupilar, de restos de masas o de fragmentos de cristalino y la presencia de vítreo en la cámara anterior (FIG 4.29). Estos hallazgos son especialmente importantes cuando la opacidad corneal producida por el edema impide la observación de la cámara anterior.
FIGURA 4.29: Pseudofaquia. Prolapso de vítreo ocupando la cámara anterior contactando con el endotelio corneal. Aunque el vítreo no puede visualizarse por ser ecogénicamente mudo se aprecia su interfase con el humor acuoso (flecha). Edema corneal discreto. (I.N.G.O.)
II.3. Edema postqueratoplastia. Rechazo del injerto corneal
La BMU aporta información adicional acerca de la unión injerto-córnea receptora y sobre los motivos del rechazo. La zona de transición entre el trasplante y la córnea receptora es difícil de explorar con medios ópticos debido a las aberraciones ópticas secundarias a la sutura y a la frecuente opacidad de la córnea receptora y, en ocasiones, del propio transplante. Mediante la BMU este área se detecta por los cambios en la reflectividad entre ambas zonas cuando la córnea receptora está opacificada (FIG 4.30). También se puede identificar por los cambios en el grosor o en la curvatura de la córnea a ese nivel. La BMU permite ver aberraciones e irregularidades en la zona de unión y con frecuencia visualiza sinequias de iris a ese nivel4,9 (FIGS 4.31 y 4.32).
FIGURA 4.30: Aposición correcta entre injerto y córnea (flechas). Superficies regulares y transito progresivo. (I.N.G.O.) FIGURA 4.31: Aposición incorrecta entre el injerto y la córnea (flechas). Edema moderado (la línea ecogénica correspondiente al epitelio aparece irregular y aumentada en su grosor). (I.N.G.O.) FIGURA 4.32: Edema corneal postqueratoplastía. Escalón muy pronunciado en la unión injerto-córnea (flecha superior). Edema importante del injerto. Adherencia del iris a la superficie posterior de la córnea llegando hasta el injerto (flechas inferiores). (I.N.G.O.) FIGURA 4.33a: Degeneración pelúcida de la córnea. Adelgazamiento de la córnea próxima al limbo y abombamiento de la córnea adyacente que conserva el espesor normal (flechas). FIGURA 4.33b: El mismo caso. Después de una resección del tejido adelgazado se regulariza la curvadura del perfil corneal. (I.N.G.O.)Cuando se produce un rechazo corneal y la visualización a través de la córnea es mala o imposible, la BMU es el único método que nos permite analizar el estado de las demás estructuras del segmento anterior.
III. Degeneraciones ectásicas
de la córnea. Degeneración Pelúcida. Queratocono
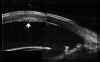
Estas degeneraciones se caracterizan por la ectasia y el adelgazamiento de la córnea. La BMU puede visualizar los cambios en el perfil corneal secundarios a estas patologías así como medir de forma precisa el espesor en cada punto de la córnea. En las FIGS 33a,b se observa el perfil de una córnea con degeneración pelúcida en la que se aprecia el característico adelgazamiento de la córnea próxima al limbo y la protrusión de la zona de espesor normal que está inmediatamente encima del área adelgazada. En el queratocono se produce una deformación cónica con adelgazamiento de la córnea que puede conducir a la rotura de la membrana de Descemet y secundariamente a la aparición de un hidrops corneal. La BMU pone de manifiesto las alteraciones corneales concurrentes en el hidrops (FIGS 4.34a, b) y las modificaciones secundarios al mecanismo de reparación del mismo (FIG 4.34c).
FIGURA 4.34a: Hydrops corneal en un queratocono de un paciente con síndrome de Down. (I.N.G.O.) FIGURA 4.34b: Hidrops corneal. Ruptura de la membrana de Descemet (flecha). Enorme edema del estroma con formación de una gran cavidad quística en su interior. (I.N.G.O.) FIGURA 4.34c: Resolución del hydrops con tratamiento médico. Desaparición del edema quedando como secuela un pequeño leucoma y adelgazamiento estromal, y una ruptura en el plano endotelio-membrana de Descemet (flecha). (I.N.G.O.)
BIBLIOGRAFIA
1. Dohlman Ch. Corneal edema. In Albert DM, Jakobiec FA: Principles and Practice of Ophthalmology. Clinical Practice. Saunder. Philadelphia 1994. 2.ª ed. I: 245-256.
2. Pazos MCB, Suárez A, Santos L, Rodríguez-Ares T, Capeans C, Sánchez-Salorio M. Biomicroscopia Ultrasónica. Un nuevo método para la exploración del segmento anterior del ojo. Studium Ohthalmologicum 1995; 14: 329-337.
3. Reinstein DZ, Silverman RH, Coleman DJ. Epithelial and corneal thickness measurements by high-frecuency ultrasound digital signal processing. Ophthalmology 1994;101: 140-146.
4. Pazos B, Sánchez-Salorio M, Suárez A, Rodríguez- Ares T, Santos L. Biomicroscopia ultrasónica en la planificación quirúrgica de la queratoplastia. Arch Soc Esp Oftalmol 1997; 72: 841-848.
5. Pavlin CJ, Foster FS. Ultrasonics Biomicroscopy of the eye. New York. Springer-Verlag Publising 1995; 163-165.
6. Pazos MCB, Suárez A, Rodríguez-Ares MT, Capeans C, Sánchez Salorio M. Estudio de la queratopatía pseudofáquica: Exploración con Biomicroscopia Ultrasónica. Arch Soc Esp Oftalmol (en prensa).
7. Vastine DW, Weinberg RS, Sugar J, Binder PS. Stripping of Descemet´s membrane associated with intraocular lens implantation. Arch Ophthalmol 1983; 101: 142-145.
8. Morinelli EN, Najac RD, Speaker MG, Tello C, Liebmann JM, Ritch R. Repair of Descement´s membrane detachment with the assistance of intraoperative ultrasound biomicroscopy. Am J Ophthalmol 1996; 121: 718-720.
9. González F, Suárez-Peñaranda JM, Díez-Feijóo E, Pazos B, Sánchez-Salorio M. Histopathological and ultrasound biomicroscopy findings in a case of irreversible mydriasis after keratoplasty in keratoconus. Acta Ophthalmol Scan 1997; 75: 474-476.