
14
DEPÓSITOS EN LAS LENTES DE CONTACTO
14
Jesús Montero Iruzubieta
![]() Introducción
Introducción
![]() Métodos de estudio
Métodos de estudio
![]() Depósitos orgánicos
Depósitos orgánicos
![]() Depósitos inorgánicos
Depósitos inorgánicos
![]() Depósitos mixtos
Depósitos mixtos
![]() Depósitos por contaminantes microbianos
Depósitos por contaminantes microbianos
![]() Depósitos por alteraciones en la fabricación
Depósitos por alteraciones en la fabricación
![]() 1. INTRODUCCION
1. INTRODUCCION
El uso de LC por parte de la población resulta una práctica cada vez mas frecuente y habitual; desde la aparición de las LC blandas, su utilización se ha extendido de una forma progresiva si bien, desde la llegada de las llamadas "lentes desechables" es cuando su porte se ha popularizado de un modo más amplio.
El incremento en el número de portadores de LC blandas, tanto en porte diario como prolongado han provocado, a su vez, la aparición de problemas asociados al incremento de los depósitos sobre la superficie de estas lentes. Estos depósitos son especialmente frecuentes en casos como las lentes de uso terapéutico o en el porte prolongado.
La presencia de depósitos supone una situación de alto riesgo para la aparición de problemas debido a las modificaciones que induce en la lente, como la disminución de su calidad óptica, o la aparición de signos de inflamación o sensibilización, pudiendo llegar a provocar cambios importantes en la superficie ocular.
La presencia de depósitos favorece la colonización de las LC por diferentes microorganismos, siendo un paso previo para una infección ocular. También hace que uno o más factores relacionados con las lentes pueden estar en situación inadecuada como:
• Medio ambiente del portador de lentes
• Calidad de la higiene ocular y métodos de limpieza
• Bioquímica de las lágrimas y su interrelación con las lentes
• Características del material de la lente y calidad de manufacturación.
Se han hecho estudios comparativos de los depósitos (lípidos y proteínas) que aparecen en dos tipos distintos de LC, grupo II (no-iónica, alta hidratación) frente a grupo IV (iónica, alta hidratación) según clasificación de la FDA (1). Concluyeron que los depósitos proteicos fueron más frecuentes en el grupo IV, mientras que los lipídicos fueron mayores en el material del grupo II. Sin embargo, el estudio mostró una gran variedad interindividual, que puede modificar significativamente el perfil de los depósitos en las LC.
CLASIFICACION DE LOS DEPÓSITOS
1. Depósitos orgánicos:
• Proteínas (lisozima, aminoácidos libres,
glicoproteínas)
• Lípidos
• Mucina
• Lipopolisacáridos
• Drogas
• Cosméticos y pigmentos orgánicos
• Contaminantes ambientales
2. Depósitos inorgánicos
• Sales de calcio (fosfato y carbonato)
• Mercurio, hierro y otros metales
• Sílice
• Magnesio
• Sal sódica
3. Depósitos mixtos
• Complejos de mucoproteínas y lípidos (MPL)
-
con / sin calcio
- con / sin otros elementos orgánicos o inorgánicos.
4. Depósitos microbianos
• Flora oportunista de párpados y conjuntiva
• Bacterias, hongos, etc, de origen extraocular
5. Depósitos intrínsecos de la lente
• Defectos de fabricación
• Impurezas del polímero
• Envejecimiento
![]() 2. MÉTODOS DE ESTUDIO
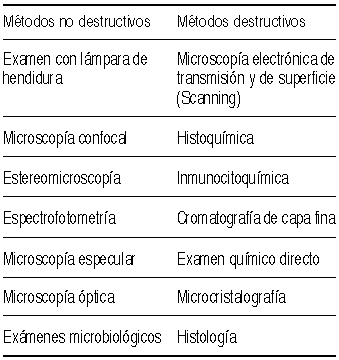
2. MÉTODOS DE ESTUDIO
Cada vez surgen nuevas tecnologías que nos permiten conocer más y mejor los depósitos de las lentes, tanto en su superficie como en el interior de la matriz de la lente. Clásicamente se han clasificado en varias categorías:
La evaluación y reconocimiento de los depósitos en las LC comienza con el reconocimiento de los signos y síntomas de los pacientes. La clínica característica muestra síntomas de irritación de la superficie de carácter inespecífico como fotofobia, ligero disconfort, sensación de cuerpo extraño y, en ocasiones, dolor.
Dentro de los síntomas visuales, puede haber ligera disminución de visión, pérdida de la calidad de las imágenes, aparición de imágenes fantasmas; que pueden llegar en casos marcados a diplopia, poliopia, efectos prismáticos, errores refractivos inducidos, alteraciones del campo visual e incluso pérdida de la binocularidad.
La presencia de depósitos pueden provocar numerosos síntomas oculares característicos como:
• Blefaroespasmo
• Secreción en borde palpebral
• Alteraciones del parpadeo
• Lagrimeo
• Aumento de las secreciones con o sin hiperemia asociada.
Podemos encontrar alteraciones conjuntivales y corneales como:
• Conjuntivitis papilar gigante (CPG)
• Queratopatía punteada superficial (QPS)
• Lesión focal , típica lesión epitelial a las III y IX (Síndrome III-IX)
• Erosiones, abrasiones y edemas del epitelio y estroma
• Disfunciones endoteliales focales o difusas que pueden ser también origen de
edema corneal.
Cuando los depósitos actúan de forma mantenida pueden llegar a provocar importantes alteraciones corneales: neovascularización, pseudopterigium, queratitis, fibrosis (superficial o profunda), necrosis corneal (infecciosa o estéril), úlceras y secuelas que pueden llevar al globo ocular a situaciones muy graves que ponen en juego su función visual.
![]() 3. DEPÓSITOS ORGÁNICOS
3. DEPÓSITOS ORGÁNICOS
La gran mayoría suele tener su origen en las glándulas de secreción tanto palpebrales como conjuntivales, productos del metabolismo y desechos tisulares. Aunque estos pueden tener un origen tanto ocular como extraocular.
Las lágrimas contienen glucosa, urea, proteínas (albúmina, globulinas, lisozima, etc.) y ácidos grasos libres, entre otros. La secreción mucosa se origina mayoritariamente en las células caliciformes de la conjuntiva, los lípidos (fosfolípidos, grasas neutras, triglicéridos, colesterol y ácidos grasos saturados e insaturados) y material sebáceo es segregado por las glándulas del párpado (Meibomio y Zeis).
Los depósitos orgánicos extraoculares tienen su origen en cosméticos, tratamientos oculares, contaminación por los dedos, contaminantes ambientales (nicotina, carbón, etc.).
3.1. Depósitos proteináceos
3.1.1. Naturaleza, etiología y patogenia
Pueden ser observados fácilmente con la lámpara de hendidura, estos forman una delgada capa superficial traslúcida o semiopaca, blanquecina, ocupando total o parcialmente la superficie de la LC (Figuras 1 y 2).
A pesar de los sistemas de limpieza proteica, generalmente queda una fina capa sobre las lentes y en ocasiones se forman auténticos conglomerados de proteínas que pueden observarse sobre su superficie.
En un estudio sobre 74 lentes de portadores con depósitos densos de proteínas tras 80 días de uso, la distribución de los depósitos proteicos mostró una curva bimodal en relación con el tipo de material según la FDA, para el grupo I (no-iónico, baja hidratación) la media fue de 45 microgramos/cm2, comparado con el grupo IV (iónico, alta hidratación) que presentó un valor medio de 1010 microgramos/cm2. Sin embargo, el nivel de depósitos "visibles" por inspección fue similar en ambos grupos (I y IV). La limpieza enzimática no disminuyó significativamente la cantidad de proteínas depositadas, aunque si redujo los depósitos "visibles", lo que sugiere que la cantidad real de proteínas depositadas y los depósitos "visibles" son fenómenos independientes (2).
No existe una relación exacta entre depósitos visibles y los reales, descubiertos por estudios más sofisticados |
Se ha presentado un análisis de la adsorción de albúmina sérica humana (HSA) a LC hidrófilas "in vitro" para intentar comprender mejor la formación de los depósitos proteicos. Utilizando 3 tipos diferentes de hidrogeles (Etafilcon A, tefilcon y vivifilcon A), concluyeron que se produce una unión irreversible de la HSA al hidrogel, en función de la cinética de desnaturalización proteica. Interacciones de carácter electrostático no parecen jugar un papel significativo. Otros factores como la deshidratación hidrofóbica y la presencia de monómeros como la N-vinil-pyrrolidona en el material de lente, podrían favorecer la adsorción de esta albúmina (3).
Los materiales hidrófilos de las lentes blandas tiene una especial afinidad por las proteínas lagrimales, especialmente lisozima, aminoácidos y glicoproteínas. El análisis bioquímico o histoquímico de estos nos muestra que esta película está formada fundamentalmente por lisozima desnaturalizada. Conocemos que la lisozima representa el 18% de las proteínas totales de las lágrimas, frente a un 60% de la albúmina y 24 % de las globulinas, lo que sugiere su afinidad por dicho material hidrófilo, quizás por su bajo peso molecular. Junto con otras moléculas proteicas similares, son adheridas y absorbidas en el material hidrogel de estas lentes, e incluso resultan atrapadas en los espacios esponjosos y en la matriz del material de estas lentes.
Se ha analizado mediante microscopía de fuerza atómica el comportamiento de los depósitos de componentes lagrimales sobre la superficie de las lentes blandas en varios periodos a lo largo de su porte en el tiempo (4). Se encontró un depósito sobre la superficie de manera uniforme (depósitos tipo I) de elementos del film lagrimal con un acúmulo progresivo de pequeños gránulos (depósitos tipo II). Tras su análisis se encontró IgA, lactoferrina, lipocalina lagrimal, lisozima, y una proteína desconocida de peso molecular 30 Kdalton.
En 1996 Scott y cols. investigaron la composición de un extraño depósito de 30Kdalton al disolver las proteínas de lentes blandas de diferentes fabricantes, procedentes de pacientes asintomáticos y con diferentes regímenes de porte (diario o prolongado) (5). Tras el análisis en el laboratorio se encontró que correspondían a dímeros de lisozima lagrimal. Este fenómeno de dimerización es el resultado de la agregación e interacción de la lisozima con el polímero de las lentes.
En ausencia de otros factores, las proteínas probablemente no forman depósitos. El incremento en el contenido de la albúmina se ha correlacionado con el aumento en los depósitos sobre las lentes.
Factores que favorecen la aparición y desarrollo de depósitos:
• Tipo de material del polímero
• Uso de sistemas de hervido de las lentes
• Las alteraciones del parpadeo
• Deficiencias lagrimales
• Alteraciones en la composición de las lágrimas
• Alergias, especialmente la CPG
• Sistema o tipo de porte.
En cuanto al efecto del porte prolongado sobre la tasa y composición de los depósitos proteicos en lentes (Grupo IV), se ha comprobado que el porte de lentes con el ojo cerrado afecta de forma significativa a los depósitos de lisozima en las lentes (6). También afecta a la composición de los constituyentes del biofilm, de manera que podría afectar a la biocompatibilidad. También se encontró en más del 90% una reducción en la secreción lagrimal de tipo reflejo.
Las investigaciones acerca de la presencia de depósitos proteicos varia entre un 14% a un 80%, en un plazo entre los 3 meses y un año de porte.
Se han hecho estudios de los depósitos en lentes de alta hidrofilia no-iónica con reemplazo mensual, durante tres meses, frente a reemplazo trimestral. La A.V., visión de contraste y confort, fueron similares en ambos grupos, aunque el grado de satisfacción fue significativamente mayor en el grupo de reemplazo mas corto (p=0.04). La humectabilidad de la superficie mostró grandes variaciones individuales, aunque significativamente reducida en el reemplazo trimestral (p=0.003) en cuyo grupo también eran significativamente mas frecuentes los depósitos visibles (p<0.05). El análisis cuantitativo de los depósitos mostró una reducción del 44% de los lípidos y del 60% de las proteínas en el grupo de reemplazo mensual.
La presencia de depósitos proteicos se manifiesta clínicamente por alteraciones en su transparencia con disminución de la agudeza visual y irritación ocular que puede ser un factor etiológico de una conjuntivitis papilar gigante (CPG) que podrá desarrollarse en semanas o meses si no se soluciona el problema (7).
Se han estudiado los depósitos proteicos en LC de paciente con y sin CPG, valorando la presencia de IgA, IgE, IgG, IgM, lactoferrina y lisozima, así como la cobertura de depósitos proteicos en una escala de 0 a 4. Todas las lentes tenían abundantes depósitos (50-75% de media) compuestos por las proteínas habituales de la lágrima, excepto la IgE. Ambos grupos de pacientes, sintomáticos y asintomáticos, presentaron depósitos similares de proteínas lagrimales, a excepción de la IgM que estaba significativamente aumentada en los depósitos precoces de pacientes sintomáticos. Las diferencias observadas en los depósitos de IgM pueden ser un reflejo de la respuesta inmune en CPG (8).
Los depósitos proteicos proporcionan un sustrato muy adecuado para el desarrollo y crecimiento de microorganismos con el consiguiente riesgo de infección.
Tripathi y cols, analizaron los depósitos glicoproteicos en lentes desechables de 2 tipos distintos (iónicas 58% hidratación y no-iónicas 38% hidratación) utilizadas por pacientes asintomáticos (9). La cantidad de depósitos proteicos fue significativamente mayor en las de alta hidratación, aunque no se encontró buena correlación entre cantidad de depósitos y tiempo de porte para cada tipo de lente. Debido a que los oligosacáridos de cadena simple de los depósitos proteicos atraen y facilitan la adherencia microbiana, su conocimiento nos permitirá inhibir o hacer reversible este tipo de infecciones.
3.1.2. Tratamiento
• Agentes surfactantes son razonablemente adecuados como
profilaxis para disminuir los depósitos.
• Agentes oxidantes (peróxido, persulfatos, perboratos, bisulfitos,
hipocloritos, etc...) aunque efectivos para eliminar los depósitos proteicos, suponen un
alto riesgo de dañar el polímero por oxidación.
• Limpiadores enzimáticos (papaína y derivados) resultan bastante efectivos en
la disminución de los depósitos proteicos, pero no son adecuados para depósitos de otro
origen e incluso pueden provocar fenómenos de alergia conjuntival. Su uso prolongado
altera el polímero y la vida media de la LC
Myers y cols. estudiaron el efecto que sobre los depósitos proteicos ejerce la limpieza enzimática en pacientes que generaban abundantes depósitos, valorando la cantidad de proteínas depositadas y el depósito de proteínas visible. El tratamiento no modificó la cantidad de proteínas depositadas, pero si redujo los depósitos de proteínas visibles, confirmando la impresión de que son dos fenómenos independientes (2).
Los limpiadores enzimáticos son relativamente eficaces para la disminución de los depósitos proteicos pero su uso frecuente altera el polímero y reduce la vida media de la lente. |
Jung y cols. estudiaron la eficacia de varios limpiadores comerciales (AOSept, Consept, Oxysept, ReNu, Opti-Free y desinfección térmica), en combinación con limpiador enzimático para LC en un modelo experimental de LC nuevas incubadas con una solución de lágrimas artificial (lisozima, albúmina, lactoferrina y glicoproteínas) (10). Sus resultados demostraron que sólo de un tercio a la mitad de los depósitos proteicos fueron eliminados por los sistemas de limpieza utilizados.
Un estudio sobre la eficacia de los sistemas de peróxido (neutralización mediante disco catalítico) en la limpieza de lentes blandas (grupo IV FDA) tras ser incubadas con solución lagrimal artificial (lisozima, albúmina, mucina, ClCa, fosfato sódico), encontró que este sistema podía eliminar en torno al 40% de los depósitos proteicos de las lentes (11).
El uso de la sal de lisina del Bendazac también fue utilizado para tratar los depósitos proteicos, mediante un modelo "in vitro" de depósitos proteicos por desnaturalización de lisozima. La presencia de depósitos en el grupo de lentes con Bendazac fue 7’17 mgramos, inferior al del grupo utilizado como control, que fue 30’6, lo que mostraba un efecto estadísticamente significativo en la disminución de la formación de depósitos proteicos (12).
Podemos sintetizar la limpieza de los depósitos proteicos en:
• La limpieza frecuente y enérgica de las lentes
disminuye los depósitos
• Las maniobras de frotar las lentes entre los dedos y la palma de la mano, así
como los lavados con suero salino, previo a la desinfección, eliminan gran parte de estos
depósitos; el inconveniente de esta maniobra es el daño físico que se le puede
ocasionar a la lente.
• Se recomienda el empleo de sistemas de limpieza como surfactantes, agentes
oxidantes (H2 O2), limpiadores enzimáticos, limpieza con ultrasonidos.
• Es aconsejable el recambio frecuente cuando se observen este tipo de
depósitos
3.2. Depósitos de lípidos
3.2.1. Naturaleza, etiología y patogenia
Estos se reconocen por su aspecto graso, de superficie homogénea, aspecto brillante y, en ocasiones, con la impronta de la huella dactilar sobre ellos. Cuando se depositan en la matriz de la lente suelen estar asociados a mucina proteínas y calcio. Entre los componentes lipídicos identificados se encuentran: fosfolípidos, grasas neutras, triglicéridos, colesterol y sus ésteres, ácidos grasos, etc. (13)
Los depósitos de lípidos disminuyen la agudeza visual. Aunque puedan tener un origen ocular, con frecuencia su origen es extraocular. En el caso de un origen ocular, existe un incremento de estos depósitos cuando aparece una conjuntivitis bacteriana, una blefaroconjuntivitis crónica o una meibomitis, en todas ellas existe un incremento en la secreción lipídica por parte de las glándulas de Meibomio.
En el caso de un origen extraocular, este puede ser muy variado. Una de las causas más frecuentes es la grasa de la piel que desde los dedos pasa a las lentes durante las maniobras de poner y quitar sobre el ojo. Los cosméticos tienen numerosos componentes grasos que pueden depositarse sobre las lentes, tales como ceras, fosfolípidos, lecitinas, colesterol, lanolinas y un largo etc. (13).
La utilización de ciertos productos como la clorhexidina parece que modifica de algún modo la superficie de la LC en el sentido de hacerla mas hidrofóbica y lipofílica, y consecuentemente favorece el depósito de lípidos.
Las lentes de silicona tienen un carácter más lipofílico que otras lentes, especialmente cuando la protección de su superficie ha sido degradada.
En lentes nuevas tanto blandas (4 tipos de FDA) como RGP, incubándolas con los lípidos más habituales del film lagrimal, se ha demostrado que las lentes RGP de carácter hidrofóbico muestran a su vez un carácter lipofílico que la hace más propensa a los depósitos de estas sustancias. También se observa que las lentes hidrófilas con polímeros no-iónicos y alta hidratación presentaban un incremento en los depósitos de lípidos (14).
Algunos autores han encontrado relación entre los niveles séricos de lipoproteinas, grasas neutros, colesterol, y fosfatasa alcalina, en relación con estos depósitos en las lentes.
También se ha comprobado que el uso de pastillas anticonceptivas está asociado con un incremento en los depósitos lipídicos en las lentes, probablemente por alteraciones cuantitativas y cualitativas de la lágrima..
3.2.2. Tratamiento
Los lípidos pueden ser eliminados con el uso de:
• Agentes surfactantes (limpiadores aniónicos, detergentes)
• Enzimas lipolíticas, estas pueden actuar también sobre la secreción de
triglicéridos por las glándulas de Meibomio y afectar a la secreción de ácidos grasos,
que son irritantes tisulares.
• En algunos pacientes el eliminar el uso de la clorhexidina disminuye la
incidencia de los depósitos de lípidos en las lentes.
3.3. Depósitos de mucina
3.3.1. Naturaleza, etiología y patogenia
Se presentan como una capa lisa o irregular, como acúmulos de aspecto gelatinoso en ocasiones o como depósitos de aspecto filamentoso, opacos, de color blanco-amarillento. Si analizamos estos depósitos podemos ver en el microscopio su carácter granular y conglomerados de filamentos que atrapan células, microorganismos, restos de todo tipo, incluso gránulos calcáreos (13).
La mucina es un elemento habitual en los pacientes con alteraciones del film lagrimal o irritación conjuntival, especialmente si es de carácter alérgico como la queratoconjuntivitis vernal o la CPG.
Los depósitos de mucina se incrementan en pacientes con conjuntivitis alérgica o papilar gigante. |
La mucina puede ser eliminada por frotamiento de la superficie de las lentes al igual que otros depósitos como proteínas y lípidos. En la matriz de las lente podemos encontrarla igualmente, aunque suele estar asociada a proteínas y lípidos.
3.3.2. Tratamiento
Suelen ser efectivos para eliminar estos depósitos de la superficie de las lentes.
• Agentes mucolíticos
• Limpiadores surfactantes
3.4. Depósitos de pigmentos orgánicos
3.4.1. Naturaleza, etiología y patogenia
La presencia de depósitos de carácter pigmentario sobre las lentes no resultan infrecuentes y suelen estar relacionados con factores diversos como las técnicas de desinfección, contaminantes ambientales, medicación ocular, cosméticos, elementos de diagnóstico, infestación microbiana, y envejecimiento del polímero (13).
En fases iniciales estos pigmentos no alteran la visión, ni producen ningún signo o síntoma, aunque en ocasiones pueden modificar los parámetros físicos de las LC, así como la matriz del material, disminuyendo la vida media.
• Melanina y polímeros de la tirosina: estos
pigmentos orgánicos aparecen como depósitos de color marrón-amarillento bajo la
superficie de la lentilla y desde el mismo borde. Bajo luz ultravioleta se observa un haz
de color azul, ya que presenta carácter fluorescente. En el microscopio de fase, se
observan depósitos de aspecto granular y filamentoso. Estos pigmentos se forman por la
polimerización de compuestos aromáticos que se encuentran en las lágrimas y su
presencia suele asociarse a sistemas de desinfección térmica como consecuencia de la
polimerización oxidativa inducida por el calor. Los pigmentos del tipo de la melanina,
son frecuentes en fumadores, ya que la producción tisular de melanina es estimulada tanto
por la nicotina como por otros compuestos aromáticos que se encuentran en el humo del
tabaco.
• Nicotina: Estos depósitos pueden modificar el color de las lentes.
Podemos contaminarlas a partir de los dedos que contienen nicotina o la exposición a
ambientes con humo de tabaco. Se pueden identificar por luz ultravioleta,
espectrofotometría, cromatografía de capa fina y microcristalografía (15).
• Adrenocromos: Son característicos de pacientes que utilizan gotas de
epinefrina durante largos periodos de tiempo. Además del cambio en la coloración, estos
pigmentos pueden alterar la flexibilidad de la lente, induciendo rugosidad en su
superficie, etc. (16).
• Tetrahidrozolina: Su utilización durante largos periodos de tiempo
para mejorar las molestias durante el porte de la lente puede provocar su depósito y
consiguiente alteración del color. Estos pueden ser detectados mediante luz ultravioleta
o espectrocopía de absorción.
• Clorhexidina: Su degradación puede dar un color amarillento verdoso
que se vuelve brillante con la luz ultravioleta. El color verdoso de las soluciones con
clorhexidina indica la descomposición del producto. La presencia de clorhexidina en las
LC puede provocar sensibilización en los ojos (menos del 1% de los pacientes), aunque en
lentes con depósitos proteinaceos desnaturalizados, cuando se combinan con clorhexidina
pueden dar lugar a productos activos con propiedades antigénicas que ocasionan
conjuntivitis. La presencia de clorhexidina en el material modifica la hidrofilia hacia la
lipofilia con el consiguiente aumento de los depósitos lipídicos.
• Fluoresceína y rosa de bengala: Las LC blandas no se deben de utilizar
tras un examen clínico con colorantes ya que estos pueden teñirlas.
3.4.2. Tratamiento
La inmersión de las lentes coloreadas en soluciones blanqueantes (H2O2) durante varias horas eliminará el coloreado, para eliminar el peróxido deberemos lavarlas en tiosulfito sódico durante 15 minutos y enjuagar abundantemente después.
La fluoresceína puede también ser eliminada por un abundante lavado o hervido en agua destilada o por inmersión en una solución de bicarbonato sódico al 1% durante varias horas. En muchos casos cuando ocurre una coloración lo mejor es eliminar la lente y reemplazarla por otra nueva.
Mientras que los agentes oxidantes pueden ser utilizados para decolorar las lentes pigmentadas, al eliminar los gránulos de pigmento de la matriz de las lentes esponjosas o porosas, ocurrirá la aparición de hendiduras. Existe incluso el riesgo de dañar el polímero por la acción de los compuestos oxidantes.
![]() 4. DEPÓSITOS INORGANICOS
4. DEPÓSITOS INORGANICOS
En este grupo incluiremos las sales de calcio, compuestos de mercurio, hierro, magnesio, sílice, y sales de sodio. Estos pueden formar depósitos o películas. Aunque las películas de origen inorgánico son menos frecuentes que las proteicas, estas causan mas molestias e irritación que las otras (13).
La presencia de un film de proteínas proporciona una superficie hidrofóbica. Esta circunstancia puede favorecer la precipitación de calcio y otras sustancias inorgánicas. En algunos pacientes prevenir la formación de una película proteica puede a su vez inhibir la formación de un film inorgánico, aunque no en todos lo casos ocurre de este modo.
Mientras que las sales de calcio se derivan principalmente del entorno ocular, otros depósitos inorgánicos tienen su origen principal en fuentes extraoculares.
4.1. Calcio
4.1.1. Naturaleza, etiología y patogenia
En las etapas precoces de los depósitos de calcio, esta sales inorgánicas aparecen clínicamente como una película blanquecina parecida a la de proteínas y que incluso resulta recubierta por esta de forma tardía. Frecuentemente se forma en la cara anterior, mas que en la cara posterior, pudiendo ocupar áreas muy variables desde grandes a pequeñas (13,17).
Además de poder formar una película, el calcio puede depositarse focalmente. Mediante examen a la lámpara de hendidura, los depósitos focales de calcio presentan un aspecto ligeramente blanquecino. Si utilizamos sistemas de mayor magnificación, como la microscopía especular, estos aparecen como depósitos de conglomerados (Figuras 3 y 4).
Los depósitos de fosfato cálcico pueden ser observados como gránulos localizados o extendidos como láminas desde la superficie o dentro de la matriz, alterando y dañando la integridad de la lente. Algunos depósitos de calcio, especialmente los constituidos por carbonato cálcico, pueden tener extensiones hacia el exterior como cuernos y resultar una fuente de irritación e intolerancia.
Por otro lado, cuando los depósitos están presentes en el centro de las lentes, provocan una disminución de la visión. El análisis mediante microscopía especular, muestra anillos concéntricos de crecimiento de estos depósitos. Si utilizamos el examen bajo luz polarizada, estos depósitos muestran birrefringencia. Los depósitos calcáreos pueden ser demostrados mediante histoquímica, microscopía óptica, electrónica, y otras muchas técnicas.
La incidencia de depósitos de sales cálcicas, sin otros depósitos asociados resulta muy variable entre los portadores y tipos de lentes. En diferentes series, con más de 500 lentes con depósitos, un 20% presentaban sales cálcicas exclusivamente. Más a menudo se encuentra combinadas con proteínas, lípidos y mucina, dando lugar a depósitos mixtos llamados MPL.
Diversos factores pueden facilitar la formación de depósitos calcáreos, como la alteración de la película lagrimal, disminución de los niveles de potasio en lágrimas, disminución de la frecuencia de parpadeo, disminución del tiempo de ruptura palpebral (BUT), síndromes de ojo seco, atmósferas o ambientes secos, necrosis tisular, rupturas del polímero de la lente y algunas técnicas de limpieza y desinfección.
Las lágrimas contienen una significativa cantidad de calcio, el que este precipite puede estar favorecido por diversos factores como un aumento en el pH secundario a una disminución de la pCO2 arterial (18).
Variaciones de la temperatura, entre la zona interpalpebral y otras de lente, o desde la zona más superficial a las profundas, lentes cerradas y gruesas (afáquicos), que sufren un efecto de desecación por la disminución del film lagrimal, y una pobre función palpebral (parpadeos incompletos y disminución de su frecuencia).
Niveles elevados de calcio y fosfato en pacientes urémicos, también favorecen el depósitos de calcio. Los tejidos lesionados o necrosados, liberan enzimas que hidrolizan pirofosfatos y fosfatos de los cuales se depositan fosfato cálcico; el mecanismo es probablemente similar al que ocurre en la calcificación distrófica y en la queratopatía en banda.
Cuando se rompe la matriz del polímero de la lente, las terminaciones hidroxil se exponen y atraen a los iones de calcio cargados positivamente. Los depósitos de calcio pueden también indicar rupturas del polímero de la lentilla. La interacción de los iones de calcio con el polímero de la lente añade un factor de debilidad a la estructura de la lente.
Los depósitos de calcio pueden comenzar a formarse incluso a los 2 días de porte y son especialmente frecuentes en el porte prolongado. En algunos pacientes la tasa de recurrencia de estos depósitos es muy alta debido a los numerosos factores ya descritos (18).
4.1.2. Tratamiento
Estos depósitos se disuelven con:
• Ácido clorhídrico diluido, el tratamiento debilita la
textura de la lente e induce cambios en sus parámetros físicos.
• Agentes quelantes como el EDTA. Esta es la razón por la que el EDTA
(0.01-0.001 %), y otros agentes quelantes son añadidos a las soluciones comerciales de
limpieza y/o desinfección.
• Algunos depósitos cálcicos como los de carbonato cálcico se solubilizan con
el calor, estos pueden ser eliminados mediante sistemas térmicos de desinfección.
La eliminación de depósitos calcáreos incrustados, con frecuencia deja fosetas, huecos e irregularidades en la superficie de la lente y en la matriz que a su vez atraerá secundariamente más depósitos y el consiguiente riesgo de infección microbiana.
4.2. Depósitos mercuriales
4.2.1. Naturaleza, etiología y patogenia
Desde un punto de vista macroscópico, una lente teñida por estos productos adquiere un color grisáceo o blanco-grisáceo. Con el microscopio de contraste de fase y alta magnificación, se puede observar una formación moteada.
Mediante análisis de activación de neutrones, los niveles de mercurio pueden ser medidos con exactitud. Estos depósitos consisten probablemente en sulfitos de mercurio de color negro insolubles en agua (19).
Con mucha frecuencia (1 de cada 5 lentes), estos depósitos tiene origen extraocular. Soluciones salinas que utilizan timerosal como conservante, al ser utilizadas en la desinfección, resultan una importante fuente de mercurio, especialmente si se combina su utilización con sistemas térmicos y si esta solución se usa mas de una vez o se ha descompuesto.
La incidencia de depósitos de mercurio es cuatro veces mayor en las lentes desinfectadas por calor en comparación con las desinfectadas químicamente. El calor es un factor precipitante del sulfito de mercurio.
La descomposición del timerosal, también puede ocurrir por un prolongado contacto con los goteros, especialmente con los fabricados con goma (contienen sulfuro). Estos depósitos tienen tendencia a acumularse gradualmente en las lentes usadas. Cuando comparamos con lentes nuevas, las lentes envejecidas contienen unas 15 veces más cantidad de timerosal. Los pacientes que utilizan medicación ocular que contiene timerosal, tienen también el riesgo de acumular este preparado.
Estos depósitos pueden disminuir la transparencia de la lente, y provocar alteración de la visión, el efecto secundario mas serio de los depósitos de mercurio es una reacción alérgica de carácter retardado lo que obliga en muchos casos a abandonar el uso de las lentes.
El timerosal también ha sido implicado en la etiología de otros problemas ocasionados por las LC como los síndromes límbicos superiores, edemas epiteliales, hiperplasia pseudoepiteliomatosa, e inflamación crónica o aguda, así como en la disminución de células caliciformes (20).
4.2.2. Tratamiento
Tras realizar la desinfección con soluciones que contengan timerosal, las lentes deben ser abundantemente enjuagadas. Las soluciones que contengan timerosal no deben ser utilizadas tras su fecha de caducidad. Las lentes no deben ser almacenadas en envases que tengan tapones con compuestos que incluyen sulfuro.
4.3. Depósitos férricos
4.3.1. Naturaleza, etiología
y patogenia
Cuerpos extraños metálicos con elementos férricos pueden resultar atrapados por las lentes, posteriormente resultaran oxidados y formaran depósitos rojos o anaranjados de sales férricas. Estos pueden ser únicos o múltiples y generalmente presentan un pequeño tamaño (Figura 5 y 6).
La presencia de manchas con color de óxido es frecuente y pueden tener un origen diverso. La mayoría procede de cuerpos extraños extraoculares. En ocasiones han aparecido en lentes nuevas y se debe a que han sido introducidos durante el proceso de fabricación.
4.3.2. Tratamiento
Se utilizan agentes reductores y ciertos limpiadores pueden cambiar temporalmente el color de las sales de hierro desde el naranja al negro, aunque la lente permanece con su depósito. La limpieza química de algunos elementos metálicos extraños resulta posible pero dejará un defecto en la superficie de la lente. Pequeños depósitos alejados del eje óptico de la lente pueden ocasionar mínimos problemas aunque siempre resulta recomendable el cambio de la lente.
4.4. Depósitos de otros minerales
El magnesio presente en las lágrimas puede acumularse en las lentes que presentan depósitos orgánicos, polímeros desnaturalizados u otros. Hervir las lentes en aguas ricas en magnesio, como zonas montañosas, resulta otra de las fuentes de este tipo de depósitos.
El sílice suele tener su origen en cuerpos extraños ambientales, especialmente en aquellos individuos que trabajan en un ambiente de construcción. Ha podido ser encontrado en lentes nuevas y su origen fue el agente que las pule durante el proceso de fabricación.
Las sales de sodio presentes en las lágrimas y en las soluciones de cuidado de las lentes pueden precipitar sobre la superficie de las lentes. Durante el secado, grandes depósitos de sal aparecen con un patrón en helecho.
Manganeso, cromo, cadmio, zinc, plata y cobre, también han sido detectados como depósitos de las lentes.
![]() 5. DEPÓSITOS MIXTOS
(orgánicos e inorgánicos) y MPL (Mucina + Proteína + Lípido)
5. DEPÓSITOS MIXTOS
(orgánicos e inorgánicos) y MPL (Mucina + Proteína + Lípido)
5.1. Naturaleza, etiología y patogenia
Películas de depósitos mixtos con proteínas, y sales de calcio ya han sido revisadas previamente. En un principio estos depósitos no son visibles a examen directo o con lámpara de hendidura y con el tiempo esta película puede llegar a verse directamente, especialmente si dejamos secar la lente.
Los depósitos mixtos están constituidos por mucina, proteínas y lípidos, con o sin sales de calcio, resultando probablemente la causa mas frecuente de depósitos en las lentes (13). Resulta característico que los depósitos MPL formen montículos de forma oval o circular, (0’15-1 mm de diámetro) pudiendo ocurrir de forma aislada, aunque frecuentemente formando grupos.
Su base se encuentra firmemente adherida a la matriz de la lente e incluso llega a infiltrarla parcialmente. Cuando se forman grandes depósitos le dan un aspecto abollonado. Estos depósitos ricos en materia orgánica, tienen una consistencia gelatinosa, mientras que los ricos en calcio tienen un aspecto duro y elevado.
Begley y cols. encontraron que el 6.8% de las lentes blandas hidrófilas contenían depósitos de aspecto nodular, investigando el papel del calcio en la formación y maduración de estos depósitos (21). Todos los depósitos demostraron contener lípidos, los polisacáridos fueron más evidentes en los de nueva formación. El calcio estaba presente en los 72 depósitos analizados distribuyéndose dentro de los depósitos mediante un patrón no cristalino, sobre todo en las zonas basales. Los resultados indican que tanto el calcio como los polisacáridos están en la base de la formación de los depósitos nodulares.
Estos depósitos mixtos, en las grandes series, aparecen casi en el 80% de las lentes, suelen ser de origen preferentemente ocular y más frecuentes en pacientes con alteraciones del film lagrimal. La proporción de cada uno de sus componentes puede variar, incluso dentro de una misma lente. Las lentes con alta hidratación (porte diario o prolongado) presentan una mayor afinidad para desarrollar este tipo de depósitos.
La deshidratación de la lente y las alteraciones lagrimales incrementan los depósitos de material mixto (mucina-proteína-lípido). |
5.2. Tratamiento
La limpieza frecuente de las lentes, por técnica físicas o químicas, ayudan a prevenir el crecimiento de estos depósitos. Debido a su variedad de elementos constitutivos, su eliminación resulta difícil. El uso de múltiples enzimas ha sido abandonado, ya que con frecuencia provocaban sensibilización.
Cambiar las lentes de alta hidratación por otras de baja hidratación, puede disminuir la formación de depósitos.
![]() 6. DEPÓSITOS POR
CONTAMINANTES MICROBIANOS
6. DEPÓSITOS POR
CONTAMINANTES MICROBIANOS
6.1. Naturaleza, etiología y patogenia
Con gran frecuencia los hongos crecen, no solo en la superficie, sino que también lo han en el interior de la matriz de la lente. Aunque los micelios son mucho más grandes que los poros de la matriz, estos penetran gracias a que son capaces de degradar y digerir el material del polímero de la lente (Figuras 7 y 8).
En el caso de las bacterias, estas resultan atrapadas en las irregularidades de la superficie o en huecos o brechas del polímero, producidas durante las maniobras de limpieza de los depósitos (22). La presencia de depósitos orgánicos (especialmente proteínas y azúcar) así como restos celulares, favorecen en crecimiento de bacterias, hongos, protozoos.
La fuente de contaminación microbiana puede resultar tanto ocular como extraocular. Debido a la posición anterior en el ojo, la flora normal del borde palpebral y la conjuntiva pueden contaminarla. También pueden contaminarse a partir de los dedos que la manipulan, de las soluciones de limpieza o mantenimiento, de los líquidos de transporte.
La amplia variedad de la flora normal, de la flora con capacidad para contaminar, de la secreciones de las glándulas de meibomio y lagrimales, puede explicar en parte el hecho de que algunos pacientes desarrollen contaminación con más rapidez que otros.
La contaminación microbiológica aparece en el 33% de las lentes con depósitos. Para que los microorganismos puedan proliferar en las lentes, deben en primer lugar poder adherirse a ellas (23). En un principio las cargas negativas iónicas de los grupos hidroxilos del polímero repelen a las bacterias cargadas también negativamente. El problema resulta similar a los mecanismos de adherencia bacteriana a las membranas celulares. Es posible que en las lentes blandas, la capa de glicoproteínas o glicolípidos resulte necesaria para que se produzca una mayor adherencia.
En 1990, Butrus y cols. demostraron que los depósitos en la superficie de las LC incrementaban la adhesión de P aeruginosa, hasta el punto de ser considerado el mayor determinante en la adhesión de este germen a la superficie de la lente e incluso concluyen que la limpieza enzimática no reduce de modo significativo esta adhesión (22).
Los depósitos en la lente de contacto incrementan la capacidad de adherencia bacteriana. |
En cuanto a la contaminación de lentes hidrófilas, se ha encontrado crecimiento bacteriano en el 95% de las lentes (media de 123 unidades formadoras de colonias) y contaminación por hongos en el 11% aunque con niveles muy bajos (3-9 levaduras y 3-18 mohos por lente). No se ha demostrado correlación entre la contaminación bacteriana y las proteínas totales, edad de la lentilla o evaluación subjetiva de la limpieza (24).
La han realizado experimentos para determinar la capacidad de adsorción de Acantamoeba castellani (trofozoitos y quistes) a 5 tipos diferentes de polímeros para LC hidrófilas como posible ruta de infección. En 80 lentes se analizaron su contenido de depósitos mediante el análisis de proteínas totales y área de superficie con depósitos y compararon la adsorción con lentes no usadas —sin depósitos— y resultó que existía un incremento significativo de esta adsorción en las lentes con depósitos en 4 de los 5 tipos de polímeros para los trofozoitos y en 1 de los 5 tipos de polímeros para los quistes. La adsorción en LC usadas era igual o mayor que en lentes nuevas (25).
Las moléculas hidrofóbicas de la superficie de las bacterias pueden facilitar la aproximación del organismo a la superficie de una lente cargada negativamente, a veces la desaparición de esta carga negativa del polímero por cambios en el pH, puede favorecer la adhesión bacteriana. Muchos microorganismos producen un ambiente ácido con su metabolismo que modifica, crea y hace favorable la situación para que se produzca la adhesión.
6.2. Tratamiento
Limpieza y desinfección frecuentes resulta de lo más efectivo para prevenir la contaminación microbiológica. Las limpiezas profilácticas son las más importantes.
Los microorganismos se localizan en brechas y agujeros que con frecuencia impiden que sean adecuadamente eliminados por los procesos de desinfección.
Tras la desinfección, restos de microorganismos y proteínas desnaturalizadas pueden provocar irritación, o actuar como auténticos estímulos antigénicos.
![]() 7. DEPÓSITOS POR ALTERACIONES
EN LA FABRICACIÓN, DEFECTOS FÍSICOS DEL POLIMERO, IMPUREZAS Y ENVEJECIMIENTO
7. DEPÓSITOS POR ALTERACIONES
EN LA FABRICACIÓN, DEFECTOS FÍSICOS DEL POLIMERO, IMPUREZAS Y ENVEJECIMIENTO
7.1. Tipos de defecto
Los defectos en la fabricación pueden abarcar:
• Las impurezas del material
• Falta de homogeneidad en la textura
• Defectos de burbuja
• Marcas
• Muescas
• Hendiduras
• Abrasiones
• Lascas
• Cortes
• Pinchazos
• Rupturas
• Superficies mal terminadas.
Estos defectos son muy frecuentes y pueden variar ampliamente de unos fabricantes a otros de pendiendo de los sistemas de control de calidad y del método utilizado en el proceso de fabricación.
Durante la polimerización del material del lente blanda, impurezas de monómeros pueden dejar lugares de uniones químicas, especialmente de los grupos hidroxilos que resultan punto de atracción y anclaje para cargas positivas como calcio y proteínas.
La reacción de grupos éster, presentes en las lentes blandas, pueden también hidrolizarse durante los procesos de limpieza y desinfección, en condiciones de acidez o alcalinidad y liberar etanol que difundirá hacia el exterior del material, modificando sus características físicas, químicas y ópticas, contribuyendo a una rápido envejecimiento del material.
Con el uso y el empleo de los sistemas de desinfección, la superficie de la lente se vuelve hidrofóbica atrayendo depósitos orgánicos e inorgánicos.
Una lente blanda no resulta indestructible, aunque resulte conveniente la limpieza mediante el frotamiento entre los dedos, dependiendo de los dedos y de la energía empleada se puede lesionar la superficie de esta lente, pudiendo observarse en una de cada 3 ó 4 lentes.
7.2. Tratamiento
Un adecuado y exigente control de calidad durante su fabricación es el único camino para eliminar estos defectos. La amenaza de que estos controles pudieran quedar relegados en las LC desechables, se ha evitado gracias a un esfuerzo notable para mejorar los métodos de producción.
![]() Bibliografía
Bibliografía
1. Jones L, Evans K, Sariri R, et al. Lipid and protein deposition of N-vinyl pyrrolidone-containing group II and group IV frequent replacement contact lenses. CLAO J 1997 23: 122-126.
2. Myers RL, Larsen DW, Tsao M, et al. Quantity of protein deposited on hydrogel contact lenses and its relation to visible protein deposits. Optom Vis Sci 1991 68: 776-782.
3. Garrett Q, Milthorpe BK. Human serum albumin adsorption on hydrogel contact lenses in vitro. Invest Ophthalmol Vis Sci 1996 37: 2594-2602.
4. Baguet J, Sommer F, Claudon-Eyl V, et al. Characterization of lacrymal component accumulation on worn soft contact lens surfaces by atomic force microscopy. Biomaterials 1995 163-9.
5. Scott G, Mowrey-McKee M. Dimerization of tear lysozyme on hydrophilic contact lens polymers. Curr Eye Res 1996 15: 461-466.
6. Sack RA, Sathe S, Hackworth LA, et al. The effect of eye closure on protein and complement deposition on Group IV hydrogel contact lenses: relationship to tear flow dynamics. Curr Eye Res 1996 15: 1092-1100.
7. Allansmith MR, Korb DR, Greiner]V, et al. Giant papillary conjunctivitis in contact lens wearers. Am J Ophthalmol 197783: 697-708.
8. Richard NR, Anderson JA, Tasevska ZG, et al. Evaluation of tear protein deposits on contact lenses from patients with and without giant papillary conjunctivitis. CLAO J 1992 18: 43-48.
9. Tripathi PC, Tripathi RC. Analysis of glycoprotein deposits on disposable soft contact lenses. Invest Ophthalmol Vis Sci, 1992 33: 121-128.
10. Jung J, Rapp J. The efficacy of hydrophilic contact lens cleaning systems in removing protein deposits. CLAO J 1993 19: 47-49.
11. Kiel JS. Protein removal from soft contact lens using disinfection/neutralization with hydrogen peroxide catalytic disc. Clin Ther 1993 15: 30-35.
12. Missiroli A, Ricci F, Pocobelli A, et al. Use of bendazac lysine to limit protein deposition on sofl contact lenses in vitro. CLAO J 1991 17:126-130.
13. Tripathi RC, Tripathi BJ, Ruben M. The pathology of soft contact lens spoilage. Ophthalmology 1980 87:365-389.
14. Bontempo AR, Rapp J. Lipid deposits on hydrophilic and rigid gas permeable contact lenses. CLAO J 1994 20242-245.
15. Broich JR, Weiss L, Rapp J. Isolation and identification of biologically active contaminants from soft contact lenses. Nicotine deposits on worn lenses. Invest Ophthalmol Vis Sci 198019:1328-1331.
16. Miller D, Brooks SM, Mobilia E. Adrenochrome staining of soft contact lenses. Ann Ophthalmol 19768: 65-67.
17. Ruben M, Tripathi RC, Winder AE. Calcium deposition as a cause of spoilation of hydrophilic soft lenses. Br J Ophthalmol 197559: 141-150.
18. Huth SW, Hirano P, Leopold H. Calcium in tears and contact lens wear. Arch Ophthalmol 1980 98: 122-125.
19. Riley H, Doyle PD, Eelty RL. A preliminary study of mercury deposition resulting in spoilage of soft contact lenses. Int Contact Lens Clin 19818: 34-38.
20. Sendele DD, Kenyon KR, Mobilia EE, et al. Superior limbic keratoconjunctivitis in contact lens wearers. Ophthalmology 198390: 616-622.
21. Begley CG, Waggoner PJ. An analysis of nodular deposits on soft contact lenses. J Am Optom Assoc 1991 62208-214
22. Butrus SI, Kiotz SA. Contact lens surface deposits increase the adhesion of Pseudomonas aeruginosa. Curr Eye Res 1990 8:717-722.
23. Beachey EH. Bacterial Adherence. Series B, vol.6: Receptors and Recognition. New York, Chapman and Hall, 1980 p 311.
24. Mowrey-McKee MF, Monnat K., Sampson HJ, et al. Microbial contamination of hydrofilic contact lens. Part I: Quantitation of microbes on patient worn-and-handled lenses. CLAO J 199218: 87-93.
25. Simmons PA, Tomlinson A, Connor R, et al. Effect of patient wear and extent of protein deposition on adsorption of Acanthamoeba to five types of hydrogel contact lenses. Optom Vis Sci 199673362-368.