|
INTRODUCCIÓN
Tradicionalmente se ha considerado la cirugía filtrante, y particularmente
la trabeculectomía, como una cirugía con bajo porcentaje de éxitos en el GP
(1-3). No obstante, en la actualidad algunos investigadores están obteniendo
resultados satisfactorios con la trabeculectomía como tratamiento inicial en el
glaucoma congénito primario —GCP— (4-7). Parece que existen ciertos
factores que condicionan un resultado desfavorable en la trabeculectomía del
GP, principalmente las cirugías previas (8). De este modo, la trabeculectomía
podría ofrecer mejores resultados en ojos no intervenidos. Luntz (9) propone
abiertamente su empleo en todos los casos de glaucoma congénito primario no
debidos a una trabeculodisgenesia aislada. Pero en la mayoría de los grupos de
trabajo la trabeculectomía es la cirugía que se emplea cuando han fracasado la
gonio o trabeculotomía.
Como queda referido en el primer capítulo acerca del GP, la trabeculectomía
es el tratamiento de elección en muchos tipos de glaucomas secundarios,
particularmente los unidos a determinados síndromes (síndrome de
Axenfeld-Rieger, anomalía de Peters), o alteraciones oculares secundarias a la
cirugía, traumatismos o uveítis.
La trabeculectomía, por todo lo anterior, se realiza frecuentemente en ojos
poliintervenidos de glaucoma sin control tensional adecuado (glaucomas
refractarios) o afectos de procesos que pueden afectar negativamente a la
supervivencia de la fístula (p.e. uveítis, afaquia, queratoplastia, angiomas
epiesclerales, hamartomatosis). En los últimos años se ha intentado mejorar el
pronóstico de la cirugía filtrante en estos globos mediante el empleo de
antimetabolitos (10-17) y la utilización de dispositivos de derivación para el
glaucoma (18) —capítulo siguiente—.
INDICACIONES
En resumen, las indicaciones de la trabeculectomía en el GP pueden resumirse
así:
A) GCP: Ver el apartado sobre indicaciones de los diferentes
procedimientos quirúrgicos en el capítulo introductorio.
Actualmente recomendamos trabeculectomía unida a trabeculotomía como
procedimiento inicial en los ojos con edema corneal moderado-severo que impida
visualizar los detalles trabeculares (19-21), y en los casos en que se aprecie
una iridotrabeculodisgenesia.
Si la cirugía combinada no ha dado resultado, se procede a nueva
trabeculectomía. Antes de indicar una tercera trabeculectomía indicaríamos
válvula de Ahmed para el glaucoma (VAG).
Si el procedimiento inicial ha sido una goniotomía, sin resultado
satisfactorio, el segundo puede ser una cirugía combinada (puede indicarse
también una nueva goniotomía). Si fracasa la combinada, se indicaría la
segunda trabeculectomía.
B) GP secundario: Está indicada inicialmente en todos los glaucomas
pediátricos secundarios sin evidencia de trabeculodisgenesia. Estos glaucomas
no son congénitos y se ven en diferentes síndromes y enfermedades oculares
ampliamente comentados en el capítulo introductorio. En la mayoría de ellos
preferimos actualmente el empleo de la VAG. Algunos grupos de trabajo
recomiendan cirugía combinada trabeculectomía-trabeculotomía en el síndrome
de Sturge-Weber (22-24), pero creemos especialmente indicada la implantación de
VAG en este síndrome (25).
CONSIDERACIONES PREOPERATORIAS
A) Anestesia
Como en toda cirugía intraocular es conveniente procurar una anestesia con
hipotensión del globo en la medida de lo posible, con el fin de eliminar una
presión excesiva sobre los contenidos intraoculares que tienda a extruirlos.
B) Medicación prequirúrgica
• En la trabeculectomía infantil pueden tomarse las mismas precauciones
que en la del adulto en lo referente al control de la PIO previa a la apertura
del globo ocular, con el fin de evitar una descompresión súbita del ojo. Esta
descompresión condicionaría una exudación en el espacio supracoroideo
provocando un desprendimiento coroideo, hemorrágico o seroso (26). Hemos
observado esta complicación casi exclusivamente en el síndrome de Sturge-Weber
y en él actualmente recomendamos el empleo de VAG. Si se va a proceder a
trabeculectomía en este síndrome se puede mantener un tratamiento hipotensor
hasta el momento de la cirugía, para utilizar manitol intravenoso a razón de 1
gr/kg de peso en infusión lenta desde 1/2 hora previa a la incisión prevista
del globo. Como se ha comentado en el capítulo introductorio, es recomendable
practicar esclerotomías profilácticas para prevenir el desprendimiento
coroideo.
• Si el niño se encuentra bajo tratamiento hipotensor éste debe
interrumpirse antes de una cirugía filtrante con el fin de que la secreción de
humor acuoso origine una ampolla de filtración. Como es sabido, los
beta-bloqueantes deben interrumpirse dos semanas antes de la cirugía. El resto
de la medicación tiene un efecto menos prolongado, por lo que puede mantenerse
hasta el día previo a la cirugía. En raras ocasiones se precisa el empleo de
acetazolamida sistémica, a dosis de 5-10 mg/Kg de peso cada 6-8 horas.
METODOLOGÍA DE LA
TRABECULECTOMÍA PEDIÁTRICA CON/SIN USO DE ANTIMITÓTICOS
A) Instrumental
El utilizado normalmente en la trabeculectomía del adulto. En la disección
escleral empleamos un cuchillete de microcirugía de 22,5°. Si se van a aplicar
antimitóticos intraoperatorios, utilizamos mitomicina C —MMC— (Kyowa®).
B) Técnica
Se describe la técnica básica de la trabeculectomía pediátrica. Exponemos
también la variante de cirugía combinada trabeculectomía-trabeculotomía
empleada en el GCP. Asimismo, se tratará del empleo de antimitóticos y de las
esclerotomías profilácticas recomendables en los nanoftalmos y síndrome de
Sturge-Weber. En principio se realiza la cirugía en alguno de los cuadrantes
superiores, debido al riesgo de endoftalmitis asociado a las trabeculectomías
inferiores (27).
1. Suturas de tracción: Pueden utilizarse las convencionales suturas
sobre el recto superior con seda de 4/0, pero actualmente nos inclinamos por una
sutura de 7/0 de Vicryl® con aguja espatulada que se pasa a través de la mitad
del espesor corneal en la zona superior yuxtalímbica, a las 12 horas. Permite
un buen acceso a todo el limbo superior. Se prefiere evitar el meridiano de las
12 horas en la trabeculectomía, con el fin de minimizar el sangrado derivado de
vasos epiesclerales relacionados con los ciliares anteriores, que proceden de
los músculos rectos (obviamente, en este caso, el recto superior).
2. Peritomía: Según las preferencias del cirujano, puede hacerse con
base limbo o con base fórnix. Actualmente nos inclinamos por la última, ya que
permite una mejor visualización del limbo, se seccionan conjuntiva y Tenon
conjuntamente, y es técnicamente más sencilla de realizar y de cerrar. Mide
alrededor de 7 mm de cuerda.
Nota: Si está previsto el empleo de MMC no recomendamos la peritomía
base fórnix, ya que es virtualmente imposible evitar un test de Seidel positivo
con este acceso, salvo practicando un cierre conjuntival estanco con nylon de
9/0 en aguja atraumática.
3. Procedimientos previos: Como ya es conocido, en el síndrome de
Sturge–Weber (28) y en los nanoftalmos (29) existe un riesgo elevado de
desprendimientos coroideos, que pueden originar serias complicaciones en su
evolución, además de comprometer el resultado quirúrgico. En estos casos es
recomendable realizar esclerotomías profilácticas inferiores. Existen diversos
modos de hacerlas, pero quizás el más sencillo sea el siguiente:
Se secciona la conjuntiva y Tenon en sentido radial desde el limbo y en
aproximadamente 6 mm de longitud. Se escoge uno o los dos cuadrantes inferiores.
Se dibuja sobre la epiesclera la futura incisión escleral. Está
centrada a unos 4-5 mm del limbo y mide unos 4 mm.
Aplicación de diatermia sobre la zona.
Sección escleral practicada en cortes sucesivos con profundización
lenta hasta llegar a úvea (pars plana).
Diatermia sobre las paredes del corte escleral para retraerlas y aumentar
el espacio de filtración.
Sutura de conjuntiva-Tenon con Vicryl® de 7/0 en puntos de colchonero.
4. Preparación de la esclera: Se denuda de tejido epiescleral. Es
frecuente practicar tenonectomía con la extensión que se pretende que posea la
ampolla. No es recomendable realizarla si se van a utilizar antimitóticos. El
lugar elegido para la trabeculotectomía se perfila con diatermia para minimizar
el sangrado en la incisión.
5. Paracentesis: La encontramos innecesaria. El ojo infantil suele
revertir la atalamia con gran facilidad, no precisando la reformación de la
cámara anterior. Si queremos comprobar el flujo de filtración o la
estanqueidad del cierre conjuntival, recurrimos a una paracentesis con aguja de
30-G y procedemos a la infusión de BSS plus®.
6. Aplicación de los antimitóticos (si están indicados): Debe
reconstituirse la MMC con suero fisiológico. La concentración que parece
obtener mejores resultados es la de 0,04% (0,4 mg/ml) aplicada durante 2-3
minutos (15). Se emplea una esponja de celulosa sumergida previamente en la
solución, situándola en el lugar donde se preve la trabeculectomía y
cubriéndola con la conjuntiva-Tenon. Se evita el contacto entre la esponja y el
borde de sección conjuntival. Una vez transcurrido el tiempo programado, se
lava el lecho con unos 15-30 ml de suero fisiológico. Debe recordarse la
toxicidad potencial de la MMC: Todo el material en contacto con ella, incluyendo
el suero, debe ser desechado en envases especiales.
7. Tallado del colgajo escleral (figura 1): El tamaño depende
especialmente de las preferencias del cirujano. Recomendamos 3-4 mm en sentido
circunferencial y 3 mm en sentido radial. Las referencias se realizan respecto a
la unión corneolimbar. Si se va a emplear MMC su profundidad será de la mitad
del espesor escleral; si no es así, recomendamos 1/3 de dicho espesor.
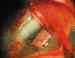
Figura 1. Tallado del colgajo escleral.
8. Trabeculotomía (si está indicada). Se continúa con el punto 4
del procedimiento apuntado en el capítulo sobre trabeculotomía. En la técnica
combinada se practica una incisión de aproximadamente 2 mm centrada sobre la
unión esclerolimbar, una vez que se ha levantado el colgajo escleral. A partir
de este momento se profundiza la incisión mediante cortes radiales hasta llegar
a la pared externa del canal de Schlemm. El procedimiento se continúa como en
la trabeculotomía simple. Alternativamente, puede tallarse el lugar destinado a
la trabeculectomía antes de realizar la incisión radial.
9. Trabeculectomía: Excisión del bloque interno de
esclera-córnea-trabeculum. Recomendamos una sección de 2 ´
2 mm de tejido (figura 2). Primeramente se perfila el lugar deseado, que debe
comenzar en córnea y extenderse hasta la unión esclero-limbar (figura 3). La
penetración en cámara anterior se realiza lentamente en una de las esquinas
del cuadrado con el cuchillete quirúrgico. Se finaliza con tijera de Vannas
(figura 4). La cámara anterior puede mantenerse con aire mientras se concluye
el procedimiento.

Figura 2. Marcado de la zona de trabeculectomía.

Figura 3. Se perfila con el cuchillete de 22,5° el lugar de la
trabeculectomía.
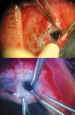
Figura 4. Trabeculectomía con cuchillete y tijera de Vannas.
10. Iridectomía (figura 5): Debe ser más amplia que la apertura de
la trabeculectomía, con el fin de impedir la incarceración iridiana. Para ello
se prende el iris cerca de su raíz con una pinza dentada y se secciona con una
tijera de Vannas sostenida en sentido circunferencial. En el primer movimiento
para un cirujano diestro, la pinza desplaza el iris hacia la izquierda mientras
la tijera secciona la mitad del tejido. En el segundo tiempo, la pinza desplaza
el iris hacia la derecha mientras tracciona levemente de él y se concluye la
iridectomía.

Figura 5. Iridectomía.
11. Cierre del colgajo escleral (figura 6): Empleamos
normalmente dos puntos de nylon de 10/0 a través de las dos esquinas
posteriores del colgajo escleral. En este momento se puede reformar la cámara
anterior a través de una paracentesis con aguja de 30-G, comprobando a la par
el flujo a través de la trabeculectomía.

Figura 6. Cierre del colgajo escleral.
12. Cierre de la peritomía: En las peritomías con base en el fórnix
se desepiteliza la córnea en su proximidad al limbo y se aplican dos puntos de
Vicryl® de 7/0 en los extremos, con paso de la sutura por la esclera
subyacente. La peritomía con base límbica se cierra con una sutura continua,
generalmente de nylon de 9/0 con aguja atraumática (cilíndrica). El cierre
debe ser especialmente meticuloso si se ha empleado MMC. En este caso es
prudente cerrar separadamente la Tenon con puntos sueltos de Vicryl® de 7/0,
realizar el cierre de la conjuntiva evitando el más mínimo desgarro (con aguja
atraumática), y comprobar la estanqueidad de la peritomía mediante aplicación
de colirio (estéril) de fluoresceína al 2%, buscando un test de Seidel
positivo. Debe comprobarse tras reformar adecuadamente la cámara anterior.
13. Finalización del procedimiento: La cámara anterior debe quedar
reformada al final de la cirugía. Si ello no sucede espontáneamente, se
empleará bien BSS plus®, bien aire. Se instila una gota de un ciclopléjico,
generalmente ciclopentolato al 1%, dada la toxicidad de la atropina en pacientes
pediátricos (21), y se aplica una pomada oftálmica con
antibiótico-corticoide. El ojo es ocluido del modo habitual.
CUIDADOS POSTOPERATORIOS
1. Medicación
Normalmente se mantiene la oclusión 24 horas.
Se pauta un colirio de antibiótico-corticoide cada 2 horas los dos
primeros días. Posteriormente se reduce la frecuencia según esta pauta
orientativa:
1.ª semana: Cada 4 horas.
2.ª semana: Cada 8 horas.
3.ª semana: Cada 12 horas.
4.ª semana: Cada 24 horas.
Se emplea ciclopentolato al 1% cada 6 horas durante 3 semanas.
2. Revisiones
El niño es dado de alta hospitalaria al 4.º día postquirúrgico si no
existen complicaciones aparentes, y se pautan revisiones semanales durante un
mes.
Si la PIO parece controlada y la evolución satisfactoria, se revisará
al mes siguiente.
Si existieran dudas acerca de la PIO y de la evolución, se planificará
una revisión tonométrica bajo anestesia general al mes postoperatorio. Las
revisiones en quirófano se repiten trimestralmente durante el primer año, si
no es posible evitarlas mediante el examen en consulta.
COMPLICACIONES
En general son mínimas. Teóricamente se pueden ver todas las complicaciones
descritas en la trabeculectomía del adulto, pero en la práctica son escasas.
Mencionaremos las más frecuentes o típicas de la trabeculectomía infantil.
1) Intraoperatorias
Es característico el prolapso del vítreo a través de la
iridectomía debido a la buftalmía presente con frecuencia. La esclera
adelgazada tiende a colapsarse tras la apertura del globo, extruyendo los
contenidos intraoculares. Normalmente se puede proceder al cierre del colgajo
escleral sin dañar la hialoides. Si se produce una vitreorragia, se realiza una
vitrectomía, preferiblemente automatizada, con mínima penetración del
vitrectomo a través de la trabeculectomía, con el fin de no dañar el
cristalino especialmente elástico de estos pacientes.
2) Postoperatorias
A. Hipo/atalamia: Esta complicación la hemos apreciado
particularmente en el síndrome de Sturge-Weber, unida a un desprendimiento
exudativo de coroides. En todos los casos se ha resuelto sin otras
complicaciones, aunque puede haber influido en la pérdida posterior de la
ampolla de filtración.
B. Desprendimientos coroideos y retinianos exudativos: Se une al
apartado anterior como queda referido, y es típica del síndrome de
Sturge-Weber (figura 7) y también de ojos buftálmicos afáquicos, generalmente
poliintervenidos. Suelen resolverse sin dar lugar a otras complicaciones.

Figura 7. Trabeculectomía en el Síndrome de Sturge-Weber: a)
Síndrome de Sturge-Weber; b) Angioma epiescleral; c) Desprendimiento retiniano
exudativo; d) Ecografía de un desprendimiento coroideo.
C. Complicaciones relacionadas con el empleo de antimitóticos: Varios
estudios coinciden en el incremento de complicaciones relacionadas con el uso de
MMC en la cirugía filtrante (14-17), particularmente ampollas quísticas
(figura 8) (15), test de Seidel positivo (15,17), hipotonía (15-17) y
endoftalmitis (14,15,17). El estudio más reciente encuentra un porcentaje de
infección relacionada con la ampolla del 17% (17). El cuadro clínico en estos
casos es de aparición tardía, curso acelerado y puede comprometer el resultado
visual final (31).

Figura 8. Ampolla de filtración en la trabeculectomía con MMC.
RESULTADOS
Los resultados de la trabeculectomía en el GP son dispares, como ya se ha
comentado. Tras varias décadas de desprestigio, estudios recientes ofrecen
resultados sorprendentes en la trabeculectomía para el GCP, tradicionalmente
indicación para gonio o trabeculotomía. Así Burke (4) refiere un porcentaje
de casos con PIO controlada del 86% a los 4 años. Fulcher obtiene tasas de
éxitos del 92 % en el GCP con una trabeculectomía y del 100% con dos (5).
Dureau (7) refiere un 87% de éxitos, con un 30% de reintervenciones; parece que
el debut precoz del glaucoma se une a un control más dificultoso. Estos casos
podrían corresponder a las iridotrabeculodisgenesias de Hoskins (32).
El empleo de antimitóticos ofrece también resultados dispares. Es necesario
recordar que la mayoría de los ojos tratados con MMC han sido previamente
intervenidos. Mandal obtuvo inicialmente un control en el 95% de los casos
tratados con MMC y seguidos durante 18 meses (13). Posteriormente ha publicado
unas tasas de control del 65% a los 3 años (16), cifra que parece coincidir con
otros estudios: Beck (14), con un 60% a los dos años, Sidoti (17), con un 60% a
los 3 años. Consideramos que estas cifras de éxitos en el control tensional
son elevadas y suponen una esperanza para los ojos afectos de GP refractario. No
obstante, el riesgo de una endoftalmitis tardía parece elevado (17), siendo
prudente controlar exhaustivamente la ampolla de filtración en las revisiones
periódicas con el fin de detectar un test de Seidel positivo (33,34). Los
padres deben ser informados de la posibilidad de este tipo de complicaciones y
del deber de consultar rápidamente ante una pérdida de agudeza visual, dolor
ocular, enrojecimiento, secreción o un cambio del aspecto externo del globo.
BIBLIOGRAFÍA
- Beauchamp GR, Parks MM. Filtering surgery in children: barriers to
success. Ophthalmology 1979; 86: 170-180.
- Gressel MG, Heuer DK, Parrish RK II. Trabeculectomy in young patients.
Ophthalmology 1984; 91: 1.242-1.246.
- Debnath SC, Teichmann KD, Salamah K. Trabeculectomy versus trabeculotomy
in congenital glaucoma. Br J Opthalmol 1989; 73: 608-611.
- Burke JP, Bowell R. Primary trabeculectomy in congenital glaucoma. Br J
Opthalmol 1989; 73: 188-190.
- Fulcher T, Chan J, Lanigan B, Bowell R, O´Keefe M. Long-term follow up of
primary trabeculectomy for infantile glaucoma. Br J Opthalmol 1996; 80: 499-502.
- Detry-Morel M, Feron EM. Trabeculectomy in congenital glaucoma:
retrospective medium and long-term results. Bull Soc Belge Ophthalmol 1996; 262:
143-151.
- Dureau P, Dollfus H, Cassegrain C, Dufier JL. Long-term results of
trabeculectomy for congenital glaucoma. J Pediatr Ophthalmol Strabismus 1998;
35: 198-202.
- Sturmer J, Broadway DC, Hitchings RA. Young patient trabeculectomy.
Assessment of risk factors for failure. Ophthalmology 1993; 100: 928-939.
- Luntz MH, Harrison R. Surgery for congenital glaucoma. In: Ritch R,
Shields MB, Krupin T eds. The glaucomas. St Louis: Mosby; 1996; vol. III:
1.761-1.781.
- Zalish M, Leiba H, Oliver M. Subconjuntival injection of 5-fluorouracil
following trabeculectomy for congenital and infantile glaucoma. Ophthalmic Surg
1992; 23: 203-205.
- Whiteside-Michel J, Liebmann JM, Ritch R. Initial 5-fluorouracil
trabeculectomy in young patients. Ophthalmology 1992; 99: 7-13.
- Susanna R, Oltrogge EW, Carani JCE, Niolela MT. Mitomycin as adjunct
chemotherapy in congenital and developmental glaucoma. J Glaucoma 1995; 4:
151-157.
- Mandal AK, Walton DS, John T, Jayagandan A. Mitomycin C-augmented
trabeculectomy in refractory congenital glaucoma. Ophthalmology 1997; 104:
996-1.003.
- Beck AD, William RW, Lynch MG, Lynn MJ, Noe R. Trabeculectomy with
adjunctive mitomycin C in pediatric glaucoma. Am J Ophthalmol 1998; 126:
648-657.
- al-Hazmi A, Zwann J, Awad A, al-Mesfer S, Mullaney PB, Wheeler DT.
Effectiveness and complications of mitomycin C use during pediatric glaucoma
surgery. Ophthalmology 1998; 105: 1.915-1.920.
- Mandal AK, Prasad K, Naduvilath TJ. Surgical results and complications of
mitomycin C-augmented trabeculectomy in refractory developmental glaucoma.
Ophthalmic Surg Lasers 1999; 30: 473-480.
- Sidoti PA, Belmomte SJ, Liebmann JM, Ritch R. Trabeculectomy with
mitomycin-C in the treatment of pediatric glaucomas. Ophthalmology 2000; 107:
422-429.
- Englert JA, Freedman SF, Cox TA. The Ahmed valve in refractory pediatric
glaucoma. Am J Ophthalmol 1999; 127: 34-42.
- Elder MJ. Combined trabeculotomy-trabeculectomy compared with primary
trabeculectomy for congenital glaucoma. Br J Opthalmol 1994; 78: 745-748.
- Mandal AK, Naduvilath TJ, Jayagandan A. Surgical results of combined
trabeculotomy-trabeculectomy for developmental glaucoma. Ophthalmology 1998;
105: 974-982.
- Mullaney PB, Selleck LVN, Al-Awad A, Al-Mesfer S, Zwann J. Combined
trabeculotomy and trabeculectomy as an initial procedure in uncomplicated
congenital glaucoma. Arch Ophthalmol 1999; 117: 457-460.
- Board RJ, Shields MB. Combined trabeculotomy-trabeculectomy for the
management of glaucoma associated with Sturge-Weber syndrome. Ophthalmic Surg
1981; 12: 813-817.
- Agarwal HC, Sandramouili S, Sihota R, Sood NN. Sturge-Weber syndrome:
management of glaucoma with combined trabeculotomy and trabeculectomy.
Ophthalmic Surg 1993; 24: 399-402.
- Mandal AK. Primary combined trabeculotomy-trabeculectomy for early-onset
glaucoma in Sturge-Weber syndrome. Ophthalmology 1999; 106: 1.621-1.627.
- Hamush NG, Coleman AL, Wilson MR. Ahmed glaucoma valve implant for the
management of glaucoma in Sturge-Weber syndrome. Am J Ophthalmol 1999; 128:
758-760.
- Thomas JV. Filtering operation with scleral flap. In: Thomas JV ed.
Glaucoma surgery. St Louis: Mosby-Year Book; 1992; 25-52.
- Liebman JM, Ritch R. Complications of glaucoma filtering surgery. In:
Ritch R, Shields MB, Krupin T eds. The glaucomas. St Louis: Mosby; 1996; vol.
III: 1.703-1.736.
- Lytle RA, Thomas JV, Simmons RJ. Glaucoma surgical techniques in eyes
with enlarged epiescleral vessels. In: Thomas JV ed. Glaucoma surgery. St Louis:
Mosby-Year Book; 1992; 235-243.
- Walsh JB, Muldoon TO. Glaucoma associated with retinal and vitroretinal
disorders. In: Ritch R, Shields MB, Krupin T eds. The glaucomas. St Louis:
Mosby; 1996; vol. II: 1.055-1.071.
- Palmer EA. How safe are ocular drugs in pediatrics? Ophthalmology 1986;
93: 1.038-1.040.
- Waheed S, Ritterband DC, Greenfield DS, Liebmann JM, Sidoti PA, Ritch R.
Bleb-related ocular infection in children after trabeculectomy with mitomycin C.
Ophthalmology 1997; 104: 2.117-2.120.
- Hoskins HD Jr, Shaffer RN, Hetherington J. Anatomical classification of
developmental glaucomas. Arch Ophthalmol 1984; 102: 1.331-1.334.
- Soltau JB, Rothman RF, Budenz DL, Greenfield DS, Feuer W, Liebmann JM,
Ritch R. Risk factors for glaucoma filtering bleb infections. Arch Ophthalmol
2000; 118: 338-342.
- Katz LJ. A call for innovative operations for glaucoma. Arch Ophthalmol
2000; 118: 412-413.
|