|
INTRODUCCIÓN
Es frecuente en la práctica clínica diaria encontrarse con el GP
refractario, esto es, aquél que ha sido poliintervenido sin encontrar el
adecuado nivel tensional. Generalmente ha sufrido ya varias trabeculectomías y
la PIO no se controla con tratamiento médico. Actualmente existen las
siguientes aproximaciones al problema:
1. Asociar antimitóticos, particularmente mitomicina C (MMC), a la
trabeculectomía (1-5). Los últimos resultados publicados con esta técnica se
aproximan al 60% de éxitos en el control tensional a los 3 años del
postoperatorio, pero con un 17% de endoftalmitis, y un elevado riesgo de
pérdida visual (6).
2. Procedimientos ciclodestructivos: La ciclocrioterapia puede
alcanzar hasta un 45% de éxitos en el control tensional (7), pero el porcentaje
de phthisis bulbi ha llegado hasta un 13% (8), además de presentarse otras
complicaciones graves, como el desprendimiento retiniano (7). La
ciclofotocoagulación transcleral parece ofrecer similares tasas de éxito
(9,10), pero con menor índice de complicaciones severas, si bien la pérdida de
agudeza visual es posible (10,11). La phthisis bulbi ha sido recientemente
descrita con este procedimiento (12).
3. Dispositivos de derivación para el glaucoma: Nos parece la opción más
atractiva en la actualidad. Molteno fue el primer autor en describir el empleo
de su dispositivo en niños (13), siendo el más estudiado a lo largo de la
historia (14-18). También se han empleado otros implantes no restrictivos, como
el de Baerveldt (19) y el de Schocket (19,20). Recientemente ha sido introducida
en el tratamiento del glaucoma refractario la válvula de Ahmed para el
glaucoma (VAG). Este dispositivo parece actuar de modo restrictivo, esto es,
como una auténtica válvula, permitiendo la salida de humor acuoso sólo cuando
la PIO es mayor de 8 mm Hg (21). Dicha capacidad se basa en el principio físico
de Bernoulli, que será explicado posteriormente. La VAG se experimentó en
pacientes pediátricos con resultados iniciales prometedores (22), que
posteriormente se han visto confirmados en un seguimiento de 2 años.
Nuestra experiencia con los dispositivos de derivación para el glaucoma se
basa en el empleo de la VAG, cuyas indicaciones, implantación, resultados y
complicaciones se describirán en este capítulo.
INDICACIONES
Se discuten en el capítulo introductorio sobre GP. En resumen, las
indicaciones de la VAG en el GP pueden resumirse así:
1. Glaucoma congénito primario (GCP): Actualmente indicamos una VAG
en los casos que han sido sometidos previamente a dos trabeculectomías sin
éxito, independientemente del procedimiento inicial (goniotomía,
trabeculotomía, trabeculectomía-trabeculotomía). Es posible que en un futuro
próximo la indicación sea más precoz.
2. GP secundario: En los GP sin indicio de trabeculodisgenesia creemos
indicada la VAG inicialmente, sin consideración a la edad del niño. La
alternativa, como se ha discutido en capítulos precedentes, es la
trabeculectomía asociada o no a MMC. Nuestra experiencia con la VAG es
particularmente positiva con el síndrome de Sturge-Weber, en el que ha
minimizado las complicaciones asociadas con la cirugía filtrante (23), y con el
glaucoma de ángulo abierto relacionado con uveítis crónicas, en las
cuales la supervivencia de la VAG parece ser especialmente prolongada (24).
CONSIDERACIONES PREOPERATORIAS
A) Anestesia
Como en toda cirugía intraocular es conveniente procurar una anestesia con
hipotensión del globo en la medida de lo posible, con el fin de eliminar una
presión excesiva sobre los contenidos intraoculares que tienda a extruirlos.
B) Medicación prequirúrgica
• En la inserción de la VAG pueden tomarse las mismas precauciones que en
la trabeculectomía clásica, en lo referente al control de la PIO previa a la
apertura del globo ocular, con el fin de evitar una descompresión súbita. Esta
descompresión podría condicionar una exudación en el espacio supracoroideo
provocando un desprendimiento coroideo, hemorrágico o seroso (26),
complicación típica del síndrome de Sturge-Weber. Sin embargo, es difícil
que una inserción de VAG origine una hipotensión prolongada en el acto
quirúrgico, por lo que estas complicaciones tienden a minimizarse. Es
recomendable, no obstante, mantener en dicho síndrome un tratamiento hipotensor
previo a la cirugía, utilizando manitol intravenoso a razón de 1 gr/kg de peso
en infusión lenta desde 30 minutos previos a la hora prevista de la
paracentesis.
• Si el niño se encuentra bajo tratamiento hipotensor éste debe
interrumpirse antes de una inserción de VAG, con el fin de que la secreción de
humor acuoso mantenga patente la VAG durante los primeros días postoperatorios
y evitar así una cicatrización perivalvular prematura. Los beta-bloqueantes
deben interrumpirse dos semanas antes de la cirugía. El resto de la medicación
tiene un efecto menos prolongado, por lo que puede mantenerse hasta el día
previo a la cirugía. En raras ocasiones recomendamos el empleo de acetazolamida
sistémica, a dosis de 5-10 mg/kg de peso cada 6-8 horas.
METODOLOGÍA DE LA INSERCIÓN VAG
A) Instrumental
El utilizado normalmente en la trabeculectomía del adulto, además de la
VAG.
La VAG (21) consite en un tubo de silastic conectado a unas membranas de
silicona que actúan como válvula. El conjunto se une a una plataforma de
polipropileno de 185 mm2. Existe una VAG pediátrica de menor tamaño. Las
membranas de silicona, de disposición paralela (figura 1), crean una cámara de
tipo Venturi regida por el principio de Bernoulli (figura 2): Ya que el orificio
de entrada a la cámara es mayor que el de salida, se establece un gradiente de
presión. La válvula se ha diseñado para permitir el paso de acuoso cuando la
PIO supera los 8 mm Hg.

Figura 1. Esquema de la VAG. El humor acuoso sigue la dirección de
las flechas transparentes a través del tubo de silastic y las membranas de
silicona. Las membranas se colocan bajo tensión en la dirección de las flechas
blancas y se unen firmemente a la plataforma de polipropileno.
Empleamos la VAG tipo adulto (o convencional) en los ojos mayores de 22 mm de
longitud axial, que son la inmensa mayoría. En los menores es recomendable la
VAG pediátrica.

Figura 2. Principio de Bernoulli: El gradiente de presión entre el
orificio de entrada a la cámara y el de salida es proporcional a la diferencia
entre sus diámetros. Si el orificio de entrada es mayor, el gradiente será
positivo, esto es, se necesitará una presión positiva para que el fluido
atraviese el segundo orificio.
B) Técnica
Se prefieren para la inserción de la VAG los cuadrantes superiores, con el
fin de evitar complicaciones infecciosas, y de modo especial el cuadrante
temporal superior, ya que los cuadrantes nasales están asociados a problemas de
motilidad ocular (27)
1. Suturas de tracción: Actualmente preferimos una sutura de 7/0 de
Vicryl® con aguja espatulada que se pasa a través de la mitad del espesor
corneal en la zona yuxtalímbica, en un lugar intermedio entre el meridiano de
las 12 horas y el lugar elegido para la inserción.
Alternativamente, se pueden colocar suturas de tracción en los músculos
adyacentes al lugar previsto para la inserción valvular de modo similar al
empleado en la cirugía del desprendimiento retiniano (figura 3).

Figura 3. Suturas musculares de tracción.
2. Peritomía: Aunque puede hacerse con base limbo, creemos que es
mucho más útil la peritomía con base fórnix, ya que permite una mejor
visualización del limbo distendido de los ojos buftálmicos, se seccionan
conjuntiva y Tenon conjuntamente y es técnicamente más sencilla de realizar y
de cerrar. Mide alrededor de 120° de cuerda para permitir sin dificultad el
paso de la VAG. Pueden utilizarse descargas radiales en los extremos. La
epiesclera es denudada hasta la región retroecuatorial, empleando disección
roma pero sin profundizar «a ciegas».
3. Comprobación de la función valvular: Se introduce una cánula o
aguja de 27-G en el orificio distal del tubo de silastic, para irrigar con suero
fisiológico todo el mecanismo valvular. Si no existen desperfectos, la
irrigación producirá la salida del suero a través del orificio valvular
posterior (figura 4), el de menor calibre y el único visible en la válvula tal
como se comercializa.
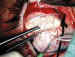
Figura 4. Comprobación del funcionamiento valvular.
4. Sutura de la VAG a la esclera: Utilizamos Dacron® de 5/0, que se
pasa a través de los hápticos de la VAG sin emplear las agujas, sino los cabos
distales de la sutura (figura 5). Preferimos actualmente realizar este paso
antes de suturar a la esclera, aunque es posible invertir el proceso, esto es,
pasar las agujas a través de la esclera y posteriormente los cabos a través de
los hápticos.
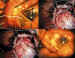
Figura 5. Sutura de la VAG a la esclera.
• Si existen vasos epiesclerales prominentes se pueden cauterizar en la
zona destinada a las suturas.
• Se recomienda la fijación a 8-10 mm del limbo (figura 6), si bien en los
cuadrantes nasales parece que no es prudente superar los 9 mm por una posible
compresión del nervio óptico (28).

Figura 6. Determinación de la correcta posición de la VAG con
compás (en este caso, a 9 mm del limbo).
• La VAG del tipo pediátrico tiene dos orificios posteriores para ayudar a
su anclaje en esclera (figura 7); se emplea el mismo tipo de sutura, pero la
dificultad es mayor, como puede suponerse.
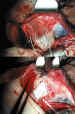
Figura 7. Sutura a la esclera de los hápticos posteriores en la VAG
pediátrica.
4. Tallado del colgajo escleral (figura 8): Empleamos
normalmente un colgajo de 4 ´
4 mm y mitad de espesor escleral, preparado del modo habitual en la
trabeculectomía.

Figura 8. Disección del colgajo escleral.
* Es posible la colocación del tubo directamente a través de una
paracentesis límbica, pero esta aproximación requiere el empleo de un
recubrimiento del tubo, bien con politetrafluoroetileno expandido (PTFEe), bien
con material homólogo (p.e. esclera).
5. Preparación del tubo: Se recorta para que penetre en cámara
anterior entre 2 y 3 mm, formando un bisel que apunte hacia el endotelio corneal
(figura 9).
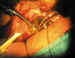
Figura 9. Sección del tubo. La penetración en cámara anterior
será de 2-3 mm.
6. Penetración en la cámara anterior: Se realiza con una aguja de
23-G (figura 10). Se levanta el colgajo escleral, se posiciona la punta de la
aguja inmediatamente anterior a la unión esclerolimbar y se punciona el limbo
siguiendo un trayecto paralelo al iris, con lentitud y controlando visualmente
en la medida de lo posible el avance de la aguja (a veces es necesario realizar
inserciones con edemas corneales severos). Acto seguido, se introduce el tubo en
cámara anterior (figura 11).

Figura 10. Paracentesis con aguja de 23-G para la introducción del
tubo valvular.
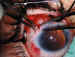
Figura 11. Introducción del tubo en la cámara anterior.
Como queda referido, es posible la colocación tubular con otros tipos de
acceso:
Inserción por vía límbica, mediante paracentesis directa: Esta
aproximación se realiza en los casos de grave adelgazamiento escleral,
generalmente en ojos buftálmicos poliintervenidos. Es necesario proteger el
tubo cerca de la paracentesis. Suele emplearse un parche de 4 ´
4 mm de los materiales antes comentados.
Inserción a través de la pars plana: Se reserva para los ojos
vitrectomizados, generalmente afáquicos. El tubo debe recubrirse también cerca
del lugar de su entrada en el globo.
8. Comprobación de la posición del tubo: El tubo debe seguir una
hipotética bisectriz angular, esto es, no aproximarse ni al iris ni al
endotelio corneal (figura 12).

Figura 12. Posicionamiento correcto del tubo: debe encontrarse en la
hipotética bisectriz angular.
9. Sutura del colgajo escleral: Empleamos dos puntos de nylon de 9/0 a
través de las dos esquinas posteriores del colgajo escleral.
En este momento se puede reformar la cámara anterior si se ha perdido
una cantidad importante de acuoso y no se recupera espontáneamente. Se realiza
a través de una paracentesis con aguja de 30-G e infusión de BSS plus®.
A la par, la irrigación de la cámara anterior pondrá en funcionamiento
la VAG, pudiendo comprobar el flujo a través de ella.
Es conveniente comprobar el correcto posicionamiento del tubo tras
replección de la cámara anterior. Puede ser necesario recolocarlo mediante una
nueva paracentesis si se aleja peligrosamente de la bisectriz angular. En gran
número de casos puede modificarse el trayecto de un tubo cercano a endotelio
mediante puntos de sutura esclerales yuxtalímbicos de nylon 9/0, a través del
colgajo escleral. Estas suturas tienden a dirigir el tubo hacia el iris.
Diversos autores preconizan la fijación del tubo valvular en todo su
trayecto, bien con suturas, bien con parches de recubrimiento (27).
10. Cierre de la peritomía: En las peritomías con base en el fórnix
se desepiteliza la córnea en su proximidad al limbo y se aplican dos puntos de
Vicryl® de 7/0 en los extremos, con paso de la sutura por la esclera subyacente
(figura 13). Es importante recubrir la VAG con la cápsula de Tenon también,
con el fin de evitar su exposición. Asimismo, se suturan las descargas radiales
con puntos sueltos del mismo tipo. La peritomía con base límbica se cierra con
una sutura continua, generalmente con Vicryl® de 7/0 o nylon de 9/0,
preferiblemente con agujas atraumáticas (cilíndricas).
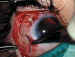
Figura 13. Cierre de la peritomía con base fórnix. Se aprecia
también la sutura del colgajo escleral.
11. Finalización del procedimiento: La cámara anterior debe quedar
reformada al final de la cirugía. Si ello no sucede espontáneamente se
procederá a paracentesis con aguja de 30-G e irrigación de BSS plus®. Se
aplica una pomada oftálmica con antibiótico-corticoide. El ojo es ocluido del
modo habitual.
CUIDADOS POSTOPERATORIOS
1. Medicación: Normalmente se mantiene la oclusión 24 horas.
Se pauta un colirio de antibiótico-corticoide cada 4 horas la primera
semana. Posteriormente se reduce la frecuencia según esta pauta orientativa:
2.ª semana: Cada 8 horas.
3.ª semana: Cada 12 horas.
4.ª semana: Cada 24 horas.
Se emplea ciclopentolato al 1% cada 6 horas durante 3 semanas.
2. Revisiones: El niño es dado de alta hospitalaria al 4.º día
postquirúrgico si no existen complicaciones aparentes, y se pautan revisiones
semanales durante un mes.
Si la PIO parece controlada y la evolución satisfactoria, se revisará
al mes siguiente.
Si existieran dudas acerca de la PIO y de la evolución, se planificará
una revisión tonométrica bajo anestesia general al mes postoperatorio. Las
revisiones en quirófano se repiten trimestralmente durante el primer año, si
no es posible evitarlas mediante el examen en consulta.
COMPLICACIONES
Se comentan las complicaciones más relevantes por su interés clínico. En
nuestra experiencia son infrecuentes y generalmente de escasa gravedad.
1. Intraoperatorias
Son extremadamente raras. Destacarían:
A. Lesiones en cristalino, iris o córnea por inadecuado trayecto de
la paracentesis.
B. Perforación escleral con el paso de una sutura de fijación: Es
posible en los globos buftálmicos, con escleras sumamente adelgazadas. Es
recomendable aplicar crioterapia alrededor de la perforación y recolocar la
sutura cerca de la primitiva: Frecuentemente el háptico puede ocluir la
perforación y actuaría como un pequeño explante escleral.
2. Postoperatorias
A. Hipo/atalamia: Esta complicación la hemos apreciado
particularmente en el síndrome de Sturge-Weber, unida a un desprendimiento
exudativo de coroides mínimo. Aparece durante el primer día postoperatorio y
en nuestra experiencia ha sido más infrecuente que con la cirugía filtrante
clásica. No se prolonga más de 48 horas y no deja secuelas.
B. Obstrucción tubular:
Cualquier tejido intraocular puede obstruir el tubo valvular, pero es
típico que el iris se incarcere en tubos con trayecto posterior y sin
bisel adecuado. Ocurre en el postoperatorio inmediato. Esta complicación se
trata mediante una iridectomía con láser en los niños mayores y
colaboradores, pero requiere una reintervención bajo anestesia general en los
más pequeños, valorando una posible recolocación tubular.
También el vítreo puede obstruir el orificio tubular en ojos
afáquicos con deficiente vitrectomía. Suele ocurrir en el postoperatorio
precoz, pero puede verse pasadas unas semanas. Esta complicación requerirá una
vitrectomía anterior con test intraoperatorio de la permeabilidad tubular,
mediante infusión en cámara anterior de BSS plus®. Puede emplearse aire para
descartar adherencias vítreas al orificio del tubo.
C. Hipertensión intraocular. Puede tener varios orígenes:
Dislocación tubular: Esta complicación puede deberse a una dislocación
de toda la válvula, por deficiente anclaje escleral. Parece motivada por
suturas superficiales en ojos con escleras adelgazadas. Pero es mucho más
frecuente contemplar una extrusión tubular producida por tejido cicatricial
epiescleral que tracciona del tubo hasta que desaparece de la cámara anterior.
Generalmente esta cicatrización se aprecia sobre el resto de la válvula,
comprometiendo también la filtración en el orificio de salida del acuoso.
Obstrucción tubular, que ya ha sido comentada.
Cicatrización perivalvular («am polla encapsulada»): Es, en nuestra
experiencia, la mayor fuente de fracasos en el control tensional. En la cirugía
de la revisión de la VAG en pacientes pediátricos es frecuente encontrar
cápsulas fibrosas de un grosor superior a 3 mm sobre las válvulas. Un
tratamiento posible es la decapsulación simple o unida a antimitóticos, que
ofrece resultados dispares (29,30). Actualmente parece más eficaz una
implantación de otra válvula (31). Una maniobra capaz de producir una
cicatrización en el interior valvular es la manipulación de la válvula
asiéndola de la zona donde reside su mecanismo, la cámara creada por las
membranas de silicona (32), por lo que debe evitarse el contacto con dicha
cámara.
D. Exposición: Se presenta con frecuencia, pero no suele tener
repercusión clínica. Si existe un test de Seidel positivo o el ojo está
irritado aconsejamos el cierre de la zona expuesta asociando un parche de PTFE-e
con el fin de prevenir nuevas exposiciones.
E. Problemas corneales:
En nuestra experiencia la complicación más frecuente producida por la
VAG es el contacto entre el tubo y endotelio. Creemos que se debe a la
extremada elasticidad del tubo y al proceso de cicatrización epiescleral que
tracciona el tubo de modo centrífugo. Por lo general se produce un edema
circunscrito a la zona de contacto, pero hemos visto casos en los que se ha
producido un englobamiento completo del tubo en el estroma corneal y su
posterior extrusión a través del epitelio. El proceso cursa
característicamente sin Seidel.
Existe la sospecha de que los implantes de Molteno pueden originar un
fallo endotelial en el injerto corneal (27), por un mecanismo que no parece
inmunológico (33). Sin embargo pueden estar implicados otros factores ajenos al
implante. En la VAG no parece existir esta problemática, si bien los implantes
combinados con queratoplastia en el mismo acto quirúrgico (figura 14) podrían
afectar negativamente a la supervivencia del injerto, contrariamente a los
implantes realizados tras la queratoplastia (34). Este tema es controvertido, y
existen trabajos con otros dispositivos de derivación en los que el riesgo de
descompensación del injerto es mayor si el implante se realiza tras la
queratoplastia (35,36). Se ha descrito un caso de glaucoma congénito severo
bilateral en el que se realizó cirugía combinada de queratoplastia e
inserción de VAG: Ambos injertos han permanecido estables más de 1 año (37),
a pesar de requerir múltiples cirugías para el control de su glaucoma.
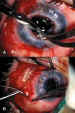
Figura 14. Procedimiento combinado queratoplastia-VAG. a) El tubo
puede recortarse tras su inserción, a través de la trepanación corneal; b)
Resultado final del procedimiento combinado.
F. Cataratas: El contacto entre el tubo valvular y la cristaloides
anterior produce generalmente una catarata localizada en el lugar del contacto,
sin repercusión visual.
G. Diplopía: Está asociada probablemente a la cicatrización
perivalvular, que puede generar adherencias entre el dispositivo y los
músculos, con un transtorno restrictivo de la motilidad (38). Es una
complicación más típica de los implantes de gran tamaño como el de Baerveldt
de 350 mm2 (38,39), y en las colocaciones nasales (27). Se ha descrito también
en la VAG (40), y en nuestra experiencia sí que existen limitaciones en la
elevación de algunos ojos con implante de VAG en el sector nasal superior.
RESULTADOS
No existen criterios uniformes para valorar el éxito en el control tensional
tras una implantación de este tipo de dispositivos en pacientes pediátricos,
comenzando por la necesidad o no de medicación antiglaucomatosa adicional y/o
de nuevos implantes. Lloyd refiere un 56% de éxitos a los 5 años, si bien a
varios pacientes se les implantaron dos dispositivos de Molteno (17). Parece que
una sola implantación produce un control en menos pacientes, llegando a un 34%
(15). Netland alcanza un 80% de éxitos a los dos años utilizando dispositivos
de Molteno y Baerveldt (41), pero con empleo de medicación antiglaucomatosa en
el 75% de los casos. Las cifras de éxito más altas se han obtenido con los
dispositivos de Molteno de doble anillo —Billson, 1989 (42)— y los de
Baerveldt —Fellenbaum, 1995 (19)—, consiguiendo un 78% y 86% de éxitos
pasado el año de evolución, respectivamente.
En lo referente a la VAG, Coleman (22) obtiene una supervivencia valvular del
60% a los dos años, asociando medicación en el 54%. Englert (23) obtiene un
58% en ese mismo lapso, con un 56% de ojos requiriendo medicación, por lo que
parece que el porcentaje de éxitos se sitúa en un 60% a los dos años, con un
60% de ellos precisando medicación antiglaucomatosa. Es de esperar que el
número de casos controlados se reduzca con el tiempo, tal como se ha apreciado
en el síndrome de Sturge-Weber (24), con cifras del 30% de ojos controlados a
los 5 años. No obstante, consideramos que estas cifras pueden mejorarse con el
incremento de la experiencia quirúrgica. Los resultados son parecidos a los de
la trabeculectomía con antimitóticos, tal como se veía en el capítulo
precedente, pero con menor índice de complicaciones, particularmente severas
(endoftalmitis).
En la actualidad parece que la VAG o dispositivos similares son la opción
más recomendable en el tratamiento del glaucoma pediátrico refractario.
BIBLIOGRAFÍA
- Mandal AK, Walton DS, John T, Jayagandan A. Mitomycin C-augmented
trabeculectomy in refractory congenital glaucoma. Ophthalmology 1997; 104:
996-1.003.
- Beck AD, William RW, Lynch MG, Lynn MJ, Noe R. Trabeculectomy with
adjunctive mitomycin C in pediatric glaucoma. Am J Ophthalmol 1998; 126:
648-657.
- al-Hazmi A, Zwann J, Awad A, al-Mesfer S, Mullaney PB, Wheeler DT.
Effectiveness and complications of mitomycin C use during pediatric glaucoma
surgery. Ophthalmology 1998; 105: 1.915-1.920.
- Mandal AK, Prasad K, Naduvilath TJ. Surgical results and complications of
mitomycin C-augmented trabeculectomy in refractory developmental glaucoma.
Ophthalmic Surg Lasers 1999; 30: 473-480.
- Sidoti PA, Belmomte SJ, Liebmann JM, Ritch R. Trabeculectomy with
mitomycin-C in the treatment of pediatric glaucomas. Ophthalmology 2000; 107:
422-429.
- Waheed S, Ritterband DC, Greenfield DS, Liebmann JM, Sidoti PA, Ritch R.
Bleb-related ocular infection in children after trabeculectomy with mitomycin C.
Ophthalmology 1997; 104: 2.117-2.120.
- Wagle NS, Freedman SF, Buckley EG, Davis JS, Biglan AW. Long-term outcome
of cyclocryotherapy for refractory pediatric glaucoma. Ophthalmology 1998; 105:
1.921-1.927.
- Klemm M, Harbeck W, Kohlhaas M. Cyclocryocoagulation in the treatment of
special types of glaucoma. Ophthalmologe 1995; 92: 556-559.
- Phelan MJ, Higginbotham EJ. Contact transscleral Nd:YAG laser
cyclophotocoagulation for the treatment of refractory pediatric glaucoma.
Ophthalmic Surg Lasers 1995; 26: 401-403.
- Bock CJ, Freedman SF, Buckley EG, Shields MB. Transscleral diode laser
cyclophotocoagulation for refractory pediatric glaucoma. J Pediatr Ophthalmol
Strabismus 1997; 34: 235-239.
- Hamard P, Kopel J, Valtot F, Quesnot, Hamard H, Haut J. Treatment of
refractory glaucoma by diode semiconductor laser cyclophotocoagulation. J Fr
Ophthalmol 1995; 18: 447-454.
- Yap-Veloso MI, Simmons RB, Echelman DA, Gonzales TK, Veira WJ, Simmons
RJ. Intraocular pressure control after contact transscleral diode
cyclophotocoagulation in eyes with intractable glaucoma. J Glaucoma 1998; 7:
319-328.
- Molteno ACB. Children with advanced glaucoma treated with draining
implants. S Afr Arch Ophthalmol 1973; 1: 55-61.
- Molteno ACB, Ancker E, Van Biljon G. Surgical technique for advanced
juvenile glaucoma. Arch Ophthalmol 1984; 102: 51-57.
- Hill RA, Heuer DK, Baerveldt G, Minckler DS, Martone JF. Molteno
implantation for glaucoma in young patients. Ophthalmology 1991; 98:
1.042-1.046.
- Munoz M, Tomey KF, Traverso C, Day SH, Senft SH. Clinical experience with
the Molteno implant in advanced infantile glaucoma. J Pediatr Ophthalmol
Strabismus 1991; 28: 68-72.
- Lloyd MA, Sedlak T, Heuer DK, Minckler DS, Baerveldt G, Lee MB, Martone
JF. Clinical experience with the single-plate Molteno implant in complicated
glaucomas: update of a pilot study. Ophthalmology 1992; 99: 679-687.
- Mills RP, Reynolds A, Emond MJ, Barlow WE, Leen MM. Long-term survival of
Molteno glaucoma drainage devices. Ophthalmology 1996; 103: 299-305.
- Fellenbaum PS, Sidoti PA, Heuer DK, Minckler DS, Baerveldt G, Lee PP.
Experience with the Baerveldt implant in young patients with complicated
glaucomas. J Glaucoma 1995; 4: 91-97.
- Eid TE, Katz LJ, Spaeth GL, Augsburger JJ. Long-term effects of
tube-shunt procedures on management of refractory childhood glaucoma.
Ophthalmology 1997; 104: 1.011-1.016.
- Coleman AL, Hill R, Wilson MR, Choplin N, Kotas-Neumann R, Tam M,
Bacharach J, Panek WC. Initial clinical experience with the Ahmed glaucoma valve
implant. Am J Ophthalmol 1995; 120: 23-31.
- Coleman AL, Smyth RJ, Wilson MR, Tam M. Initial clinical experience with
the Ahmed glaucoma valve implant in pediatric patients. Arch Ophthalmol 1997;
115: 186-191.
- Englert JA, Freedman SF, Cox TA. The Ahmed valve in refractory pediatric
glaucoma. Am J Ophthalmol 1999; 127: 34-42.
- Hamush NG, Coleman AL, Wilson MR. Ahmed glaucoma valve implant for the
management of glaucoma in Sturge-Weber syndrome. Am J Ophthalmol 1999; 128:
758-760.
- Da Mata A, Burk SE, Netland PA, Baltatzis S, Chisten W, Foster CS.
Management of uveitic glaucoma with Ahmed glaucoma valve implantation.
Ophthalmology 1999; 106: 2.168-2.172.
- Thomas JV. Filtering operation with scleral flap. In: Thomas JV ed.
Glaucoma surgery. St Louis: Mosby-Year Book; 1992:25-52.
- Rosenberg LF, Krupin T. Implants in glaucoma surgery. In: Ritch R,
Shields MB, Krupin T eds. The glaucomas. St Louis: Mosby; 1996; vol. III:
1.783-1.807.
- Leen MM, Witkop GS, George DP. Anatomic considerations in the
implantation of the Ahmed glaucoma valve. Arch Ophthalmol 1996; 114: 223-224.
- Lee D, Shin DH, Birt CM, Kim C, Kupin TH, Olivier MMG, Khatana AK, Reed
SY. The effect of adjunctive mitomycin C in Molteno implant surgery.
Ophthalmology 1997; 104: 2.126-2.135.
- Kook MS, Yoon J, Kim J, Lee MS. Clinical results of Ahmed glaucoma valve
implantation in refractory glaucoma with adjunctive mitomycin C. Ophthalmic Surg
Lasers 2000; 31: 100-106.
- Shah AA, WuDunn D, Cantor LB. Shunt revision versus additional tube shunt
implantation after failed tube shunt surgery in refractory glaucoma. Am J
Ophthalmol 2000; 129: 455-460.
- Hill RA, Pirouzian A, Lih-Huei L. Pathophysiology of and prophylaxis
against late Ahmed glaucoma valve occlusion. Am J Ophthalmol 2000; 129: 608-612.
- O´Day DG. Glaucoma after penetrating keratoplasty. In: Krachmer JH,
Mannis MJ, Holland EJ eds: Cornea. Surgery of the cornea and conjunctiva, vol
III, St Louis: Mosby-Year Book; 1997; 1.719-1.730.
- Coleman AL, Mondino BJ, Wilson MR, Casey R. Clinical experience with the
Ahmed glaucoma valve implant in eyes with prior or concurrent penetrating
keratoplasties. Am J Ophthalmol 1997; 123: 54-61.
- Beebe WE, Starita RJ, Fellman RL, Lynn JR, Gelender H. The use of Molteno
implant and anterior chamber tube shunt to encircling band for the treatment of
glaucoma in keratoplasty patients. Ophthalmology 1990; 97: 1.414-1.422.
- Rapuano CJ, Schmidt CM, Cohen EJ, Rajpal RK, Raber IM, Katz LJ, Wilson
RP, Laibson PR, Kremer I. Results of alloplastic tube shunt procedures before,
during, or after penetrating keratoplasty. Cornea 1995; 14: 26-32.
- Zacharia PT, Harrison DA, Wheeler DT. Penetrating keratoplasty with a
valved glaucoma drainage implant for congenital glaucoma and corneal scarring
secondary to hydrops. Ophthalmic Surg Lasers 1998; 29: 318-322.
- Munoz M, Parrish RK2d. Strabismus following implantation of Baerveldt
drainage devices. Arch Ophthalmol 1993; 1.096-1.099.
- Smith SL, Starita RJ, Fellman RL, Lynn JR. Early clinical experience with
the Baerveldt 350-mm2 glaucoma implant and associated extraocular muscle
imbalance. Ophthalmology 1993; 100: 914-918.
- Coats DK, Paysse EA, Orenga-Nania S. Acquired Pseudo-Brown´s syndrome
immediately following Ahmed valve glaucoma implant. Ophthalmic Surg Lasers 1999;
30: 396-397.
- Netland PA, Walton DS. Glaucoma drainage implants in pediatric patients.
Ophthalmic Surg 1993; 24: 723-729.
- Billson F, Thomas R, Aylward W. The use of two-stage Molteno implants in
developmental glaucoma. J Pediatr Ophthalmol Strabismus 1989; 26: 3-8.
|