|
INTRODUCCIÓN
En este capítulo se pretende resumir parte de la experiencia que de forma
ininterrupida durante más de 20 años ha conseguido la labor en equipo de
varias generaciones de oftalmólogos en el Hospital Clínico San Carlos de
Madrid, bajo la dirección del Prof. García Sánchez. En este Servicio de
Oftalmología se consiguió reunir con los años una casuística de glaucomas
congénitos y juveniles que, a pesar de la rareza de esta enfermedad, puede ser
considerada una de las más importantes a nivel mundial. Todo lo que se va a
exponer a partir de ahora proviene del quehacer cotidiano en la Sección de
Glaucoma de dicho Hospital donde tuve el privilegio de trabajar durante varios
años y ser un eslabón más de la larga cadena de la «Escuela de Glaucoma»
del Prof. García Sánchez.
Los criterios diagnósticos y terapéuticos, y sobre todo los conceptos,
aquí vertidos, son fruto de innumerables charlas, reflexiones y discusiones
acumuladas en el tiempo. Aquí van a estar plasmadas las experiencias del Prof.
Miralles, el Prof. Zato, el Dr. Fernández Vila y todos aquellos que de una u
otra forma nos hemos acercado al problema del glaucoma congénito poniendo
nuestro granito de arena, y sobre todo la del Prof. García Sánchez, que ha
sido la persona que de forma ininterrumpida ha seguido esta evolución durante
todos estos años.
TERMINOLOGÍA
Desde que Collins (1) en 1893 y Cross en 1896 (2) determinaron como probable
causa del glaucoma congénito la alteración en el desarrollo embrionario de las
estructuras del ángulo iridocorneal, han sido muchos los que han llegado a la
misma conclusión (3,4), en el sentido que sería una alteración en este
desarrollo lo que determinaría una elevación en la presión intraocular y
secundariamente el desarrollo de glaucoma.
Los llamados glaucomas del desarrollo son un grupo de enfermedades
caracterizadas por un defectuoso desarrollo del sistema de drenaje del humor
acuoso y aunque el glaucoma puede no manifestarse hasta la edad adulta, la
mayoría se presentan en la infancia.
El desarrollo incompleto del segmento anterior puede llevar a distintas
formas de glaucoma. Con el término de glaucoma congénito se ha
designado clásicamente aquellos casos en los que el glaucoma se pone de
manifiesto en los primeros años de vida. Si la alteración en el segmento
anterior es más leve, provocaría una elevación de la presión más tardía,
dando lugar al denominado glaucoma juvenil. Esta terminología ha sido
abandonada por muchos autores al considerar que la edad no puede ser criterio
para una clasificación (5). Otros autores (4,6) consideran al glaucoma juvenil
como un glaucoma congénito tardío que aparece habitualmente después de los 4
años. A esta edad la resistencia parietal del globo ocular es tan similar a la
del adulto que ya no se producirían alteraciones morfológicas clínicamente
detectables. La clínica y el comportamiento de estos pacientes nos obliga a
considerar dos entidades totalmente distintas, que precisan un tratamiento y un
seguimiento diferentes en ambos grupos.
I. GLAUCOMA CONGÉNITO
I.1. Definición
Dentro de los glaucomas del desarrollo, el Glaucoma Congénito Primario es
una enfermedad que se manifiesta en los primeros meses de la vida caracterizada
por la existencia de una alteración en el desarrollo de la malla trabecular y
estructuras angulares, no asociada a otras anomalías oculares o enfermedades
sistémicas, y que va a condicionar una elevación patológica de la presión
intraocular y secundariamente una lesión glaucomatosa del nervio óptico y
alteraciones anatómicas en el globo ocular.
I.2. Epidemiología
El glaucoma congénito primario presenta una incidencia de 1/10.000 a 15.000
recién nacidos (0,01 a 0,04%) según los diferentes estudios (7-9); alcanzando
incluso 1 de cada 1.250 en la población gitana de Eslovaquia (10). Si se
considera el glaucoma infantil (incluyendo glaucomas complicados) la incidencia
alcanza el 1/2.000.
En un estudio español analizando 1.124.654 nacimientos consecutivos para
estudiar las malformaciones oculares congénitas, la prevalencia del glaucoma
congenito en el naciemiento es de 2.85/100.000 (11).
Aparece de forma bilateral en el 75-80% de los casos, existiendo una
predilección por el sexo masculino del 53% al 68% en USA y Europa (7-9,12-14),
mientras que en el Japón (8) existe un predominio de mujeres (63%). La mayoría
(más del 80%) se manifiestan antes del año de edad.
I.3. Herencia
Habitualmente la aparición del glaucoma congénito es esporádica. En el 10%
existen antecedentes familiares con un patrón de herencia autosómico recesivo
(8,13,14), aunque la penetrancia es muy variable (40-80%) y se cree que se debe
a un patrón multifactorial. En algunas familias la aparente transmisión
vertical se puede explicar por pseudo-dominancia. La frecuencia de los casos
esporádicos se puede ser debida a la falta de penetrancia (40%), la rareza del
gen, las nuevas mutaciones y la existencia de fenocopias (13).
La asociación del glaucoma congenito con anomalías cromosómicas es muy
frecuente, habiéndose reconocido en más de 17 autosomas diferentes (16).
Desde el punto de vista del consejo genético podría estimarse el riesgo de
presentar glaucoma congénito para los hermanos o descendientes de un niño
afectado en el 3%-4%.
La forma autosómica recesiva del glaucoma congénito primario (símbolo del
gen GLC3) se ha mapeado recientemente en dos loci diferente, GLC3A en 2p21 y
GLC3B en 1p36, respectivamente, en familias de origen turco, gitanos eslovacos y
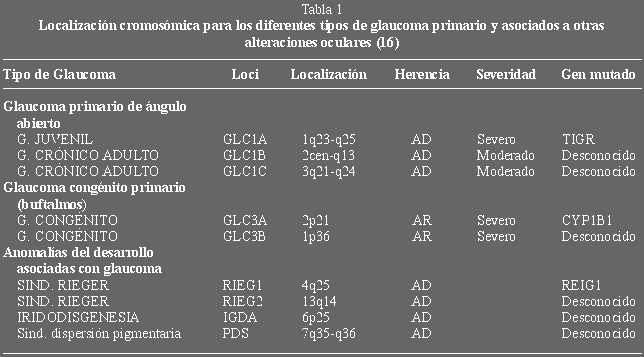
de Arabia Saudita (tabla 1) (16).
Las mutataciones del gen del citocromo P4501B1(CYP1B1) (17), se han
identificado como la causa principal de la enfermedad (18), vinculando el
glaucoma congénito primario al locus GLC3A en el cromosoma 2p21. Podría ser
que los miembros de la familia del citocromo P450 podría controlar los procesos
de crecimiento y diferenciación (19-21). Las mutaciones en el 1p36 aún no se
han identificado.
Con el extraordinario progreso que se ha realizado en el desarrollo de la
genética en esta enfermedad, en un futuro muy próximo se podrá determinar el
riesgo individual de una familia, permitiendo un seguimiento efectivo y la
instauración de un tratamiento precoz (22).
Las goniodisgenesias se heredan de forma dominante (23) y en la misma familia
pueden existir glaucomas congénitos puros, tardíos, juveniles y/o congénitos
del adulto.
I.4. Clasificación
Aunque existen varias clasificaciones de los glaucomas congénitos, la más
utilizada es la de Shaffer-Weiss (12) (tabla 2) que los clasifica desde un punto
de vista etiológico en:
A) Glaucoma congénito primario: en el que la anomalía se
circunscribe al desarrollo del ángulo camerular.
B) Glaucoma asociado a otras anomalías oculares o sistémicas.
C) Glaucomas secundarios a otras enfermedades oculares, como traumatismos,
infección o tumores.
Aunque frecuentemente se engloban los dos últimos grupos como glaucomas
complicados.

Hoskins y Shaffer en 1984 (24) presentan una nueva clasificación basándose
en las características anatomopatológicas observadas en 250 casos de glaucoma
infantil, según que la estructura más afecta de la cámara anterior sea la
malla trabecular, el iris o la córnea. Esta clasificación permite una mayor
precisión en la descripción de los casos y permite predecir un pronóstico
quirúrgico, además de conseguir una estandarización de la terminología
(tabla 3). En esta clasificación se distingue:
a) Trabeculodisgenesias aisladas: presentes en aproximadamente el 50%
de los glaucomas infantiles y juveniles. No existen alteraciones en la córnea o
iris salvo las secundarias a la hipertensión ocular prolongada.
b) Iridodisgenesias: además de las alteraciones referidas, pueden
verse en el ángulo procesos, vasos anómalos o adherencias iridocorneales. En
el iris podemos encontrar:
—Defectos del estroma anterior: la hipoplasia es lo más frecuente, y se
caracteriza por ausencia o marcada reducción de las criptas iridianas con
malformación del collarete, apareciendo muy prominente el esfínter pupilar.
Hay que diferenciar la hipoplasia de la atrofia o adelgazamiento normal
secundario al aumento de presión y distensión ocular. La hiperplasia del iris
es poco frecuente y tiene una apariencia engrosada y aterciopelada. Puede verse
a veces en el Síndrome de Sturge-Weber.

— Anomalías de los vasos iridianos: puede existir persistencia de la
túnica vasculosa lentis, con vasos que penetran en el área pupilar, o bien
existir vasos superficiales sobre la superficie del iris, que habitualmente se
asocian a distorsión de la pupila y/o áreas de hipoplasia del estroma
anterior. La existencia de estos vasos se asocia a mal pronóstico.
— Anomalías estructurales del iris: pueden variar desde pequeños agujeros
que no afecten el esfínter a colobomas completos. Su grado más grave es la
aniridia.
c) Corneodisgenesias: a parte del aumento de tamaño y opacidad
secundarias al aumento de tensión ocular pueden existir defectos en la córnea
periférica, medioperiférica o central o bien anomalías en su tamaño. En la
mayoría de los casos se asocian defectos iridianos. El glaucoma en estos casos
suele tener peor pronóstico.
— Anomalías periféricas: anomalía de Axenfeld, en la que existen bridas
de tejido iridiano adherentes a una línea de Schwalbe muy prominente
(embriotoxon posterior).
— Anomalías medioperiféricas: anomalía de Rieger, en la que hay amplias
adherencias del iris a córneas opacificadas que se extienden hasta la zona
central, asociadas a policoria y corectopia.
— Anomalías centrales: anomalía de Peters, en la que el collarete del
iris está adherido al centro de la córnea, que suele estar opacificada y a
veces adelgazada. La córnea periférica entre el limbo y el leucoma central
suele estar transparente.
— Anomalías del tamaño: la microcórnea se asocia a múltiples anomalías
congénitas (microftalmos, nanoftalmos, anomalía de Rieger, persistencia del
vítreo primario y rubeola congénita). Podemos encontrar megalocórnea en el
Síndrome de Axenfeld y en la megalocórnea hereditaria recesiva ligada al
cromosoma X.
I.5. Clínica
Los síntomas clásicos presentes en el glaucoma congénito son epífora,
fotofobia, blefarospasmo; y los signos observables, el aumento de tamaño y la
opacidad de la córnea en fases más avanzadas; siendo este último el signo
clínico inicial más frecuente y la causa más habitual de consulta, ya que la
megalocórnea y la epífora pueden pasar desapercibidas en muchos casos.
En el ojo del niño la presión intraocular elevada sobre un globo con menor
rigidez escleral va a provocar una distensión generalizada del mismo que se
traducirá en alteraciones a nivel de las distintas estructuras oculares.
En la córnea se van a producir unas rupturas en la membrana de Descemet
(estrías de Haab), que se manifiestan como aumento súbito del edema corneal,
con aumento del lagrimeo y epífora. Pueden ser únicas o múltiples y se
visualizan como líneas paralelas en la parte posterior de la córnea. Más
tarde, el endotelio se extiende sobre ellas desapareciendo el edema. Pueden ser
asintomáticas o provocar un astigmatismo irregular que afecte en mayor o menor
medida la visión.
A nivel del limbo y córnea periférica se produce un crecimiento
compensatorio del tejido epiescleral y conjuntival, que adopta la forma de una
semiluna blanquecina evidente sobre todo en el limbo superior.
Si la hipertensión ocular no se controla, la clínica empeorará y el
aumento de tamaño de la córnea y las rupturas en la membrana de Descemet
darán lugar a la cicatrización, erosiones y finalmente a ulceraciones de la
córnea.
La afectación de la zónula en forma de distensión y ruptura puede dar
lugar a la subluxación del cristalino.
Como consecuencia de todas estas alteraciones anatómicas estos ojos quedan
con una debilidad manifiesta de forma que si estos ojos sufren traumatismos
contusos, fácilmente se pueden producir hifemas e incluso rupturas del globo,
llegando en último término a la ptisis bulbi (25,26).
A partir de los 3-4 años, el crecimiento del globo ya no suele progresar
pero la esclera sigue conservando su elasticidad (se estima que hasta los 10-11
años) pudiendo dar lugar a una miopía rápidamente progresiva, que debe
considerarse como un signo sospechoso de glaucoma (aunque la progresión de la
miopía simple es frecuente en el niño), siendo más significativo cuando se
trata de una anisometropía (27).
La aparición de un nistagmus, es poco frecuente en el glaucoma congénito y
su existencia es la expresión de un déficit visual grave.
Aunque el niño mayor puede quejarse de dolor, esto es excepcional.
Habitualmente, cuando el inicio de la hipertensión ocular secundaria a glaucoma
congénito se produce a partir de los tres años de edad no existen síntomas
hasta que la pérdida de campo visual se hace evidente.
I.6. Diagnóstico
El diagnóstico de presunción se basa en la clínica y en este sentido es
primordial la colaboración del pediatra como primer eslabón de la cadena
diagnóstica. La inespecificidad de la clínica hace que la sospecha del cuadro
sea fundamental para el inicio del examen diagnóstico concreto.
La confirmación se basará en la determinación de la presión intraocular
(P.I.O.) y en la presencia de signos específicos. Aunque la mayoría de los
autores consideran que la P.I.O. en el niño varía en una rango similar a la
del adulto, diversos estudios como los de Sampaolesi (28) y Domínguez (29)
demuestran que es alrededor de 5 mm Hg inferior a la del adulto.
La edad del niño es un factor claramente diferenciador de la estrategia
diagnóstica a utilizar. En la mayoría de los casos, los niños mayores de 5
años, y si son especialmente cooperadores a partir de 3 años, pueden ser
explorados en consulta sin problemas, de forma que el examen sin anestesia puede
darnos el diagnóstico con un alto grado de certeza.
Es posible realizar varias exploraciones importantes como: la evaluación de
la función visual, biomicroscopia, oftalmoscopia, retinoscopia e incluso la
tonometría con un aparato manual (el sistema de tonometría Tono-pen y los
pneumotonómetros manuales pueden resultar muy útiles).
En el glaucoma congénito primario la P.I.O. suele estar claramente elevada,
oscilando entre 30-40 mm Hg, aunque siempre una P.I.O. de 20 ó más mm Hg debe
ser considerada como altamente sospechosa.
Las exploraciones en la sospecha de glaucoma congénito están condicionadas
por el hecho de ser necesario realizarlas bajo anestesia general. En este
sentido es importante tener preparado el protocolo quirúrgico para que, si se
confirma el diagnóstico, se proceda inmediatamente y en la misma anestesia a la
intervención quirúrgica.
La secuencia diagnóstica bajo anestesia general es:
1. Medida de los diámetros corneales: la determinación del diámetro
corneal es una medida del grado de distensión secundaria a la hipertensión
ocular. Los valores normales varían en función del crecimiento normal del
globo ocular por lo que sus valores se modifican de acuerdo a la edad del niño:
en el recién nacido el diámetro normal horizontal es de 9,5-10,5 mm, a los 5-6
meses es de 11 mm, puede llegar a 11,5-12 mm al año de edad, y como máximo
puede medir 12,5 mm a los 3 años. La medida debe considerarse desde el punto en
que aparecen las primeras fibras blancas en el limbo hasta el punto opuesto en
el limbo del otro lado. Es fundamental realizar una buena medida inicial que nos
sirva de referencia para el control posterior. Se considera como medida más
fiable el diámetro horizontal ya que, la determinación del diámetro vertical
es menos definitoria al existir un ensanchamiento del limbo da lugar a un
embriotoxon anterior muy pronunciado en la zona superior, con lo que la
medición es más inexacta. Se consideran sospechosas de glaucoma congénito
medidas de 12-12,5 en niños menores de 1 año y de 13 mm o más a cualquier
edad. A partir de la primera medición, el tamaño de la córnea aporta
información no sólo para el diagnóstico, sino también para el seguimiento
del control del proceso. El aumento progresivo del diámetro corneal indica
control inadecuado del glaucoma, independientemente de la determinación de la
PIO, aunque hay que tener en cuenta que cambios inferiores a 0,5 mm no son
valorables.
2. Exploración de segmento anterior: debe realizarse con lámpara de
hendidura si es posible, y si no, con una linterna y una lupa. Hay que explorar
la córnea valorando el grado de transparencia, la existencia de estrías y/o
roturas de la capa de Descemet y el grado de edema. En fases más avanzadas la
córnea puede tener un aspecto opalescente o puede mostrar zonas opacas en las
áreas correspondientes a roturas de la Descemet. Hay que identificar la
presencia de alteraciones asociadas en iris o córnea. Esta exploración tiene
también valor pronóstico ya que permite valorar el abordaje quirúrgico que
podrá realizarse en función de la transparencia de medios (foto 1).
En aquellos casos en los que la transparencia de los medios no permita la
exploración los nuevos biomicroscopios ultrasónicos puede ser de gran utilidad
(30).
3. Gonioscopia: por las características del glaucoma en el recién
nacido en ocasiones es difícil de valorar por la pérdida de transparencia
corneal. Si la turbidez corneal dificulta la gonioscopia puede mejorarse la
transparencia eliminando el epitelio corneal o aplicando glicerina tópica
preoperatoriamente. Cuando esto sucede es importante dejar esta exploración
para el final ya que impediría una correcta determinación de los otros
exámenes diagnósticos.

Foto 1. Estrías de Haab.
Puede utilizarse cualquier lente de gonioscopia de las usadas habitualmente
en la clínica (Goldman, Koeppe, Ritch, etc.). La lente de Worst tiene la
ventaja de que proporciona la misma visualización del ángulo que se obtendrá
en el momento operatorio por lo que aporta también información de las
posibilidades quirúrgicas en caso de goniotomía (foto 2 ).

Foto 2. Lente gonioscópica de Worst, durante una goniotomía.
La apariencia del ángulo en el recién nacido y niño pequeño tiene unas
características propias y es distinta a la del adulto. Durante los cuatro
primeros años de vida postnatal, continúa el crecimiento de los componentes
del ángulo. Así en el niño, el iris en la periferia presenta un estroma
anterior delgado, especialmente en los ojos azules, de forma que las arcadas
pigmentadas son fácilmente visibles; esto no es una hipoplasia del estroma
anterior sino un desarrollo incompleto que posteriormente terminará. Las capas
uveal y córneo-escleral de la malla trabecular han aumentado de tamaño,
longitudinalmente, mientras las células de la raíz del iris permanecen con una
configuración reticular (25).
La inserción del iris es normalmente plana, anclándose en el ángulo
detrás del espolón escleral, dejando expuesto el cuerpo ciliar. Es raro
observar en un ojo normal que el iris se ancle en la malla trabecular o anterior
al espolón escleral. En la pared externa del ángulo vemos la línea de
Schwalbe, el trabeculado escleral, de color gris un poco más oscuro, el
espolón escleral y la banda del cuerpo ciliar de un color más oscuro. En la
pared interna vemos la base y raíz del iris.
Cuando existe un retraso en la separación del iris de la pared angular puede
ser el resultado de una trabeculodisgenesia, siendo este grado de separación lo
que distingue una configuración normal u anómala.
Es característico ver una especie de triángulos oscuros de base externa que
corresponden a la capa pigmentaria del iris, que se transparenta por el escaso
desarrollo del estroma iridiano anterior. Separando estos triángulos existen
unos cordones más claros que corresponden al tejido conectivo que acompaña los
vasos radiales del iris. Dentro de los triángulos pueden verse cordones no
vasculares. En la base más externa de los triángulos existe una zona más
clara rosada que corresponde al tejido conectivo del círculo arterial mayor del
iris y que forma una banda más clara y rosada justo por detrás de la banda
ciliar.
Pueden existir restos del tejido mesodérmico que le dan al ángulo una
apariencia aún más redondeada y que se ven como una fina membrana transparente
y de superficie granular, pero sólo podremos ver esta estructura si la
buscamos. Cuando los restos mesodérmicos están pigmentados o son opacos
ocultan las estructuras que se hallan por debajo del mismo, van desde la raíz
del iris hasta la pared externa, a veces hasta la altura del canal de Schlemm,
en forma de arborizaciones, y corresponden a los procesos iridianos que a veces
pueden verse en el adulto. Hay que diferenciar entre la base y la raíz del
iris. La base del iris corresponde al nivel de terminación del último pliegue
circular del iris. La raíz del iris se extiende desde la base hasta la banda
del cuerpo ciliar. Los procesos mesodérmicos normales no pueden avanzar más
que hasta la raíz del iris.
El receso normal del ángulo se desarrolla progresivamente en los primeros
6-12 meses de vida.
Por la gran fragilidad de las estructuras angulares la información obtenida
de los exámenes anatomopatológicos no es totalmente fidedigna. Ademas pocas
muestras histopatológicas son representativas, pues la gran parte provienen de
ojos alterados con intervenciones quirúrgicas y con glaucoma absoluto.
Anderson (6) señaló que la mayoría de los investigadores no han
clarificado que características morfológicas del ángulo camerular, en los
ojos con glaucoma congénito, son propios de ojos infantiles y cuáles son las
que distinguen el glaucoma congénito del ojo infantil normal.
En 1940 Castelli describió la histología del ángulo irido corneal de un
niño de dos meses, con glaucoma congénito no intervenido. Observó que el
canal de Schlemm estaba alterado y parcialmente ausente, el espolón escleral
era hipoplásico; la malla uveal era abundante, con una superficie cóncava
hacia la cámara anterior. La malla córneo-escleral era compacta y pobremente
desarrollada. Había una hipoplasia de la uvea (2).
Barkan (3) indicó que la membrana que tapiza normalmente el ángulo, en el
glaucoma congénito se hace menos transparente, e impermeable, denominándose
membrana de Barkan y ésta impediría el flujo del humor acuoso. Son muchos los
autores que han observado esta membrana, sin embargo la naturaleza de ésta es
muy discutida y muchos autores cuestionan su auténtica existencia.
Anderson (6) 1971, mostró mediante scanning y microscopia de transmisión,
que la membrana descrita en estos pacientes, representa las capas más internas
de la malla uveal. Muchos autores han observado la configuración fetal del
ángulo camerular en el glaucoma congénito, formada por un tejido mesodérmico
embrionario idéntico a aquel que constituye el trabeculum primitivo de los ojos
de los fetos (23). Sampaolesi (28) indica que la histología del glaucoma
congénito presenta el mismo aspecto que el seno camerular en el séptimo mes de
desarrollo intrauterino.
Por todo lo expuesto la configuración del ángulo camerular del glaucoma congénito es un tema muy controvertido y en resumen podemos considerar
patológicos los siguientes hallazgos gonioscópicos (25):
— Membrana transparente, brillante por delante de la malla trabecular
(Membrana de Barkan). Actualmente se piensa que es una imagen gonioscópica
características de las formas precoces de glaucoma congénito y no una
alteración anatomo-patológica.
— Inserción anterior del iris. Es característico que en el niño con
glaucoma congénito primario no se vea la banda ciliar (queda oculta). La raíz
del iris se inserta próxima a la línea de Schwalbe o sobre ella (foto 3).

Foto 3. Inserción alta de iris.
Restos mesodérmicos, a veces vascularizados. Suelen contener acúmulos más
o menos intensos de pigmento. Su mayor o menor gravedad estará en función de
la cantidad de ángulo que esté ocupado por estos restos mesodérmicos. (fotos
4 y 5).

Foto 4. Restos mesodérmicos.

Foto 5. Restos mesodérmicos vascularizados.
4. Tonometría bajo anestesia general: éste continúa siendo un tema
controvertido. Cualquier sustancia farmacológica utilizada en la inducción de
la anestesia general va a influir en mayor o menor grado en la presión
intraocular.
No deben darse barbitúricos o narcóticos previamente porque bajan la
P.I.O., la única premedicación aconsejable es la atropina. Puede usarse la
ketamina o anestésicos inhalatorios con o sin intubación. La ketamina aumenta
la PIO. Los anestésicos inhalatorios bajan la P.I.O. proporcionalmente al grado
de profundidad de la anestesia.
Es fundamental que en cada exploración se utilice siempre la misma pauta de
inducción a la anestesia para que las cifras de PIO obtenidas puedan ser
valorables.
Podemos considerar como cifras de referencia, aunque luego siempre hay que
individualizar cada caso, las siguientes:
— PIO inferior a 15 mmHg, en la primera determinación, con presencia de
signos de sospecha de glaucoma congénito: se debe repetir la exploración antes
del mes.
— PIO entre 15-20 mmHg, sin signos acompañantes de sospecha de glaucoma
congénito: se debe repetir la exploración.
— PIO entre 15-20 mmHg con signos claros de glaucoma congénito: se
confirma el diagnóstico de glaucoma congénito y se pauta tratamiento
quirúrgico.
— PIO superior a 21 mmHg, se confirma el diagnóstico de glaucoma
congénito y se pauta tratamiento quirúrgico.
En caso de disparidad entre la cifra de presión intraocular y el resto de la
exploración hay que tener en cuenta que la determinación de la presión
intraocular, sobre todo condicionada por el hecho de ser tomada bajo anestesia
general, no es un valor absoluto y hay que considerar factores asociados (31).
Así en un estudio realizado por la Academia de Oftalmología de Nueva
Orleans, comparando los resultados de la PIO en niños normales y glaucomatosos
se encontró (32):
Glaucoma (n=169) Normales (n=74)
< 21 mmHg 14 < 15 mmHg 26
21-24 mmHg 10 15-21 mmHg 39
> 24 mmHg 145 21-24 mmHg 4
Sin embargo, también hay que tener en cuenta que en la clínica diaria la
experiencia nos dice que las cifras de PIO claramente elevadas confirman el
diagnóstico de glaucoma congénito.
5. Oftalmoscopia: la excavación de la papila es un signo precoz y
ocurre antes y con tensiones más bajas que en el adulto, probablemente debido a
la mayor elasticidad de los tejidos en el niño y a la falta de desarrollo del
tejido conectivo de la lámina cribosa. Robin (33) en su serie de glaucoma
congénito observa una excavación media de 0,68±0,24 siendo ésta más acusada
verticalmente. Además los cambios en el disco óptico del niño difieren de la
de los adultos: el canal escleral se elonga secundariamente a la elevación de
la PIO, y el diámetro del canal escleral aumenta más horizontal que
verticalmente. Así en estos glaucomas el tamaño de la excavación puede venir
determinado por la pérdida de tejido neural, por la elongación del canal
escleral o por una combinación de ambos. Quigley en estudios histológicos
(34,35), ha observado que mientras el tejido neural, glial y elementos
vasculares de la cabeza del nervio óptico tienen la configuración del adulto
ya durante la gestación, el tejido conectivo de la lámina cribosa presenta un
desarrollo incompleto en el nacimiento.
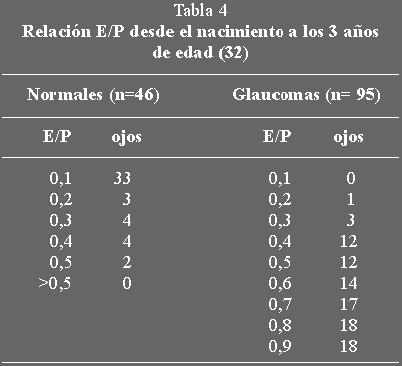
La excavación en el niño suele ser redondeada, muy central y profunda. Se
considera patológico una excavación mayor de 0,4, o una asimetría mayor a 0,2
(25) (tabla 4). Cuando la PIO se normaliza, la excavación puede permanecer
estable o puede disminuir, de forma muy evidente en el niño menor de 1 año
(foto 6).
Foto 6. Papila con excavación glaucomatosa.
Por las características de la excavación patológica en el niño su
existencia confirma el diagnóstico, pero no guarda relación con la gravedad
del proceso ni puede usarse como criterio de control del glaucoma.
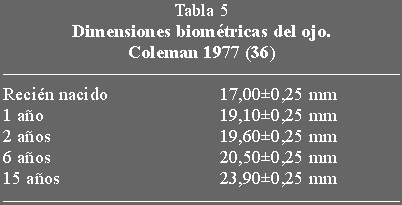
6. Determinación de la longitud axial: Es una exploración
fundamental en el glaucoma congénito. Su importancia viene determinada no tanto
por el interés en la confirmación del diagnóstico como en el seguimiento del
control del proceso glaucomatoso en el tiempo. Tanto es así, que desde nuestro
punto de vista es la exploración fundamental en el postoperatorio no pudiendo
considerar controlado un glaucoma congénito mientras el eje antero-posterior
del ojo siga aumentando independientemente que los valores tensionales puedan
parecer normales.
Los valores pueden solaparse con los del ojo normal por lo que es necesario
establecer una comparación con los valores considerados como normales para cada
edad (tabla 5).
7. Retinoscopia: una vez controlada la tensión ocular, la
determinación de la refracción bajo cicloplejía es siempre necesaria y
especialmente importante en los casos de glaucoma unilateral, para compensar la
diferencia de graduación y evitar la aparición de la ambliopía
anisometrópica.
8. Exploración sistémica: para detectar posibles anomalías
asociadas y como preparación a la anestesia.
I.6.1. Diagnóstico diferencial
I. Otros glaucomas
1. Glaucomas con asociación de alteraciones del desarrollo sistémico:
Síndrome de Rubenstein-Taybi, Síndrome de Sturge-Weber, Síndrome de Loewe,
etc.
II. Causas de aumento del tamaño corneal y de edema de la córnea
1. Megalocórnea: aumento anómalo del diámetro corneal hasta valores
comprendidos entre 14 y 16 mm, pero con ausencia de signos de glaucoma
congénito como hipertensión ocular, excavación papilar patológica y/o
estrías de Haab. El 90% de los casos afecta a varones con una herencia ligada
al sexo.
2. Miopía magna: puede presentar aumento marcado del eje antero-posterior
del ojo y córnea de mayor tamaño del normal pero con ausencia de otros signos
de glaucoma congénito.
3. Enfermedades del metabolismo pueden presentar edema corneal y cierto grado
de opacidad corneal: cistinosis, mucopolisacaridosis y mucoliposis.
4. Distrofia endotelial hereditaria congénita: puede cursar con edema
corneal con posible lagrimeo y fotofobia en el nacimiento o a los 2 años de
edad.
5. Trauma obstétrico: puede provocar rupturas en las membranas de Descemet
con imagen de estrías.
6. Enfermedades inflamatorias: queratitis, iridociclitis pueden provocar
edema corneal, especialmente la queratitis de la rubeola que se manifiesta en el
recien nacido.
III. Causas de epífora y/o fotofobia
1. Distrofia endotelial hereditaria congénita.
2. Obstrucción del conducto lacrimonasal en el recién nacido.
3. Conjuntivitis del recién nacido.
IV. Anomalías del nervio óptico
1. Fosetas papilares.
2. Colobomas del nervio óptico (foto 7).
3. Hipoplasia del nervio óptico (foto 8).
4. Papilas oblicuas y crecientes papilares en miopía axial (foto 9).
5. Excavaciones papilares amplias fisiológicas (foto 10).
I.7. Tratamiento
I.7.1. Tratamiento médico

Foto 7. Coloboma del nervio óptico.

Foto 8. Síndrome de Morning Glory.

Foto 9. Papilas oblicuas con creciente papilar en miopía axial.
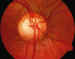
Foto 10. Papila de excavación amplia fisiológica.
No existe ninguna posibilidad de tratamiento médico del glaucoma congénito
sea cual sea el fármaco empleado. Solamente se puede recurrir a la utilización
de fármacos hipotensores en situaciones especiales y muy concretas y siempre de
forma transitoria. Estas situaciones son:
— Falta de transparencia de medios por edema corneal en el momento de la
sospecha de glaucoma:
En estos casos, si se piensa que reduciendo la cifra de presión intraocular
se puede mejorar la transparencia corneal para facilitar la exploración
diagnóstica y el posterior abordaje quirúrgico, puede utilizarse pilocarpina
1% en forma de colirio cada 4 horas asociada a colirio de ClNa (antiedema).
Habitualmente con esta pauta es suficiente, no siendo necesario incrementar el
número de fármacos hipotensores.
— Demora en la cirugía:
No es infrecuente que en los niños, sobre todo de corta edad, existan
afecciones de las vías respiratorias altas que recomienden diferir la anestesia
general. En estos casos se instaura una pauta terapéutica de pilocarpina 1%
cada 6 horas, con el fin de reducir en lo posible la cifra de PIO y al mismo
tiempo facilitar el abordaje quirúrgico del ángulo iridocorneal si se va a
realizar una goniotomía. El uso de betabloqueantes suele estar muy restringido
por sus efectos secundarios adversos, que en el caso de niños menores de 1 año
tienen mayor repercusión.
— Intervalo entre cirugías:
Como se verá más adelante, no es infrecuente la necesidad de reintervenir
en los glaucomas congénitos. Durante los controles postoperatorios hasta
decidir la actitud quirúrgica puede ser conveniente asociar tratamiento médico
hipotensor si el tiempo entre intervenciones va a ser prolongado. La pauta
terapéutica será igual que en el apartado anterior.
— Fracaso quirúrgico:
La única situación en la que el tratamiento médico hipotensor en el
glaucoma congénito puede prolongarse en el tiempo es ésta. Cuando después de
agotar todas las posibilidades quirúrgicas no se ha conseguido controlar la
hipertensión ocular y existe un claro riesgo de progresión del déficit visual
no queda otra alternativa que asociar tratamiento médico hipotensor. En esta
situación la pauta terapéutica deberá, como es lógico, adaptarse a cada caso
en particular pero puede inicarse con monoterapia de betabloqueantes en forma de
colirio y en caso de ser necesario recurrir también a asociaciones
medicamentosas con inhibidores de la anhidrasa carbónica tópicos
(dorzolamida). La estrategia terapéutica en estos casos es similar a la
utilizada en el glaucoma primario de ángulo abierto del adulto.
I.7.2. Tratamiento quirúrgico
El tratamiento del glaucoma congénito, sea cual sea su forma, es única y
exclusivamente quirúrgico. Como se ha señalado en el apartado anterior,
actualmente no existe ninguna forma de tratamiento médico de esta enfermedad.
Las técnicas quirúrgicas que pueden utilizarse para el tratamiento del
glaucoma congénito son:
— Goniotomía.
— Trabeculotomía.
— Trabeculectomía.
Cada una de ellas tiene su lugar en la estrategia quirúrgica, aunque existen
diferencias muy significativas entre los resultados obtenidos con cada una de
ellas. Desde nuestro punto de vista, y desde nuestra experiencia la técnica de
elección para el tratamiento del glaucoma congénito es la goniotomía.
Esta técnica es la única que actúa directamente sobre la causa de la
hipertensión ocular en el recién nacido y al mismo tiempo es la que presenta
unos mejores resultados a largo plazo en el control de la enfermedad. Sin
embargo, el estado del ojo en el momento del diagnóstico de glaucoma congénito
va a hacer que en ocasiones el abordaje quirúrgico para la goniotomía no sea
posible y sea necesario recurrir a otras técnicas quirúrgicas de segunda
elección.
Goniotomía
La técnica quirúrgica de la goniotomía está muy sistematizada habiendo
presentado pocos cambios desde su primera descripción por Barkan. Los puntos de
mayor interés son:
Fuente de iluminación:
aunque se han utilizado diversas formas de
iluminación del campo quirúrgico, la única fuente de luz que permite una
correcta visualización y una magnificación suficiente del ángulo iridocorneal
es la luz del microscopio coaxial. Las únicas limitaciones que presenta son la
necesidad de una suficiente transparencia corneal, la capacidad del microscopio
de modificar su ángulo de incidencia sobre la córnea y el hecho de que el
cirujano debe trabajar más alejado del campo quirúrgico. Solo en caso de no
poder realizar la goniotomía con el microscopio quirúrgico puede recurrirse a
la utilización como fuente de luz de un oftalmoscopio binocular indirecto.
Gonioscopio:
es quizá la parte fundamental en la goniotomía ya que va a
permitir la correcta visualización del campo quirúrgico durante toda la
cirugía. Existen diversos modelos en el mercado y cualquiera de ellos reúne
las condiciones necesarias para la correcta visualización del ángulo, sin
embargo nosotros preferimos el gonioscopio fenestrado de Worst ya que permite un
campo amplio de visualización de las estructuras angulares y al mismo tiempo el
hecho de estar fijado al globo ocular, lejos de ser un inconveniente, supone la
ventaja de permitir al cirujano su movilización facilitando las maniobras del
goniotomo durante la cirugía. Durante los momentos previos a su colocación
sobre el globo ocular es aconsejable mantener el gonioscopio sumergido en una
solución que disminuya la tensión superficial con lo que se mejora las
características de visualización del instrumento (foto 11).
Goniotomo:
habitualmente el utilizado es el goniotomo hidrostático de
Worst, que permite mediante la irrigación continua el lavado del sangrado que
con frecuencia se produce al lacerar los restos mesodermicopretrabeculares
vascularizados y al mismo tiempo, aunque en menor medida permite mantener un
cierto grado de amplitud de la cámara anterior. Esta circunstancia se ha visto
mejorada notablemente con el uso de viscoelásticos durante la cirugía, que
posibilitan una buena amplitud de la cámara anterior y una distensión del
ángulo facilitando el paso del goniotomo.

Foto 11. Gonioscopio de Worst.
Incisión:
la punción con el goniotomo a nivel del limbo esclero-corneal
supone a nuestro criterio el punto crítico de la cirugía de goniotomía. Es el
único momento en que entramos en cámara anterior con un instrumento punzante
«a ciegas» y la mayor atención se centra en la visualización inmediata de la
punta del goniotomo en la cámara anterior. Es en este momento quirúrgico
cuando pueden suceder las principales complicaciones de la goniotomía derivadas
de la lesión directa con el goniotomo de las estructuras de la cámara anterior
(endotelio corneal, iris, cristalino) (foto 12).

Foto 12. Visualización de la incisión con el goniotomo a través
de la lente gonioscópica de Worst durante la goniotomía.
Goniotomía:
el otro momento clave durante la cirugía es la colocación
correcta de la punta del goniotomo sobre las estructuras angulares de manera que
al desplazarse rasge los restos mesodérmicos que tapizan el ángulo y no otras
estructuras. Una situación excesivamente anterior, lesionará el endotelio
corneal y una muy posterior podrá producir una iridodiálisis. Cuando el
goniotomo está correctamente colocado se visualiza una línea de color
blanquecino que no es otra cosa que la zona trabecular libre de restos
mesodérmicos. Cuando al desplazar el goniotomo se observa movimiento del iris e
incluso un cierto grado de plegamiento quiere decir que está situado por debajo
de la zona y está desplazando la raíz del iris. El recorrido del goniotomo
debe ser tan amplio como lo permita la visualización a través del gonioscopio.
Al finalizar esta maniobra se retira el goniotomo, no precisando ninguna sutura
corneal, dando por finalizada la cirugía (fotos 13 y 14).

Foto 13. Recorrido del goniotomo liberando el ángulo iridocorneal
de los restos mesodérmicos.

Foto 14. Visualización del ángulo libre de restos mesodérmicos
una vez terminada la goniotomía.
Como preparación a la goniotomía es recomendable la instilación previa de
pilocarpina 1% con la finalidad de reducir el tamaño pupilar y ampliar el
ángulo iridocorneal.
En el niño menor de 3 años con córnea transparente está indicada siempre
como primera elección la goniotomía, siendo la técnica preferida por la
mayoría de los autores entre 1 y 24 meses de edad, ya que no altera la
conjuntiva y actúa únicamente sobre los tejidos del trabéculo superficial. En
los niños menores de 1 mes suelen asociarse anomalías del iris que empeoran
los resultados, mientras que los mayores de 2 años suelen tener peor respuesta
a la goniotomía. En los niños mayores de 3 años, y aquellos menores de 3
años con opacidad corneal que limite la visión del segmento anterior, la
trabeculotomía será la técnica de elección y en caso de fracaso de ésta, la
trabeculectomía. Es fundamental que el tratamiento quirúrgico se haga
precozmente, antes de que la compresión prolongada de las estructuras
trabeculares por la hipertensión intraocular impida su reapertura.
Trabeculotomía
Al igual que sucede con la goniotomía, es una técnica complicada y require
gran experiencia por parte del cirujano. La técnica utilizada es la de Harms
(1969) usando el trabeculotomo de dos ramas de Harms para la canalización del
canal de Schlemm. El inconveniente de esta técnica es la dificultad de
canalizar el canal de Schlemm con el trabeculotomo y en caso de conseguirlo la
gran tendencia que tiene a cicatrizar la trabeculotomía realizada. En nuestra
corta experiencia con esta técnica los resultados han sido prácticamente nulos
por lo que no la utilizamos, sin embargo otros autores reportan resultados
satisfactorios en el control del glaucoma congénito (37).
En caso de fracaso de ambas técnicas o de ausencia de transparencia corneal,
estará indicada la trabeculectomía.
Trabeculectomía
La técnica quirúrgica empleada es la misma que la descrita por García
Sánchez (38) para el tratamiento quirúrgico del glaucoma primario de ángulo
abierto. Las únicas características diferenciales radican en dos hechos (foto
15):
— La esclera de los niños suele ser más delgada y más en los glaucomas
congénitos al estar distendida, por esto es aconsejable que el colgajo escleral
superficial sea más grueso para garantizar su superviviencia en el tiempo.
— La disección para entrar en lamelas corneales debe ser más pronunciada
al estar también distendido el limbo esclero-corneal.
Foto 15. Trabeculectomía en glaucoma congénito.
Dado que la principal complicación es el fallo secundario atribuido a un
exceso de cicatrización, algunos autores aconsejan el uso de moduladores de la
cicatrización. El 5-fluouracilo solo es utilizado de forma preoperatoria de
igual manera que la mitomicina C y solo será aplicable en casos seleccionados
(39). Algo parecido sucede con la inyección subconjuntival intraoperatoria
(antes de abrir la conjuntiva) de un corticoide de acción prolongada como la
triamcinolona que puede mejorar el pronóstico. Nosotros no somos partidarios
del uso de antimitóticos de primera intención en el tratamiento quirúrgico
del glaucoma congénito por los grandes y graves riesgos que puede comportar una
dosis inadecuada en una esclera adelgazada y con posibilidad de mayor
distensión en el futuro. Solamente en casos de reintervenciones en niños de
más de 12 años de edad y en casos muy seleccionados utilizamos mitomicina C.
En casos de glaucomas congénitos resistentes al tratamiento y en edades en
las que el crecimiento del ojo está estancado preferimos el uso de implantes
valvulares tipo Ahmed pediátrico para controlar la hipertensión ocular (foto
16).

Foto 16. Implante valvular en glaucoma congénito.
ESTRATEGIA TERAPÉUTICA
1. Primera cirugía:
a) Córnea transparente: GONIOTOMÍA
b) Córnea opaca: TRABECULOTOMÍA
TRABECULECTOMÍA
2. Reintervencion:
a) Fracaso de 1.ª goniotomía: GONIOTOMÍA (hasta recorrer todo el ángulo
irido-corneal).
b) Fracaso de goniotomía: TRABECULECTOMÍA
c) Fracaso de trabeculectomía:
TRABECULECTOMÍA + Mitomicina C/5-Fu VÁLVULA DE AHMED PEDIÁTRICA.
CONTROL POSTOPERATORIO
Tras la cirugía, el primer control se realizará en la primera semana, y
después al mes, cada 3 meses durante el primer año y en caso de control del
proceso, cada 6 meses hasta los 4 años de edad. A partir de aquí los controles
serán anuales.
El examen postoperatorio seguirá la misma sistemática que el de
diagnóstico de glaucoma congénito. Sin embargo, el valor que cada parámetro
de la exploración tiene es diferente. Lógicamente, la cifra de PIO tiene
importancia en el concepto de control de la enfermedad pero no es el único ni
el más importante. Desde nuestro punto de vista el parámetro más objetivo y
menos influenciable por factores ajenos a la enfermedad (como la anestesia
general) es la medida del eje antero-posterior del globo ocular. Hasta tal punto
esto es así, que con incrementos superiores a 1,5 mm del eje antero-posterior
entre exploraciones consecutivas, independientemente de la cifra de PIO
consideramos que el glaucoma congénito está descontrolado y requiere
nuevamente tratamiento quirúrgico.
Cuando el tratamiento inicial ha tenido éxito, el pronóstico funcional en
el glaucoma congénito primario es bueno, con buen control tensional, nervio
óptico estable y campos visuales habitualmente sin afectación.
En los casos en los que la cirugía ha sido tardía o no ha controlado
adecuadamente la P.I.O. en los primeros momentos existe un crecimiento marcado
del ojo, aunque luego se normalice la PIO. En estos casos, además de la atrofia
del nervio óptico y defectos campimétricos secundarios, la distensión del
polo posterior puede contribuir a disminuir la visión por distorsión y
elongación de la región macular.
I.7.3. Rehabilitación visual
Las alteraciones en el tamaño del globo ocular secundarias a la
hipertensión ocular en el glaucoma congénito, sobre todo en el aumento del eje
antero-posterior del ojo van a condicionar una serie de defectos de refracción
más o menos importantes en función de la gravedad del caso. Esto unido al
hecho de que habitualmente estos glaucomas son asimétricos y en ocasiones
unilaterales condiciona la aparición de anisometropías.
La ignorancia de este fenómeno y de su repercusión sobre la función
visual, ha dado lugar en ocasiones a déficits importantes en la función visual
incluso ceguera legal en casos en los que el control tensional después de la
cirugía había sido un éxito.
Actualmente no se puede abordar el tratamiento de un glaucoma congénito si
no se dispone también de un servicio de rehabilitación visual que coordine el
tratamiento de la ambliopía secundaria a la anisometropía resultante en todos
los casos.
I.7.4. Resultados
En nuestra experiencia tenemos estudiada una muestra de un total de 573 casos
diagnosticados de glaucoma congénito y tratados todos ellos quirúrgicamente en
un período de tiempo comprendido entre 1969 y 1999 en la Sección de Glaucoma
del Servicio de Oftalmología del Hospital Clínico San Carlos de Madrid.
En esta muestra el 79% de los casos fueron glaucomas congénitos bilaterales,
sin significación estadística en cuanto a la afectación por sexos.
Desde el punto de vista gonioscópico se encontró:
— Inserción alta de iris 50%
— Restos mesodérmicos 42%
— Procesos de iris 8%
La edad media al momento del diagnóstico fue de 2,9±4,58 meses, mientras
que la edad media al momento del diagnóstico en nuestro centro fue de
6,8±10,40 meses. Una vez confirmado el diagnóstico la primera cirugía se
realizó con una edad media de 8,77±21,95 meses.
En algunos casos los pacientes venían previamente diagnosticados de glaucoma
congénito y con tratamiento médico previo instaurado en el centro de origen
(tabla 6).

En la exploración realizada para confirmar el diagnóstico de glaucoma
congénito los parámetros clínicos fueron:
• PIO (anestesia general) 26,46±,74 mmHg
• Diámetro corneal horizontal 12,21±1,26 mm
• Longitud axil globo ocular 20,94±2,03 mm
• Relación E/P papilar 0,4±0,23
Por las características de los glaucomas en el momento del diagnóstico se
pudo realizar goniotomía como técnica de elección en el 63,33% de los ojos y
en el 36,66% se tuvo que realizar trabeculectomía por imposibilidad de realizar
goniotomía.
Si analizamos el número de intervenciones quirúrgicas que fue necesario
realizar en los casos tratados con goniotomía y en los tratados con
trabeculectomía se observa que fue mayor el número de cirugías en los casos
con trabeculectomía primaria. Esto concuerda con el hecho de que los ojos en
los que no se puede realizar de primera intención una goniotomía es porque
presentan un peor estado de transparencia ocular y consecuentemente se trata de
glaucomas más avanzados y la mayoría de las veces de aparición más precoz lo
que empeora el pronóstico final (figuras 1 y 2, tablas 7 y 8).

Figura 1. Porcentaje de ojos tratados con goniotomía como primera
intervención.

Figura 2. Porcentaje de ojos tratados con trabeculectomía como
primera intervención.


El control conseguido con goniotomía fue significativamente superior al
obtenido con la trabeculectomía. En los ojos operados con goniotomía se obtuvo
el control del proceso en un 75,40% de los ojos intervenidos. Con la
trabeculectomía solo se obtuvo el control en el 58,70% de los casos, siendo
necesario en un 41,30% asociar tratamiento médico hipotensor por fracaso de la
cirugía. Estos resultados concuerdan con lo expresado anteriormente en cuanto a
la gravedad de los casos en función de la técnica quirúrgica empleada (figura
3).

Figura 3. Porcentaje de casos controlados con cada una de las
opciones terapéuticas.
La probabilidad de control de la enfermedad en los ojos tratados aparece
reseñada en la figura 4.

Figura 4. Probabilidad de control de los ojos tratados.
La evolución de la PIO en el primer año del postoperatorio con ambas
técnicas fue similar, siendo menor la PIO media obtenida con goniotomía
(figura 5).

Figura 5. Evolución de la PIO en el primer año postoperatorio.
Los datos referentes a evolución del diámetro corneal y de la longitud
axial después de la cirugía se reflejan en las figuras 6 y 7 respectivamente.

Figura 6. Evolución del diámetro corneal horizontal en el primer
año del postoperatorio.

Figura 7. Evolución de la longitud axial del ojo en el primer año
del postoperatorio.
Las complicaciones quirúgicas con cada una de las técnicas quirúrgicas
aparecen reseñadas en la tabla 9.

I.8. Rehabilitación visual
Tienen especial importancia como se comentó en el apartado de tratamiento
del glaucoma congénito la rehabilitación visual de la ambliopía resultante de
la anisometropía secundaria al aumento de la longitud axil del ojo.
Los controles realizados a los pacientes se han llevado a cabo con la misma
periodicidad que las otras exploraciones, indicando la corrección óptica
necesaria lo más precozmente posible después de la normalización de la cifra
de presión introcular.
La pauta seguida en nuestros pacientes fue la siguiente:
— Adaptación de lente de contacto para corregir la anisometropía, siempre
que fue posible. Contrariamente a lo que algunos piensan, no existe ninguna
contraindicación para la adaptación de lentes de contacto en ojos con glaucoma
congénito. La dificultad viene dada por el mayor tamaño de la córnea que
obliga a utilizar en ocasiones radios especiales para las lentes de contacto.
— Oclusión total y directa del ojo dominante. La pauta a seguir se
individualiza en cada caso, pero como esquema se puede decir que:
• Niños menores de 1 año: oclusiones horarias.
• Niños mayores de 1 año: oclusión total y directa a razón de 1 semana
por año de edad hasta un máximo de 3 semanas del ojo dominante y 1 día el ojo
ambliope.
Con esta pauta de tratamiento de la ambliopía las revisiones deben
realizarse cada 15 días y se irá modificando la pauta en función de la
evolución de cada caso en particular.
En nuestros casos, la aparición de ambliopía en mayor o menor grado fue en
un 70,69% de todos los casos diagnosticados y tratados. Cuando el glaucoma
congénito fue monolateral la ambliopía se produjo en un 94,82% de los ojos,
mientras que cuando la afectación fue bilateral la ambliopía apareció en el
60,30% de los casos (figura 8).

Figura 8. Porcentaje de ambliopías secundarias a glaucoma
congénito.
Si analizamos el grado de ambliopía resultante en función de la edad en la
que se inicia la rehabilitación después del control del glaucoma congénito se
observa que hay diferencias muy significativas entre lo conseguido antes y
después de los 4 años de edad. Cuando la rehabilitación visual se inicia
antes de los 4 años de edad los resultados de ambliopía leve son moderadamente
satisfactorios (55,17%), mientras que a partir de esta edad existe un pequeño
porcentaje de ojos con ambliopía leve y sin embargo se incrementa notablemente
el número de ambliopía profundas, llegando hasta un 76,93% en mayores de 6
años (figura 9, tabla 10).

Figura 9. Grado de ambliopía en función de la edad de
rehabilitación.

Como resumen, se puede concluir que el glaucoma congénito es una enfermedad
infantil altamente invalidante, que suele provocar un déficit importante de la
función visual a pesar del tratamiento y que la única posibilidad de impedir
ó al menos limitar esta evolución hacia la ceguera se basa en los mismos tres
pilares que el resto de enfermedades:
1.º Diagnóstico precoz.
2.º Cirugía precoz.
3.º Rehabilitación visual precoz.
AGRADECIMIENTOS
Al Dr. P. Gili Manzanaro, de la Fundación Hospital Alcorcón, por su
colaboración en la iconografía.
BIBLIOGRAFÍA
- Collins ET. Congenital defects of the iris and glaucoma. Trans Ophthalmol
Soc U K. 1893; 13: 114.
- Cross FR. Congenital hidrophthalmos. Trans Ophthalmol Soc U K. 1896; 16:
340.
- Lagrange F. Traitement du glaucoma infantile. Bull Soc Ophtalmol Fr 1925;
38: 189.
- Löhlein W. Das glaukom der jugendlichen. Albrecht v Graefes Arch Ophthal
1913; 85: 393.
- Becker B, Shaffer R. Diagnosis and therapy of the glaucomas. 2nd ed. St.
Louis; 1961.
- Anderson JR. Hidrophthalmia or congenital glaucoma. Cambridge University
press 1939.
- Goldwyn R, Waltman SR, Becker B. Primary open-angle glaucoma. Arch
Ophthalmol 1970; 84: 579-582.
- DeLuise VP, Anderson DR. Primary infantile glaucoma (congenital glaucoma).
Surv Ophthalmol 1983; 28: 1-19.
- García Sanchez J, Zato M, Fernández-Vila PC. Glaucoma congénito. Madrid;
1982; 16-17.
- DeLuise VP, Anderson DR. Primary infantile glaucoma (congenital glaucoma).
Surv Ophthalmol 1983; 28: 1-19.
- García Sanchez J, Zato M, Fernández-Vila PC. Glaucoma congénito.
Madrid; 1982; 16-17.
- Gencik A. Epidemiology and genetics of primary congenital glaucomain
Slovakia: description of a form of primary congenital glaucoma in gypsies with
autosomal dominant inheritance and complete penetrance. Dev Ophthalmol. 1989;
16.76-115.
- Bermejo E, Martínez-Frías ML. Congenital eye malformations:
clinical-epidemiological analysis of 1,124,654 consucutive biths in Spain. Am J
Med Genet 1998; 75: 497-504.
- Shaffer RN, Weiss DI. Congenital and pediatric glaucomas. St. Louis;
1970; 37.
- François J. La prèdisposition génetique au glaucoma. J Fr Ophtalmol
1980; 3: 6-7.
- François J. Congenital glaucoma and its inheritance. Ophthalmologica,
Basel; 1980; 181: 61-73.
- Lotufo D, Ritch R, Szmyd L, Burris JE. Juvenile glaucoma, race, and
refracción. JAMA. 1989; 261: 249-281.
- Sarfafazi M. Recent advances in molecular genetics of glaucomas. Hum Mol
Genet 1997; 6(10): 1.667-1.688.
- Bejjani BA, Lewis RA. Tomey KF, anderson KL, Dueker DK, Jabak M, AstleWF,
Otterud B, Leppert M, Lupski JR. Mutations in CYP1B1, the gene for cytochrome
P4501B1, are the predominant cause of primary congeenital glaucoma in Saudi
Arabia.Am J Hum Gent 1998; 62: 325-333.
- Plasilova M, Ferakova E, Kadasi L, Polakova H, Gerinec A, Ott J, Ferak V.
Linkage of autosomal recessive primary congenital glaucoma to the GLC3A locus in
roms (gypsies) from Slovakia. Hum Hered 1998; 48: 30-33.
- Bejjani ba, Stockton DW, Lewis RA, Tomey KF, dueker Dk, Jaba AstleWF,
Lupski JR. Multiple CYP1B1 mutations and incomplete penetrance in inbred
population segregating primary congenital glaucoma frequent de novo events and a
dominant modifier locus. Hum Mol Genet 2000 Feb 12; 9(3): 367-374.
- Stoilov I, Akarsu AN, Alozie I, Child A, Barsoumhomsy M, Turacli ME, Or M,
Lewis RA, Ozdemir N, Brice G, Aktan SG, Chevrette L, Cocaprados M, Sarfarazi M.
Sequence analysis and homology modeling suggest that primary congenital glaucoma
on 2p21 results from mutations disrupting either the hinge region or the
conserved core structures of cytochrome P4501B1. Am J Hum Genet 1998; 62:
573-584.
- Damji KF. Advances in molecular genetics of glaucoma: a perspective
clinician. Semin Ophthalmol 1999 Sep; 14(3): 171-179.
- Nguyen RL, Sharath CR, Traboulsi EI: Screening relatives of patients with
familial chronic open angle glaucoma. Ophthalmology 2000; 107: 1.294-1.297.
- Jerndal T. Congenital glaucoma due to dominant goniodysgenesis.. Am J Hum
Genet 1983; 35: 645-651.
- Hoskins HD, Shaffer RN, Hetherington J. Anatomical classification of the
developmental glaucomas. Arch Ophthalmol 1984; 102: 1.331-1.336.
- Wong PC, Dickens CJ, Hoskins HD. The developmental glaucomas. In: Tasman
W, Jaeger EA, eds. Duane’s Clinical Ophthalmology.Vol 3. Philadelphia: J.B.
Lippincott Company, 1995; 1-18.
- Shields MB. Glaucomas del desarrollo con anomalías asociadas. In:
Panamericana, ed. Glaucoma Shields. 2nd ed. Buenos Aires: Ester Lewi A, 1987;
208-222.
- Quinn GE, Berlin JA, Young TL, Ziylan S, Stone RA. Association of
intraocular pressure and myiopia in children. Ophthalmology 1995; 102(2):
180-185.
- Sampaolesi R. Nuevos avances en glaucoma congenito. Highlights of
Ophthalmolgy. Panamá, 1987; 4: 5-8.
- Domínguez A, Baños MS, Álvarez MG, Contra GF, Quintela FB: Intraocular
pressure measurement in infants under general anesthesia. Am J Ophthalmol 1974;
78: 110-115.
- Dietlein TS, Engels BF, Jacobi PC, Krieglstein GK. Ultrasound
biomicroscopic patterns after glaucoma surgery in congenital glaucoma.
Ophthalmology 2000; 107: 1.200-1.205.
- Cioffi GA. Goniotomy and trabeculotomy.In:Weinreb RN, Mills RP. Glaucoma
surgery.Second edition. American Academy of ophthalmology. San Francisco. LEO,
1998; 196-203.
- Ritch R, Shields MB, in The Glaucomas, Vol 2, Cap 42 pag 776, Mosby Co
1989.
- Robin AL, Quigley HA, Pollack IP. An analysis of visual acuity, visual
fields, and disk cupping in childhood glaucoma. Am J Ophthalmol 1979; 88:
847-858.
- Quigley HA. The pathogenesis of reversible cupping in congenital
glaucoma. Am J Ophthalmol 1977; 84(3): 358-370.
- Quigley HA. Childhood glaucoma.Results with trabeculotomy and study of
reversible cupping. Ophthalmology 1982; 89(3): 219-226.
- Coleman. Ultrasonic measurement of eye dimensions. Ophthalmic biometry
using ultrasond. Int Ophthal Clin 1969; 9: 667.
- Olsen KE, Huang AS, Wright MM. the efficacy of goniotomy/trabeculotomy in
early-onset glaucoma associated with the Sturge –Weber syndrome. J AAPOS 1998
Dec; 2(6): 365-368.
- García Sánchez J, Lázaro C, García Feijoó J. Resultados de la
macrotrabeculectomia en el glaucoma. In: Honrubia FM. Actualización en el
tratamiento del glaucoma. Aula Médica Ediciones: Madrid 1999; 136-146.
- Azuara-Blanco A, Wilson RP, Spaeth GL, Schmidt CM, Augsburg C. Filtration
procedures supplementd with mitomycin C in the management of chilhood glaucoma.
Br J Ophthalmol 1999 Feb; 83(2): 151-156.
|