|
II. GLAUCOMA JUVENIL
II.1. Definición
El término glaucoma juvenil designa a un grupo heterogéneo de
pacientes que son diagnosticados de glaucoma, entre los 4 y los 39 años de
edad. Con este término se engloba a todas aquellas diferentes clases de
glaucomas presentes en este rango de edad.
En general podemos considerar dos grandes grupos:
El glaucoma juvenil con alteraciones en el desarrollo del ángulo
iridocorneal o goniodisgenesias también denominados síndromes de clivaje.
Aquellos glaucomas en los que el estudio gonioscópico es totalmente
normal, siendo la causa desconocida (1,2), pudiendo considerarse glaucomas
primarios de ángulo abierto de aparición precoz.
Por otra parte esta subdivisión crea problemas al ser difícil en muchos
casos distinguir entre los hallazgos gonioscópicos normales y anómalos; pues
estas anomalías del ángulo varían en los diferentes estudios y algunas de
éstas parecen estar en relación con la gonioscopia. Además, la existencia de
ojos con goniodisgenesias que no llegan a desarrollar glaucoma parecen indicar
que estas anomalías no son la causa principal de la hipertensión ocular (1-3).
II.2. Epidemiología
Pocas series de glaucoma juvenil han sido publicadas; Goldwyn (4) encontró
28 casos de glaucoma primario de ángulo abierto en 4.000 pacientes consecutivos
en una evaluación por glaucoma, sugiriendo una prevalencia aproximada del 0,7%.
La relación hombre:mujer, es de 1,8:1 según varios autores (4-6), a diferencia
del glaucoma primario de ángulo abierto en pacientes mayores (7), donde no
existe predilección por ningún sexo. Jerndal (8) no observa diferencias en
relación con el sexo.
En el Health Interview Survey (9) de 1976 a 1977, que analiza la incidencia
del glaucoma en grupos de edad, observan que en menores de 45 años esta
incidencia es de 0,1%, frente al 1,1 de los 45 a 64 años y del 3,9% en mayores
de 65 años.
II.3. Herencia
Numerosos autores (8,10-15) están de acuerdo en que el glaucoma juvenil se
transmite con una herencia autosómica dominante. Incluso este glaucoma ha sido
denominado glaucoma hereditario juvenil, pues se transmite con este
patrón de herencia, afecta a ambos sexos por igual y generalmente está
presente en todas las generaciones sin saltar ninguna. Así cuando un progenitor
está afecto, el 50% de los hijos padecerán glaucoma.
En nuestra serie, de 123 glaucomas juveniles encontramos diversos patrones
hereditarios, confirmando la herencia autosómica dominante. Como ejemplo
característico de este patrón se muestra el arbol genealógico de una de las
familias estudiadas (figura 1).
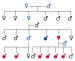
Figura 1. Árbol genealógico de una de las familias con glaucoma
juvenil y un patrón autosómico dominante.
Azul:sujetos sanos. Rojo: sujetos afectos de la enfermedad.
Sheffield (14) en 1993, revisando los miembros de una familia con glaucoma
juvenil y herencia autosómica dominante, familia publicada previamente por
Johnson (11), observó en estos pacientes un gen anómalo en el cromosoma 1-q
(GLC1A) en la región 21-31. Posteriormente, Richards y Lichter (15) en 1994
analizando una gran familia caucasiana con 16 miembros afectos de glaucoma
juvenil, encuentran de nuevo una anomalía en el brazo largo del cromosoma 1 en
la región 21-44. En poco tiempo han sido muchos los estudios en familias de
todo el mundo que han confirmado estos hechos (16-18).
En 1997, Stone (19) y otro 14 investigadores de diferentes laboratorios
publicaron la identificación del gen TIGR asociándolo al glaucoma juvenil y al
glaucoma primario de ángulo abierto. El gen GLC1A (MYOC/TIGR) es un gen
conocido del glaucoma de ángulo abierto juvenil que codifica la proteína de la
miocilina. Ésta es una proteína citoesquelética que participa en la
morfogénesis del cuerpo basal, un centro organizador de microtúbulos, del
epitelio ciliado. La miocilina es prácticamente idéntica a la proteína TIGR,
proteína de respuesta a los glucocorticoides inducida por la malla trabecular
(20). La expresión del gen de respuesta a los glucocorticoides inducido por la
malla trabecular aumenta progresivamente desde niveles apenas detectables hasta
más del 2% del ARNm celular total durante una exposición de 10 días de las
células de la malla trabecular a la dexametaxona. La organización genómica
del MYOC/TIGR está determinada por 3 exones (regiones de codificación)
separados por 2 intrones. Así el gen tiene una gran región promotora de 5
kilobases que controla la expresión del gen (58,59). El TIGR ha sido mapeado de
forma detallada por fluorescencia en el cromosoma 1q23-q24 (21).
Hasta nuestros días se han registrado 26 mutaciones diferentes en la
secuencia del gen TIGR todas ellas asociadas a glaucomas juveniles o glaucomas
primarios de ángulo abierto del adulto (22). E incluso en algunos casos se han
asociado mutaciones específicas con un curso clínico determinado de glaucoma.
Posteriormente se han identificado diferentes mutaciones. Pero en absoluto todos
los casos de glaucoma juvenil tienen mutaciones en este gen lo que indica que
son necesarios más descubrimientos de otros genes que estén también
implicados en esta enfermedad (22,23). Son necesarios estudios prospectivos del
poder predictivo de las mutaciones de este gen y de otros loci para determinar
la utilidad clínica del estudio genético ante la detección y tratamiento de
estos casos de glaucoma.
II.4. Clínica
A diferencia de los glaucomas congénitos, estos glaucomas presentan escasa
sintomatología siendo extraordinariamente difícil su diagnóstico precoz,
apareciendo como un hallazgo casual dentro de una exploración oftalmológica
rutinaria. En nuestra serie, sobre 123 pacientes que presentaron glaucoma
juvenil en un total de 231 ojos, el 39,3% de los glaucomas fueron diagnosticados
al acudir a la consulta por disminución de agudeza visual, siendo este hecho
consecuencia del gran porcentaje de patología ocular asociada: miopía,
estrabismos, nistagmus, ambliopías, que explicaría la revisión oftálmica.
Por el contrario, en los glaucomas con goniodisgenesias, el 64,86% de los
diagnósticos han sido realizados al acudir los pacientes a revisión, sin más
sintomatología; ello podría ser debido a los numerosos casos con antecedentes
familiares lo que llevaría a estos pacientes a la consulta al estar muy
sensibilizados con el problema de carácter hereditario. Así esta mínima
sintomatología explicaría el alto porcentaje glaucomas en estados avanzados de
nuestra serie.
II.5. Diagnóstico
La estrategia diagnóstica del glaucoma juvenil, no difiere de la del adulto
y se basa principalmente en la tonometría, la gonioscopia, la oftalmoscopia del
nervio óptico y la campimetría.
Tonometría
Los glaucomas juveniles suelen cursar con una presión intraocular más
elevada que la observada en otros tipos de glaucomas. En nuestra serie la PIO
basal media encontrada fue de 32 mmHg, siendo esta media bastante coincidente
con la observada por otros autores (5,24).
Campo visual
A diferencia de la ingente bibliografía sobre las alteraciones
campimétricas en los glaucomas primarios de ángulo abierto del adulto, no
hemos encontrado en la literatura estudios sobre las características
campimétricas en los glaucomas juveniles.
Al analizar nuestra serie de 231 casos estudiados, hemos observado que los
defectos campimétricos que se correspondían con las menores excavaciones
papilares, eran la contracción periférica (23,97%), y la disminución de la
sensibilidad (12,85%), seguidos por los escotomas en el área de Bjerrum
(23,39%).
Robin (25) en un estudio sobre glaucomas congénitos (edad de diagnóstico de
0 a 13 años) observa que el 39% presentan defectos en el área arcuata, el
defecto precoz se localiza en el área de Bjerrum, y en el 43% el defecto en el
hemicampo superior es mayor que en el inferior, es decir que estos defectos no
difieren de los observados en los adultos. Por otra parte en un estudio (26,27)
realizado en pacientes con miopía elevada y glaucoma, comparándolo con
glaucomas de ángulo abierto y otros defectos de refracción, se observó que un
aumento en la mancha ciega y cambios mínimos en la región paracentral, eran
hallazgos comunes en los ojos altamente miopes sin glaucoma primario de ángulo
abierto. Los defectos del campo visual periférico eran raros, y este autor
considera que deberían estos últimos ser considerados como defectos
glaucomatosos. También observa que los defectos en los casos de elevada miopía
son más progresivos y pueden extenderse a la fijación en un estado
relativamente precoz; cuando analizamos aquellos casos en los que se produce una
progresión de los defectos campimétricos a los 5 años de seguimiento
(21,92%), observamos un aumento del riesgo, aunque mínimo en el grupo de miopes
(p=0,04), pero al analizar la influencia del grado de miopía, no observamos
diferencias significativas (p=0,5).
Oftalmoscopia de la papila
No hemos encontrado unas características específicas en las papilas de los
pacientes con glaucoma juvenil. Geijssen y Greve (28), en los glaucomas que
denomina de alta tensión (edad media 54 años y signos de disgenesia
mesodérmica en la cámara anterior) observa que la excavación es mayor,
concéntrica y más profunda que la observada en pacientes mayores, además la
atrofia peripapilar es raramente observada en jóvenes no miopes, pues parece
ser un signo de isquemia vascular local. En la campimetría de estos pacientes
se observa en estados tempranos una mayor afectación del hemicampo superior,
pero posteriormente en estados más avanzados no se observa ninguna diferencia.
En estudios (29) realizados en grandes miopes con glaucoma se observa una
excavación media de 0,75, mientras que en los miopes sin glaucoma esta
excavación es de 0,61; en los casos de inserción oblicua el margen nasal de la
excavación pareció socavado, cuando no había inserción oblicua, había una
inserción superficial.
Gonioscopia
La inspección del ángulo iridocorneal con la lámpara de hendidura ofrece
poca información; se puede observar la prominencia de la línea de Schwalbe, la
superficie del iris, y la posible presencia de atrofia del estroma iridiano por
transiluminación. Es necesario realizar un estudio gonioscópico para poder
examinar el ángulo iridocorneal.
Otros datos ha tener en cuenta y que pueden tener un significado clínico
importante son: la profundidad de la cámara anterior, la curvatura corneal y el
diámetro de la córnea.
Jerndal (8), en su serie de glaucomas juveniles, no ha podido demostrar
ninguna diferencia en la profundidad de la cámara anterior entre ojos normales
y con glaucoma, a diferencia de los resultados de Berg (30), mientras que
Jerndal si observó un tamaño mayor en el radio corneal externo y en el
diámetro corneal de estos pacientes.
El aspecto gonioscópico puede ser idéntico al observado en los adultos,
aunque es frecuente la presencia de goniodisgenesias.
Figura 2. Esquema
de goniodisgenesias según Jerndal (8).
Dentro de las goniodisgenesias posibles las más frecuentes son (3,8,31,32)
[figura 2 (8)].
El limbo corneal es a veces opaco (33).
La línea de Schwalbe es con frecuencia irregular (34). Puede ser
prominente, nacarada e incluso duplicada en algunas zonas e invisible en otras.
El canal de Schlemm es visible solamente en el 10% de los casos (35).
El espolón escleral está pobremente desarrollado pudiendo ser difícil
de identificar (36).
La banda ciliar a menudo se encuentra escondida por la malla uveal pero a
veces puede ser visible como una banda marrón claro en los ojos oscuros, o como
una banda grisácea en los azules (37).
La inserción del iris es por lo general más anterior de lo normal
siendo con frecuencia imposible diferenciar el borde entre la verdadera raíz
del iris y la malla uveal (38).
El estroma periférico del iris es delgado y muestra áreas de hipoplasia
en forma de lagunas ovaladas o fenestraciones en forma de arcadas. También se
puede observar una hipoplasia del resto del estroma (4) (foto 1).

Foto 1. Iris hipoplásico.
La malla trabecular (39), puede tener un aspecto gonioscópico normal
pero generalmente es más ancho y amplio. A veces tiene un aspecto lanoso o
cubierto por una capa membranosa. La pigmentación puede ser muy abundante o
estar ausente (40) (foto 2).

Foto 2. Ángulo pigmentado.
La malla uveal (41) es generalmente rica y densa. A veces parece cubrir
el receso y da al ángulo un contorno redondeado. El borde anterior de la malla
se inserta en la línea de Schwalbe o en la banda trabecular con una línea
escarpada o con una banda de procesos de iris bien desarrollados. En algunos
casos el único signo de mal desarrollo son los numerosos y gruesos procesos de
iris. El borde posterior de la malla uveal se continúa con el estroma de la
raíz del iris sin un borde marcado, esto se observa especialmente en los ojos
marrones dando la falsa impresión de una inserción anterior del iris (fotos 3
y 4).

Foto 3. Procesos de iris que se extienden sobre estructuras
angulares.

Foto 4. Síndrome de Axenfeld. Bandas de tejido iridiano que alcanza
la línea de Schwalve.
En ocasiones, se producen autenticas adherencias anteriores de la
periferia del iris, alcanzando hasta la línea de Schwalbe (foto 5).

Foto 5. Síndrome de Axenfeld. Bandas de tejido iridiano que se unen
a la línea de Schwalve.
La gran variación de la vascularización normal puede dificultar la
interpretación de éstos, pero los bucles marcados y las gruesas
irregularidades de los vasos se pueden interpretar como encuentros patológicos.
Así por ejemplo, una característica vascular anómala es un tronco orientado
circunferencialmente sobre la superficie de la extrema periferia del iris con
ramas radiales hacia la pupila bifurcándose formando una arcada (42,43).
No se suele observar una pigmentación abundante en la superficie de la malla
trabecular pero se encuentra invariablemente en la malla uveal. Por lo tanto la
pigmentación de la malla trabecular en este glaucoma se debe probablemente a
una sábana sobrepuesta de la malla uveal.
Como hemos descrito anteriormente los cambios gonioscópicos, estos glaucomas
pueden ser bastante sutiles especialmente en casos atípicos. Siendo necesario
una meticulosa gonioscopia para demostrar los cambios característicos de las
disgenesias.
En nuestra muestra los hallazgos gonioscópicos fueron bastante
característicos y coincidentes con lo expuesto (tablas 1 y 2).
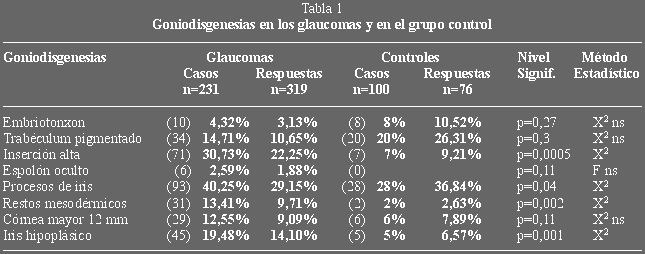
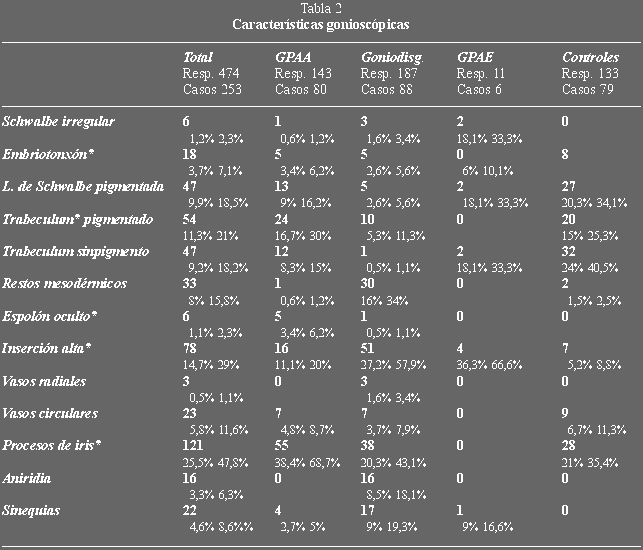

Figura 3. Porcentaje de control de la enfermedad.

Figura 4. Porcentaje de pacientes controlados a los 5 años.
Refracción
Von Graefe en 1869, sugería que una distensión del globo ocular en el
glaucoma podría ser una de las causas de la miopía axial (8). En la literatura
se encuentra una amplia evidencia de que el glaucoma es más frecuente en miopes
(32,44). En los pacientes con glaucoma juvenil se ha observado una mayor
prevalencia de la miopía; en nuestra serie coincidiendo con Goldwyn (4), el 54%
eran miopes, en la serie de Lotufo (5) hasta el 72,3%. En la población general,
la prevalencia de la miopía es aproximadamente del 25% (5,45,46). En los
glaucomas de ángulo abierto en mayores de 50 años, la incidencia de la miopía
varía del 27,4% (44) al 32% (46), siendo así esta incidencia mucho más baja
que en los glaucomas de menores de 35 años.
II.6. Tratamiento
El tratamiento del glaucoma juvenil, al igual que sucede con el congénito,
es únicamente quirúrgico, siendo la técnica de elección la trabeculectomía.
La juventud es considerada generalmente como un factor de riesgo para el fracaso
de la cirugía filtrante. Pero esta idea deriva de los resultados de series con
edades heterogéneas. En nuestra serie hemos realizado trabeculectomía en 126
ojos, el 40,4% ya habían sido intervenidos previamente. La técnica quirúrgica
empleada en nuestros casos ha sido la macrotrabeculectomía (17). A los 36 meses
de seguimiento la PIO media sin tratamiento médico fue de 14,8±4,4 (mediana
14). No observamos diferencias significativas en los diferentes tipos de
glaucoma (p=0,09); esta media es similar a la de la serie de Costa (47).
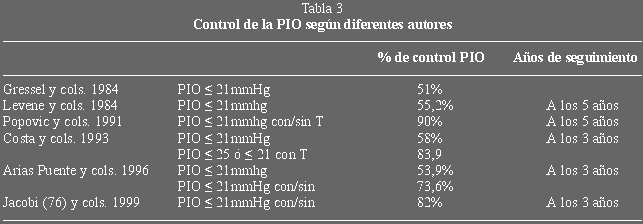
A los 3 años de seguimiento (tablas 3 y 4), los pacientes controlados sin
tratamiento médico (PIO<21mmHg), fueron el 53,9%; si además consideramos
los casos controlados con tratamiento, el éxito alcanzó al 73,6%. En la serie
de Costa (47), dentro de los casos no complicados, alcanzó el control en 83,9%,
éste lo definía como PIO menor o igual a 25mm de Hg sin medicación, o igual o
menor de 21 con medicación; en el 58,06% la PIO era menor o igual a 21 mm de Hg
sin tratamiento médico (seguimiento 36,8±21,8 meses). Si consideramos sólo
los casos en los que se realizó trabeculectomía primaria como en la serie de
Costa, nuestros resultados son muy similares, obteniendo control sin tratamiento
en el 58,66%. Otras series como la de Gressel (48), 117 trabeculectomías en
pacientes menores de 50 años, el control completo (PIO< 21 sin medicación)
se obtuvo en el 51%, porcentaje muy cercano al alcanzado en nuestra serie pero
él sí observó diferencias en los diferentes tipos de glaucoma: en el glaucoma
primario se consigue el control en el 74% más alto que el conseguido en los
glaucomas secundarios (48%) o los del desarrollo (35%). En nuestra serie
(figuras 3 y 4) (tabla 5) no encontramos diferencias, sí observamos una mayor
proporción de casos que precisaban tratamiento médico dentro de las
goniodisgenesias frente a los GPAA (26,41% sobre 18,18% de forma global y 24,24%
sobre 7,14% en las trabeculectomías primarias).

Parece que la edad puede ser un factor importante en el resultado de la
cirugía, determinado por factores anatómicos, como un mayor grosor de la
cápsula de Tenon que podría impedir la filtración o la mejor cicatrización
que presentan estos pacientes. Levene (49) en un estudio retrospectivo donde
evalúa los factores que determinan el control de la PIO después de
intervenciones filtrantes, en pacientes con varios tipos de glaucoma, incluyendo
glaucoma congénito, demuestra que la edad menor de 30 años es un factor de
riesgo estadísticamente significativo, aunque no discute el grado de relación;
Gressel (48) observa que de 0 a 9 años no consigue control en ningún caso,
entre 10 a 19 años en el 37%, en mayores de 30 en el 68%. En nuestra serie
observamos también este hecho (tabla 6), el control va mejorando con la edad
(del 52% al 62%), pero debido al diseño de nuestro estudio (sólo valoramos
entre 4 a 35 años) y al alto porcentaje de casos perdidos en los mayores de 30
años, no hemos observado diferencias significativas.


En series de población como la de Popovic (50) o la de Mills (51), se
conseguía el control de la PIO en una proporción más alta que en nuestra
serie, el 90% de los ojos a los 5 años (PIO a 21 mm de Hg con o sin
tratamiento), la proporción de ojos que no necesitaban medicación para el
control, disminuía linealmente con el tiempo desde el 90% al 60%, entre 1 a 10
años, estos resultados son mejores que los observados por Levene (49) en su
serie el éxito (PIO < 21 sin medicación) a los 5 años es sólo del 55,2%,
quizá puede venir determinado por el alto porcentaje de afáquicos incluidos en
este estudio. En nuestra serie al realizar las curvas de supervivencia (tabla 7
y figuras 5-7), observamos igualmente que los pacientes controlados sin
tratamiento disminuyen a lo largo de los años desde el 82% al primer año, al
64% a los 5 años, alcanzando a los 10 años 49%; si consideramos control con o
sin tratamiento médico, al año el 97% están controlados y el 85% a los 5
años.

Figura 5. Porcentaje de ojos controlados a lo largo del tiempo de
seguimiento.
Figura 6. Evaluación de pacientes después de la trabeculectomía.
Kaplan Meier.
Figura 7. Evaluación de pacientes después de la trabeculectomía.
Log-rank.
En las figuras 8 y 9 se reseñan aquellos factores que podían influir en el
tiempo de control tras trabeculectomía, y únicamente hemos observado
diferencias con relación al sexo, edad, y campimetría previa. Cuando estos
factores eran analizados conjuntamente sólo el campo visual (p=0,03) seguía
teniendo significación. Levene (49), estudiando aquellos factores que influían
en el éxito de las intervenciones filtrantes, observó que la afaquia y la
ausencia de ampolla filtrante eran las más importantes, la edad y el
procedimiento quirúrgico las siguientes, la raza y el sexo las que menos
influían (coeficiente de determinación del 6 al 16%).
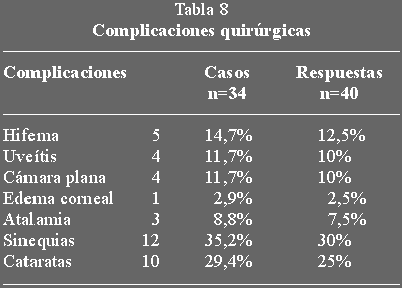

Figura 8. Factores no influyentes en el éxito del tratamiento del
glaucoma juvenil.

Figura 9. Factores influyentes en el éxito del tratamiento del
glaucoma juvenil.
No hemos encontrado diferencias en el control de los pacientes que habían
recibido tratamiento médico previo a la cirugía, ni ante el número de estos
fármacos. Por otro lado, el control en los glaucomas con ángulos más cerrados
fue más bajo que en los ángulos más amplios (50% frente al 75,2%). Por
último, en los casos controlados con tratamiento médico existía una miopía
algo más elevada 10,72±8 (41).
En nuestro estudio valorando la progresión de los defectos campimétricos a
los 5 años de la trabeculectomía, se produjo un empeoramiento en el 21,62% de
los casos a los 3 años, alcanzando a los 5 años al 23%, porcentaje algo menor
del de Popovic (52), 28% de progresión a los 5 años; mientras que en la serie
de Kidd (53) a los 5 años de seguimiento observa progresión de los defectos en
el 18% de los casos. Al igual que en los datos de otros autores (52,53),
existió un número de pacientes en los que el CV continuó deteriorándose a
pesar de que la PIO desciende a un nivel estadísticamente normal. En la
mayoría de estos casos de progresión, la excavación papilar fue mayor de 0,5.
Hubo una mayor tendencia a la progresión en los pacientes miopes y
especialmente en los de más de 10 Dp. En la serie de Popovic (52) todos los
casos de progresión presentaban una campimetría preoperatoria con defectos
medios a moderados, nosotros también observamos esta tendencia aunque no
obtenemos diferencias significativas.
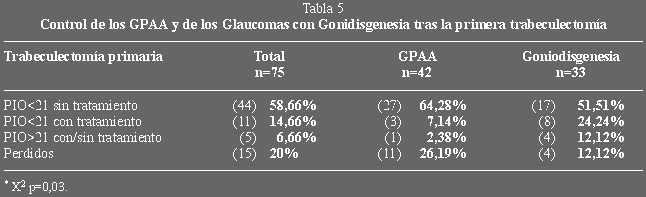
Complicaciones
En la tabla 8 se muestran todas las complicaciones encontradas en los casos
tratados. La presencia de catarata probablemente en relación con la
trabeculectomía la hemos observado en el 29,4% de nuestros casos, en otras
series (50,54) con casos de edades más heterogéneas, esta complicación era
algo mayor, del 35% al 38% de los pacientes desarrollaron cataratas durante el
seguimiento, observando que la aparición de catarata se correlacionaba con la
edad de los pacientes en el momento de la cirugía y con la presencia opacidades
previas a la misma, en otras series (51-54) también se observa una relación
con la incidencia de hipotonía y cámara plana. En nuestra serie no observamos
diferencias con relación a la edad ni con la hipotonía ocular, pues el número
de cataratas directamente relacionado con la trabeculectomía registrada fue
pequeño (n=10).
Como conclusión, a la vista de nuestros resultados, la trabeculectomía en
el glaucoma juvenil, puede ser eficaz, con resultados comparables a los
obtenidos en pacientes de mayor edad con glaucoma primario, consiguiendo el
control del proceso en la mayoría de los casos. Por otra parte hay que destacar
la importancia de realizar en estos pacientes jóvenes un diagnóstico precoz
que es la única posibilidad de prevenir la grave pérdida visual secundaria a
esta enfermedad.
Teniendo en cuenta que la sintomatología en el glaucoma juvenil es escasa y
la mayoría de los casos es diagnosticado de forma casual en el transcurso de
una exploración oftalmológica general, es fundamental que a todos los
pacientes se les realice de forma rutinaria una tonometría y un estudio de
fondo de ojo, sea cual sea la causa de la consulta.
AGRADECIMIENTOS
Al Dr. P. Gili Manzanaro, de la Fundación Hospital Alcorcón, por su
colaboración en la iconografía.
BIBLIOGRAFÍA
- Tawara A, Inomata H. Developmental immaturity of the trabecular meshwork
in juvenile glaucoma. Am J Ophthalmol 1984; 98: 82-97.
- Tawara A, Inomata H. Developmental immaturity of the trabecular meshwork
in congenital glaucoma. Am J Ophthalmol 1981; 92: 508-525.
- Kimura R, Levene RZ. Gonioscopic differences between primary open-angle
glaucoma and normal subjects over 40 years of age. Am J Ophthalmol 1975; 80:
56-61.
- Goldwyn R, Waltman SR, Becker B. Primary open-angle glaucoma. Arch
Ophthalmol 1970; 84: 579-582.
- Lotufo D, Ritch R, Szmyd L, Burris JE. Juvenile glaucoma, race, and
refracción. JAMA. 1989; 261: 249-281.
- Perkins ES. Glaucoma in the younger age groups.. Arch Ophthalmol 1960; 64:
882-891.
- Klein BEK, Klein R, Sponsel WE, Franke T. Prevalencia of Glaucoma.The
Beaver Dam study. Ophthalmology 1992; 99: 1.499-1.504.
- Jerndal T. Goniodysgenesis and hereditary juvenile glaucoma. A clinical
study of a swedish pedigree. Acta Ophthalmol (Copenh). 1970; 107.
(Supplementum): 1-98.
- Howie LJ, Drury IF. Current estimates from the Health Interview Survey,
1977. In: US Dept of Health Education and Welfare publications., ed.Vital and
health Statistics series 10, n.º 126. Philadelphia: 1978.
- Weatherill J.R., Hart CT. Familial hypoplasia of the iris stroma
associated with glaucoma. Br J Ophthalmol 1969; 53: 433-438.
- Johnson AT, Drack AV, Cannon RL, Stone EM, Alward WLM. Clinical features
and linkage analysis of a family with autosomal dominant juvenile glaucoma.
Ophthalmology 1993; 100: 524-529.
- Crombie AL, Cullen JF. Hereditary glaucoma. Occurrence in five
generations of an Edinburgh family. Br J Ophthalmol 1964; 48: 143-147.
- Denis D, Gabisson P, Saracco JB. Les syndromes de clivage du segment
antérieur. Bull Soc Ophtalmol Fr 1990; 5: 557-560.
- Sheffield VC, Stone EM, Alward WLM, Drack AV, Johnson A. Genetic linkage
of familial open angle glaucoma to chromosome 1q21-q31. Nature Genet. 1993; 4:
47-50.
- Richards JE, Lichter PR, Boehnke M, et al. Mapping of a gene for
autosomal dominant juvenile-onset open-angle glaucoma to chromosome 1q. Am J Hum
Genet 1994; 54: 62-70.
- Olsen KE, Huang AS, Wright MM. the efficacy of goniotomy/trabeculotomy in
early-onset glaucoma associated with the Sturge Weber syndrome. J AAPOS 1998
Dec; 2(6): 365-368.
- García Sánchez J, Lázaro C, García Feijoó J. Resultados de la
macrotrabeculectomia en el glaucoma. In: Honrubia FM. Actualización en el
tratamiento del glaucoma. Aula Médica Ediciones: Madrid 1999; 136-146.
- Azuara-Blanco A, Wilson RP, Spaeth GL, Schmidt CM, Augsburg C. Filtration
procedures supplementd with mitomycin C in the management of chilhood glaucoma.
Br J Ophthalmol 1999 Feb; 83(2): 151-156.
- Stone EM, Fingert JH, Alward WLM, Nguyen TD, Polansky JR, Sunden SLF and
cols. Identification of gene that causes primary open angle glaucoma. Science
1997; 275: 668-670
- Nguyen TD, Chen P, Huang WD, Chen H, Johnson D, Polansky JR. Gene
structure and properties of TIGR, an olfactomedin-related glycoprotein cloned
from glucocorticoid-induced trabecular meshwork cell.. J Biol Chem 1998; 273:
6.341-6.350.
- Boot A, Chen P, Do TT, et al. Studies on the TIRG promoter functions.
Invest Ophthalmol Vis Sci 1998; 39: 514.
- Johnson DH. Myocilin and glaucoma: A TIGR by the tail? Arch Ophtalmol
2000 jul; 118(7): 974-978.
- Booth AP, Anwar R, Chen H, Churchill J, Jay Jeffrey, et al. Genetic
screeinig in large family with juvenile onset primary open angle glaucoma. Br J
Ophthalmol 2000; 84: 722-726.
- Melamed S, Latina MA, Epstein DL. Neodymium: YAG laser trabeculopuncture
in juvenile open-angle glaucoma. Ophthalmology 1987; 94: 163-170.
- Robin AL, Quigley HA, Pollack IP. An analysis of visual acuity, visual
fields, and disk cupping in childhood glaucoma. Am J Ophthalmol 1979; 88:
847-858.
- Asman P, Heij A. Diffuse visual field loss and glaucoma. Acta Ophthalmol
(Copenh). 1994; 72(3): 303-308.
- Nakase Y. Glaucoma primario de ángulo abierto en miopía elevada.
Informe I. Efecto de la miopía elevada sobre los defectos del campo visual.
Acta Soc Ophthalmol Jpn. 1987; 91(3): 376-382.
- Geijssen HC, Greve EL. The spectrum of primary open-angle glaucoma I:
Senile sclerotic glaucoma versus high tension glaucoma. Ophthalmic Surg 1987;
18: 207-213.
- Nakase Y. Glaucoma de ángulo abierto en miopía elevada. II Efecto de la
miopía elevada sobre la excavación glaucomatosa del disco óptico. Acta Soc
Ophthalmol Jpn 1987; 91(4): 442-447.
- Berg F. Erbliches jugendliches glaukom. Acta Ophthalmol (Copenh). 1932;
10: 568-587.
- Verbraak FD, Berg Wvd, Delleman JW, Greve EL. Goniodysgenesis in familial
primary open-angle glaucoma. Acta Ophthalmol(Copenh). 1994; 72: 98-102.
- David R, Zangwill LM, Tessler Z, Yassur Y. The correlation between
intraocular pressure and refractive status. Arch Ophthalmol 1985; 103:
1.812-1.815.
- Collins ET. Congenital defects of the iris and glaucoma. Trans Ophthalmol
Soc U K. 1893; 13: 114.
- Cross FR. Congenital hidrophthalmos. Trans Ophthalmol Soc U K. 1896; 16:
340.
- Lagrange F. Traitement du glaucoma infantile. Bull Soc Ophtalmol Fr 1925;
38: 189.
- Löhlein W. Das glaukom der jugendlichen. Albrecht v Graefes Arch Ophthal
1913; 85: 393.
- Becker B, Shaffer R. Diagnosis and therapy of the glaucomas. 2nd ed. St.
Louis; 1961.
- Anderson JR. Hidrophthalmia or congenital glaucoma. Cambridge University
press 1939.
- García Sanchez J, Zato M, Fernández-Vila PC. Glaucoma congénito.
Madrid; 1982; 16-17.
- DeLuise VP, Anderson DR. Primary infantile glaucoma (congenital
glaucoma). Surv Ophthalmol 1983; 28: 1-19.
- Gencik A. Epidemiology and genetics of primary congenital glaucomain
Slovakia: description of a form of primary congenital glaucoma in gypsies with
autosomal dominant inheritance and complete penetrance. Dev Ophthalmol. 1989;
16.76-115.
- Bermejo E, Martínez-Frías ML. Congenital eye malformations:
clinical-epidemiological analysis of 1,124,654 consucutive biths in Spain. Am J
Med Genet 1998; 75: 497-504.
- Shaffer RN, Weiss DI. Congenital and pediatric glaucomas. St. Louis;
1970; 37.
- Perkins E, Phelps CD. Open angle glaucoma, ocular hipertension,
low-tension glaucoma, and refraccion. Arch Ophthalmol 1982; 100: 1.464-1.467.
- Belmonte Gónzalez N. Sobre refracción ocular. Barcelona; 1989: 57-58.
- Roberts J, Rowland M. Refraction status and motility defects of persons
4-74 years, US 1971-1972. In: US Dept.of Health E, ed.Vital and health survey
statistics series 11, National Health Survey 206. Philadelphia; 1978; 78-1.651.
- Costa VP, Katz LJ, Spaeth GL, Smith M, Gandham S. Primary trabeculectomy
in young adults. Ophthalmology 1993; 100: 1.071-1.076.
- Gressel MG, Heuer DK, Parrish II RK. Trabeculectomy in young patients.
Ophthalmology. 1984; 91: 1.242-1.246.
- Levene RZ. Glaucoma filtering surgery: factors that determine pressure
control. Ophthalmic Surg 1984; 15: 475-483.
- Popovic V, Sjöstrand J. Long-term outcome following trabeculectomy: I
Retrospective analysis of intraocular pressure regulation and cataract
formation. Acta Ophthalmol (Copenh). 1991; 69(3): 299-304.
- Mills KB. Trabeculectomy: a retrospective long-term follow-up of 444
cases. Br J Ophthalmol 1981; 65: 790-795.
- Popovic V, Sjöstrand J. Long-term outcome following trabeculectomy: II
visual field survival. Acta Ophthalmol (Copenh). 1991; 69: 305-309.
- Kidd MN, OConnor M. Progression of field loss after trabeculectomy: a
five-year follow-up. Br J Ophthalmol 1985; 69: 827-831.
- DErmo F, Bonomi L, Doro D. A critical analysis of the long-term
results of trabeculectomy. Am J Ophthalmol 1979; 88: 829-835.
- Jacobi PC, Dietlein TS, Krieglestein GK. Primary trabeculectomy in young
adults. Long clinical and factors influencing the outcome. Ophthalmic Surg
Lasers 1999 Sep-Oct; 30(8): 637-646.
|