|
Introducción
A) Finalidad
El tratamiento de los grados iniciales de la RP tiene como finalidad prevenir
el desprendimiento retiniano típico de los grados más avanzados (grados 4 y
5). Se indica cuando existe una proliferación fibrovascular vitreorretiniana
(grado 3) que ha alcanzado una extensión importante, con alta probabilidad de
inducir un desprendimiento retiniano. Normalmente se la denomina como enfermedad
«umbral», tal como se la define en el Estudio Multicéntrico para la
Crioterapia en la RP (1), y comprende la existencia de 5 sectores retinianos de
30º contiguos u 8 acumulativos con un grado 3 «plus» (+) en la zona I o II.
Sin embargo, como se verá, esta indicación está sujeta hoy a revisión.
El objetivo es la destrucción de la retina periférica inmadura productora
de factores vaso y fibroproliferativos (2,3). Asimismo, la retina queda unida
por medio de una cicatriz a la coroides subyacente, con lo que adquiere mayor
resistencia al desprendimiento frente a una hipotética tracción sobre ella.
B) Precedentes históricos
1. Crioterapia: Los primeros trabajos fueron publicados por Payne y
Patz (4) si bien la finalidad del tratamiento era la destrucción del tejido
proliferativo, criterio que tuvo moderada aceptación (5-7). Paralelamente se
formó otra corriente de autores partida rios de destruir la retina avascular y
que acabaría imponiéndose (8-14).
Los resultados favorables obtenidos por estos autores en los grados activos
de la RP motivaron un estudio más ambicio so, multicéntrico, randomizado y con
un gran número de casos: El Es tu dio Multicéntrico para la Crioterapia en la
RP (1,15-18), que demostró la eficacia del tratamiento sobre un total de 291
niños incluidos en el protocolo y utilizando la mitad de los ojos como
testigos. Actualmente sigue siendo una referencia obligada para los tratamientos
practicados en el grado 3+ de RP.
2. Fotocoagulación: Los primeros investigadores que aplicaron el
xenon para el tratamiento de la RP fueron japoneses (19-21), destacando los
trabajos de Nagata y su grupo. Los esfuerzos iban dirigidos a ocluir la
neovascularización periférica cuando esta existía. Cada autor ofrecía
resultados dispares (22). Estas situaciones, junto al hecho de requerirse una
instru menta ción sofisticada y ser el tratamiento relativamente compli cado
por la disposición periférica de los neovasos, ocasionaron que el tratamiento
con xenon no ganara adeptos.
A principios de la década de los 90, y conociéndose ya la utilidad de la
crioterapia en la RP tras el Estudio Multicéntrico, volvió a renacer el
interés por la foto coagulación en la RP (23-25). Mediante la aplicación del
láser de argón unido al oftalmoscopio binocular indirecto varios autores
trataron de realizar una ablación de la retina periférica avascular en los
casos que serían indicación de trata miento según el protocolo para la
crioterapia. Posteriormente se introdujo el láser de diodo (semiconductores),
de gran versatilidad y fácil manejo, comenzando a compararse la
fotocoagulación con este tipo de láser frente a la crioterapia (26,27). La
eficacia parecía similar o mayor en la fotocoagulación pero con menos
complicaciones. En los últimos tiempos se han multiplicado los estudios sobre
fotocoagulación con láser de diodo en la RP (28-34), constatándose su
utilidad. Ha reemplazado progresivamente a la crioterapia como tratamiento de
elección en esta patología (33) debido a:
• Su facilidad de aplicación al ser un sistema portátil y adaptable a un
oftalmoscopio binocular indirecto.
• El acceso a la RP posterior es sencillo y no requiere peritomías.
• Carece de complicaciones importantes.
• Los resultados con la RP en zona I parecen superiores (28,29,33).
• Parece que tiene menos efectos negativos sobre la agudeza visual y la
refracción final (miopía) (35-36).
Indicaciones
Actualmente el criterio internacionalmente aceptado para la
destrucción de la retina periférica avascular en la RP es el de enfermedad
«umbral» tal como se la define en el Estudio Multicéntrico para la
Crioterapia en la RP (1). Consiste en la existencia de 5 sectores retinianos de
30° contiguos u 8 acumulativos con un grado 3 «plus» en la zona I o II
(figura 1). Una vez detectada la indicación, el tratamiento se lleva a cabo
dentro de las primeras 72 horas. Este criterio es arbitrario y fue aceptado tras
arduas deliberaciones. Se le atribuyó un riesgo de desencadenar un
desprendimiento retiniano cifrado en un 50%. La eficacia de esta aproximación
ha sido comentada ya (16,17), pero existen evidencias acerca de su menor
efectividad y potencial peligrosidad en el manejo de la RP de zona I (28,29,37).
Para este tipo de RP varios autores recomiendan un tratamiento «pre-umbral»
(28,33,34), que se ha demostrado eficaz y carente de complicaciones. Por otra
parte, tal como ha sido expuesto, el láser de diodo se ha erigido en el
tratamiento de elección de esta patología, destacando su seguridad. Se impone
una redefinición de enfermedad «umbral» (38). De este modo podríamos resumir
las indicaciones actuales del tratamiento así:
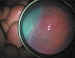
Figura 1. Grado 3+ de RP.
1. Fotocoagulación:
• Enfermedad «umbral» en zona II.
• Enfermedad «pre-umbral» (definida como grado 3+ que no llega a la
extensión «umbral»):
* RP en zona I (la que tiene al menos 30° del borde de avance de la
vascularización retiniana en esta zona).
* RP en ojo único (anatómica y/o funcionalmente).
* RP en la que existan dudas acerca de su extensión.
* RP en la que existan dudas acerca del seguimiento posterior del niño.
2. Crioterapia:
• Enfermedad «umbral» en zona II cuando el láser no está disponible o
los medios oculares se encuentran severamente turbios imposibilitando la visión
del «spot» del láser sobre la superficie retiniana [en estos casos es
también posible la fotocoagulación transescleral (39)].
• Casos fotocoagulados previamente, con progresión a pesar del
tratamiento. La finalidad es conseguir una destrucción mayor de la retina
avascular, y una retinopexia que evite el desprendimiento.
Consideraciones preoperatorias
A) Anestesia
Puede emplearse tanto anestesia general como analgosedación. La anestesia
general, como es sabido, implica miorrelajación con necesidad de asistencia
ventilatoria. En ambos casos se utilizan analgésicos mayores y benzodiazepinas
inductoras de la hipnosis.
La crioterapia parece especialmente dolorosa, particularmente si es necesario
realizar peritomías para alcanzar esclera posterior. Asimismo, el impacto con
láser de diodo resulta doloroso al prematuro, circunstancia que se comprueba al
comenzar el tratamiento con escasa sedación, lo cual suele motivar su
irritabilidad y aumento de movilidad. Si el niño se mueve existe un riesgo de
impactos accidentales en lugares no deseados. SI NO SE EMPLEA ANESTESIA GENERAL
DEBE SUJETARSE AL NIÑO DURANTE TODO EL PROCEDIMIENTO, circunstancia mal
tolerada por el niño y el personal auxiliar.
En cualquier caso es necesaria una monitorización cardiorrespiratoria
completa con pulsioximetría durante el procedimiento, por el peligro de
bradicardias-asistolia y pausas de apnea (1). En nuestro Hospital hemos
realizado la fotocoagulación con analgosedación en bastantes casos, siendo un
procedimiento lento y complicado por los movimientos el niño. Actualmente la
realizamos bajo anestesia general en la U.C.I. neonatal o en quirófano,
indistintamente. Los propios neonatólogos y anestesistas prefieren la anestesia
general por la seguridad que les ofrece.
B) Midriasis
El ciclopentolato y la fenilefrina pueden ocasionar importantes efectos
secundarios a los prematuros (40,41), por lo que no deben sobrepasarse las
concentraciones de 0,5% para el ciclopentolato y de 2,5% en la fenilefrina. Se
instila una gota de cada compuesto, que se repite a los 10 minutos,
aproximadamente una hora antes de la exploración y/o tratamiento.
Metodología de la fotocoagulación
A) Instrumental
Se requiere una fuente de láser, que en la mayoría de los grupos de trabajo
es un láser de diodo (semiconductores) de GaAlAs, el cual produce una
radiación de 813-814 nm (infrarrojo). El sistema se une a través de una fibra
óptica a un oftalmoscopio binocular indirecto. Para visualizar y aplicar el
tratamiento se emplean lentes convencionales de oftalmoscopia (comúnmente de
+28 dioptrías) y se utilizan depresores esclerales convencionales (figura 2).

Figura 2. Visualización de los impactos con láser de diodo.
En los casos en que se aplica de manera transescleral, la fuente se une a una
sonda especial de retinopexia.
B) Técnica (tabla 1)

* Seleccionar parámetros iniciales del láser: Normalmente se
comienza por 300mW de potencia y 300 mseg. Se incrementa la potencia si ésta no
basta para producir una quemadura blanco-cremosa (ligera-moderada, grado 1-2,
figura 3).
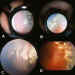
Figura 3. Fotocoagulación con láser de diodo: a y b) Impactos
recientes; c y d) Cicatrices pasado el mes de evolución.
Nota:
El incremento de la potencia debe hacerse fundamentalmente
por la presencia de medios turbios (túnica vasculosa lentis persistente) o
fondos hipopigmentados.
* Distancia entre impactos: Medio impacto.
* Se trata TODA la retina avascular. Si la RP está localizada en zona I es
prudente no tratar la zona yuxtamacular, por el riesgo de la extensión de la
cicatriz a la fóvea.
Metodología de la crioterapia
A) Instrumental
Criodos: No se precisan especiales de tipo pediátrico. Los de cataratas y de
retina convencionales pueden emplearse. Cuanto mayor, más rápido el
procedimiento.
Oftalmoscopia binocular indirecta: Resulta fundamental para el control
adecuado de las crioaplicaciones, si bien a veces se realiza la técnica sin
visualización («a ciegas»).
B) Técnica (tabla 2)

* Tiempo: Hasta el blanqueamiento de la retina avascular (3-6 segundos
generalmente; variables según aparato y el niño) (figura 4).
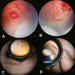
Figura 4. Crioterapia. a y b) Crioaplicaciones recientes; c y d)
Cicatrices pasado el mes de evolución.
* Aguardar a la descongelación antes de retirar el crio do, y hacerlo con
suavidad. La esclera de un prematuro puede desgarrarse con facilidad.
* Las aplicaciones deben ser contiguas.
* Criocoagulación de TODA la retina avascular hasta la extrema periferia.
* Puede incluirse o no la cresta (mayor riesgo de hemo rra gias si se
incluye, pero puede destruir la prolifera ción fibrovascular).
* Si una hemorragia impide la visualización del procedi miento debe
interrumpirse y reanudarse cuando se pueda controlar mejor. Si consideramos que
el caso es muy agresivo, se puede completar «a ciegas» tomando como referencia
crioaplicaciones previas que delimiten la extensión de la retina avascular.
Cuidados postoperatorios
En los dos tipos de procedimientos existe manipulación conjuntival, por lo
que cabe esperar cierta inflamación y pequeñas laceraciones. Se pauta una
pomada oftálmica con corticoides y antibiótico cada 6 horas durante 5 días.
Crioterapia: Puede producir una quemosis importante, por lo que a veces es
necesario añadir una tarsorrafia temporal con sutura de seda de 6/0. Asimismo,
para aliviar el espasmo ciliar, se indica generalmente un colirio de
ciclopentolato al 0,5% cada 6-8 horas durante 5 días.
Las revisiones se pautan semanalmente hasta que se objetive una regresión de
la enfermedad y es prudente continuar esta frecuencia hasta que se ha
estabilizado el aspecto fundoscópico en dos revisiones consecutivas.
Posteriormente se pautan cada dos semanas hasta completar los dos meses tras el
procedimiento. A partir de entonces pueden ser trimestrales. En la primera
revisión trimestral se realiza ya una esquiascopia.
Complicaciones
Fotocoagulación
* Potencialmente se pueden producir quemaduras accidentales en cualquier zona
de la retina. Este riesgo parece importante si se está fotocoagulando en zona I
cerca de la mácula y el niño está moviéndose.
* Se han descrito cataratas visualmente significativas en un número
importante de ojos tratados con láser de argón (6% de la serie de
Christiansen) (42). El mecanismo no ha sido clarificado, pero se especula que se
debe a la absorción de la energía por una túnica vasculosa lentis anterior
prominente. Hasta la fecha se han descrito cataratas visualmente significativas
en 3 ojos tratados con láser de diodo (43); se cree que el mecanismo
responsable es una rotación anterior del cuerpo ciliar motivada por la energía
absorbida, produciéndose un contacto entre cristalino y córnea.
Crioterapia
* Hemorragias intraoculares: Se producen con elevada frecuencia (hasta un 20%
de los casos) y son normalmente retinianas o prerretinianas (1). No parecen
afectar negativamente a la evolución tras el procedimiento.
* Hemorragias conjuntivales-subconjuntivales.
* Quemosis: Puede ser necesaria una tarsorrafia temporal para evitar la
lagoftalmia.
Indicaciones para el retratamiento y actitud ante la evolución desfavorable
Tradicionalmente se considera en los estudios sobre RP una evolución
desfavorable tras crioterapia (1) o fotocoagulación (35), la presencia de:
1. un desprendimiento retiniano en zona I, o
2. un pliegue retiniano afectando la mácula, o
3. una masa-tejido retrolental (que afecte al eje visual).
Estos criterios son objetivos, con evidente sustrato anatómico y facilitan
la comparación entre las técnicas. Pero creemos que son insuficientes. No se
valora la posibilidad de una ectopia macular como secuela cicatricial, la
afectación macular por extensión de las cicatrices, la posibilidad de glaucoma
por tejido cicatricial retrolental (glaucoma maligno), una miopía o
anisometropía severa o una baja visión por déficit funcional de la retina
tras los procedimientos. Los estudios a largo plazo demuestran los resultados
funcionales obtenidos, que son los verdaderamente trascendentales. Creemos
que deben considerarse resultados desfavorables también los aquí expuestos
(44), que se van objetivando tras varios meses de observación del niño.
Actitud ante la insuficiencia de respuesta al tratamiento y la evolución
anatómicamente desfavorable inicial (evolución al grado 4a):
• Si no existe una involución adecuada y existen áreas de retina
avascular no tratadas (por cualquier motivo: cansancio del cirujano,
imposibilidad de visualizar retina, aparatos no funcionantes), lo primero es
terminar el tratamiento. Esta indicación se suele llevar a cabo tras la segunda
revisión semanal cuando existen áreas no tratadas en contigüidad con zonas
proliferativas que se mantienen igual o han empeorado, sin resolución de la
enfermedad «plus» (tabla 3).

• Si la retina avascular ha sido convenientemente tratada y no se aprecia
ningún signo involutivo de la RP tenemos varias opciones:
— Aplicar crioterapia si el tratamiento previo fue láser, con el fin de
conseguir una mayor destrucción de la retina avascular y una retinopexia más
consistente.
— Fotocoagular retina vascular, imitando la panfotocoagulación de la
retinopatía diabética (32).
— Cerclaje escleral: Parece tener un efecto sobre los grados 4a iniciales,
presumiblemente disminuyendo la isquemia de la retina periférica (45). El
efecto positivo se restringiría a los desprendimientos exudativos (46,47).
Resultados
El Es tu dio Multicéntrico para la Crioterapia en la RP (1,15-18), demostró
la eficacia del tratamiento sobre un total de 291 niños incluidos en el
protocolo.
La crioterapia disminuyó el riesgo de padecer un desprendimiento retiniano
en casi un 50%, obteniéndose en un 25% de los ojos tratados una evolución
desfavorable al año del procedimiento (16). Los resultados a largo plazo
demuestran una eficacia mantenida, si bien se ha sugerido un posible efecto
adverso sobre la agudeza visual (17), el campo visual (18) y la miopización del
ojo (16).
La fotocoagulación se comparó favorablemente con la crioterapia en los
primeros estudios randomizados (26,27), y los estudios posteriores han arrojado
cifras de resultados anatómicos favorables superiores al 85% en la mayoría de
ellos (28,29,33,34). Existen evidencias acerca de una mayor eficacia del láser
de diodo aplicado de manera casi-confluente (95%) (48). La fotocoagulación
parece, pues, ser más eficaz que la crioterapia en cuanto a resultados
anatómicos, pero además induce menos miopía que la crioterapia (35,36,49,50)
y la agudeza visual final parece superior: White (35) a los 3 años
postratamiento; Connolly (36), a los 6.
Perspectivas
El mejor tratamiento de una enfermedad es su prevención. La prevención en
RP pasa por conocer mejor su patogenia y actuar antes del desarrollo de la
proliferación vitreorretiniana. Esto puede teóricamente lograrse identificando
factores causales, y minimizando su impacto, pero los resultados en este campo
son desalentadores a lo largo de muchos años de investigación.
BIBLIOGRAFÍA
- Cryothe rapy for Retinopathy of Prematurity Cooperative Gr oup.
Multicenter T rial of Cryotherapy for Retinopathy of Prematu rity: preliminary
re sults. Arch Ophthalmol 1988; 106: 471-479.
- Kretzer FL, Mc Pherson AR, Hittner HM. An interpretation of retinopathy of
prematurity in terms of spindle cells. Relations hip to vitamin E prophylaxis
and cryotherapy. Albrecht von Grae fes Arch Clin Exp Ophthalmol 1986; 224:
205-214.
- Barritault D, Arruti C, Courtois Y. Is there a ubiquitous gr owth factor
in the eye? Proliferation induced in different cell types by eye-derived growth
factors. Differentiation 1981; 18: 29-42.
- Payne JW, Patz A. Treatment of acute proliferative retrolental
fibroplasia. Trans Am Acad Ophthalmol Otolaryngol 1972; 76: 1.234-1.241.
- Nagata M, Yamagishi M, Ikeda S. Summarized results of the treatment of
acute proliferative retinopathy of prematurity du ring the past 15 years in
Tenri Hospital. Acta Soc Ophthalmol Jpn 1 982; 86: 1.236-1.244.
- Yamashita Y. Studies on retinopathy of prematurity. III: Cryo cautery for
retinopathy of prematurity. Jpn J Clin Ophthalmol 1972; 26: 385-393.
- Hindle NW. Cryotherapy for retinopathy of prematurity to pre vent
retrolental fibroplasia. Can J Ophthalmol 1982; 17: 207-212.
- Mc Pherson A, Hittner H, Kretzer F. Current concepts and con troversies.
Retinopathy of Prematurity. Toronto: BC Decker; 1986; 161-178.
- Kingham JD. Acute retrolental fibroplasia II. Treatment by cryosurgery.
Arch Ophthalmol 1978; 96: 2.049-2.053.
- Harris GS, Mc Cormick AQ. The prophylactic treatment of retro lental
fibroplasia. Mod Probl Ophthalmol 1977; 18: 364-367.
- Mousel DK. Cryotherapy for retinopathy of prematurity. A per sonal
retrospective. Ophthalmology 1985; 92: 375-378.
- Ben Sira I, Nissenkorn I, Weinberger D. Long-term re sults of cryotherapy
for active stages of retinopathy of prematu rity. Ophthalmology 1986; 93:
1423-1428.
- Reisner SH, Amir J, Shohat M. Retinopathy of prematurity: inci dence and
treatment. Arch Dis Child 1985; 60: 698-701.
- Tasman W. Management of retinopathy of prematurity. Ophthalmology 1985;
92: 995-999.
- Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter
Trial of Cryotherapy for Retinopathy of Prematurity: Three-month outcome. Arch
Ophthalmol 1990; 108: 195-204.
- Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter
Trial of Cryotherapy for Retinopathy of Prematurity: One year outcome-Structure
and function. Arch Ophthalmol 1990; 108: 1.408-1.416.
- Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter
Trial of Cryotherapy for Retinopathy of Prematurity: Snellen visual acuity and
structural outcome at 51/2 years after randomization. Arch Ophthalmol 1996; 114:
417-424.
- Quinn GE, Miller DL, Evans JA, Tasman WE, McNamara JA, Schaffer DB.
Measurement of Goldmann visual fields in older children who received cryotherapy
as infants for threshold retinopathy of prematurity. Arch Ophthalmol 1996; 114:
425-428.
- Nagata M. Treatment of acute proliferative retrolental fibroplasia with
xenon arc photocoagulation:its indications and limitations. Jpn J Ophthalmol
1977; 21: 436-459.
- Nagata M, Kobayashi Y, Fukuda H, et al. Photocoagulation for the
treatment of retinopathy of prematurity. Jpn J Clin Ophthalmol 1968; 22:
419-427.
- Nagata M, Tsuruoka Y. Treatment of acute retrolental fibroplasia with
xenon arc photocoagulation. Jpn J Ophthalmol 1972; 16: 131-143.
- Uemura Y. Current status of retrolental fibroplasia: Report of the Joint
Committee for the Study of Retrolental Fibroplasia in Japan. Jpn J Ophthalmol
1973; 21: 366-378.
- Landers III MB, Semple HC, Rulen JR. Argon laser photocoagulation for
advanced retinopathy of prematurity. Am J Ophthalmol 1990; 110: 429-430.
- Mc Namara JA, Tasman W, Brown GC, Federman JL. Laser photocoagulation for
stage 3+ retinopathy of prematurity. Ophthalmology 1991; 98: 576-580.
- Landers III MB, Toth CA, Semple HC, Morse LS. Treatment of retinopathy of
prematurity with argon laser photocoagulation. Arch Ophthalmol 1992; 110: 44-47.
- Mc Namara JA, Tasman W, Vander JF, Brown GC. Diode laser photocoagulation
for retinopathy of prematurity. Preliminary results. Arch Ophthalmol 1992; 110:
1.714-1.716.
- Hunter DG, Repka MX. Diode laser photocoagulation for threshold
retinopathy of prematurity. Ophthalmology 1993; 100: 238-244.
- Fleming TN, Runge PE, Charles ST. Diode laser photocoagulation for
prethreshold, posterior retinopathy of prematurity. Am J Ophthalmol 1992; 114:
589-592.
- Capone A JR, Diaz-Rohena R, Sternberg P, Mandell B, Lambert M, Lopez PF.
Diode-laser photocoagulation for zone 1 threshold retinopathy of prematurity. Am
J Ophthalmol 1993; 116: 444-450.
- González Viejo I, Ferrer C, Pablo LE, Marco A, Honrubia FM. Tratamiento
con láser de diodo en la retinopatía del prematuro. Arch Soc Españ Oftalmol
1994; 67: 539-546.
- Peralta J, Abelairas J, Fonseca A. Fotocoagulación con láser de diodo
en la retinopatía del prematuro «umbral». St Ophthal 1995; XIV: 215-219.
- O'Keefe M, Burke J, Algawi K, Goggin M. Diode laser photocoagulation to
the vascular retina for progressively advancing retinopathy of prematurity. Br J
Ophthalmol 1995; 79: 1.012-1.014.
- Noonan CP, Clark DI. Trends in the management of stage 3 retinopathy of
prematurity. Br J Ophthalmol 1996; 80: 278-281.
- Vanders JF, Handa J, Mc Namara JA, Trese M, Spencer R, Repka MX et al.
Early treatment of posterior retinopathy of prematurity. A controlled trial.
Ophthalmology 1997; 104: 1.731-1.736.
- White JE, Repka MX. Randomized comparison of diode laser photocoagulation
versus cryotherapy for threshold retinopathy of prematurity: 3-year outcome. J
Pediatr Ophthalmol Strabismus 1997; 34: 83-87.
- Connolly BP, Mc Namara JA, Sharma S, Regillo CD, Tasman W. A comparison
of laser photocoagulation with transscleral cryotherapy in the treatment of
threshold retinopathy of prematurity. Ophthalmology 1998; 105: 1.628-1.631.
- Sternberg P, Lopez PF, Lambert M, Aaberg TM, Capone A. Controversies in
the management of retinopathy of prematurity. Am J Ophthalmol 1992; 113:
198-202.
- Tasman W: Threshold retinopathy of prematurity revisited. Arch Ophthalmol
1992; 110: 623-624.
- Seiberth V, Linderkamp O, Vardarli I. Transscleral vs transpupillary
diode laser photocoagulation for the treatment of threshold retinopathy of
prematurity. Arch Ophthalmol 1997; 115: 1.270-1.275.
- Bauer CR, Trottier MCT, Stern L. Systemic cyclopentolate (cyclogyl)
toxicity in the new born infant. J Pediatr 1973; 82: 501-505.
- Borromeo-McGrail V, Bordiuk JM, Keitel H. Systemic hypertension following
ocular administration of 10% phenilephrine in the neonate. J Pediatr 1973; 81:
1.032-1.036.
- Chistiansen SP, Bradford JD. Cataract in infants treated with argon laser
photocoagulation for threshold retinopathy of prematurity. Am J Ophthalmol 1995;
119: 175-180.
- Chistiansen SP, Bradford JD. Cataract following diode laser photoablation
for retinopathy of prematurity. Arch Ophthalmol 1997; 115: 275-276.
- Hindle NW. Is a «favorable» outcome acceptable? Arch Ophthalmol 1995;
113: 697-698.
- Hinz BJ, De Juan E, Repka MX. Scleral buckling surgery for active stage
4A retinopathy of prematurity. Ophthalmology 1998; 105: 1.827-1.830.
- Trese MT. Scleral buckling for retinopathy of prematurity. Ophthalmology
1994; 101: 23-26.
- Trese MT, Droste PJ. Long term postoperative results of a consecutive
series of stages 4 and 5 retinopathy of prematurity. Ophthalmology 1998; 105:
992-997.
- Banach MJ, Ferrone PJ, Trese MT. A comparison of dense versus less dense
diode laser photocoagulation patterns for threshold retinopathy of prematurity.
Ophthalmology 2000; 107: 324-328.
- Knight-Nanan DM, O’Keefe M. Refractive outcome in eyes with retinopathy
of prematurity treated with cryotherapy or diode laser: 3 year follow up. Br J
Opthalmol 1996; 80: 998-1.001.
- Laws F, Laws D, Clark D. Cryotherapy and laser treatment for acute
retinopathy of prematurity. Refractive outcomes, a longitudinal study. Br J
Ophthalmol 1997; 81: 2-3.
|