|
El desprendimiento de
retina, es un proceso cuya incidencia aumenta claramente con la edad,
por lo que es muy raro en la infancia, en la que casi siempre existe
otra entidad que va a actuar de causa directa o predisponente. La
clasificación clásica en regmatógenos, traccionales, y exudativos es
perfectamente aplicable a los niños, aunque los orígenes etiológicos
sean bastante diferentes a los del adulto; además no son situaciones
estancas, sino que un desprendimiento en un principio exudativo puede
ser luego regmatógeno, o traccional, y viceversa, o también pueden
combinarse entre sí los tres prototipos. Por lo tanto veremos que una
misma enfermedad puede aparecer clasificada en apartados distintos.
SINTOMATOLOGÍA
En general en los niños
menores de cinco a siete años, la sintomatología del desprendimiento
de retina, se encuentra enmascarada por la imposibilidad de aquellos
para analizar y entender sus propias sensaciones; no van a ser capaces
de transmitir la aparición de la típica cortina negra, ni la disminución
de agudeza y campo visual, que algunas veces, ni siquiera los adultos
son suficientemente hábiles para comprender. Por ello, en la mayoría
de las ocasiones, van a tener que ser los padres los que se den cuenta
de que al niño le está pasando algo; si la situación es bilateral,
los padres percibirán la disminución visual por la incapacidad del niño
para seguir un objeto, o por la aparición, demasiado tardía, de un
nistagmus. En una afección unilateral, como no sea por la aparición de
un estrabismo, lo más probable es que el desprendimiento de retina,
pase completamente desapercibido para los progenitores.
En muchos casos, cuando
el desprendimiento del niño es secundario a otra afección ocular, el
conocimiento de la existencia de la misma, va a servir para que el
oftalmólogo esté pendiente de la posibilidad de aparición de un
desprendimiento de retina, e indique a los padres cuáles son los síntomas,
y que pruebas sencillas pueden realizar, para descubrir que algo anormal
está pasando en la visión del niño. Naturalmente la mayor parte de
las exploraciones subjetivas van a encontrarse muy limitadas y el oftalmólogo
va a tener que recurrir a las objetivas para centrar el problema. El que
el niño se frote un ojo o lo apriete, o que este se ponga rojo,
disminuya o aumente de tamaño, o duela, nos puede indicar la existencia
de una uveítis o un glaucoma secundario; esto puede suponer que, quizá
es demasiado tarde para tratar el problema causal.
A partir de los siete años
de edad, las posibilidades de que el infante sea capaz de reconocer una
alteración del campo visual, y sobre todo una disminución de visión,
aumentan considerablemente, y a partir de los doce, hay que considerarlo
ya como si fuera un adulto, y pensar, que va a ser capaz de reconocer
los síntomas normales de un desprendimiento de retina.
Los síntomas clásicos
de la aparición de un desgarro, como las fotopsias pasajeras o
mantenidas, las moscas volantes, o la lluvia de hollín producto de una
hemorragia vítrea moderada, pueden alarmar a un joven, pero difícilmente
a un niño.
Como antes dijimos, la
etiología de los desprendimientos de retina infantiles y juveniles, con
mucha frecuencia es secundaria a la existencia de diversas enfermedades
y síndromes, por lo que es importante diagnosticar éstos, para estar
pendiente de la posible aparición de aquellos y tratar de prevenirlos.
Tengamos pues en cuenta
entre otras cosas que:
1.º: Algunas vítreo
retinopatías y formas de miopía son hereditarias.
2.º: La historia
familiar de desprendimientos de retina y el hallazgo de patología
articular, alteraciones del paladar y catarata, hacen pensar en el síndrome
de Stickler.
3.º: En la vítreo
retinopatía exudativa familiar (VREF) hay antecedentes familiares de
desprendimiento, en ausencia de prematuridad y signos sistémicos.
4.º: En las patologías
ligadas al cromosoma X hay historia familiar. Hay que indagar en los tíos
maternos.
5.º: El antecedente de
prematuridad obliga al seguimiento, y a sospechar una futura miopía.
6.º: Si no hay
desprendimiento de retina, los pacientes de Stickler, miopes y con VREF
pueden tener buena agudeza visual corregida. Debe sospecharse la ambliopía
anisometrópica y tratarse. Se prescribirán lentes correctoras en niños
menores de seis meses con más de 6 D de miopía, y en niños mayores de
6 meses con más de 3 D.
7.º: El síndrome de
Stickler, al margen de la patología retiniana que se describirá,
asocia cataratas precoces y glaucoma de ángulo abierto, más la
degeneración en las articulaciones de más carga, y displasia
epifisaria. Las anomalías orofaciales consisten en alteraciones del
paladar submucoso. El hallazgo de una úvula bífida está en más del
75% de los pacientes.
8.º: La VREF se asemeja
a la retinopatía del prematuro, pero sin los antecedentes de
prematuridad y administración de oxígeno. El patrón de herencia es
autosómico dominante.
Las áreas de
avascularidad son de extensión variable. La tracción de la retina
produce ectopia macular, generando un ángulo kappa positivo y
estrabismo con frecuencia.
La patogenia del
desprendimiento es básicamente traccional en la primera década de la
vida, y regmatógena en la segunda.
9.º: Las alteraciones de
la fóvea y la retinosquisis periférica, se ven tanto en la
retinosquisis juvenil ligada al cromosoma X como en el síndrome de
Goldmann-Favré. Esta última se hereda de forma autosómica recesiva
con pérdida progresiva de visión, ceguera nocturna, catarata
progresiva y degeneración pigmentaria de la retina de aspecto osteoclástica.
La mácula tiene alteraciones microquísticas. Hay alteraciones del ERG
muy marcadas.
La retinosquisis juvenil
se transmite ligada al cromosoma X y se da en varones. La alteración
foveal puede ser el único hallazgo en la mitad de los casos, y en un
40% se apreciará la afectación periférica. La pérdida de función
macular es rápida en los cinco primeros años de vida y luego se hace más
lenta y progresiva. El ERG tiene selectivamente afectada la amplitud de
la onda B. El desprendimiento de retina y la hemorragia vítrea se dan
con menor frecuencia que los problemas maculares. (1)
EXPLORACIÓN
La oftalmoscopia en niños
es más difícil de realizar que en los adultos debido a la escasa
cooperación. Es imperativo conseguir la mejor midriasis que se pueda,
para lo que usaremos fenilefrina al 2% y ciclopentolato al 0,5% o
tropicamida al 0,5%. Exploraremos con oftalmoscopio indirecto y lente de
28 dioptrías, con la que consiguiremos una perspectiva amplia y
soportaremos mejor los movimientos del niño que utilizando lentes de
20. Si el infante tiene pocos meses, sujetando un ayudante brazos y
cabeza y abriendo el ojo con un blefarostato infantil, podremos realizar
una exploración bastante buena incluyendo depresión escleral; en los más
mayores, solo podremos hacer una aproximación diagnóstica, dejando
para la anestesia general un registro pormenorizado. Para ciertos propósitos
puede ser mejor sostener al niño entre los brazos, y puede aportar más
información varios vistazos, que una exploración muy prolongada; con
frecuencia es mejor mantener una situación de semipenumbra, porque la
oscuridad completa puede asustar a los niños.
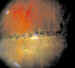
Figura 1. Desprendimiento antiguo autolimitado.
CIRUGÍA EXTRAESCLERAL
DEL DESPRENDIMIENTO DE RETINA
El objetivo de la cirugía
en el desprendimiento de retina es, o bien evitarlo mediante el
tratamiento de las lesiones que predisponen a él, o bien reaplicar el
neurepitelio cuando está desprendido.
Como todos sabemos, el
desprendimiento de retina regmatógeno, se produce como consecuencia de
la aparición de soluciones de continuidad, que afectan al espesor total
de la misma. Estas roturas retinianas son básicamente de dos tipos:
desgarros (que evidencian siempre tracción del vítreo sobre la retina)
y agujeros redondos. Cuando encima de una solución de continuidad
redondeada, flotando en el vítreo, se aprecia un opérculo retiniano su
origen es una tracción vítrea, y por lo tanto son desgarros redondos,
y cuando no tienen opérculo, son agujeros debidos a razones tróficas.

Figura 2. Implantes en meridianos y en paralelo con y sin cerclaje.
Los desgarros que tienen
formas diversas, (herradura, punta de lanza o flecha, media luna,
redondos, etc) son los ligados más directamente al desprendimiento. En
ellos, muchas veces el colapso vítreo origen de la tracción, deja un
espacio de vítreo fluido que pasa fácilmente al espacio subretiniano.
Los agujeros tróficos son menos proclives a generar desprendimientos,
puesto que el vítreo no tiene por que desprenderse a su nivel y los
tapona impidiendo el ingreso de líquido detrás del neuroepitelio.
La diálisis de la retina
es una solución de continuidad a nivel de la ora serrata en la inserción
de la retina con la pars plana. Los traumáticos se localizan
frecuentemente en los cuadrantes superonasales, mientras que los idiopáticos,
típicos de los varones jóvenes, suelen ser inferotemporales. La
progresión de los desprendimientos por diálisis suele ser lenta.
La degeneración en
empalizada (o reja) es la afección de la retina más frecuentemente
asociada a la génesis de desgarros. Se da en un 8-10% de la población
general. Es una lesión ovalada, de localización ecuatorial y paralela
a este. El vítreo suprayacente está licuado, hay cambios pigmentarios,
y esclerosis blanca de los vasos, que le dan un aspecto enrejado, de
donde le viene el nombre. La retina se va adelgazando dando lugar a
agujeros, y el vítreo tira de los bordes donde esta adherido
produciendo desgarros.
Los síntomas de un
desgarro, las fotópsias, las moscas volantes, la turbidez visual o la
lluvia de hollín será difícil que nos los cuente un niño, y si bien
en un adulto, un desgarro agudo debe tratarse, en el infante hemos de
descubrirlo en una exploración periódica por padecer una degeneración
vítreo-retiniana, o por una exploración rutinaria; en todo caso si
existe una enfermedad predisponente al desprendimiento, aparecen
desgarros o hay degeneraciones ecuatoriales graves, lo mejor es hacer
una fotocoagulación focal.
Una alteración muy
parecida al desprendimiento de retina es la retinosquisis, de forma que
a veces son difíciles de distinguir; en esta última no hay desgarros,
pero si agujeros en la capa interna, faltan las líneas de demarcación,
la disposición es en cúpula, y los bordes de la lesión están bien
definidos, hay movimientos sinérgicos de la capa interna de la retina y
del EPR, y hay lesiones iguales en el ojo contralateral. La
fotocoagulación deja una señal blanca encima del epitelio pigmentario,
lo que no sucede en el desprendimiento.
El objetivo de la cirugía
extraescleral es, obturar todas las soluciones de continuidad que
producen el desprendimiento. Es obligado un estudio detallado del
desprendimiento, registrando en una hoja la extensión del mismo, todas
las roturas retinianas a tratar, y los detalles más relevantes. La
exploración cuidadosa se hará bajo anestesia general, puesto que, la
realizada en los niños despiertos solo servirá para una aproximación
diagnóstica.
La cirugía
extraescleral, provoca una alteración intencional de la geometría del
globo ocular buscando un efecto de indentación. Se acerca el epitelio
pigmentario a la retina emparedándola entre éste y el vítreo denso:
con este paso se consigue la reaplicación de la retina.
La reaplicación es
necesaria pero no suficiente para garantizar una curación mantenida en
el tiempo. Por ello, hay que conseguir una adherencia firme entre la
retina y el epitelio pigmentario: pexia. Se pueden utilizar la
crioterapia, la diatermia (en desuso) y la fotocoagulación con laser;
la retinopexia y la reaplicación pueden ser simultáneas o
secuenciales. La criocoagulación produce cicatriz de fuera adentro en
coroides, epitelio pigmentario y retina (efecto apreciable en unos 5 días),
la diatermia, también de fuera adentro en esclera, coroides, epitelio
pigmentario y retina (el plazo es similar al de la criocoagulación) y
el láser desde el susodicho epitelio, se propaga a la retina con un
efecto visible inmediato que aumenta en adherencia en los días
siguientes (tabla 1).
SISTEMAS DE REAPLICACIÓN
1. Reposo y
posicionamiento: tratan de utilizar el vítreo espeso como sistema de
taponamiento interno, pero requiere una inmovilidad que no se consigue
en los niños. Un cierto reposo puede evitar la progresión rápida de
la bolsa y retrasar la afectación macular.
2. Punción del LSR.
Permite la reaplicación perquirúrgica.
3. Indentación escleral,
que por si sola rompe el ciclo: entrada de liquido por la
rotura-eliminación del mismo por el epitelio pigmentario, a favor de
este último.
4. Taponamiento interno:
gases expansivos, que en forma de neumocausis no se utiliza en los niños.

TÉCNICA QUIRÚRGICA
1.º: Peritomía,
exposición de la esclera y suturas de tracción en cada músculo recto.
2.º: Localización de
los desgarros o agujeros y marcado con rotulador de los mismos. En los
grandes se marca el límite posterior y los dos anteriores.
3.º: Crioterapia,
siempre bajo control oftalmoscópico. Haremos aplicaciones únicas en
los agujeros pequeños, y bordearemos los de mayor tamaño.
4.º: Colocación del
implante. En los explantes extraesclerales no es necesaria la disección
escleral; se usará esponja de silicona que es blanda, elástica y
comprimible. Se pueden recortar para adaptarlos a cada caso específico.
La de silicona dura no es porosa y no suele utilizarse en la cirugía
extraescleral. Tanto la blanda como la dura acaban encapsulándose.

Figura 3. Implantes en meridiano.
Explantes radiales
Se colocan en meridiano
con suturas en U de Dacron de 5-0, colocadas perpendiculares al limbo y
separando entre sí las ramas de la U el doble del grosor del implante,
dejando el desgarro justo en el medio; el implante debe sobrepasar al
desgarro unos 3 mm por delante y por detrás. Están indicados en los
desgarros únicos de menos de 7 mm, o si existen varios desgarros, que
estén lo suficientemente separados entre sí para que quepan los
implantes, viéndose en el fondo de ojo valles entre ellos. Si el
desgarro es mayor de 7 mm se podrían colocar varios implantes
perfectamente contiguos para producir juntos una sola indentación, pero
nosotros no somos partidarios. Los implantes en meridiano, producen un
abultamiento en el fondo de ojo, mas redondeado que los
circunferenciales por lo que expulsan mejor el líquido subretiniano, y
no generan los pliegues radiales, cuya aparición favorecen los
implantes en paralelo, con el riesgo consiguiente de apertura de los
desgarros en boca de pez.
Explantes
circunferenciales
Se indican cuando no se
puede usar un explante radial, porque el desgarro es más ancho de 7 mm,
o hay varios desgarros en línea en el mismo paralelo, o se trata de una
diálisis grande de la ora. Lógicamente, los pasos de la aguja se
realizan en sentido paralelo al limbo, dejando los rotos enteros en la
vertiente anterior de la indentación.
Los implantes
circunferenciales, como antes dijimos, pueden producir pliegues radiales
que comunican los desgarros con la bolsa, y eliminan peor el líquido
subretiniano. Un gas expansivo ayuda a taponar en el post-operatorio,
aunque en los niños el posicionamiento siempre es problemático.
Cerclaje
Las indicaciones
fundamentales para colocar un cerclaje, son aflojar la tracción vítrea
y ajustar el volumen ocular a la superficie de la retina. Por ello la
existencia de desgarros múltiples, o la aparición secuencial de los
mismos, los pliegues meridionales llamativos, la existencia de zonas
traccionadas, o un vítreo muy alterado, son indicaciones de cerclaje
como también lo es una VRP moderada. Hay otras razones opcionales para
poner un cerclaje, como degeneraciones periféricas añadidas, no
encontrar un roto retiniano, afaquia, pseudofaquia, miopía elevada,
reintervenciones, etc. Naturalmente es un complemento de los explantes
radiales o circunferenciales. El cerclaje se sujeta con suturas
paralelas al limbo, o con puentes disecados en la esclera. Se debe
controlar siempre el grado de indentación, y el latido de la arteria
central de la retina.

Figura 4. Cerclaje e implante en paralelo.
No debemos olvidar, que
mientras el ojo está en período de crecimiento, tenemos que ir
aflojando el cerclaje periódicamente, con la frecuencia que nos indique
la tabla de incrementos volumétricos del globo ocular.
DRENAJE DEL LÍQUIDO
SUBRETINIANO
Las indicaciones para
vaciar el líquido subretiniano van a ser más la tendencia del cirujano
que cualquier otro condicionante, pero a título orientativo podríamos
incluir: mala obturación de los desgarros, desprendimientos extensos y
antiguos, bolsas sobrecolgantes, desprendimientos con varios desgarros,
falta de espacio para apretar los implantes, etc.
Es el último paso de la
cirugía, cuando la crioterapia está ya aplicada y las suturas
precolocadas; hay que buscar las zonas post-ecuatoriales con el
desprendimiento más elevado. Terminaremos la operación apretando las
suturas de los implantes y cerrando la conjuntiva. Si el ojo queda hipotónico
se debe inyectar suero fisiológico por la pars plana.
Antes de tapar el ojo
pondremos una inyección de antibióticos y corticoides subtenonianos.
VITRECTOMÍA EN RETINA
PEDIÁTRICA
La vitrectomía en el niño
presenta una serie de características que la diferencian de la del
adulto y que en gran parte van a venir determinadas por el tamaño del
ojo.
En el momento del
nacimiento, el volumen del ojo es de unos 2,8 cc, mientras que en el
adulto es de 6,8 a 7,5 cc. Además estas diferencias volumétricas van a
ser desproporcionadas, pues mientras que el volumen del segmento
anterior es el 80% en el adulto, el del segmento posterior es de sólo
la mitad. Por otra parte en el momento del nacimiento el tamaño
antero-posterior del ojo es de unos 17 mm y va a alcanzar
aproximadamente a los trece o quince años los 23 y medio o 24 mm que va
a tener definitivamente.

Figura 5. Llenado insuficiente de silicona.
Vemos pues que la mayor
parte del crecimiento va a ser fundamentalmente del polo posterior. La
esclerótica no tiene problemas para aumentar su tamaño como tampoco la
tiene la coroides, pero la retina no tiene estas capacidades
reproductoras por lo que tiene que tener prácticamente la misma
superficie desde el nacimiento hasta la muerte. Si hay algún aumento de
la misma, tendrá que ser a partir de las células de sostén pero no de
las células nobles. Por lo tanto el crecimiento del segmento posterior
se tendrá que hacer casi exclusivamente a partir del cuerpo ciliar.
Esto quiere decir que en
el momento del nacimiento el cuerpo ciliar es muy pequeño, y la pars
plana es de poco mas de 1/2 mm.
Por lo tanto si nosotros
hacemos las esclerotomías a 3 1/2 mm del limbo, que es por donde lo
hacemos en el adulto, nos vamos a meter directamente en la retina
originando grandes desgarros traccionados; tenemos pues que meternos por
la pars plicata. Para ello hemos de hacer las esclerotomías justo detrás
del iris. Por otra parte, el cristalino va a crecer durante toda la
vida, pero en el niño es en proporción al tamaño del ojo, más grande
que en el adulto.
En consecuencia, si
introducimos los instrumentos de la vitrectomía por la pars plicata,
tendremos que dirigirnos directamente hacia atrás, y practicar una
vitrectomía limitada a la mitad postero-central del vítreo (2), y por
lo tanto insuficiente. En cuanto tratemos de actuar sobre el vítreo
anterior o periférico tropezaremos con el cristalino haciendo una
catarata.
Como consecuencia de todo
esto si queremos hacer una buena vitrectomía en un niño de menos de
tres años vamos a tener que empezar por practicar una lensectomía.
Aunque entremos justo por
detrás del iris (0,5 mm del limbo), vamos a estar mucho más cerca de
la ora serrata que cuando en un adulto entramos a 3,5 mm del limbo, y
por ello, tendremos mas posibilidades de originar desgarros adyacentes a
las esclerotomías; la situación se acentúa por la fuerte unión del vítreo
a la retina y la gran densidad del mismo.
A partir de los 5 años,
al ojo sólo le queda por crecer 1 mm por lo que ya podremos entrar por
3,5 mm.
El vítreo en el niño es
muy espeso y abundante, no esta desprendido, y está fuertemente unido a
la retina; esto trae como consecuencia que aunque usemos un vitrectomo
muy afilado vamos a dar de forma continua tirones sobre ella. La unión
vítreo-retina es tan íntima, que es casi imposible separarlos auque
aspiremos con una cánula, por lo que casi siempre dejaremos pegada a la
retina no solo la hialoides, sino también corteza vítrea; esto va a
favorecer la aparición posterior de una vitreoretinopatía
proliferativa.
La vitrectomía por
desprendimiento de retina se practica, proporcionalmente, con mucha más
frecuencia en el infante que en el adulto, en primer lugar, porque
muchos desprendimientos, en los niños, son secundarios a enfermedades
que la indican especialmente, y en segundo lugar, por la tendencia que
ya hemos explicado, (y que se agrava por el diagnóstico generalmente
tardío), a hacer vitreoretinopatías proliferativas (VRP).
Es ya clásica la
clasificación de la VRP del comité de terminología de la Sociedad
Americana de Retina (1983) (3), que muchos oftalmólogos siguen usando
en la intimidad y que se expone en la tabla 2.
El Oil Silicone Study
Group (4) emite otra clasificación que respecto a la anterior cambia en
que elimina el estadío D, y en el estadío C diferencia la forma
anterior de la posterior. La forma anterior es extremadamente importante
como responsable de muchos fracasos quirúrgicos y en la que actúan
fuerzas en sentido perpendicular, anteroposterior y circunferencial.

Machemer en 1991 (5) basándose
en la clasificación de 1983 establece las siguientes modificaciones:
sigue conservando los grados A y B, elimina el D, y divide el C en: C1:
focal posterior; C2: difusa posterior; C3: sub-retiniana; C4: contracción
del borde de la base del vítreo con retracción de la retina hacia el
centro; C5: desplazamiento anterior de la base del vítreo.
Como factores de riesgo
para la aparición de una VRP están: la hemorragia vítrea,
traumatismos severos, duración del desprendimiento, desgarros grandes y
abundantes, desgarro gigante, cirugías vítreo-retinianas previas,
agresivas, y no exitosas, la edad (los niños y jóvenes tienen un
riesgo muy elevado de padecerla) y en un segundo término, la afaquia,
la pseudofaquia, la capsulotomía, el implante secundario, etc.
La VRP secundaria a una
intervención de desprendimiento suele aparecer entre las 3 y las 7
semanas después de ésta.
PASOS QUIRÚRGICOS
Peritomía: Se abren a
nivel del limbo 360 grados si se va a poner un cerclaje, y de IX a II si
no hace falta éste. Las esclerotomías de los instrumentos activos se
hacen próximas a las 10 y a las 2, y la de infusión se coloca en
temporal inferior, a nivel del borde inferior del recto lateral y es la
primera en ponerse y última en retirar y suturar.
En los casos de retinopatía
del prematuro y en la persistencia de la vascularización fetal la única
vía de abordaje viable y segura es a través de la raíz del iris o
bien limbar.
A partir de los 7 años
se pueden usar las mismas medidas al limbo que en los adultos, pero hay
que evitar las entradas y salidas repetidas de los instrumentos pues es
más fácil hacer desgarros por arrastre vítreo. En casos especiales de
gran componente proliferativo anterior, será más seguro usar cánulas
especiales de infusión límbica.
La transiluminación en
los ojos de niños que están en proceso de crecimiento permite definir
la extensión de la pars plana.
En fáquicos es mejor
usar cánulas de infusión de 2,5 mm de longitud y en afáquicos y
pseudofaco, de 4 mm, haciendo siempre control visual de la mismas.
La lensectomía es
paso obligado en todas las situaciones en las que existe un componente
de proliferación vítreo retiniana anterior. En niños el material
cristaliniano es muy blando y se puede aspirar con el vitrectomo. Hay
que remover totalmente las cápsulas anterior y posterior.
La vitrectomía debe de
ser lo mas completa posible afeitando la retina con el vitrectomo, para
eliminar la mayor cantidad posible de corteza vítrea, que va a estar íntimamente
unida a la retina; intentaremos separar la hialoides posterior mediante
una cánula con silicona en la punta, lo que probablemente no
consigamos, para dejar sin sustrato una ulterior reproliferación.
La disección de
membranas debe ser muy cuidadosa pues la adhesión es mayor que en el
adulto y la producción de roturas mas grave que en estos.
La inyección de
perfluorocarbono y el intercambio liquido-gas no difiere de la de un ojo
maduro, pero el posicionamiento suele ser malo y los resultados igual.
Si por la edad del niño
no es viable la posición terapéutica en el post-operatorio, o el
cuadro es especialmente grave, se usará aceite de silicona. (6) Este
nunca rellena de forma total el globo ocular, pues siempre queda un
menisco de líquido en la parte inferior, lo cual impide el taponamiento
efectivo de esta zona.
Las complicaciones (7) de
la permanencia del aceite de silicona dentro del ojo son las ya
conocidas en adultos y se presentan con mayor frecuencia: opacidades
corneales (más frecuentes en los áfacos), cataratas en los fáquicos
(60%), el glaucoma se da en menor proporción que en los adultos, sin
embargo la hipotonía es más frecuente que en éstos: la proliferación
anterior ahoga o desprende el cuerpo ciliar.
La extracción de la
silicona con la intención de minimizar los efectos secundarios, va
seguida de tasas nada desdeñables de redesprendimiento.
Dado el mal pronóstico
de una porción importante de casos de DR con VRP, existen dos líneas
de actuación coadyuvantes en tanto los resultados quirúrgicos no
arrojen mayor proporción de éxitos. Por una parte, intentar modular el
proceso inflamatorio con el uso de corticoides o agentes citostáticos
del tipo de 5-fluoruracilo intravítreos, y por otra parte extremar la
actividad preventiva en los casos de un segundo ojo con DR por
degeneraciones vítreo retinianas: fotocoagulación de lesiones
predisponentes y cerclajes profilácticos.
El uso de
perfluorofenantreno (Vitreón) (8) en niños tiene un especial interés,
porque el mantenimiento de la posición postoperatoria en supino cuando
se utiliza éste, es más fácil de mantener que el prono, que es la
posición típica cuando se usa gas.
Una vez realizada la
vitrectomía se inyecta el vitreón desde la papila y se va reaplicando.
Posteriormente se realiza endofotocoagulación o frío transescleral.
Otra ventaja añadida es que no requiere hacer retinotomías para
evacuar el líquido subretiniano.
El mantenimiento de la
posición es obligadamente en supino cuando son afáquicos, para evitar
el contacto con la córnea, pero en los casos de fáquicos esta
exigencia no es tan estricta, y además si permanecen sentados, la
retina inferior obtiene un mayor efecto taponador mientras se van
haciendo las cicatrices de la retinopexia.
Pasadas unas tres semanas
hay que retirar el perfluorocarbono; si la retina permanece reaplicada
no hay que hacer nada más, pero si se desprende de nuevo hay que volver
a reaplicarla e inyectar aceite de silicona.
Las principales
indicaciones del perfluorofenantreno son: desgarros gigantes,
desprendimientos complejos, VRP, e imposibilidad de mantener el prono.
El mayor inconveniente es la reacción fibrinoide, que en los niños es
especialmente importante.
CLASIFICACIÓN DE LOS
DESPRENDIMIENTOS DE RETINA EN LA INFANCIA
Desprendimiento de retina
regmatógeno
ESPONTÁNEOS (raros y
frecuentemente originados por diálisis retinianas no traumáticas)
Ligados a enfermedades
hereditarias
Retinosquisis ligada al
sexo
Síndrome de Goldmann y
Favre
Síndrome de Stickler
Síndrome de Wagner
Síndrome de
Ehlers-Danlos
Síndrome de Marfan
Vitreoretinoptía
exudativa familiar
Incontinencia pigmenti
Degeneración vítreo-retiniana
en copos de nieve
Ligados a anomalías del
desarrollo
Miopía magna
Catarata congénita
Glaucoma congénito
Coloboma de coroides
Anomalías del nervio óptico
PHPV
Retinopatía del
prematuro
Traumáticos
Contusiones
Heridas penetrantes
Cuerpo extraño
intraocular
Lesiones no accidentales
DESPRENDIMIENTO DE RETINA
TRACCIONAL
Retinopatía del
prematuro
Incontinentia pigmenti
Vitreoretinopatía
exudativa familiar
Trauma
Toxocariasis
DESPRENDIMIENTO DE RETINA
EXUDATIVO
Retinopatía del
prematuro
Enfermedad de Coats
Retinosis pigmentaria
Hemangioma capilar de la
retina
Escleritis posterior
Enfermedad de Harada
Hemangioma coroideo
Retinoblastoma.
RETINOSQUISIS CONGÉNITA
La retinosquisis congénita,
descrita primero por Haas en 1898 (9) y luego por Anderson (10) en 1932,
se caracteriza por la separación, entre la capa de las fibras del
nervio óptico y las restantes de la retina, en la zona macular y a
veces en la periferia. La enfermedad, bilateral y transmitida de forma
recesiva ligada al sexo, es padecida por varones, hijos de una madre
portadora, aunque se han descrito casos raros de tipo autosómico; el
proceso ya existe en el momento del nacimiento y posiblemente es
consecuencia de una debilidad de las células de Müller (11).
Como consecuencia de la
afectación macular, bien sea primitiva o por extensión de un quiste
periférico, en la retinosquisis congénita suele haber una visión
pobre (puede llegar a movimientos de la mano), a menudo agravada por una
hemorragia vítrea (percepción y proyección de luz), que a veces se
manifiesta por estrabismo, o nistagmus. La alteración macular primitiva
tiene el aspecto de micro-quistes, dispuestos en forma estrellada o en
panal de abeja, con un aspecto oftalmoscópico muy parecido al del edema
macular quístico, del que se diferencia, porque la angiografía
fluoresceínica no muestra tinción típica, en pétalos de flor. En
algunos casos, la zona de esquisis muy elevada, ocupa toda el área
central hasta las arcadas vasculares, mientras que en otros, la alteración
macular es muy sutil, apareciendo como pliegues superficiales apenas
visibles, incluso en un examen cuidadoso con la lámpara de hendidura.
En algunos casos, el único cambio macular es un ligero moteado
pigmentario, o la ausencia de reflejo foveal. La mácula puede estar
fuera de su sitio por tracción vitreoretiniana, puede sufrir una
hipotrofia del epitelio pigmentario, o una atrofia de la coriocapilar.
La alteración macular,
que existe en el 100% de los casos, puede ser la única manifestación
de la retinosquisis congénita. La lesión más característica fuera de
la mácula es la separación entre la capa de las fibras nerviosas y las
más externas de la retina, formando un quiste gigante, que se localiza
en la periferia inferior de la misma; en un 4% de los casos se localiza
en los cuadrantes superiores, generalmente en el temporal (12). A veces
en la capa interna, hay un agujero oval grande o múltiples más pequeños;
los agujeros pueden hacerse casi tan grandes como la propia
retinosquisis. La localización de los desgarros diferencia la forma
congénita de la adquirida, pues mientras que en la primera son
frecuentes en la capa interna, en la segunda los desgarros suelen
aparecer en la capa externa, probablemente porque la delaminación
ocurre en la retinosquisis congénita en la capa de las fibras
nerviosas, la más superficial de la retina, mientras que en la
adquirida, la separación ocurre en capas más profundas, como la
plexiforme externa o la nuclear interna. La retinosquisis periférica se
presenta entre el 36 (13) y el 70% (14,15) de los casos.
En algunas ocasiones, la
lámina interna es tan elevada que puede verse detrás del cristalino;
esto ocurre en niños menores de 10 años, pues con el paso del tiempo
esta capa, o se reaplica o desaparece, de tal forma que después de los
50 años de edad no se ven quistes periféricos (13).
Los vasos sanguíneos
retinianos en las primeras fases de la enfermedad, corren por la lámina
interna y de vez en cuando pasan a la externa, pero en las fases tardías
la capa interna y los vasos se hacen invisibles, o bien estos flotan
libres en la cavidad vítrea, o salen de la retina como si fueran
proliferantes. A menudo los vasos se cierran y aparecen como un enrejado
blanco sobre la lámina interna. Otras veces la retinosquisis se
manifiesta como velos que flotan en el vítreo, unidos o no a la pared
ocular, como consecuencia de la destrucción paulatina de la capa
interna. Las hemorragias, tanto dentro del quiste como en el vítreo,
son relativamente comunes. Con los años la capa externa se degenera, y
aparecen múltiples acúmulos pigmentarios, por lo que, los pacientes
masculinos con pigmentación, y sin vasos retinianos visibles en la
mitad inferior del fondo, son sospechosos de padecer una retinosquisis
congénita. En situaciones avanzadas el nervio óptico se atrofia.
El electroretinograma se
caracteriza por una disminución de la amplitud de la onda «b»
comparada con la onda «a», que puede ser normal. Este tipo de
electroretinograma se observa incluso en los casos en los que la lesión
se limita a la mácula. Cuando la enfermedad progresa y los
fotorreceptores degeneran, la amplitud de la onda «a» también
disminuye, de tal forma que cuando la retinosquisis está avanzada y el
fondo muestra abundante pigmento y desaparición de los vasos
retinianos, la onda «b» puede estar completamente ausente y el
electroretinograma componerse solo de una onda «a» pequeña, o incluso
ser totalmente plano. Esta forma de alteración electroretinográfica
indica que siempre existe una afectación difusa de toda la retina,
aunque la imagen oftalmoscópica esté más o menos limitada.
En la retinosquisis
adquirida el ERG es normal o subnormal, dependiendo de la magnitud del
área afectada, lo que indica que en la forma adquirida, no hay una
degeneración difusa de la retina.
El electro-oculograma es
normal en cerca del 90% de los casos y cuando se muestra alterado
coincide con un ERG en sus estadíos finales.
Las hembras portadoras
suelen ser oftalmoscópicamente normales, aunque a veces pueden
encontrarse fruncimientos maculares de la membrana limitante interna, o
bien quistes periféricos pequeños, y siempre hay hallazgos
electroretinográficos (incapacidad para mejorar la función de los
conos cuando se pasa de la oscuridad a la penumbra). El gen responsable
de la enfermedad se encuentra en el brazo corto del cromosoma X, en la
región Xp22, y por ello el estudio genético nos sirve, tanto para
identificar a las hembras portadoras, como para ayudar al diagnóstico
precoz del niño enfermo.
La evolución de la
retinosquisis congénita es de una progresión lenta y continua, con
fases de remisión espontánea, en las que se deshincha o se destruye el
quiste, hasta desaparecer definitivamente. La progresión rápida de la
enfermedad, ocurre durante la primera década, al final de la cual
comienza la aparente mejoría anatómica, y continua el deterioro
funcional. El control de la enfermedad, puesto que el campo visual en
los niños con frecuencia no se puede realizar, requiere el examen
cuidadoso y repetido, casi siempre bajo anestesia general, del fondo de
ojo con oftalmoscopia indirecta y depresión escleral, haciendo un
dibujo cuidadoso del mismo cada vez, así como retinografías. Debido a
la naturaleza poco o nada progresiva de la retinosquisis congénita en
la mayoría de los pacientes, no es necesario ningún tratamiento, a
menos que las complicaciones o el crecimiento del quiste periférico
amenacen la visión. Por otra parte, el intento de frenar el crecimiento
de un quiste periférico, limitándolo con una barrera de láser, será
en general infructuoso (13) y a veces peligroso. Tampoco suele dar
resultado aunque puede intentarse, tratar de curarlo con un cerclaje. La
vitrectomía eliminando el córtex vítreo, fuertemente adherido a la
retina, seguida de planchado con perfluorocarbono, posterior
fotocoagulación extensa, e intercambio líquido-gas, sin embargo suele
ser beneficiosa, (16,17) aunque debe de limitarse a aquellos casos en
que el quiste periférico crece rápidamente, y amenaza a la mácula.
Probablemente los mejores resultados se consigan eliminando toda la lámina
interna de la retinosquisis, pues con este sistema hacemos desaparecer
toda la tracción vítrea que se ejerce sobre la misma, y que
posiblemente sea la responsable de su crecimiento. (18,19)
Una hemorragia vítrea
reciente, se trata mejor de forma conservadora esperando en un reposo
relativo. Si el vítreo se aclara, fotocoagularemos, si se encuentran,
los vasos responsables del sangrado, que con frecuencia son: mechones
neovasculares, vasos retinianos traccionados o vasos que cruzan de una a
otra capa la retinosquisis. La vitrectomía la dejaremos para el caso de
que la sangre no se reabsorba, o porque la edad del niño amenace con
producir una ambliopía. Si la hemorragia es intra-quística también
podremos esperar a que se reabsorba, si ésta no induce un crecimiento
de la esquisis, o eliminarla con una vitrectomía en caso contrario.
El desprendimiento de
retina es una de las posibles complicaciones de la retinosquisis, que
puede originarse por desgarros en ambas capas del quiste (lo menos
frecuente), por desgarro fuera de la zona afecta pero relacionado con el
problema, por degeneraciones en otra parte de la retina, o por tracción
a partir de penachos vasculares capaces de producir proliferación
fibrosa. Cada caso tiene su posibilidad terapéutica pero siempre se
colocará un cerclaje que incluirá un implante en el caso de que el
desgarro esté fuera de la zona quística. En el resto de las
situaciones, tras el cerclaje se debe realizar una vitrectomía con
eliminación interna de líquido intra-retiniano, alisado con
perfluorocarbono y panfotocoagulación del área afecta, terminando con
un intercambio líquido-gas, usando SF6 o dejando el ojo lleno de
perfluorofenantreno durante una semana, si el niño es muy pequeño.
También podemos eliminar la capa más interna de la retinosquisis,
previa aplicación de diatermia en los vasos retinianos que corran sobre
ella.
SÍNDROME DE
GOLDMANN-FAVRE
La degeneración
vitreotapetoretiniana, como también se denomina a este síndrome, es
una enfermedad rara en la que se produce pérdida progresiva de visión
debida a: retinosquisis macular y/o periférica, catarata progresiva, y
degeneración pigmentaria de la retina, con acúmulos de pigmento de
aspecto osteoclástico. Se hereda con carácter autosómico recesivo,
fue descrita en 1957 por Goldmman (20) y en 1958 por Favre (21), y
parece una mezcla entre la retinosquisis congénita juvenil ligada al
sexo, y la enfermedad de Wagner.
Suele descubrirse entre
los 10 y 20 años de edad, debido a ceguera nocturna y visión pobre. El
examen con lámpara de hendidura, revela licuefacción vítrea
generalizada con múltiples cuerdas de vítreo condensado; la corteza vítrea
toma el aspecto de una membrana pre-retiniana. Las papilas están pálidas,
las arterias y venas envainadas y atenuadas, y en la media periferia, se
observan las típicas manchas estrelladas de pigmento. La retinosquisis
es central (100% de los casos) y periférica (50% de los casos) y exacta
a la ligada al sexo; la periférica empieza entre el ecuador y la ora
serrata, y puede crecer progresivamente hasta afectar a la retina
central. Generalmente la mácula padece alteraciones microquísticas y
cambios de color. La angiografía fluoresceínica no muestra llenado de
los quistes, al contrario de lo que ocurre en el edema macular quístico,
puesto que ellos son similares a los de la forma congénita. En la mayor
parte de las ocasiones aparecen cataratas sub-capsulares posteriores. El
electroretinograma es sub-normal o extinguido, y puede haber una
discrepancia entre la amplitud fotópica del flash y la frecuencia de
fusión (22).
La adaptación a la
oscuridad es baja desde una edad muy temprana, y el campo visual muestra
un escotoma anular denso, similar al de la retinosis pigmentaria.
La pérdida visual
central es consecuencia, generalmente, de la retinosquisis macular y
suele ser precoz, de tal forma que la agudeza visual puede reducirse a
menos de 1/10, en la niñez.
El desprendimiento de
retina, cuando se produce, es en todo superponible al de la
retinosquisis ligada al sexo, y todo lo dicho para ella sirve para el síndrome
de Goldmman y Favre.
ENFERMEDAD DE WAGNER
Wagner describió en 1938
(23) una familia suiza con miopía, catarata temprana, licuefacción del
vítreo, y alteraciones vasculares y pigmentarias en la retina. Ninguno
de los miembros familiares identificados por Wagner tenía anormalidades
extraoculares o desarrolló un desprendimiento de retina. La enfermedad
que es sumamente rara, se hereda de forma autosómica dominante con un
100% de penetrancia.
Los síntomas y signos
oculares en esta enfermedad son: miopía moderada, (–3,00 a –5,00D)
un vítreo degenerado y ópticamente vacío, membranas pre-retinianas
avasculares (consecuencia de la condensación de la corteza vítrea), y
vasos envainados o rodeados de pigmento, degeneraciones en reja, así
como atrofia corio-retiniana y pigmentación espicular dispersa.
Los pacientes aquejan
reducción temprana de la visión nocturna, con pérdida progresiva del
campo visual secundario a atrofia corio-retiniana, y conservación, al
principio, de la visión central, que más tarde se altera por la
formación de catarata entre los 30 y 40 años de edad. Las alteraciones
del cristalino suelen ser opacidades corticales posteriores y anteriores
y generalmente la cirugía de la catarata permite restaurar la visión.
El electroretinograma
revela una amplitud de la onda B reducida que puede conducir a una
situación extinguida.
En un principio se creyó
que estos pacientes no eran propensos a padecer un desprendimiento de
retina, por lo que no se recomendaba el tratamiento profiláctico del
mismo, fotocoagulando las degeneraciones en reja y los desgarros, pero
desde entonces se han encontrado muchos casos de esta enfermedad en las
que se produjeron desprendimientos extraordinariamente graves y de mal
pronóstico. La manera de comportarse estos ojos es exactamente la misma
que en el síndrome de Stickler, puesto que los hallazgos oculares de
ambos procesos son similares, diferenciándose entre sí sólo por los
componentes sistémicos del Stickler, que no existen en el Wagner;
posiblemente fuera mejor hablar de enfermedad de Wagner-Stickler.
SÍNDROME DE STICKLER
En 1965, Stickler y col.
(24) describieron un síndrome al que llamaron artro-oftalmopatía
hereditaria progresiva, que se asociaba con miopía alta, cambios
degenerativos prematuros de los cartílagos articulares y,
desprendimiento de retina total en la primera década de la vida. Se
hereda con carácter autosómico dominante de penetrancia variable.
Las alteraciones oculares
de este síndrome son: miopía media o alta (–3,00 a –18,00 D), congénita
y progresiva durante los primeros 20 años de vida, vítreo claro ópticamente
vacío, en el que flotan cuerdas, velos, y membranas vítreas, y
desprendimiento de retina, que surge a menudo en la primera década de
la existencia. La degeneración vítrea puede presentarse ya en los
primeros meses después del nacimiento, o aparecer después de los 30 años
y la mayor parte de las veces es previa a las lesiones retinianas aunque
otras es posterior a estas (25). El córtex vítreo está engrosado y
forma membranas pre-retinianas, y en la periferia da muestras claras de
tracción sobre la retina, con la aparición de pliegues meridionales
muy llamativos, y amplias zonas de blanco con y sin presión.
La retina presenta a
menudo acúmulos pigmentarios redondeados peri vasculares y/o
espiculares ecuatoriales. Si bien el cono miópico y la hipo-pigmentación
del fondo acompañan a los grados más altos de miopía, en el síndrome
de Stickler son raros el estafiloma posterior, las líneas de laca, y la
membrana neo-vascular sub-retiniana. Los vasos retinianos pueden estar
atenuados o envainados. Hay placas de atrofia corioretiniana en la
extrema periferia. A veces existe una retinosquisis.
Es muy frecuente la
formación de desgarros múltiples que originan desprendimientos de
retina complicados, en un 50% de los ojos afectos. Aproximadamente 1/3
de los pacientes sufren un glaucoma de ángulo abierto o una hipertensión
ocular. En el 50% de los casos se asocian cataratas que pueden ser
nucleares y progresivas de aparición precoz (antes de los 45 años), o
corticales y estacionarias.
Las manifestaciones sistémicas
son anormalidades oro faciales y osteo-articulares. En el ámbito
articular las primeras manifestaciones ocurren en las articulaciones que
aguantan el peso corporal, y aparece una displasia epifisaria del fémur,
tibia, y cúbito, lo que origina el agrandamiento óseo de los tobillos,
rodillas, y muñecas, y la laxitud e hiperextensibilidad de las
articulaciones. Hay anormalidades dentales como: mal posicionamiento,
persistencia de los dientes de leche, o hipoplasia del esmalte. Las
anomalías oro faciales suelen ser paladar arqueado o hendido, y úvula
bífida, así como acortamiento de ambos maxilares. Otras asociaciones
sistémicas pueden ser sordera neuro-sensorial, anomalía de
Pierre-Robin y prolapso de la válvula mitral .
La alteración genética
(26,27) de Stickler parece ser una mutación en el gen del procolágeno
II (COL 2A1), lo que origina la terminación prematura de la cadena de
colágeno tipo II, que es el que compone la estructura fibrilar del vítreo
y del cartílago. Snead comprobó que en realidad hay dos tipos de síndrome
de Stickler el tipo I en el que existen alteraciones vítreas congénitas
y un tipo II en los que no hay estas alteraciones y que no estaría
asociado al susodicho gen. Por lo demás no se distinguen por el resto
de los signos y síntomas ni por el comportamiento (28).
A los niños en los que
sospechemos un síndrome de Stickler se les deben hacer refracciones
bajo cicloplejía frecuentemente, corrigiendo su miopía para prevenir
cualquier posible ambliopía, así como oftalmoscopias con depresión
escleral, en busca de la aparición de desgarros que deben
fotocoagularse con láser inmediatamente. También deben tratarse las
degeneraciones en reja. Algunos autores hacen fotocoagulaciones extensas
en la periferia en los 360°, pero nosotros creemos que pueden ser más
perjudiciales que beneficiosas. En los casos en que los desgarros
aparezcan masivamente, o sean grandes, se debe de colocar un cerclaje
preventivo además de realizar la fotocoagulación focal (29,30).
Los desprendimientos de
retina suelen ser de mal pronóstico y difícil tratamiento, ya que con
frecuencia hay múltiples desgarros traccionados, a menudo muy
posteriores y colocados a distinto nivel, o se producen desgarros
gigantes que en algunas estadísticas (31), llegan al 20%.
Como el vítreo esta
licuado en su totalidad, pero mantiene la corteza condensada y sin
desprender, si se producen agujeros degenerativos en las zonas de
enrejado, el desprendimiento avanzará muy lentamente, pues los taponará
el vítreo espeso; si por el contrario se origina por desgarros
traccionados, el espacio sub-retiniano se pondrá en contacto con vítreo
fluido, y el desprendimiento será bulloso y de crecimiento rápido
(32).
La condensación del córtex
vítreo y la formación de membranas pre-retinianas, junto con la
abundancia y el tamaño de los desgarros, favorecerá la tendencia a la
vítreo-retinopatía proliferativa. Todos estos factores, a veces
agravados por la presencia de una catarata que ocasiona una visualización
deficiente, hacen que los desprendimientos de retina en esta enfermedad
sean especialmente graves y de mal pronóstico.
Se debe de intentar
siempre que se pueda la cirugía escleral, siendo muy parco con la
retinopexia y empleando si se puede láser. Si existe VRP o el desgarro
es gigante, no queda más remedio que recurrir a la vitrectomía
empleando aceite de silicona en los más pequeños y perfluorofenantreno
o gas si son mayores.
SÍNDROME DE
EHLERS-DANLOS
El síndrome de
Ehlers-Danlos, es una anormalidad rara del tejido conjuntivo,
caracterizada por fracaso de las fibras de colágeno para formar una red
de sostén fuerte. Los haces de colágeno se estiran, resbalan, y rotan
anormalmente. Este defecto se hereda de forma autosómica (dominante o
recesiva), o ligada al sexo, y se manifiesta también en los tejidos
oculares. En realidad, hay al menos ocho formas de Ehlers-Danlos genética
y fenotípicamente distintas, de las cuales la VI (autosómica recesiva)
es la que suele tener componentes oftálmicos.
Los pacientes con síndrome
de Ehlers-Danlos presentan piel frágil e hiperelástica, tejidos
friables, e hiperelasticidad de las articulaciones. Estos enfermos se
traumatizan fácilmente y cicatrizan con dificultad, sufren a veces
ruptura de los grandes vasos y de órganos internos como los intestinos
y pulmones, así como hernias diafragmáticas. Otros posibles síntomas
son: acromegalia, angiomatosis facial con hiperfosfatemia, púrpura
trombocitopénica, síndrome de hamartoma múltiple con cáncer uterino,
poliposis familiar, hypo o abetalipoproteinemia, hiperfosfatemia
familiar crónica, hemocromatosis, diabetes, anemia hemolítica,
hipercalcinosis, hiperfosfatemia, neurofibromatosis, elastosis senil,
esclerosis tuberosa, lipomatosis difusa, enanismo y epilepsia.
Los anexos oculares y la
mayor parte de las cubiertas del ojo contienen principalmente tejido
conjuntivo, por lo que casi todas las estructuras oculares están
afectadas y aparecen: pliegues palpebrales colgantes, ectropión,
ptosis, epicantus y estrabismos; la debilidad corneal existente, puede
causar queratocono y dehiscencias postoperatorias, y la de la esclera
miopía, estafiloma posterior, escleróticas azules, o melanocitosis.
El vítreo esta licuado,
colapsado, con membranas y cuerdas flotando en su cavidad, separado del
cristalino, ejerciendo tracción y formando membranas preretinianas.
Las alteraciones funduscópicas
son: estrías angioides, membranas neovasculares sub-retinianas
maculares, blanco con y sin presión, degeneraciones en empalizada, y
desprendimiento de retina, este último causado por desgarros en
herradura o desgarros gigantes. No es excepcional la hemorragia vítrea
originada por una rotura retiniana o por una membrana neovascular.
Los desprendimientos de
retina en pacientes con síndrome de Ehlers-Danlos, son en general de
pronóstico incierto debido a la delgadez escleral, las alteraciones vítreo-retinianas,
y la tendencia a las hemorragias. Debemos estar atentos a la posibilidad
de realizar un tratamiento profiláctico, y si se desencadena el
desprendimiento, usar métodos estraesclerales sólo si la esclera lo
permite; si es muy delgada, pasaremos directamente a la vitrectomía.
SÍNDROME DE MARFAN
El Síndrome de Marfan,
también llamado distrofia mesodérmica congénita, es una enfermedad
hereditaria autosómica dominante, con casi el 100% de penetrancia,
relacionada genéticamente con los genes fibrilares del cromosoma 15. La
prevalencia la podriamos estimar entre 1 y 2 por cada 20.000 habitantes
(33,34).
En su forma clásica, el
síndrome de Marfan se caracteriza por la presencia de anormalidades
oculares, cardiovasculares y esqueléticas. Las alteraciones locomotoras
incluyen alargamiento de los huesos de las extremidades, en especial los
distales, con piernas y brazos largos, aracnodactilia y pie plano; la
talla suele ser alta con una distancia del pubis hasta los pies mayor
que de pubis a la cabeza, suele haber pecho excavado y cifoescoliosis.
La musculatura es hipoplásica, como los ligamentos y tendones, por lo
que existe una hiper extensibilidad de las articulaciones, y el
individuo tiene un aspecto asténico y frágil. Pueden darse además
hernias diafragmáticas e inguinales.
Las alteraciones
cardiovasculares más frecuentes son: dilatación de la raíz aórtica y
aneurismas de la misma, así como menos frecuentemente foramen oval y
trasposición de los grandes vasos.
Otros signos generales
son: ectasia dural, quistes, aplasia y fibrosis pulmonares, neumotorax,
movilidad renal y estrías de distensión en la piel.
El signo ocular más
frecuente es la subluxación del cristalino, que se presenta entre el 55
y 70% (34,35) de los casos de síndrome de Marfan; en general la
desviación es hacia el lado temporal superior pero también puede
hacerlo en otras direcciones, suele ser menor y más esférico de lo
normal, y tiene tendencia a la catarata. La subluxación es lentamente
progresiva sobre todo durante la infancia y la juventud, suele ser
compatible con muy buena visión, y a veces termina luxándose a vítreo
y mucho menos frecuentemente a cámara anterior; el ojo suele ser miope
(40% de los casos). La pupila es miótica y dilata con dificultad por
atrofia del músculo dilatador, y es posible encontrar una iridodonesis.
La córnea, en aproximadamente el 20% de los pacientes es más plana de
lo normal y en raras ocasiones hay una megalocórnea. El estrabismo es más
común en el síndrome de Marfan que en la población general, como
también lo es el glaucoma de ángulo abierto.
Las indicaciones para
extraer el cristalino son, la aparición de catarata, y mala visión
consecuencia del astigmatismo creado por el borde cristaliniano, pero
siempre debemos de tener en cuenta que con su extracción, aumenta el
riesgo de aparición de un desprendimiento de retina. A no ser que sea
estrictamente necesario, el cristalino debe de dejarse en su sitio,
graduando al niño por la parte que mejor vea, la fáquica, o la afáquica
que suele ser la preferida.
El desprendimiento de
retina es una complicación frecuente que aparece en el síndrome de
Marfan (35) sobre todo cuando hay luxación del cristalino, y más aun
cuando el cristalino se luxa a vítreo, o después de la extracción del
mismo. Si la extracción se hace via pars plana combinando vitrectomía
y ultrasonidos, las posibilidades de desprendimiento disminuyen; después
se puede colocar una lente de contacto (36-39), o bien durante la cirugía
se puede suturar una lente a surco (40). También es posible realizar
una facoemulsificación usando un anillo capsular, o incluso sujetando
el cristalino con ganchos dilatadores agarrados a la capsulorexis, para
luego una vez introducida la LIO, suturar el anillo a sulcus; si
terminamos la operación haciendo una cuidadosa vitrectomía los
resultados pueden ser muy satisfactorios.
El desprendimiento de
retina, que se presenta entre el 5 y el 38% (41) según los distintos
autores, (bilateral hasta en el 70%) suele estar complicado por la mala
visualización producida por el borde del cristalino y por la mala
dilatación pupilar, que hacen difícil encontrar los pequeños
desgarros muy periféricos, que con frecuencia lo originan. Algunas
veces los desgarros son más grandes o incluso gigantes. En ocasiones se
puede utilizar para tratarlos cirugía escleral, (41,42) pero lo cierto
es que en la mayoría de los casos tendremos que recurrir a la vitrectomía
(43): previa colocación de un cerclaje, haremos una lensectomía, o una
facofragmentación según la dureza cristaliniana, y luego continuaremos
con vitrectomía, planchado con perfluorocarbono, y fotocoagulación de
los desgarros y de todas las degeneraciones ecuatoriales, para terminar
haciendo un intercambio líquido-gas.
Naturalmente, si el
cristalino está luxado a vítreo no hay más opción que la vitrectomía.
VÍTREO-RETINOPATÍA
EXUDATIVA FAMILIAR
En 1969, Criswick y
Schepens (44) describieron en seis pacientes una alteración de la
retina y vítreo, que era clínicamente similar a la retinopatía del
prematuro pero, sin una historia de prematuridad ni de utilización de
oxígeno. Criswick y Schepens llamaron a esta entidad (VREF)
vitreo-retinopatía exudativa familiar. La VREF (también conocida como
síndrome de Criswick-Schepens) se caracteriza por la avascularidad de
la retina periférica que es especialmente evidente en la angiografía
fluoresceínica. La proliferación fibrovascular secundaria a la
isquemia, produce un tejido cicatricial que tracciona la retina desde la
periferia temporal, produciendo pliegues falciformes, que tiran de la
papila y de la mácula desplazándolas de su sitio, o producen
desprendimiento de retina. El origen de esta enfermedad parece ser la
detención en el desarrollo de los vasos de la retina.

Figura 6. Vitreorretinopatía exudativa familiar (cortesía de
Alfredo Domínguez).
La VREF es una enfermedad
rara, bilateral, lentamente progresiva y asintomática en las fases
tempranas. Se hereda de forma autosómica dominante con una penetrancia
muy alta, y el gen responsable puede estar ligado al brazo largo del
cromosoma 11. Se han descrito casos raros de herencia ligada al sexo. Es
un proceso especialmente frecuente en los Países Bajos y Japón.
Pendergas y Trese (45), desde un punto de vista quirúrgico e imitando
la clasificación de la retinopatía del prematuro, dividen la
enfermedad en cinco estadios que pueden presentarse a cualquier edad.
En el estadío 1, podemos
observar en la periferia del fondo, sobre todo en la zona temporal del
ojo, entre el ecuador y la ora serrata, la línea de separación entre
la zona vascular y avascular de la retina, como un margen engrosado que
con frecuencia tiene forma de cuña. Normalmente en este área existe
una atrofia corio-retiniana, blanco con y sin presión, degeneración quística
periférica, y bandas vítreas. La zona periférica avascular de la
retina, con frecuencia es difícil de ver oftalmoscópicamente, pero fácilmente
demostrable mediante angiografía fluoresceínica. Con este método se
aprecian en la periferia telangiectasias y dilataciones vasculares,
micro y macro aneurismas y shunt arterio-venosos. Los vasos en este área
terminan de forma arborizada y entrelazada a lo largo del límite con la
zona avascular. En muchos individuos, la zona avascular periférica
persiste en la vida adulta sin regresar ni progresar.
El estadío 2 representa
su fase proliferativa y exudativa. Además de los hallazgos descritos en
la fase 1 se ve proliferación fibrovascular, pudiendo existir o no,
exudación intra-retiniana y sub-retiniana en la periferia temporal; si
no lo hay seria estadio 2A y si lo hay 2B. La cicatriz fibrovascular
puede acortar y traccionar la retina produciendo ectopia macular (un
aumento del ángulo en kappa es evidencia de aumento de la tracción
periférica y de desplazamiento maculo-papilar). La fluoresceingrafía
muestra la neovascularización, creciendo en el límite entre la zona
vascular y avascular de la retina, así como la filtración de fluoresceína
hacia el espacio sub-retiniano y hacia el vítreo. La región temporal
de la retina es de nuevo el área más común de neovascularización.
En el estadío 3 aparecen
desprendimientos de retina floridos que no afectan la mácula mientras
que en el 4 la invaden. Cada uno de estos grados serán: A, si el
desprendimiento es exudativo, y B, si es traccional. Diremos que el
desprendimiento es traccional, si existen membranas o zonas fibrosas que
ocasionan un levantamiento retiniano anterior, si el desprendimiento es
cóncavo, o si no hay exudación amarillenta o hemorragias detrás de la
retina; también lo supondremos si la mácula está desplazada.
Finalmente el estadio 5 es cuando el desprendimiento es total: 5 A con túnel
abierto y 5 B con él cerrado. En las fases avanzadas de la enfermedad,
pueden aparecer cataratas, atrofia y rubeosis del iris, glaucoma
neovascular, y queratopatía en banda. La celularidad y turbidez vítrea,
la midriasis pobre, el Thyndal del humor acuoso y las sinequias
posteriores son signos de desprendimiento de retina.
En cualquiera de las
fases mencionadas, si existe tracción, se pueden generar desgarros y
por lo tanto producirse un desprendimiento regmatógeno; de hecho hay
que considerar como tales todos los que aparecen con grado 5.
En conclusión: los
desprendimientos de retina son relativamente comunes en la VREF y
constituyen la causa más frecuente de pérdida visual en estos
pacientes; su incidencia está entre el 20 y el 32 por ciento. La forma
regmatógena es la más común representando entre el 25 y el 63 por
ciento de ellos y los desgarros responsables son, desde redondos, hasta
en herradura o gigantes. Este tipo de desprendimiento normalmente
aparece en la segunda o tercera década de la vida. La tendencia al
desprendimiento regmatógeno en estos pacientes se debe por una parte a
tracciones vítreo-retinianas (se ven bandas y adherencias vítreas a la
retina incluso en las fases tempranas de la enfermedad) y, por otra, a
atrofia retiniana (se ven agujeros en la zona de atrófica avascular de
la retina).
Los desprendimientos de
retina regmatógenos suelen ser casos difíciles, que a menudo engendran
vítreo-retinopatía proliferativa y conllevan varias operaciones con un
postoperatorio uveítico complicado. La hemorragia vítrea es rara, pero
puede conducir a una situación de vítreo-retinopatía irreversible.
Los pliegues falciformes también entran dentro de la normalidad (15 a
39 por ciento de los casos) y se extienden generalmente desde la
periferia infero-temporal a la cabeza del nervio óptico.
La VREF se diferencia de
la retinopatía del prematuro por la ausencia de una historia familiar,
la falta de prematuridad, y de la necesidad de oxigeno, además de toda
una evolución y aparición de complicaciones distintas, que hacen estas
enfermedades difícilmente confundibles. Aparte de la retinopatía del
prematuro, este proceso puede tener un cierto grado de confusión, entre
otras, con la anemia de células falciformes, y ciertas hemoglobinopatías,
con la enfermedad de Eales, la incontinencia pigmenti, la persistencia
de la vascularización fetal, la infección por Toxocara canis, la
enfermedad de Norrie, las enfermedades telangiectásicas y angiomatosas,
y la parsplanitis.
La causa más frecuente
de pérdida visual en casos de VREF es el desprendimiento de retina, que
suele ser complicado y difícil de curar; se necesitan a menudo varios
procedimientos quirúrgicos que se centrarán en aliviar la tracción vítreo-retiniana
y tapar los desgarros, que suelen ser múltiples. Y peor pronóstico
tendrá cuanto más joven sea el enfermo, puesto que tiene más
probabilidades de desarrollar un nuevo desprendimiento, o una vítreo-retinopatía
proliferativa.
El tratamiento ideal es
la prevención, realizando en los niños con una historia familiar de
riesgo, exámenes tempranos y repetidos con pupila dilatada y depresión
escleral.
La destrucción del área
sin vascularización impedirá el desarrollo de neovasos, y si estos
existen, inducirá su desaparición igual que ocurre en la proliferante
diabética, en la retinopatía del prematuro, en la retinopatía
falciforme, en la obstrucción venosa, o en cualquier otro proceso que
origine retina isquémica.
En principio en el estadío
1 aunque como hemos dicho el tratamiento de la zona avascular podría
impedir la aparición de los neovasos, también es cierto que muchos
enfermos no pasan nunca de esta fase.
En el estadío 2 tanto A
como B, es preceptivo la ablación de toda la zona avascular, como si
fuera una retinopatía del prematuro, con frío, o mejor con láser.
Durante el estadío 3 y
4, si se trata de situaciones A (exudativa) se hará cirugía
extraescleral, y si se trata de situaciones B (traccional), se realizará
una vitrectomía al igual que en todos los grados 5 o cuando la situación
sea claramente regmatógena.
Muchos autores abogan por
la vitrectomía en todos los casos en que se presente un desprendimiento
de retina (46,47), y si bien en muchos da resultados satisfactorios, la
existencia de abundantes membranas en el área periférica sin vasos es
signo de mal pronóstico (48).
INCONTINENCIA PIGMENTI
Se trata de una
enfermedad rara, de herencia ligada al sexo transmitida y padecida por
mujeres, con anormalidades en la piel, sistema nervioso central, dientes
y ojos. La retinopatía (49) se caracteriza por avascularidad de la
retina periférica, con posterior neovascularización, y desprendimiento
de retina traccional similar al de la retinopatía del prematuro, o al
de la retinopatía exudativa familiar.
DEGENERACIÓN VÍTREO-RETINIANA
HEREDITARIA EN COPOS DE NIEVE
Es una enfermedad
hereditaria autosómica dominante con penetración inconstante. Los
copos de nieve son manchas blancas de unas 100 a 200 micras de diámetro,
que aparecen en áreas de blanco sin presión, generalmente después de
los 25 años. Los vasos de la retina en el área de la degeneración en
copos de nieve se envainan, y toman el aspecto de hilos blancos
apareciendo pigmento en el margen posterior de la zona degenerada; con
el tiempo desaparecen los vasos en el área afectada. El vítreo esta
licuado y en su interior se ven cuerdas de condensación.
Las cataratas aparecen en
todos los pacientes de más de 35 años en forma de esclerosis nuclear,
opacidades corticales, o sub-capsulares posteriores.
La degeneración en copos
de nieve, se asocia con una incidencia alta de desprendimientos de
retina que suelen ser de mal pronóstico, dada la extensión de las
zonas causales y la situación del vítreo. Por ello se debe de
fotocoagular (50) cualquier erosión, agujero, o desgarro que aparezca.
No siempre este tipo de
degeneración sigue una evolución tan negativa, sino que en muchas
ocasiones puede comportarse de forma benigna y no ser mas que un
hallazgo.
MIOPÍA CONGÉNITA
Aparte de los
desprendimientos traumáticos, que suelen estar producidos por
desinserciones de la ora serrata casi siempre nasales, y de las raras
desinserciones espontáneas de los jóvenes casi siempre temporales
(ambas de un magnífico pronóstico anatómico tras la colocación de un
implante), la mayor parte de los desprendimientos de la niñez y
adolescencia van a producirse en individuos que padecen una miopía congénita.
Este tipo de
desprendimiento suele trasmitirse de forma bastante dominante, acompañado
generalmente de degeneraciones en reja. Las empalizadas suelen ser
abundantes, largas, y con frecuencia muy anchas, y sobre ellas se forman
múltiples desgarros y agujeros pequeños. Los desprendimientos al igual
que las rejas, muchas veces son bilaterales y más o menos simétricos.
El tratamiento, con cirugía extraescleral, consistirá casi siempre en
la colocación de implantes en paralelo largos, cogiendo todas las zonas
degeneradas.
En ocasiones estos niños
con miopía y desprendimiento de retina, presentan otras anoma lías
sistémicas (51), en especial faciales, en cuyo caso los
desprendimientos suelen ser de peor pronóstico, no faltando los
originados por desgarros gigantes.
COLOBOMA DE COROIDES Y
RETINA
El coloboma de coroides y
retina es el resultado del fracaso en el cierre de la hendidura
embrionaria, 33 a 40 días después de la concepción.
Si la cúpula óptica
(embozo de la retina) permanece abierta, sus componentes ectodérmicos
no van a estimular, a este nivel, el desarrollo de la coroides
subyacente, por lo que esta zona solo estará cubierta por la esclerótica.
Si la hendidura no se cierra por delante, faltarán los soportes ectodérmicos
del iris y por lo tanto habrá un coloboma de éste, y si no cierra por
detrás, tendremos un coloboma del nervio óptico, o en sus formas
frustradas un morning glory, una foseta colobomatosa, o una deformidad
papilar.

Figura 7. Arriba:coloboma de coroides. Abajo: Estafiloma de papila y
Morning Glory.
Los colobomas pueden ser
unilaterales o bilaterales, y en este último caso son a menudo asimétricos.
La capacidad visual del ojo afecto dependerá de la extensión de la
malformación y del grado de microftalmia que frecuentemente la acompaña.
Un coloboma del nervio produce algo de disminución visual, aun cuando
la fóvea no esté incluida y la disminución será mucho mayor si está
afectada.
Parece ser que el
coloboma se hereda de forma autosómica dominante con expresión
inconstante y fenotipo que va desde el anoftalmos, hasta diversas
localizaciones del coloboma, morning glory, fosetas colobomatosas, o
deformidad papilar.
El coloboma puede
aparecer como una entidad aislada o asociado a múltiples alteraciones
sistémicas como Aicardi, agenesia del cuerpo calloso, síndromes de
Rubinstein-Tabi o Goldenhar, alteraciones cromosómicas diversas, etc.
La asociación del coloboma con enfermedades y síndromes sistémicos
alcanza hasta un 38% de los casos, por lo cual siempre que nos
encontremos con esta malformación, debemos hacer una cuidadosa
exploración pediátrica (52).
El desprendimiento de
retina es una complicación frecuente de esta anomalía que puede
alcanzar hasta el 40% de los casos, aunque durante la niñez y juventud
no alcance mas del 10%.
Los desgarros, en general
pequeños, se suelen encontrar o en el interior del coloboma o en los márgenes
del mismo, y con frecuencia pasan desapercibidos a la exploración.
Los resultados de la
cirugía escleral fueron siempre desalentadores, pero los de la
vitrectomía pueden alcanzar éxitos de cerca del 100% (53,54).

Figura 8. Foseta colobomatosa.
Después de colocar un
cerclaje, realizaremos la vitrectomía tratando de eliminar la hialodes
posterior; haremos luego un intercambio líquido-gas, extrayendo el
fluido sub-retiniano a través del desgarro, o si no lo encontramos, a
través de una pequeña retinotomía hecha por nosotros. Terminaremos la
intervención fotocoagulando o bien sólo el desgarro, o también los
bordes y el interior del coloboma. En determinados casos no queda más
remedio que recurrir al aceite de silicona (55).
MORNING GLORY
El Morning Glory es una
anomalia congénita de la papila, que consiste en una excavación en
forma de embudo, en cuyo centro se encuentra una papila óptica
agrandada, de color rosa o anaranjado, unas veces también excavada, y
otras sobreelevada. Rodeando la excavación hay una zona anular y
elevada de pigmentación. La mácula puede o no estar incluida en la
zona alterada, y a veces, está desplazada en dirección al nervio óptico.
Los vasos de la retina de
grosor variable se irradian rectos desde la papila, y se bifurcan en ángulo
agudo, siendo a menudo difícil de distinguir las arterias de las venas.
La agudeza visual es muy
variable desde la unidad hasta contar dedos, dependiendo de la extensión
de la lesión, del grado de afectación macular, y de la profundidad de
la ambliopía que esta malformación puede generar.
El morning glory se
asocia con frecuencia a alteraciones medio-faciales y craneales como:
encefalocele, hipertelorismo, labio y paladar hendido, puente nasal
deprimido, etc.
El defecto en si
predispone al desprendimiento de retina que aparece en un 30 a 38% de
los casos, casi siempre en la retina peripapilar aunque en ocasiones es
extenso y bulloso. No está clara la procedencia del líquido
sub-retiniano, que puede proceder del vítreo y entrar por un agujero
existente en la zona excavada (56-58), o ser fluido cerebro-espinal que
por el defecto papilar gana el espacio sub-retiniano (59), o bien una
combinación de ambos; se han descrito también casos de desgarros en la
retina y de exudación a partir de neovasos (60). El desprendimiento es
del mismo tipo del que aparece en las fosetas colobomatosas y colobomas
del nervio óptico.
La forma más usual de
tratar en este momento el desprendimiento, es la vitrectomía seguida de
intercambio líquido-gas, y posterior aplicación de láser (Diodo)
alrededor de la papila, o bien no aplicar láser y meter aceite de
silicona.
MISCELÁNEA
El desprendimiento de
retina en la catarata congénita, aparece típicamente muchos años
después de la cirugía, en la etapa media de la vida, y muy
frecuentemente en individuos miopes. A menudo los desgarros son pequeños
y difíciles de descubrir (61), no solo por su tamaño sino también por
las dificultades de visualización: las pupilas suelen dilatar mal y no
son raras las sinéquias, las deformidades pupilares, y los restos
capsulares. La fotofobia es frecuente y no es excepcional el nistagmus.
A veces los desgarros son grandes e incluso gigantes. La cirugía
escleral (62), usando cerclaje e implantes, puede tener resultados
satisfactorios en los casos en que se encuentran las roturas. Sin
embargo cuando la visualización es mala, o existe una vítreo-retinopatía
proliferativa a la que son muy proclives estos ojos, lo mejor es
recurrir a la vitrectomía (63) que nos permite al mismo tiempo tratar
el desprendimiento y mejorar la pupila.
Axenfeld, a principios de
siglo, fue el primero en describir que el glaucoma congénito se
complica con desprendimiento de retina (64), y que este era una causa
importante de ceguera en aquella enfermedad. El desprendimiento se
presenta en un 1 a 4,5% de los casos de glaucoma congénito. Siempre son
ojos miopes altos y en muchas ocasiones buftálmicos, las opacidades
corneales son casi la regla, y hay cataratas o sub-luxaciones del
cristalino; no son raras las desviaciones pupilares debidas a cirugías
antiglaucomatosas previas. Consecuentemente los desgarros no se
encuentran en más del 50% de los ojos. Los mejores resultados se
consiguen mediante la vitrectomía, previo cerclaje, usando casi siempre
aceite de silicona como taponamiento (65).
BIBLIOGRAFÍA
- Brown D, Weingeist TA.
Decision making in Pediatric Ophthalmology St. Louis: Mosby. 1993;
136-137.
- Lens-sparing
vitreoretinal surgery in infants Arc. Ophthalmol. 1992; 110: 284-286.
- Retina Society
Terminology Committee. The classification of retinal detachment with
proliferative vitreoretinopathy. Ophthalmology. 1983; 90: 121-125.
- The Silicone Study
Group. Proliferative vitreoretinopathy. Am. J. Ophthalmol. 1985; 99:
593-595.
- Machemer R, Aaberg TM,
Freedman HM, Irvine AR, Lean JS, Michels RS. An update classification of
retinal detachment with proliferative vitreoretinopathy. Am. J.
Ophthalmol 1991; 112: 159-165.
- Moisseiev J, Vidne O,
Treister G. Vitrectomy and silicone oil injection in pediatric patients.
Retina. 1998; 18: 221-227.
- Ferrone PJ, Mc Cuen
BW, de Juan E Jr, Machemer R.The efficacy of silicone oil for
complicated retinal detachments in the pediatric population. Arch.
Ophthalmol. 1994; 112(6): 773-777.
- Verma LK, Peyman GA,
Wafapoor H, Greve MDJ, Millsap CM, Adile SL. Vitreon Collaborative
Study. An analysis of posterior segment complications after vitrectomy
using the perfluorocarbon perfluoroperhydrophenantrene (Vitreon).
Ophthalmic Surgery 1995; 26: 29-33.
- Haas J. Uber das
Zusammenvorkommem vonVeranderugen der Retna und Choriodea. Arch.
Aungenheild. 1898; 37: 343-348,
- Citado por
Duke-Elder. System of Ophthalmology: vol X pág 658.
- Yanoff M, Rahn EK,
Zimmerman LE. Histopathology of juvenile retinoschisis. Ach. Ophthalmol.
1968; 79: 49-53.
- Kellner U, Briimmer
S, Foerster MH, Wessin A. X-linked congenital retinoschisis. Graefe
Arch. Ophthalmol. 1990; 228: 432-437.
- Turut P, Francois P,
Castier P, Milazzo S. Analysis of results in the treatment of peripheral
retinoschisis in sex-linked congenital retinoschisis. Ophthalmologica,
1987; 194: 95-102.
- Tanino T, Katsumi O,
Hirose T. Electrophysiological similarities between two eyes with
X-linked recessive retinoschisis Documenta Ophthalmologica. 1985; 60:
149-161.
- George NDL,Yates JRW,
Moore AT. Clinical feature in affected males with X-linked
retinoschisis. Arch. Ophthalmol. 1996; 114: 274-280.
- Schulman J, Peyman
GA, Jednock N, Larson B. Indication for vitrectomy in congenital
retinoschisis. Br. J.Ophthalmol. 1985; 69: 482-486.
- Aslan O, Batman C,
Cekic O, Ozalp S. The use of perfluorodecalin in retinal detachments
with retinoschisis. Ophthalmic. Surg. Laser. 1998; 29: 818-821.
- Ferrone PJ, Trese MT,
Lewis H. Vitreoretinal Surgery for Complications of Congenital
Retinoschisis. Am. J. Ophthalmol. 1997; 123: 742-747.
- Rosenfeld PJ, Flynn
HW, McDonald RH, Rubsamen PE et al. Outcomes of Vitreoretinal Surgery in
Patients With X-Linked Retinoschisis. Ophthalmic. Surg. Laser. 1998; 29:
190-197.
- Goldmman H. La
biomicroscopie du corps vítre et du fond de l‘oil. Bull. Men. Soc.
Fr. Opthalmol. 1957; 70: 265-272.
- Favre M. A propos de
deux cas de dégénérescence hialoideorétinienne. Ophthalmologyca.
1958; 135: 604-609.
- Fishman GA, Jampol
LM, Goldberg MF. Diagnostic feature of the Favre-Goldmann syndrome.
Brit. J. Ophthalmol. 1976; 60: 345-353.
- Wagner H. Ein bisher
unbekanntes Erbleiden de Auges (Degeneratio hyalodeo- retinalis
hereditaria),beobachtet im Kanton Zürich. Klin.Mbl.Augen. 1938;
100:840-857.
- Stickler GB, Belau
PG, Farrell FJ, Jonse JD. Hereditary progressive athro-ophthalmopathy.
1965; Mayo. Clin. Proc 40: 433-355.
- Godel V, Nemet P,
Lazar M. The Wagner-Stickler syndrome complex Documenta Ophthalmol.
1981; 52:179-188.
- Ahmad NN, Ala-Kokko
L, Knowlton RG, Jimenez SA, Weaver EJ et al. Stop codon in the
procollagen 11 gene (COL2AI) in a family with the Stickler syndrome
(arthro-ophthalmopathy). Prc. Natl. Acad. Sci. USA. 1991; 86: 6624-6627.
- William CJ, Ganguly
A, Considine E, McCarron S. and all. A-G transition at the acceptor
splide site of IVS17 characterize the COL2A1 gene mutation in de
original Stickler sindrome kindre. Am. J. Med. Genet. 1996; 63: 461-467.
- Snead MP, Payne SJ,
Barton DE, Yates JV et al. Sticker syndrome: correlation between
vitreoretinal phenotypes and linkage to COL 2A1. Eye 1994; 8: 609-614.
- Monin CL, van
Effenterre G, Andre-Sereys P, Aut. J. Prophylaxie du decollement de
retine de la maladie de Wagner-Stickler.Etude comparative des diferentes
méthodes. A propos de vingt-deux cas. J. Fr. Ophtalmol. 1994; 17:
167-174.
- Leiba H, Oliver M,
Pollack A. Prophylactic laser photocoagulation in stickler syndrome Eye.
1996; 10: 701-708.
- Billington BM, Leaver
PK, McLeod D. Management of retinal detachment in the Wagner Stickler
Syndrome. Trans. Ophthalmol. Soc. U.K. 1985; 104: 875-879.
- Watanabe Y, Ueda M,
Adachi-Usami E. Retinal detachment in identical twins with Stickler
syndrome type1. Br. J. Ophthalmol. 1996; 80: 976-981.
- Pyeritz RN, McKunick
VA. The Marfan syndrome: diagnosis and management. N. Engl. J. Med.
1979; 300: 772-777.
- Fuchs J. Marfan
syndrome and other systemic disorders with congenital ectopia lentis. A
Danish national survey. Acta. Pediat. 1997; 86: 947-952.
- Saracco JB, Estachy
G, Gastaud P, Ridings B. Syndrome de Marfan et Decollement de retine.
Bull. Soc. Opht. France. 1980; 80: 6-7.
- Peyman GA, Raichand
M, Goldberg MF, Ritaca D. Management of suluxated and dislocated lenses
with the vitrophage. Br. J. Ophthalmol. 1979; 63: 771-778.
- Turut P, Françous P,
Flori P, Langlois JL. La phacophagie des ectopies cristalliniennes par
pars plana-Apropos de 20 cas. Bull. Soc. Ophtalmol. Fr. 1979; 8:
757-760.
- Halpert M, BenEzra D.
Surgery of hereditary subluxated lens in children. Ophthomology 1996;
103: 681-686.
- Hubbard AD, Charteris
DG, Cooling J. Vitreolensectomy in Marfan’s syndrome Eye 1998; 12:
412-416.
- Omulecki W, Nawrocki
J, Palenga-Pydyn D, Sempinska-Szeuczyk J.Pars plana vitrectomy,
lensectomy, or extraction in transscleral intraocular lens fixation for
the management of dislocated lenses in family with Marfan‘s syndrome
Ophthalmic. Surg. Laser. 1998; 29: 375-379.
- Abboud EB. Retinal
detachment surgery in Marfan’s syndrome. Retina. 1998; 18: 405-409.
- Dotrelova D, Karel I,
Clupkova E. Retinal detachment in Marfan’s syndrome Characteristics
and Surgical Results. Retina 1997; 17: 390-396.
- Greco GM, Ambrosino
L. Treatment of Retinal Detachment in Marfan Syndrome. Ann.
Ophthalmol.1993; 25: 72-76.
- Criswick VG, Schepens
CL. Familial exudative vitreoretinopathy. Amer. J. Ophthalmol. 1969; 68:
578-594.
- Pendergast SD, Trese
MT. Familial exudative vitreoretinopathy: Results of Surgical
Management. Ophthalmology. 1998; 105: 1015-1023.
- Glazer LC, Maguire A,
Blmenkranz MS, Trese MT, Green WR. Improved surgical treatment of
familial exudative vitreoretinopathy in children. Amer. J, Ophthalmol.
1995; 120: 471479.
- Shubert A, Tasman W.
Familial exudative vitreoretinopathy: surgical intervention and visual
acuity outcomes. Graefes´s. Arch. Clin. Exp. Ophthalmol. 1997; 235:
490-493.
- Ikeda T, Fujikado T,
Tano Y, Tsujikawa K, Koizumi K et al. Vitrectomy for Rhegmatogenous or
tracional Retinal Detachment With Familial Exudative Vitreoretinopathy.
Ophthalmology. 1999; 106: 1081-1085.
- Wald KJ, Mehta MC,
Katsumi O, Sabates NR et al. Retinal Detachments in Incontinentia
Pigmenti. Arch. Ophthalmol. 1993; 111: 614-617.
- Pollach A, Uchenik D,
Chenke, Oliver. Prophylactic laser photocoagulation in hereditary
snowflake vitreoretinal degeneration. Arch. Ophthalmol. 1983; 101:
1536-1539.
- Scott JD. Congenital
myopia and retinal detachment. Trans. Ophthal. Soc. U.K.1980; 100:
69-71.
- Daufenbach DR, Ruttun
MS, Pulido JS, Keech RV. Chorioretinal colobomas in pediatric
population. Ophthalmology. 1998; 105: 1455-1458.
- McDonald HR, Lewis H,
Brown G, Sipperley JO. Vitreous surgery for retinal detachment
associated with choroidal coloboma. Arch. Ophthalmol. 1991; 109:
1399-1402.
- Corcostegui B, Güell
JL, Garcia-Arumi J. Surgical treatment of retinal detachment in the
choroidal colobomas. Retina. 1992; 12: 237-241.
- Hanneken A, Juan E,
McCuen BK. The management of retinal detachment associated with
choroidal coloboma by vitreous surgery. Am. J. Ophthalmol. 1991; 111:
271-275.
- Harris MJ, Bustros S,
Mmichels RG, Joondeph HC. Treatment of combined traction-rhegmatogenous
retinal detachment in the morning glory syndrome. Retina. 1984; 4:
249-242.
- Bartz-Schmidt KU,
Heimann K. Pathogenesis of retinal detachment associated with morning
glory disc. Internat. Ophthalmol. 1995; 19: 35-38.
- Coll GE, Chang S,
Flyn TE, Brown GC. Communication between the subretinal space.
Graefe‘s Arch. Exp. Ophthalmol. 1995; 38: 441-443.
- Chang S, Haik BG,
Ellsworth RM, St. Llouis L. Treatment of total retinal detachment in
morning glory syndrome. Am. J. Ophthalmol. 1984; 97: 596-600.
- Akamine T, Doi M,
Takahashi H. Morning Glory syndrome with peripheral exudative retinal
detachment. Retina. 1997; 17: 74-74.
- Toyofuku H, Hirose T,
Schepens CL. Retinal detachment following congenital cataract surgery. I
Preoperative findings in 114 eyes. Arch. Ophthalmol. 1980; 98: 669-675.
- Kanski JJ, Elkington
AR, Daniel R. Retinal detachment after congenital cataract surgery.
Brit. J. Ophthalmol. 1974; 58: 92-95.
- Jagger JD, Cooling
RJ, Fison LG, Laever PK. Management of retinal detachment following
congenital catarct surgery. Trans. Opthalmol. Soc. U.K. 1983; 103:
103-107.
- Cooling RJ, Rice NSC,
McCleod D. Retinal detachment in congenital glaucoma. Brit. J.
Ophthalmol. 1980; 64:417-421.
- Wiedemann P, Heimann
K. Retinal detachment in eyes with congenital glaucoma. Retina. 1992;
12: S51-S54.
|