|
ENFERMEDAD DE COATS
Introducción
George Coats (1) fue el primero en describir una enfermedad retiniana
idiopática que posteriormente llevaría su nombre y se caracteriza por
exudación masiva intra y subretiniana con anomalías vasculares periféricas,
que se presenta generalmente de forma unilateral en varones jóvenes, sin
evidencia de enfermedad sistémica.
Coats separó esta nueva entidad en tres grupos: 1) ojos con exudación
subretiniana masiva sin anomalías vasculares demostrables; 2) ojos con
exudación subretiniana masiva y múltiple anomalías vasculares retinianas con
hemorragias retinianas; 3) ojos con malformaciones arteriovenosas francas y
exudación subretiniana. Este tercer grupo sería separado después por Von
Hippel al demostrar que se trataba de una enfermedad diferente caracterizada por
una angiomatosis de la retina.
Posteriormente Leber describió una enfermedad con alteraciones vasculares
similares a la enfermedad de Coats pero sin la existencia de una exudación
subretiniana masiva pasándose a llamar más tarde Enfermedad de Múltiples
Aneurismas miliares de Leber.
Reese en los años 50 aclaró la situación demostrando que la enfermedad de
Leber era una manifestación inicial y parte del síndrome de Coats al observar
que un paciente con enfermedad de Leber en su evolución desarrolló una
enfermedad de Coats (2).
Etiopatogenia
La etiología de esta enfermedad está poco clara. En el pasado muchos
investigadores estudiaron la posibilidad de que fuera de origen infeccioso,
inflamatorio, metabólico y de otros orígenes sin haberse podido nunca
demostrar una relación consistente con ninguna de estas causas (2).
En ocasiones ha sido descrito como un síndrome en asociación con varias
enfermedades oculares hereditarias como Retinitis Pigmentosa , síndrome de
Hallermann Streiff, Síndrome de Senior Loken, Síndrome de Cornelia de Lange,
Síndrom de Parry Romberg y el síndrome del Nevus epidérmico (3-8).
Últimamente Black et al (9) describen una mujer con enf. de Coats, que dio a
luz a un niño con enfermedad de Norrie, portando ambos una mutación en el gen
NDP en el cromosoma Xp11.2. Posteriormente analizaron las retinas de 9 ojos
enucleados de varones con enf. de Coats, hallando en uno una mutación somática
en el gen NDP que no estaba presente en tejido no retiniano, por lo que
sugieren, que la enfermedad de Coats es secundaria a una mutación somática del
gen NDP que resulta en una deficiencia de Norrin (proteína que fabrica este
gen) dentro del desarrollo retiniano, que además, como confirman otras
observaciones esta proteína sería crítica también para una vasculogénesis
normal (10).
Características clínicas
La enf. de Coats tiene una edad media en el diagnóstico de entre 9 y 10
años. Afecta a varones tres veces de forma más frecuente que a mujeres y es
unilateral en más del 80% de casos sin haberse observado transmisión
hereditaria (11-15). Los síntomas más frecuentes de presentación dependerán
de la edad del diagnóstico. En los niños más pequeños se suele presentar en
forma de leucocoria, estrabismo o a veces los padres refieren que notan algo
raro en la mirada del niño. En niños mayores, las quejas más frecuentes
suelen ser disminución de agudeza visual progresiva o incluso ser descubierto
en un examen rutinario en el colegio (13-15).
El cuadro típico oftalmoscópico es muy variable dependiendo del estadio de
la enfermedad. En las formas leves a moderadas se suele observar un
desprendimiento exudativo que no suele afectar a más de dos cuadrantes, siendo
los más frecuentes los de la zona temporal, acompañados de alteraciones
vasculares de aspecto telangiectásicos o aneurismático de la periferia. La
exudación suele tener un aspecto blanco amarillento debido a su contenido
lipídico y puede ser tanto subretiniana como intrarretininana (figuras 1 y 2).
En la evolución se va a producir un desprendimiento exudativo total que a veces
puede incluso llegar a colocar la retina detrás del cristalino (figura 3). Esta
segunda forma se denomina Coats avanzado (14,16). Las alteraciones vasculares
pueden ser mínimas y pasar desapercibidas o por el contrario ser el signo
predominante del cuadro (figuras 4 y 5).
Histopatología
Las muestras patológicas de ojos con enf. de Coats fueron en el pasado
abundantes debido a las enucleaciones por sospecha de tumor intraocular o por
desarrollo de glaucomas que llevaban a ojos dolorosos (11,15).

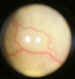
Figuras 1 y 2. Placas típicas de exudación amarillenta
subretiniana.
El examen patológico con microscopia óptica y electrónica, revela pérdida
de células endoteliales y pericitos, con la consiguiente alteración en la
pared del vaso, con dilataciones aneurismáticas y telangiectásiscas y pérdida
de la barrera hematorretiniana interna. Secundario a esto se observan la
exudación intra y subretiniana de predominio lipídico y con abundante
macrófagos llenos de lípidos (figura 6).
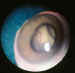
Figura 3. Coats avanzado. Desprendimiento retiniano bulloso con la
retina contactando casi con el cristalino.
Diagnóstico
El diagnóstico se basará en las características típicas clínicas de la
enf. de Coats, aunque en ocasiones deberemos utilizar pruebas diagnósticas
accesorias, sobre todo en niños pequeños para descartar principalmente la
existencia de un retinoblastoma, ya que un error en su diagnóstico podría
acarrear consecuencias fatales para la vida del niño (14,16,17). Otras
patologías que se incluirían en el diagnóstico diferencial serían en general
todas las causas de leucocoria como la persistencia de vítreo primario
hiperplásico, toxocariasis, hemorragias subretinianas organizadas o angiomas
(18,19).
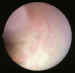

Figuras 4 y 5. Dilataciones telangiectásicas típicas de enf. de
Coats.
La angiografía fluoresceínica nos será de utilidad en casos de enf. de
Coats temprana o moderada, que normalmente será diagnosticada en niños mayores
siendo las características angiográficas típicas, anomalías vasculares
consistentes en una red capilar anormal con capilares dilatados, presencia de
dilataciones aneurismáticas y fusiformes con importante rezume en fases
tardías. Las arteriolas afectadas a veces terminan en dilataciones
macroaneurismáticas, rodeadas por zonas de cierre capilar atravesadas por
shunts arteriovenosos (2,15,20-22) (figura 7).

Figura 6. Corte histológico de globo ocular con enf. de Coats donde
se aprecia la retina totalmente desprendida junto al cuerpo ciliar y detrás del
cristalino, con grandes vasos dilatados (flecha) y exudación conteniendo
macrófagos llenos de lípidos.
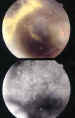
Figura 7. AFG de paciente con enf. de Coats.
En caso de enf. de Coats más avanzada con un desprendimiento exudativo
importante o si existen dudas razonables en el diagnóstico tenemos una serie de
pruebas que podemos realizar para intentar llegar al diagnóstico de certeza:
1. Ecografía y eco doppler.
La ecografía es una prueba fácil de
realizar, sin riesgo biológico y nos será de utilidad sobre todo para
descartar la presencia de calcificaciones subretinianas que inducirían a pensar
en un retinoblastoma (17).
El eco doppler es capaz de detectar vasos en los tumores no calcificados lo
que nos diferenciaría el retinoblastoma que es un tumor vascularizado de la
enf. de Coats (23).
2. Tomografía computerizada.
Nos será de mucha utilidad también para
el diagnóstico diferencial con el retinoblastoma y se caracterizaría por la
observación de un desprendimiento de retina con una densidad homogénea en el
espacio subretiniano. En caso de Coats más evolucionados las densidades
subretinianas pueden ser algo más heterogéneas pero sin llegar a la densidad
observada en lesiones calcificadas.
Si se realiza un TAC con contraste, no se observará una elevación en las
densidades subretinianas y sí acaso se notará un aumento de densidad a nivel
de la línea de transición con el vítreo que indica una mayor vascularización
a nivel intrarretiniano (18).
Con las modernas técnicas de TAC espiral que permite una exploración mucho
más rápida, incluso esta prueba puede hacerse con el niño no anestesiado
(24).
3. Resonancia magnética nuclear.
Al igual que en el TAC la retina está
por encima de los límites de resolución espacial de la RMN y el
desprendimiento es solo visualizado como diferencia de fluidos de distinta
composición y densidad.
El material exudativo subretinano compuesto de colesterol, ácidos grasos
libres, y proteínas es de baja intensidad en T1 lo que es de esperar dada su
similitud con la grasa. El contraste entre la exudación subretiniana y la
cavidad vítrea se acentúa en T2 siendo visto el material subretiniano como un
área hiperintensa y homogénea (19).
4. Examen citopatológico.
En pacientes donde se realiza drenaje de
líquido subretiniano el examen citopatológico confirmará el diagnóstico
mostrando ausencia de células malignas, así como macrófagos llenos de
lípidos (17).
Tratamiento
Históricamente la mayoría de ojos con síndrome de Coats avanzado en la
infancia, fueron enucleados a causa de su difícil diagnóstico diferencial con
el retinoblastoma. En la serie que publica Gómez Morales, 13 de 18
enucleaciones fueron debidas a la posibilidad de tumor maligno (11). Esto se
corrobora en otras series en las que un número de ojos fueron enucleados con el
diagnóstico incorrecto de retinoblastoma (15,25).
En los últimos tiempos el mejor conocimiento del patrón clínico de la enf.
de Coats y el uso de pruebas diagnósticas más sensibles, como el TAC
(17,18,24), ecografía (17) o resonancia magnética (14,19), han permitido un
diagnóstico más correcto y por tanto ha evitado la mayoría de las
enucleaciones por este motivo.
Otro de los motivos históricos para enuclear estos ojos era el desarrollo en
su evolución de un desprendimiento de retina exudativo bulloso total, con
posterior progresión a cierre angular y neovascularización secundaria llegando
a un ojo doloroso y ciego, aunque esto no ocurre necesariamente en todos los
casos (11,13,15,16). El manejo óptimo de la enf. de Coats avanzada con
desprendimiento de retina exudativo total, es motivo de controversia. Hoy día,
la tendencia, es tratar los ojos con enf. de Coats avanzada, incluso aunque
éstos sean ya ciegos, ya que se ha visto, que en muchas ocasiones se consigue
conservarlos de forma cosmética aceptable y sin dolor. (14,16,17). No obstante,
si un oftalmólogo sospecha que se trata de una enf. de Coats, pero es incapaz
de descartar la posibilidad de retinoblastoma de forma concluyente, debe optar
por referirlo a alguien con mayor experiencia en el diagnóstico diferencial de
retinoblastomas, o proceder a la enucleación.
Hasta los años 70 el tratamiento de la enf. de Coats era descorazonador
(11). En los años 70 se publicaron algunas series usando fotocoagulación o
crioterapia con resultados algo más prometedores (12,13,25).
En la actualidad el tratamiento de la enf. de Coats va a depender
fundamentalmente de la edad del paciente y del grado de afectación y estadio
evolutivo de la enfermedad, teniendo en cuenta sobre todo la presencia o no de
desprendimientos exudativos.
1. Crioterapia.
Se utiliza sobre todo para lesiones periféricas con o
sin exudación. Debe intentarse tratar solo las zonas de telangiectasia. La
técnica utilizada será la de congelar-descongelar en dos o tres ciclos. En
casos de enfermedad avanzada, se puede unir a drenaje de líquido subretiniano
como luego describiremos. La exudación puede aumentar inmediatamente después
del tratamiento. Es recomendable tratar un máximo de cuatro horas en cada
sesión para evitar en lo posible el aumento del DR exudativo (13,15, 17,26)
(figura 8).
2. Fotocoagulación con láser.
Muchos pacientes con Coats son demasiado
jóvenes para colaborar y permitir el tratamiento en la lámpara de hendidura.
Tradicionalmente eran tratados con crioterapia o fotocoagulación con arco de
xenon bajo anestesia general. La fotocoagulación con arco de xenon, es
técnicamente difícil sobre todo en lesiones periféricas y la crioterapia
suele producir un desprendimiento de retina exudativo secundario, que se suele
resolver de forma espontánea con el tiempo.
Hoy en día, en estos pequeños pacientes tenemos la posibilidad de aplicar
el láser, a través del oftalmoscopio indirecto, permitiéndonos una excelente
visualización de la periferia retiniana que uniéndolo a la posibilidad de
realizar depresión escleral, nos va a permitir tratar de forma fácil incluso
las telangiectasias más periféricas. Se debe utilizar láser argón verde, YAG
doblado, o cualquier otro que sea bien absorbido por la hemoglobina, utilizando
grandes tamaños de spot y larga duración. Nosotros tratamos los vasos
telangiectásicos intentando cerrarlos y también la retina isquémica (figura
9). A veces se necesitan varias aplicaciones para cerrar estos vasos. Esta
técnica también es usada por algún otro autor (27).

Figura 8. Tratamiento con crioterapia de vasos telangiectásicos en
la periferia retiniana.
Budning en su serie realiza una barrera de láser en el límite del
desprendimiento asociado a crioterapia en las telangiectasias, observando una
menor evolución de la exudación hacia el polo posterior (26).
En pacientes cooperadores se puede usar el láser a través de la lámpara de
hendidura. Se usa spot de 500 micras y tiempos entre 0,2 y 0,5 segundos,
intentando producir un espasmo del vaso y quemadura blanca en la retina
adyacente (13).
3. Drenaje del líquido subretiniano.
Se suele utilizar en casos
avanzados con gran componente exudativo, para permitir, un efecto adecuado del
frío o del láser. Existen diferentes técnicas dependiendo de los autores.
Rydley et al (13), utilizan un cerclaje para restaurar una mejor presión
intraocular, así como, relajar tracciones ví treas, mientras que Silodor (16)
realiza una esclerotomía postecuatorial y pone una infusión por pars plana o
limbo quirúrgico a presión para forzar el drenaje de líquido subretiniano, a
la vez, que mantiene una buena tensión en el ojo, todo ello, mediante
visualización con oftalmoscopio indirecto, inyectando después aire o gas a
presión para mantener la aposición retinocoroidea, pasando entonces a realizar
crioterapia de vasos telangiectásicos. Esta técnica ha sido utilizada también
por algún otro autor con buenos resultados (14)
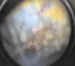
Figura 9. Tratamiento con láser de argón a través de
oftalmoscopio indirecto.
En muchas ocasiones, una de estas técnicas o varias de ellas, deben ser
repetidas varias veces, hasta el completo cierre de todos los vasos
telangiectásicos, la desaparición de la exudación subretiniana, su
disminución, o al menos su estabilización, ya que a veces, no se consigue su
total desaparición. El número de sesiones en las diferentes series fueron
desde una hasta nueve de las distintas terapias (13-17). Como ya se ha dicho, la
severidad de la enfermedad, es mayor en niños cuanto más pequeños por lo que
éstos suelen requerir mayor número de tratamiento y de forma más agresiva que
los mayores (13).
En casos no muy avanzados si el tratamiento ha sido efectivo, la
obliteración de los vasos, así como, una cicatriz pigmentada suele estar
presente en el primer mes y en unos meses se observará una disminución gradual
de los exudados, hasta la desaparición, aunque los nódulos sólidos de
exudación sobre todo a nivel foveal no desaparecerán sino que irán hacia la
fibrosis (13) (figuras 10 y 11).
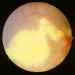
Figura 10. Gran placa macular de exudación lipídica.

Figura 11. Corte histológico postmortem de cicatriz fibrosa
subretiniana macular (flecha) con desestructuración de la retina sobre ella y
quistes a nivel de capas retinianas internas secundarios a edema macular
quístico crónico, en una niña con enf. de Coats que fue tratada con láser.
Se han descrito casos en los que se producen membranas epirretinianas
maculares, debidas al tratamiento con láser o crioterapia, que incluso, pueden
llegar a producir desprendimientos traccionales en casos de Coats juveniles
(28,29). En otros casos se describe la aparición de estas membranas previas al
tratamiento (21,22) (figura 7). Estos casos pueden ser una indicación de
vitrectomía para liberar dichas tracciones o extraer dichas membranas, aunque
se ha descrito la separación espontánea de dichas membranas después del
tratamiento de las alteraciones vasculares con láser (22).
Evolución y pronóstico
La evolución natural es variable, aunque generalmente progresiva, fases de
exacerbación aguda pueden ir seguidas de estabilización durante tiempo. En
general sin tratamiento las complicaciones secundarias como iridociclitis,
cataratas y glaucoma neovascular o congestivo, pueden llegar a producir ojos
dolorosos y finalmente ptisis bulbi (11,13-16), aunque esto no siempre ocurre
(17).
La enfermedad de Coats sobre todo en niños menores de 4 años, suele
evolucionar de forma muy agresiva y es frecuente que el desprendimiento de
retina sea total y con gran exudación en el momento del diagnóstico ya que los
niños pequeños no se suelen quejar de mala visión en un ojo (13,14,17,26). La
mayoría de los trabajos consideran un éxito de tratamiento en estos casos,
cuando han conseguido parar la progresión de la enfermedad con disminución
importante o desaparición de la exudación subretiniana, aunque en estos casos
la recuperación de agudeza visual fue mínima a causa de la gliosis
subrretiniana foveal y la ambliopía (13,14,16).
Budning en su serie de 25 casos ha encontrado que los factores más
importantes que determinan el pronóstico visual en un ojo con enf. de Coats son
1. la cantidad de retina periférica afectada por la telangiectasias, siendo
mejor pronóstico una afectación menor de 5 horas así como 2 la no presencia
de DR exudativo en el momento del diagnóstico (26).
ANGIOMA CAPILAR DE LA RETINA Y ENFERMEDAD DE VON HIPPEL-LINDAU
Los angiomas capilares retinianos son tumores histológicamente benignos que
pueden aparecer en la retina periférica o alrededor de la papila. Ambos se
pueden dar de forma aislada (30) o ser una de las manifestaciones del síndrome
de Von Hippel-Lindau (VHL) (31), siendo idénticos en sus características
clínicas, histología y evolución (30).
Síndrome de Von Hippel-Lindau
El síndrome de VHL es una enfermedad multisistémica que se hereda de forma
autosómica dominante, con expresividad variable, caracterizada por la
predisposición a desarrollar una amplia variedad de tumores, siendo los más
frecuentes el hemangioblastoma de retina y sistema nervioso central, el
carcinoma de células renales, feocromocitoma y quistes renales, pancreáticos y
epididimales (31).
La incidencia de nacimientos de heterozigotos es de 1:36.000 y la penetrancia
es casi completa a los 65 años, aunque la enfermedad puede estar ya presente en
la infancia o ser diagnosticada en la séptima década. La esperanza de vida
media es de 49 años y el carcinoma de células renales, la causa más común de
muerte (31).
El aislamiento del gen del síndrome de VHL en el brazo corto del cromosoma
3p en 1993, nos ha dado la oportunidad de determinar las bases genéticas del
angioma ocular. El gen se piensa que funciona como un gen supresor tumoral
típico, por lo que necesitaría de la inactivación homocigótica de ambos
alelos VHL, para iniciar la tumorigénesis en una célula susceptible (32).
El síndrome de VHL es un paradigma de la importancia del diagnóstico precoz
y el screening. Dado que el angioma retiniano suele ser el primer tumor del VHL
en desarrollarse y ser diagnosticado (31), el oftalmólogo juega un importante
papel en el diagnóstico precoz de esta enfermedad, ya que el reconocimiento y
tratamiento de las manifestaciones del síndrome VHL en un estadio temprano, son
importantes para reducir la morbimortalidad, por lo que Webster recomienda el
siguiente programa de screning (tabla 1) (30).

Cuando existe historia familiar del síndrome de VHL, la detección de un
hemangioblastoma retiniano o del sistema nervioso central es suficiente para su
diagnóstico. Si no existe historia familiar son necesarias un mínimo de dos
complicaciones para el diagnóstico (ej. dos o más angiomas retinianos o del
SNC) o un angioma solitario en asociación con una manifestación visceral (33).
Como ya hemos dicho, pueden darse angiomas retinianos esporádicos no
asociados a síndrome VHL, aunque son mucho menos frecuentes. Dado que la edad
de presentación cuando son sintomáticos, morfología, localización anatómica
y complicaciones son similares a las que se ven en el síndrome VHL y teniendo
en cuenta que la sensibilidad de los test de ADN para detectar la enfermedad es
incompleta, en los casos de angiomas solitarios se recomienda también el mismo
screening periódico (30).
Características clínicas
En un estudio en el año 98, donde se revisaron los casos de angiomas
aparecidos en la literatura entre 1964 y 1998, se vio que la edad media de
presentación de angiomas aislados fue de 48 años, mientras que si se asociaban
al síndrome de VHL esta edad media era de 25 años (34), aunque en otro estudio
posterior se demuestra que cuando los angiomas solitarios eran sintomáticos, la
edad de diagnóstico era similar a la de los enfermos con VHL (30). Los angiomas
retinianos son raros en edad pediátrica, en la serie de Maher menos del 1% se
dieron en niños menores de 5 años y menos del 5% en niños menores de 10 años
(31). La edad de diagnóstico, como es lógico, suele ser menor en individuos
que se presentan con síntomas teniendo además estos últimos más
probabilidades de pérdida de visión. No se ha encontrado predilección por
raza o sexo (30).
Los síntomas de presentación en edad pediátrica van desde descubrimiento
de disminución de agudeza visual en exploración rutinaria del colegio, de
forma rara leucocoria, o en caso de niños mayores disminución de agudeza
visual o metamorfopsia, dependiendo del grado de afectación macular. En caso de
síndrome de VHL el diagnóstico a veces se realiza durante la exploración de
screening al existir algún miembro de la familia ya diagnosticado o al ser
remitido por otro especialista con diagnóstico previo de VHL (30,35-37).
Los hemangiomas capilares pueden desarrollarse en la retina periférica o en
la papila y a su alrededor.
Los hemangiomas capilares retinianos periféricos, también llamados
tumores de Von Hippel pueden tener diferente aspecto según su estado evolutivo.
Típicamente son de color rojo o rosado, forma oval y se asocian con un shunt
arteriovenoso entre una arteria nutricia muy dilatada y tortuosa y una vena de
drenaje (figuras 12 y 13).

Figura 12. Angiomas capilares múltiples periféricos en Sd. de Von
Hippel Lindau, con fibrosis prerretiniana sobre dos de ellos.
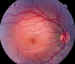
Figura 13. Arcada temporal sup. del mismo paciente de la figura 12
algo más dilatada que la inferior. En cuadrante temporal sup. comienza a verse
una arteria nutricia de los angiomas (flecha).
El tamaño varía desde microscópicos hasta mayores de 5 mm de diámetro.
Los angiomas más pequeños, también llamados microangiomas (37), suelen ser
asintomáticos e incluso pueden no ser detectados mediante oftalmoscopia y ser
visto solo con angiofluoresceingrafía (31,37).
La localización más frecuente es en la retina supratemporal (38).
Los angiomas más grandes son los que de forma más común estarán asociados
a complicaciones que son las que nos van a producir disminución o pérdida de
agudeza visual. En la serie de Webster (38), la complicación más frecuente es
el desprendimiento de retina exudativo, seguido de la angiomatosis secundaria en
las áreas cercanas a la retina tratada o desprendida, exudación
intrarretiniana que puede afectar a la mácula, desarrollo de membranas
epirretinianas maculares, hemorragias vítreas, desprendimientos de retina
regmatógenos, y neovascularización papilar o retiniana. Los angiomas menores
de 0,5 mm o 1/3 del diámetro papilar no suelen causar complicaciones que
produzcan disminución de agudeza visual (35,38,39).
En casos más avanzados incluso se puede producir proliferación fibrosa
sobre la retina y a nivel del vítreo que en su evolución nos van a provocar un
desprendimiento de retina traccional con ectopia macular. Esta tracción puede
desgarrar la retina llevándonos a un desprendimiento de tipo mixto traccional
regmatógeno (29,40). La neovascularización papilar o retiniana, se da en estos
pacientes a pesar de tener el resto de la retina y su vascularización sana.
Esto se podría explicar, porqué se ha visto una alteración en la regulación
del factor de crecimiento endotelial en cultivos de células VHL (41).
A veces, sufren regresión espontánea aunque es poco frecuente, apareciendo
como lesiones blanquecinas con vasos nutricios muy atenuados, permaneciendo
hiperfluorescentes en la AFG, siendo también denominados angiomas fibrosos
(37).
Los angiomas capilares papilares son más frecuentes que los
periféricos si comparamos el área de superficie papilar con la retiniana,
aunque en términos absolutos son menos frecuentes (38). Pueden adoptar dos
formas clínicas fundamentales: endofítico y exofítico. Los endofíticos se
desarrollan a partir de los capilares de los estratos retinianos superficiales y
crecen hacia el vítreo como un nódulo rojizo o anaranjado bien delimitado,
aunque sin vasos aferentes ni eferentes como el angioma capilar periférico. El
exofítico se desarrolla desde los estratos retinianos más externos y suelen
tener un crecimiento sesil de bordes mal definidos, produciendo una imagen
oftalmoscópica peculiar que es a menudo confundida con papiledema unilateral,
papilitis, neovascularización coroidea o hemangioma coroideo (42,43). Las
complicaciones asociadas con los angiomas papilares y que llevan a una
disminución o pérdida de la visión incluyen exudación intrarretiniana,
membranas epirretinianas maculares, estrías o tracción macular,
desprendimiento de retina exudativo y hemorragia vítrea (35,38,43).
Histopatología
Los estudios histológicos de ojos enucleados describen el angioma retiniano
como un tumor compuesto de una proliferación de capilares y células gliales
como estroma. Los grandes capilares que forman el tumor muestran su endotelio,
membrana basal y pericitos normales, siendo las células estromales
identificadas como astrocitos conteniendo grandes vacuolas rellenas de lípidos.
En el caso de angiomas yuxtapapilares se ha visto que en ocasiones existen
comunicaciones vasculares tanto con la circulación retiniana como coroidea
(44,45).
Diagnóstico diferencial
El diagnóstico del angioma capilar periférico con sus características
clínicas típicas, de masa intrarretiniana rojo anaranjada, con vasos nutricios
muy dilatados, es fácil con la oftalmoscopia indirecta y más si existen
antecedentes de enfermedad de VHL.
La angiografía fluoresceínica es una prueba diagnóstica fundamental sobre
todo en los estadios iniciales de su desarrollo, en donde a veces es difícil
indentificarlos mediante oftalmoscopia (30,31,37,46)
Las características angiográficas típicas son un rápido llenado de la
arteria nutricia y del tumor en tiempos tempranos de la AFG demostrando su
origen vascular. En tumores pequeños no habrá extravasación de contraste,
pero sí existirá fuga de colorante a espacio vítreo en los tumores mayores.
También nos será de utilidad para valorar el efecto del tratamiento (46).
En edad pediátrica, aunque son raros, es fundamental el diagnóstico
diferencial con el retinoblastoma que a veces puede tener vasos nutricios aunque
nunca tan dilatados como el angioma, así como el angioma tener una superficie
de aspecto blanquecino que puede confundirnos. También se ha descrito algún
caso de desprendimiento de retina exudativo, que ha llevado a la enucleación
para confirmar el diagnóstico (30). En estos casos puede ser de utilidad
pruebas accesorias como ecografía, ecodoppler, TAC o RNM, para realizar un buen
diagnóstico diferencial. Otras patologías que nos pueden producir exudación
macular o desprendimiento de retina exudativo en esta edad, son el Coats (11),
lesiones vasoproliferativas de aspecto tumoral, como las descritas por Shields,
aunque ninguno de ellos presenta unos vasos nutricios tan dilatados como el
angioma capilar (47).
Las malformaciones arteriovenosas congénitas retinianas, como el angioma
cirsoide o el hemangioma cavernoso, aunque tienen shunts arteriovenosos
dilatados, no presentan la tumoración en el centro del shunt como el angioma
retiniano (48).
Los angiomas papilares, como ya se ha dicho, pueden ser confundidos con
papiledema unilateral, coroiditis peripapilares, o neovascularización coroidea
yuxtapapilar, siendo la angiografía fluoresceínica y la clínica acompañante,
importantes para el diagnóstico diferencial (43).
Tratamiento
Aunque los angiomas retinianos son lesiones benignas, pueden crecer y
producir pérdida visual debido a las complicaciones ya comentadas, llegando
incluso a la ceguera. Se ha visto gran variabilidad, tanto en la velocidad de
crecimiento del tumor, como en la agresividad de la enfermedad, desde la no
evolución durante años, hasta un rápido deterioro de la visión (49). Dado
que el pronóstico visual es mucho mejor cuando son detectados y tratados en una
etapa asintomática, se recomienda su tratamiento nada más sean detectados ya
que se ha visto que las complicaciones del tratamiento en estos casos son
mínimas (31,37,38,49,50).
El tipo de tratamiento va a depender del tamaño, localización y presencia
de complicaciones fundamentalmente.
Fotocoagulación con láser. Es el tratamiento de elección para la
mayoría de angiomas no complicados (33,37,46,49,50). El láser más usado es el
argón verde, aunque el YAG doblado tiene un longitud de onda (532 nm), que
será mejor absorbida por la hemoglobina y últimamente se está extendiendo su
uso.
Se utilizan spots de entre 250 y 500 micras, con tiempos de exposición de
entre 0,2 y 1 segundo empezando con bajas intensidades hasta producir una
quemadura blanca.
En tumores pequeños y planos, el tratamiento se puede realizar directamente
sobre el tumor, siendo incluso suficiente con una sesión. En tumores mayores de
1 diámetro de papila, se necesitan más sesiones, incluso algunos autores
realizan primero un tratamiento sobre la arteria nutricia justo al lado del
tumor para disminuir el flujo y permitir un mejor tratamiento posterior del
tumor (50,51). En otra serie realizan un tratamiento de la retina adyacente al
tumor para intentar evitar un posible desprendimiento de retina ya que esa zona
es más susceptible de roturas debido a la posible tracción sobre el angioma
(37).
Las complicaciones descritas con el láser, no suelen producir disminución
de visión y normalmente se reducen a hemorragias peritumorales retinianas o
vítreas. Si el tumor se encuentra cerca del área macular se puede producir un
edema de la mácula que generalmente se resuelve en semanas. En ocasiones se
producen recidivas de los angiomas tratados que deben ser fotocoaguladas de
nuevo (37,50).
La atenuación de los vasos nutricios y la ausencia de tumor en angiografía
fluoresceínica son un indicador del éxito del tratamiento (33,37,50).
Crioterapia.
En los años 70 diferentes autores recomendaban el
tratamiento con crioterapia de angiomas mayores de 1 diámetro de papila, ya que
pensaban que el láser no era efectivo en esos angiomas (46,49,52).
Posteriormente se han publicado varias series utilizando el láser en angiomas
de hasta 4 mm e incluso algunos de ellos con discreta exudación retiniana, con
buenos resultados (37,50,51).
En general se acepta que la crioterapia es útil para tumores mayores de 3 mm
periféricos, personas no colaboradoras como niños pequeños o cuando los
medios son opacos (33).
Se utiliza una técnica de congelación-descongelación triple, intentando no
dar más de 10 ó 12 aplicaciones por sesión y separando las sesiones entre 6 y
8 semanas. Se ha observado como complicación un aumento de la exudación sobre
todo en grandes tumores o en aquellos que la tenían previa al tratamiento. En
casos de tratamientos agresivos puede llegar incluso a producirse proliferación
vítreo retiniana (49).
Radioterapia.
Se usa generalmente en tumores grandes. Kreusel ha
publicado una serie de 25 ojos con angiomas grandes periféricos de 2 diámetros
de papila de tamaño medio tratados mediante braquiterapia con Rutenio-106, con
buenos resultados en angiomas menores de 5 mm y cuando no existía un
desprendimiento de retina exudativo importante previo (36). También se ha
utilizado el tratamiento con bomba de protones en estos casos y en casos de
angioma papilar (53).
Cirugía escleral y vítreo retiniana.
Estas técnicas se utilizan en los
casos de angiomas complicados. Si el angioma está produciendo un
desprendimiento exudativo suficientemente grande como para no permitir otro
tratamiento convencional, deberemos realizar el drenaje del líquido
subretiniano transescleral, con colocación de un cerclaje y tratamiento del
angioma mediante cualquier técnica de las descritas anteriormente (37,49).
En los casos en que se desarrolle una membrana epirretiniana macular previa
al tratamiento del angioma, la mayoría de los autores abogan por tratar el
tumor con láser o crioterapia y esperar un tiempo, ya que en ocasiones se
produce un pelado espontáneo de la membrana después del tratamiento, aunque no
está claro el tiempo que se debe esperar. Si después de unos meses no se ha
producido el pelado espontáneo, la realización de una vitrectomía con
extirpación de la membrana suele dar buenos resultados (40,54-56).
En los casos más complicados donde existe un desprendimiento traccional o
mixto traccional regmatógeno, es necesaria la colocación de un cerclaje para
relajar tracciones periféricas, así como realizar vitrectomías más extensas
llevando a cabo la resección de las membrana fibrovasculares de forma
cuidadosa, con técnicas de cirugía bimanual y utilizando perfluorocarbonos
líquidos para manipular la retina en los casos en los que existan agujeros,
así como fotocoagulación de éstos, utilizando posteriormente tamponadores de
larga duración como C3F8 o aceite de silicona, éste último muy útil en
niños por su dificultad para mantener la postura en el postoperatorio. Además
se debe realizar tratamiento de la masa tumoral bien con láser endoocular,
crioterapia transescleral o endoocular. En las dos series más grandes de
vitrectomía en este tipo de patología consultadas, obtienen unos resultados
funcionales bastante aceptables. Las complicaciones más frecuentes fueron
hemovítreos generalmente limitados, recidivas de membranas epimaculares y
desprendimientos de retina tanto regmatógenos como traccionales que necesitaron
ser reintervenidos (40,54).
El angioma capilar papilar es de manejo mucho más difícil que el
periférico por su localización y generalmente tanto su evolución natural como
su tratamiento van seguidas de una disminución de agudeza visual sin existir en
este momento un tratamiento ideal (35,38).
Shields (57) propone, basado en su experiencia, el siguiente algoritmo de
tratamiento:
1. Lesiones asintomáticas. Seguimiento cada 4 ó 6 meses hasta que se vea
progresión que amenace la visión del paciente.
2. Si existe exudación o líquido subretiniano que amenace la visión
central, tratar con láser argón verde o teñido y repetir cada 2 ó 3 meses si
vemos que va disminuyendo la exudación hasta su resolución, aunque el tumor no
haya sido destruido totalmente. A veces puede producirse un aumento temporal de
exudación después del láser.
3. Si existe la progresión a pesar del tratamiento, y se produce fibrosis y
tracción vítrea, se realizará vitrectomía y tratamiento con endoláser.
4. En casos más extremos o si no se consiguen resultados con las técnicas
anteriores, podría ser usada la radiación externa.
García Arumí propugna la utilización de láser argón verde sobre la
superficie del tumor localizado en la papila y de diodo sobre la porción de
tumor retiniano, previniendo en parte la lesión del estrato de fibras nerviosas
sobre todo en las lesiones en el haz papilo macular. También ha utilizado
termoterapia transpupilar aunque su experiencia no ha sido efectiva teniendo que
tratar posteriormente con láser (35).
Otros tratamientos como diatermia (46), fotocoagulación con arco de xenon
(46), resección tumoral externa (58), no son de elección hoy día.
Pronóstico
Los factores pronósticos más importantes son la edad al diagnóstico, el
tamaño, la localización y la presencia de síntomas en el momento del
diagnóstico.
En varias series se ha visto que a menor edad en el momento del diagnóstico
era mayor la posibilidad de pérdida de agudeza visual (37,38).
A menor tamaño del angioma las posibilidades de complicaciones eran menores
siendo además el tratamiento mucho más efectivo (37,38).
Los angiomas de localización papilar tienen un pronóstico mucho peor por
encontrarse sobre el nervio y a veces sobre el haz papilomacular, por lo que
tanto su evolución natural como su tratamiento, nos van a provocar pérdida de
agudeza visual (35,38).
También se ha visto que cuando el diagnóstico se efectuaba por los
síntomas, el pronóstico visual era mucho peor, ya que la presencia de
síntomas implica la presencia de complicaciones, que aunque sean tratadas con
éxito casi siempre van a llevarnos a una disminución o pérdida de agudeza
visual (35,37,38).
Es muy importante la detección precoz de individuos con síndrome VHL y su
familia, al ser una condición autosómica dominante, no sólo porque el
pronóstico visual es muy bueno cuando son detectados en fase asintomática,
sino también por las posibles repercusiones para la vida del individuo (31).
Los pacientes con múltiples angiomas tienen predisposición a la aparición
de nuevos angiomas. Debido a ésto, es conveniente vigilar periódicamente a
estos pacientes después del tratamiento. Como regla general, Schmidt (37)
propone una revisión dos veces al año en pacientes hasta los 30 años ya que
se ha visto que el riesgo de pérdida visual es mayor antes de los 30 años
(38), y a partir de esa edad una vez al año, o cada dos a tres años, ya que la
posibilidad de nuevos angiomas es más rara (31,37,38,46).
BIBLIOGRAFÍA
- Coats G. Forms of retinal disease with massive exudation. R Lond
Ophthalmic Hosp Rep 1908; 17: 440-525.
- Haller JA. Coats' disease. In: Ryan SJ. Retina. St. Louis: Mosby; 1994;
II: 1.453-1.460.
- Morgan WE III. Crawford JB.Retinitis pigmentosa and Coats disease.Arch
Ophthalmol 1960; 79: 146-149.
- Burch JV, LeVeille AS, Morse PH. Ichthyosis Histrix (epidermal nevus
syndrome) and Coats disease. Am J Ophthalmol 1980; 89: 25-30.
- Folk JC, Genovese FN, Biglan AW. Coats' disease in a patient with Cornelia
de Lange syndrome. Am J Ophthalmol 1981; 91: 607-610.
- Schuman JS, Lieberman KV, Friedman, et al. Senior Loken syndrome (familial
renal-retinal dystrophy) and Coats' disease. Am J Ophthalmol 1985; 100: 822-827.
- Newell SW, Hall BD, Anderson CW, et al. Hallermann-Streiff syndrome with
Coats disease. J Pediatr Ophthalmol Strabismus 1994; 31: 123-125.
- Gass JD, Harbin TS Jr, Del Piero EJ. Exudative stellate neuroretinopathy
and Coats´syndrome in patients with progressive hemifacial atrophy. Eur J
Ophthalmol 1991; 1: 2-10.
- Black GCM, Perveen R, Bonshek R, Cahill M, Clayton-Smith J, Lloyd IC,
McLeod D. Coats’ disease of the retina (unilateral retinal telangiectasis)
caused by somatic mutation in the NDP gene: a role for norrin in retinal
angiogenesis. Hum Mol Genet 1999; 8: 2.031-2.035.
- Richter M, Gottanka J, May CA, Welge-Lusseu L,Berger W, Lutjeu-Drecoll E.
Retinal vasculature changes in Norrie disease mice. Invest Ophthalmol Vis Sci
1998; 39: 2.450-2.457.
- Gómez-Morales A. Coats’ disease. Natural history and results of
treatment. Am J Ophthalmol 1965; 60: 855-865.
- Egerer I, Tasman W, Tomer TL. Coats’ disease. Arch Ophthalmol 1974; 92:
109-112.
- Ridley ME, Shields JA, Brown GC, Tasman W. Coats’ disease. Evaluation
of management. Ophthalmology 1982; 89: 1.381-1.387.
- Kirath H, Eldem B. Management of moderate to advanced Coats’ disease.
Ophthalmologica 1998; 212: 19-22.
- Tarkkanen A, Laatikainen L. Coats’ disease. Clinical, angiographic,
histopathological findings and clinical management. Br J Ophthalmol 1983; 67:
766-776.
- Silodor SW, Augsburger JJ, Shields JA, Tasman W. Natural history and
management of advanced Coats’ disease. Ophthalmic Surg 1988; 19: 89-93.
- Char DH. Coats’ syndrome: long term follow up. Br J Ophthalmol 2000;
84: 37-39.
- Haik BG, Saint Louis L, Smith ME, Abramson DH, Ellsworth RM. Computed
tomography of the nonrhegmatogenous retinal detachment in the pediatric patient.
Ophthalmology 1985; 92: 1.133-1.142.
- Haik BG, Saint Louis L, Smith ME, et al. Magnetic resonance imaging in
the evaluation of leukocoria. Ophthalmology 1985; 92: 1.143-1.152.
- Corcostegui B. Telangiectasias retinianas. In: Gomez Ulla F Angiografia
fluoresceinica y laser. Santiago de Compostela: Servicio de publicaciones e
intercambio cientifico; 1988; 133-160.
- Wolfensberger TJ, Holz FG, Gregor ZJ. Juvenile Coats’ disease
associated with epiretinal menbrane formation. Retina 1995; 15: 261-263.
- Lafaut BA, Priem H, De Laey JJ. Premacular fibrosis in juvenile Coats’
disease with spontaneous peeling after photocoagulation of the congenital
vascular anomalies. Bull Soc belge Ophthalmol 1996; 261: 79-84.
- Lieb WE, Shields JA, Steven MC, et.al. Color doppler imaging in the
management of intraocular tumors. Ophthalmology 1990; 97: 1.660-1.664.
- O’Brien JM, Char DH, Tucker N, et al. Efficacy of unanesthetized spiral
computedtomography scanning in initial evaluation of chilhood leukocoria.
Ophthalmology 1995; 102: 1.345-1.350.
- Tripathi R, Ashton N. Electron microscopical study of Coats’ disease.
Br J Ophthalmol 1971; 55: 289-301.
- Budning AS, Heon E, Gallie BL. Visual prognosis of Coats’ disease. J
AAPOS 1998; 2: 356-359.
- Sneed SR, Blodi CF, Pulido JS. Treatment of Coats’ disease with the
binocular indirect argon laser photocoagulator. Arch Ophthalmol 1989; 107:
789-790.
- Appiah AP, Hirose T. Secondary causes of premacular fibrosis.
Ophthalmology 1989; 96: 389-392.
- Machemer R, Williams JM. Pathogenesis and therapy of traction detachment
in various retinal vascular diseases. Am J Ophthalmol 1988; 105: 170-181.
- Webster AR, Maher ER, Bird AC, Gregor ZJ ,Moore AT. A clinical and
molecular genetic analysis of solitary ocular angioma. Ophthalmology 1999; 106:
623-629.
- Maher ER, Yates JR, Harries R,et al. Clinical features and natural
history of Von Hippel-Lindau disease. QJ Med 1990; 77: 1.151-1.163.
- Latif F, Tory K, Gnarra J, et al. Identification of the Von Hippel-Lindau
disease tumor suppressor gene. Science 1993; 260: 1.317-1.320.
- Maher ER, Webster AR, Moore AT. Clinical features and molecular genetics
of Von Hippel-Lindau disease. Ophthalmic Genet 1995; 16: 79-84.
- Niemela M, Lemeta S, Sainio S, et al. Hemangioblastomas of the retina:
Impact of Von Hippel-Lindau disease. Invest Ophthalmol Vis Sci 2000; 41:
1.909-1.915.
- García-Arumí J, Sarasols LH, Cavero L, Escalada F, Corcostegui BF.
Therapeutic options for capillary papillary hemangiomas. Ophthalmology 2000;
107: 48-54.
- Kreusel KM, Bornfeld N, Lommatzsch A, Wessing A, Foerster MH.
Ruthenium-106 brachytherapy for peripheral retinal capillary hemangioma.
Ophthalmology 1998; 105: 1.386-1.392.
- Schmidt D, Natt E, Neumann HP. Long term results of laser treatment for
retinal angiomatosis in Von Hippel-Lindau disease. Eur J Med Res 2000; 5: 47-58.
- Webster AR, Maher ER, Moore AT. Clinical characteristics of ocular
angiomatosis in Von Hippel-Lindau disease and correlation with germline
mutation. Arch Ophthalmol 1999; 117: 371-378.
- Rosa RH, Goldberg MF, Green WR. Clinicopathologic correlation of argon
laser photocoagulation of retinal angiomas in a patient with Von Hippel-Lindau
disease followed for more than 20 years. Retina 1996; 16: 145-156.
- García-Arumí J, Sarasols L. Hemangiomas capilares retinianos. In:
Capeans Tome C. Actualización en tumores intraoculares. Madrid: Tecnimedia;
1999; 221-232.
- Wizigmann-Voos S, Breier G, Risau W, Plate KH. Up-regulation of vascular
endotelial growth factor and its receptor in Von Hippel-Lindau
disease-associated and sporadic hemangioblastomas. Cancer Res 1995; 55:
1.358-1.364.
- Gass JDM. Developmental tumors of the retinal pigment epithelium and
retina.In: Gass JDM. Stereoscopic atlas of macular diseases, diagnosis and
treatment. St Louis: Mosby; 1997; II: 809-866.
- Gass JD, Braunstein R. Sessile and exophytic capillary angiomas of the
juxtapapillary retina and optic nerve head. Arch Ophthalmol 1980; 1.790-1.797.
- Grossniklaus HE, Thomas JW, Vigneswaran N, Jarrett WH. Retinal
hemangioblastoma. A histologic, immunohistochemical, and ultrastructural
evaluation. Ophthalmology 1992; 99: 140-145.
- Nicholson DH, Green WR, Kenyon KR. Light and electron microscopic study
of early lesions in angiomatosis retinae. Am J Ophthalmol 1976; 82: 193-204.
- Goldberg MF, Koenig S. Argon laser treatment of Von Hippel-Lindau retinal
angiomas I. Clinical and angiographic findings. Arch Ophthalmol 1974; 92:
121-125.
- Shields CL, Shields JA, Barrett J, De Potter P. Vasoproliferative tumors
of the ocular fundus. Classification and clinical manifestations in 103
patients. Arch Ophthalmol 1995; 113: 615-623.
- Corcóstegui B, Buill JA, Gómez Ulla F. Tumores de la retina y coroides.
In: Gómez Ulla F. Angiografía Fluoresceínica y láser. Santiago de
Compostela: Servicio de publicaciones e intercambio científico; 1988; 305-338.
- Ridley M, Green J, Johnson G. Retinal angiomatosis: the ocular
manifestations of von Hippel-Lindau disease. Can J Ophthalmol 1986; 21: 276-283.
- Lane CL, Turner J, Gregor ZJ, Bird AC. Laser treatment of retinal
angiomatosis. Eye 1989; 3: 33-38.
- Blodi CF, Russell SR, Pulido JS, Folk JC. Direct and feeder vessel
photocoagulation of retinal angiomas with dye yellow laser. Ophthalmology 1990.
97: 791-797.
- Amoils SP, Smith TR. Cryotherapy of angiomatosis retinae. Arch Ophthalmol
1969; 81: 689-691.
- Palmer JD, Gragoudas ES. Advances in treatment of retinal angiomas. Int
Ophthalmol Clin 1997; 37: 159-170.
- McDonald HR, Schatz H, Johnson RN, et al. Vitrectomy in eyes with
peripheral retinal angioma associated with traction macular detachment.
Ophthalmology 1996; 103: 329-335.
- Sumers KD, Jampol LM, Goldberg MF, Huamonte FU. Spontaneous separation of
epiretinal menbranes. Arch Ophthalmol 1980; 98: 318-320.
- Laatikainen L, Immonen I, Summanen P. Peripheral retinal angiomalike
lesion and macular pucker. Am J Ophthalmol 1989; 108: 563-566.
- Shields JA. Discussion. Ophthalmology 2000; 107: 54. Comment on:
Ophthalmology 2000; 107: 48-54.
- Peyman GA, Rednam KR, Mottow-Lippa L, Flood T. Treatment of large von
Hippel tumors by eye wall resection. Ophthalmology 1983; 90: 840-847.
|