|
INTRODUCCIÓN
Hasta hace poco el tratamiento del retinoblastoma, especialmente en los casos
avanzados (estadio V de Reese), se basaba en la enucleación y radioterapia
externa, reservándose la quimioterapia para la invasión local del nervio
óptico, coroides u órbita y para la extensión extraocular (1-5). El enfoque
terapéutico más actual se basa en la quimioterapia como tratamiento inicial
para reducir el tamaño del tumor y lograr su control final (consolidación)
con métodos locales conservadores: fotocoagulación, crioterapia, termoterapia
y braquiterapia (6-11): Quimiorreducción. Se intenta así
conservar el globo ocular y evitar los efectos secundarios de la radioterapia
externa: catarata, ojo seco, retinopatía radiactiva, alteraciones en el
desarrollo óseo orbitario (12) y riesgo de neoplasias secundarias (13),
especialmente en niños menores de 12 meses (14) con alteraciones germinales en
el gen del retinoblastoma.
En menos de 5 años la enucleación y radioterapia externa han pasado, de ser
consideradas técnicas de elección en retinoblastomas avanzados, a ser
minusvaloradas. Esto complica su uso y contribuye a confundir a las familias
afectas de retinoblastoma; debe resaltarse su utilidad y plena actualidad,
aunque sus indicaciones estén más restringidas.
En 1969 Ellsworth presentó una supervivencia ocular del 29% en casos grado V
tratados con radioterapia externa, un hito en su época (15). En 1995,
Hungerford (16) presenta en casos grado V una supervivencia ocular del 45%
usando sólo radioterapia y del 66% asociando terapias focales.
En la Reunión de la AAO de 1995, Greenwald y Strauss (Memorial Hospital,
Chicago) comunican buenos resultados en el tratamiento inicial del
retinoblastoma con carboplatino y etopósido (9); en enero de 1996 comenzamos a
utilizar esta pauta en el Servicio de Oftalmología Infantil del Hospital La
Paz.

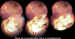
Figura 1. Retinoblastomas masivos. Diversos tipos de manifestaciones que
producen síndromes de enmascaramiento.
En noviembre de 1996 varios autores (6-8,10) establecen los patrones
iniciales de un estudio multicéntrico en el abordaje del retinoblastoma con
quimiorreducción, comunicándose un 70% de éxito en la conservación del globo
ocular en retinoblastomas grado V mediante la asociación de quimiorreducción y
radioterapia externa (10). Otros centros se han incorporado después,
utilizándose diversos fármacos. Todos los que nos dedicamos a la Oncología
Infantil esperamos la finalización de este estudio.
Por otra parte tenemos que la clasificación de Reese-Ellsworth, ideada para
valorar el pronóstico de estos tumores tras aplicar radioterapia externa, es
poco práctica a la hora de valorar la respuesta a la quimiorreducción. Por
ejemplo un tumor de 3 mm cercano a ora serrata (grado IV B) se trata de modo
sencillo y efectivo con crioterapia o bien focos con una pequeña siembra
vítrea (estadio V B) responden muy bien a la quimiorreducción y braquiterapia.
Sigue siendo sin embargo útil para normalizar los resultados entre los
distintos grupos.
Podemos hacer así una Clasificación Práctica del Retinoblastoma:
Pequeños :
– Menores de 4,5 mm o 3 diámetros papilares.
Medianos:
– Entre 4,5-12 mm o 3-8 diámetros papilares.
Grandes:
– Entre 12-18 mm o 8-12 diámetros papilares.
Avanzados:
– Mayores de 18 mm o 12 diámetros papilares.
Actualmente consideramos susceptibles de quimioterapia a los retinoblastomas
de hasta 15 mm de altura, pudiendo estar en 18 mm el límite de su base. La
siembra vítrea y la localización macular ensombrecen el pronóstico, siendo la
enucleación una alternativa válida en estos casos. En retinoblastomas
bilaterales con gran afectación somos más permisivos y empleamos la
quimioterapia como primera opción para intentar reducirlos al máximo,
complementando el tratamiento con terapias focales y/o radioterapia externa.
Otra posibilidad es la radioterapia externa como primera posibilidad para
niños mayores de 1 año.
PROTOCOLOS DE QUIMIOTERAPIA
Desde que Greenwald presentara en 1995 sus primeros casos tratados con
carboplatino y etopósido, han aparecido otros autores que asocian distintos
agentes quimioterápicos y terapias de consolidación. Actualmente son
necesarias unidades multidisciplinarias para un adecuado control oftalmológico
y oncológico de estos niños, que sigue siendo complejo aunque su seguimiento
se realice en régimen ambulatorio.
Se encuentran diferentes pautas de quimioterapia:
1. Carboplatino + etopósido (VP16) (1,5,9).
2. Carboplatino + etopósido + vincristina (CEV) (7).
3. Ciclosporina A + carboplatino + etopósido (17).
4. Ciclosporina A + CEV (17).
5. Ciclosporina A + carboplatino (8,11).
6. Carboplatino + termoterapia (11,18).
7. Ciclosporina A + carboplatino + etopósido + termoterapia (6).
8. Ciclosporina A + CEV + termoterapia (10,17,19).
En el Hospital Infantil La Paz comenzamos con la pauta nº 1 y actualmente se
emplea la nº 3, asociando termoterapia en ciertos tumores. El tratamiento
comienza a las 8 de la mañana en la Unidad de Día Oncológica Infantil y a las
14 horas se le aplica la termoterapia (a partir del tercer ciclo) en quirófano.
En ocasiones el etopósido se administra por la tarde si hubo complicaciones.
Además de actuar por sí misma, la termoterapia facilita la fijación tumoral
de los fármacos quimioterápicos.
Las distintas series publicadas ofrecen respuestas muy altas a la
quimioterapia, con reducciones en el tamaño tumoral del 40% de media entre el
segundo y tercer ciclos, e incluso antes. No es la panacea, pero los nuevos
tumores que aparecen suelen ser menos agresivos y se tratan más fácilmente con
las terapias de consolidación.
Pese a las resistencias iniciales a emplear ciclosporina A por algunos
autores, su administración previa a la quimioterapia consigue un mayor número
de respuestas. Esta droga bloquea la expresión de la P-glicoproteína en las
células tumorales, que actúa como una bomba de flujo que impide la entrada de
los quimioterápicos en las células del retinoblastoma. A pesar de su uso
siguen apareciendo tumores, especialmente en el 4º-5º ciclo de quimioterapia.
La radioterapia externa es una alternativa válida para evitar su eclosión y no
dudamos en utilizarla si hay posibilidades de visión o la familia se niega a la
enucleación una vez que se han agotado otras medidas terapéuticas.
Singh y Shields (20) encuentran tumores con falta de respuesta a la
quimioterapia. La radioterapia externa actúa en estos tumores más lentamente,
pero el número de recidivas o nuevos tumores es menor que con quimioterapia.
La radioterapia tiene más efectos secundarios, aunque también se han
descrito celulitis y sepsis por inmunodepresión asociadas a la quimioterapia.
También hay aproximaciones locales al uso de la quimioterapia:
Quimioterapia periocular: Abramson ha presentado una comunicación
personal (21) sobre la inyección de carboplatino periocular (1.5-2 cc) a una
concentración de 10 mg/cc en una jeringa de 3 cc y aguja de 30G para casos de
retinoblastoma con siembra vítrea. Según su experiencia y la de Mendelson
(22), retinoblastomas que progresan pese a la quimioterapia sistémica pueden
responder a su administración periocular. Esta vía puede producir gran edema
local y pseudocelulitis.
Quimioterapia con Melfalán en la Arteria Oftálmica: Akimiko Kaneco (23)
ha desarrollado en Tokio la técnica de inyección selectiva de este fármaco en
la arteria oftálmica en 4 casos de retinoblastoma. El neuroradiólogo coloca un
balón-catéter intrafemoral en la carótida que se insufla una vez pasada la
arteria oftálmica, permitiendo inyectar el melfalán a razón de 5-10 mg/m2.

Inyección de carboplatino periocular en el tratamiento del retinoblastoma.
TERAPIAS DE CONSOLIDACIÓN
La quimioterapia por sí sola no consigue erradicar el tumor, debiéndose
aplicar distintos métodos locales conservadores para lograr su control final.
Estas técnicas se aplican durante o tras la quimioterapia. Se intentan así
evitar los efectos secundarios de la radioterapia externa, dejando la
enucleación como última posibilidad terapéutica.
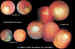
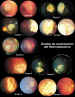
Clasificación de Reese. Grado 1A: Tumores solitarios menores de 4
diámetros papilares. Grado 1B: Tumores múltiples, menores de 4 diámetros
papilares en/o posterior al ecuador. La discordancia en la clasificación de
Reese se puede apreciar en el montaje fotográfico. Tienen la misma
clasificación dos tumores minúsculos que cuatro tumores de mayor tamaño o
múltiples tumores dispersos en toda la retina.
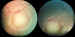
Clasificación de Reese. Grado 2A:
Tumores solitarios de 4 a 10
diámetros papilares.

Clasificación de Reese. Grado 2B: Tumores múltiples, entre 4 y 10
diámetros papilares en/o posterior al ecuador.

Clasificación de Reese. Grado 3A:
Cualquier tumor anterior al ecuador.

Clasificación de Reese. Grado 3B: Tumor único mayor de 10 diámetros
papilares, posterior al ecuador.

Clasificación de Reese. Grado 4A:
Tumores múltiples, alguno mayor de 10
diámetros papilares posteriores al ecuador.

Clasificación de Reese. Grado 4B: Tumores unidos a la ora serrata.

Clasificación de Reese. Grado 5A: Tumor masivo de más de la mitad de la
retina.
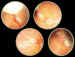
Clasificación de Reese. Grado 5B-1: Quistes en siembra vítrea.
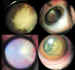
Clasificación de Reese. Grado 5B-2: Siembra
vítrea masiva.

Crioterapia en un retinoblastoma periférico con congelación de la masa
tumoral.
Pese al riesgo de segundos tumores en niños con mutaciones germinales en el
gen del retinoblastoma (13,14), la radioterapia externa aún tiene un papel
importante en el control del retinoblastoma por varios factores:
– Los retinoblastomas no se curan sólo con quimioterapia (6-10,16).
– Pueden aparecer nuevos tumores mientras los iniciales responden al
tratamiento.
– Distintos tumores en el mismo ojo tienen diferentes respuestas en un
mismo tiempo.
– Alta recurrencia de los focos vítreos y siembras subretinianas.
– Las técnicas focales no solucionan todos los casos (10,11).
Crioterapia
Técnica de elección para tumores pequeños periféricos. Se aplica bajo
control con oftalmoscopio indirecto y a ser posible con un criodo de
descongelación automática (24,25), realizando la triple congelación del tumor
con intervalos de 1 minuto.
Las mejores respuestas se dan con tumores menores de 1,5 mm; entre 1,5-3 mm
el resultado también es muy bueno. Los tumores de 3-6 mm pueden recurrir.
Es el tratamiento de consolidación más utilizado en nuestra serie,
consiguiendo generalmente un patrón de regresión tipo 4. Un método
alternativo es la termoterapia con láser de diodo transescleral.
Termoterapia con láser diodo
Es una de las terapias más modernas de que disponemos (6,26-30); utiliza una
radiación infrarroja de 810 nm que produce calor estable dentro del tumor.
Necesita un mínimo de 20 segundos para el efecto termoterápico; si actúa
antes produce fotocoagulación. Se pueden dividir sus efectos según la
temperatura:
• 42-46º. Sensibiliza las células tumorales a la quimioterapia y
radioterapia.
Inhibe los mecanismos de reparación del DNA tumoral.
La isquemia condensa el calor dentro del retinoblastoma.
• 46-60º. Efecto citotóxico.
No hay coagulación directa.
Altera las membranas celulares.
Desnaturaliza las proteínas y lesiona los cromosomas.
Provoca toxicidad mitocondrial y disrupción del proceso bioquímico.
La termoterapia (TT) deja la cápsula tumoral intacta y produce una
reducción progresiva del retinoblastoma, con una mínima cicatrización.
Precisa anestesia general (en niños) y mucha dilatación pupilar. El láser
diodo puede adaptarse al microscopio quirúrgico, oftalmoscopio indirecto o
lámpara de hendidura y también puede usarse transescleralmente. Las lentes de
Goldman, O´Malley, Mainster, Rodenstock y Nikon de 20 dioptrías son las más
usadas.
El láser diodo penetra 3,9 mm en la tumoración (26,27); puede utilizarse
como técnica aislada, asociado a cada ciclo de quimioterapia o a braquiterapia
si el tumor es mayor de 6 mm de altura; esto facilita la actuación sobre la
base y la zona apical de la tumoración y permite disminuir la dosis radiactiva.
Aunque está descrito (11) el uso de la TT de forma aislada en retinoblastomas
con 12 mm de base y 6 mm de altura, es preferible asociar quimioterapia para una
mejor resolución.
La TT actúa sinérgicamente con la quimioterapia al facilitar la entrada de
dichos fármacos en el retinoblastoma, esto permite tratar tumores con una base
de 12 mm y una altura de 6 mm. Uno de los últimos modelos terapéuticos
(6,17,31) consiste en administrar inicialmente ciclosporina A, seguida de la
quimioterapia y a las 2 horas y bajo anestesia general se aplica la TT: Quimiotermoterapia.
Estos tiempos de actuación pueden variar, siendo aconsejable desde el inicio
del tratamiento la colocación de un port-a cath que facilite la realización de
procedimientos posteriores. El esquema suele repetirse a intervalos de 21 días,
variando el número de ciclos según el grado de respuesta del retinoblastoma.
En ocasiones se produce una necrosis aguda intratumoral que genera celulitis
palpebral y signos de afectación masiva intraocular. Aunque el estudio
anatomopatológico no revela afectación extraocular ni metastásica, no existe
en la literatura nadie que prosiga con el tratamiento.
El tamaño de spot (0,3, 0,8, 1,2, 1,5, 1,7, 2 y 3 mm) varía según el
sistema de adaptación. La potencia y tiempo de exposición son variables y
cuesta trabajo tabular los parámetros de edema o blanqueamiento en una
tumoración ya nacarada. El blanqueamiento refleja el efecto termoterápico e
impide que el calor penetre en el tumor, por lo que debemos parar la
intervención para no producir sobredosificación.
La TT se aplica en toda la masa tumoral y hasta 1 mm de su borde libre.
Inicialmente no se usaba en papila y haz papilomacular, pero posteriormente se
ha utilizado con muy buenos resultados. Cuando se usa entre arcadas es
preferible aumentar el número de sesiones recomendadas para producir una mejor
reducción tumoral. Si se producen hemorragias o necrosis pueden aparecer
tracciones y fibrosis retiniana, trombosis, agujeros retinianos y
desprendimiento de retina. Al igual que la crioterapia, no es aconsejable su
empleo sobre masas calcificadas por el riesgo de producir roturas o
microagujeros retinianos con las espículas calcáreas del tumor.
Fotocoagulación láser
La técnica consiste en realizar una doble barrera alrededor del
retinoblastoma para interrumpir su aporte sanguíneo y conseguir su necrosis; no
se utiliza directamente sobre la tumoración para evitar la rotura de la
membrana limitante interna y posible diseminación a vítreo y retina adyacentes
(32). El láser azul-verde consigue una cicatrización rápida y aunque pueden
ser necesarias varias sesiones, los resultados son buenos (33).
Radioterapia en placas
El empleo de la braquiterapia en nuestro país ha sido escaso desde que
Stallard comenzara en 1962 a usar sus placas de cobalto en retinoblastomas,
debido sobre todo a que los tumores referidos a los hospitales eran muy
avanzados y requerían enucleación o radioterapia externa. Queremos expresar
nuestro reconocimiento al Dr. García Alix, pionero en la introducción de las
placas de Stallard en la Clínica Puerta de Hierro, así como al Dr. Encinas,
que recogió su legado. Con la llegada de la quimiorreducción han aumentado las
indicaciones para la colocación de placas y hemos compartido pacientes y
aprendizaje con los Drs. Shields, De Potter, Munier y García Arumí. Nuestro
agradecimiento a todos por su colaboración.

Aplicación de termoterapia sobre un tumor de polo posterior. El
blanqueamiento indica el final de la terapéutica.
Entre sus ventajas destaca la menor radiación de la órbita, que reduce el
riesgo de segundos tumores e hipoplasia orbitaria. En general se usa en tumores
localizados y de crecimiento lento; además puede aplicarse en tumores pequeños
con siembra vítrea y en los que recurren tras radioterapia externa (34)
evitando así la enucleación.

Colección de placas de rutenio que se usan en Oftalmología, suministradas
por Bebig.

Colección de placas de rutenio que se usan en pediatría.
Entre sus complicaciones destacan la retinopatía radiactiva, especialmente
con quimioterapia previa (8) y la formación de cataratas (11). Los exudados
blandos de la retinopatía pueden confundirse con nuevos tumores; las
hemorragias son menos frecuentes, pero si aparecen en áreas calcificadas pueden
hacer volumen parcial con el tumor y artefactan la ecografía.
Actualmente se emplean varios materiales radiactivos en el tratamiento del
retinoblastoma.
Rutenio 106. Emisión de partículas, con una energía de 3,6 MeV. Su
vida media es de 369 días, con una actividad de 0.5 mCi; penetra hasta 1,8 cm
en el ojo. Usado en el tratamiento del retinoblastoma en Europa, Australia,
Extremo Oriente y menos en USA. Sus indicaciones se rían retinoblastomas de
hasta 15 mm de base y 12 mm de altura, aconsejándose termoterapia en el
vértice del tumor para reducir la dosis; como planteamiento individual la
altura ideal sería hasta 8-10 mm.

Transiluminación y diagramas retinianos para colocación de placas de
rutenio.
El material radiactivo (0,2 mm de grosor) se encapsula en láminas de plata
hasta un grosor total de 1 mm que se colocan en la concavidad de la placa. Hay
15 tipos de placas de diferentes formas y tamaños, aunque en retinoblastomas
sólo se usan 7-8 Melvin A. Astrahan ha desarrollado un programa informático
que facilita el cálculo dosimétrico y colocación, estableciéndose una mayor
interacción entre los integrantes del grupo de tratamiento del retinoblastoma.

Colocación de placas de rutenio con escotadura para nervio óptico y
diagrama tridimensional para simulación.
Yodo 125. Emisión gamma (fotones), con una energía de 35,5 KeV. Su vida
media es de 60 días, con una actividad de 4,5 mCi y un HVL de 2 cm. Es el
aplicador más usado. Empleado en el tratamiento del retinoblastoma en USA y
alternando con el Ru 106 en Inglaterra y Francia (son complementarios). Sus
indicaciones serían tumores de hasta 16x16x13 mm, gracias a su mayor poder de
penetración, aunque su dosificación es más complicada y se describen más
efectos secundarios.

Diversas placas de yodo utilizadas en Estados Unidos.
El I 125 se suministra en semillas radiactivas que se absorben en plata y se
recubren con titanio; en total la semilla mide 4,5x0,8 mm. El número y
distribución de las semillas dentro de la placa depende del tamaño tumoral. El
diámetro de las placas varía entre 10-22 mm, siendo las menores las más
usadas en los retinoblastomas. J.E. Freire, L.W. Brady y cols (35) elaboran
desde hace años las placas para J.A. Shields, con magníficos resultados. Los
programas informáticos actuales simplifican las dosimetrías. Recientemente las
casas ROPES y BEBIG han desarrollado unos aplicadores oftálmicos de acero y
reutilizables, en los que se insertan placas acrílicas con muescas para la
introducción de las semillas de I 125. Las semillas tienen varias
distribuciones dependiendo de tipos tumorales prefijados por su frecuencia. La
fijación de las placas a esclera se realiza con anillos parecidos a los de las
lentes de vitrectomía.
Paladio 103. Usado en retinoblastomas desde hace poco en USA; los datos
son aún escasos. Se incorpora en semillas y aplicadores de protección.
Introducido dentro del desarrollo de la ecografía tridimensional, en las
conferencias de Finger (36) se visualizan perfectamente las semillas
radiactivas, su relación con el tumor y la correcta colocación de la placa.
Cobalto 60. Actualmente su uso se limita a Rusia y antiguos países
satélites, consiguiendo buenos resultados. El problema es la alta dosis de
radiación para paciente y cirujano y el tamaño de las placas. Zoografos en
Lausanne tiene amplia experiencia con Munier y Balmer. Han intentado desarrollar
algún nuevo prototipo de cobalto, pero finalmente optaron por utilizar las
placas de rutenio (37).
Las placas se colocan con anestesia general. La fijación de la placa durante
2-4 días depende de las necesidades de dosimetría, carga y vida media de las
unidades que reutilicemos y terapias complementarias. Localizamos y marcamos el
tumor bajo oftalmoscopia indirecta; en el futuro serán rutinarios el soporte
informático adaptado al TAC helicoidal o angiógrafo digital y la ecografía
tridimensional. La elección del tipo de placas tiene connotaciones económicas,
necesitando un volumen de pacientes que haga rentable la inversión. Hay que
valorar la vida media de los isótopos, penetración, grosor de las placas y
distribución de las dosis.
El Eye Tumor Group recomendaba dosis de 45-50 Gy en el ápex tumoral, con una
distribución de 50-150 cGy/hora. Actualmente se tiende a usar dosis de 35-40 Gy
en el ápex, sobre todo tras quimioterapia debido a que potencia la retinopatía
radiactiva (7).
Actualmente el campo de la braquiterapia aparece limitado por un lado por la
Quimiotermoterapia, que reduce su actuación en retinoblastomas de menor
tamaño, y por otro lado por las modernas técnicas de radioterapia, en
retinoblastomas mayores. La investigación en marcadores cerámicos que den
menos artefactos permitirá, con menor dosificación, explorar el campo del
acelerador lineal de protones.
RADIOTERAPIA EXTERNA
En los últimos años diversos autores, especialmente Abramson (13,14), han
resaltado los efectos secundarios de la radioterapia externa; actualmente ha
comenzado a presentar las complicaciones de la quimioterapia. Abramson ha
descrito en 1993 que la radioterapia externa en niños con mutaciones germinales
en el gen del retinoblastoma se asocia a un incremento del riesgo de muerte por
neoplasias secundarias del 35% a los 30 años (13) frente a un riesgo del 6% en
los no radiados (hay que tener en cuenta que todos los retinoblastomas
bilaterales son hereditarios). Actualmente en su artículo de 1998 no es tan
catastrofista, pero insiste en preservar de radioterapia a los niños menores de
12 meses (14); en estos casos creemos aconsejable emplear quimioterapia.
El 60% de los retinoblastomas no son hereditarios, con lo que el riesgo de
segundos tumores yatrogénicos es menor y puede aplicarse radioterapia externa
como técnica de consolidación tras su quimiorreducción o bien de modo
aislado.
Así pues es fundamental contar con una unidad de tratamiento integrado del
retinoblastoma, con genetistas que nos ayuden a discriminar los pacientes y
disminuir el número de revisiones en familiares no afectos (38). En cuanto a la
radioterapia externa es vital la sensatez, actualización y optimización de
recursos, de ahí nuestro agradecimiento al Dr. de la Torre y Dr. Aragón del
Servicio de Oncología Radioterápica de la Clínica Puerta de Hierro, al Dr.
Arcas de su Servicio de Anestesiología, al Dr. Otero y a todos los que han
compartido con nuestros pacientes las largas sesiones de tratamiento.
En el manejo del retinoblastoma es fundamental el fraccionamiento de dosis,
orientando la radiación sobre el tumor y evitando la afectación de estructuras
óseas y cerebrales adyacentes. Las distintas técnicas de protección del
cristalino (39,40) tienen poca aceptación actualmente. El Departamento de
Radioterapia de la Universidad de Allegheny (Filadelfia), que colabora con el
Wills Eye Hospital y tiene una casuística de más de 1.000 retinoblastomas
tratados, valora más la orientación en varios campos, menor dosificación en
cada incidencia y procurar que no haya sumaciones de radiación en la órbita,
línea media y cerebro.
Otras técnicas aún no muy desarrolladas para el manejo del retinoblastoma,
pero que pueden tener mayor importancia en el futuro son el acelerador de
protones, LINAC tridimensional y Gamma Knife (41-43).
PATRONES DE REGRESIÓN
Hay coincidencia en establecer una misma clasificación para evaluar la
respuesta a las distintas terapias de consolidación, aunque su origen era
evaluar la respuesta a la radioterapia.
Tipo 0: no hay evidencia oftalmoscópica de tumor y/o calcio, con
mínimos cambios o ausencia de estos en el epitelio pigmentario de la retina.
Poco frecuente; aparece tras radioterapia o quimioterapia y en tumores pequeños
(<3 mm). Se considera un resultado excelente.
Tipo 1: aspecto blanco reluciente (requesón), calcificado. Rodeando el
tumor puede haber zonas de hiperplasia o hipoplasia del epitelio pigmentario.
Suele conllevar una enorme reducción de la masa tumoral y un buen pronóstico.
Tipo 2: aspecto gris traslúcido, homogéneo (escama de pescado), con
pocos cambios en el EPR y poca disminución del tamaño tumoral. Hay que hacer
diagnóstico diferencial con tumor viable (opacidad y vasos emisarios) lo que
obliga a una conducta vigilante.
Tipo 3: combinación de 1 y 2. Parece tener una mayor tendencia a la
recurrencia.
Tipo 4: cicatriz coriorretiniana plana y despigmentada, con desaparición
total del tumor y excelente pronóstico. Frecuente tras crioterapia,
braquiterapia o termoterapia.
¿Cuándo consideramos curado al paciente clínicamente?
La finalización de la vigilancia en las exploraciones de los niños afectos
no está bien definida en la literatura. La aparición de retinoblastomas en la
edad adulta (44-46) y la experiencia personal en casos de R.B. con 7 y 8 años,
e incluso con 4 años de intervalo entre un ojo y el otro nos hace ser muy
cautos.
Los tipos 0,1 y 4 de regresión se consideran un resultado final excelente.
En los Grados 2 ó 3 con un pequeño componente en escama de pescado tenemos que
seguir expectantes.
Hay menos recurrencias y aparición de nuevos tumores con la radioterapia
externa que con la quimioterapia.
¿Qué sucede con la agudeza visual en estos niños?
No coinciden las diversas publicaciones en aclarar los grados de agudeza
visual que pierden al aplicarles técnicas focales.
Hay casos de regresión espontanea en retinoblastomas múltiples con
conservación de la AV. (47).
Tumores en la mácula conservan 0,33 de AV, después de aplicarle
radioterapia externa y los alejados de ella en ocasiones pese a ser grados 0 de
cicatrización son amauróticos, incluso en ojos únicos (48).
Otros casos con tumores radiados con braquiterapia en la
mácula, presentan
buenas agudezas visuales (49,50).
Están variando las indicaciones y los resultados.
La termoterapia afecta mucho menos si se aplica en mayor número de sesiones
cerca del área macular. Combinada con quimioterapia Lueder (19) consiguió con
oclusiones un resultado espectacular en un niño afecto de retinoblastoma. Al
ver la cicatriz en polo posterior nos sorprendemos de su visión (0,3).
¿Realizamos punciones lumbares y medulares en los retinoblastomas de forma
sistemática?
NO. Cuando hay sospecha de extensión extraocular tenemos que hacerlo. Cada
vez las indicaciones están más restringidas (31,38,48).
¿Hacemos biopsias y muestras para citología del tumor, del humor acuoso y
del vítreo?
NO. Sólo en casos extremos de enmasca ramiento y procurando que la puerta de
entrada sea superior y lo más alejada que podamos de la tumoración y de las
posibles siembras ví treas (48,49).
¿Qué sucede con las cataratas en el retinoblastoma (LIOS si, LIOS no)?
Sigue existiendo una gran controversia en la literatura. Hay autores que
operan con capsulorrexis amplias y vitrectomía anterior, con análisis de lo
aspirado por Citología y Anatomía Patológica. Si se considera estable la
tumoración y el niño tiene entre 3-4 años, se puede colocar una lente
intraocular (50,51).
En retinoblastomas tratados con radioterapia no hay tanto riesgo de recidivas
rápidas, pero existen pacientes en que la reactivación se produce a los 3
años. Si además se le asoció quimioterapia, tienen más posibilidades de
recurrencia. Las opacidades de las cápsulas en su periferia y las reacciones a
la lente intraocular en los implantes hace que sea complicada su exploración,
teniendo que realizar y repetir muchas pruebas complementarias de neuroimagen.
Si es ojo único consideramos muy arriesgado el ponerle una LIO, pese a no
tolerar lentes de contacto y la mala visión con gafas. Por suerte las recidivas
y reactivaciones son menos agresivas en los tratados con radioterapia (52) y en
su crecimiento podemos diferenciarlos y tener sospechas. Cada caso es
independiente y se comporta de una forma distinta. Debemos observar su
evolución frecuentemente. Requiere mucha dedicación y múltiples revisiones
siendo una difícil decisión muchas veces la colocación de una LIO en niños
con retinoblastoma y solo un ojo.
Si es unilateral no lo dudamos pese al sobreesfuerzo que nos supone su
control. Los implantes secundarios no son problemáticos, aunque somos
igualmente remisos en los ojos únicos y no consolidados.
Debido a la presencia en la literatura de extensiones extraoculares y mayor
riesgo de desprendimientos de retina en la manipulación de la pars
plana-plicata, preferimos la vía límbica con vitrectomía anterior en la
cirugía de las cataratas y el retinoblastoma (50). Si los pacientes colaboran
la capsulotomía posterior se puede realizar con láser YAG. Se evita la
manipulación vítrea y sus complicaciones.
María Portellos con Edward Buckley presenta en 1998 (51), 11 ojos de 8
pacientes con retinoblastoma tratados con LIO, recomendando esperar 16 meses
después de considerar el tumor inactivo y sin complicaciones por usar la pars
plana como vía de acceso. Solo 3 niños eran bilaterales, con edades de 1, 8, 6
y 8 años. No refieren ningún ojo único en sus operados con lo que la
decisión límite y realmente complicada que debían asumir en sus
retinoblastomas no se les presentó.
Cuando hay desprendimiento de retina ¿qué hacemos?
La regresión de un retinoblastoma por radiación es más lenta que por
quimiorreducción. Los procedimientos de consolidación (crioterapia, TT,
placas) repetidos y la propia quimioterapia aumentan las posibilidades de
agujeros retinianos y desprendimientos (54-56).
La cirugía de las cataratas radiactivas con vitrectomía pars plicata-plana,
tiene más riesgo que la translimbar por vía anterior y ésta mayor que la
extracapsular simple. Las manipulaciones en la base del vítreo y las tracciones
quirúrgicas en ojos tan frágiles deben ser cuidadosas (51-53,57).
En las áreas tratadas, la presencia de fibrosis, calcificación y
pigmentación hace más difícil visualizar las microroturas. Según Lim y
Robertson de14 casos publicados existentes en la literatura (53) sólo en 7 se
confirmó el agujero al operarse. En su casuística sólo pudieron apreciar
desgarros en 1 de 5 DR. El calcio enmascara el tejido retiniano e impide definir
las zonas problemáticas.

Crioterapia, cerclaje e implante sin punción de bolsa subretiniana en un
desprendimiento de retina de un retinoblastoma.
El aplicar TT o Crioterapia en una regresión de RB con calcio y espículas
calcáreas es casi premonitorio de roturas retinianas.
Hay que hacer diagnóstico diferencial con los desprendimientos exudativos
postradiación que se resuelven espontáneamente. Si recurren ya hay que
sospechar una reactivación. En ausencia de actividad o tracciones
vitreorretinianas siempre se confirma un DR regmatógeno.
También resaltar que en el proceso de la quimiorreducción la regresión
tumoral a veces es tan rápida que la retina está desprendida y no hay
desgarros. Si esperamos 1 ó 2 ciclos (42 días) se produce la reaplicación
espontánea ante nuestra sorpresa.
El procedimiento quirúrgico en el desprendimiento pasa por realizar
cerclajes e implantes que taponen las zonas problemáticas (59). La punción del
líquido subretiniano está en discusión permanente por el riesgo de actividad
y diseminación de células tumorales durante la cirugía. En los tratados con
quimioterapia, 1 mes puede ser tiempo suficiente en nuestra experiencia para que
afloren nuevos focos y siembras. Con radiación hay que esperar más. De
cualquier forma se pueden intentar procedimientos externos sin punción a los 30
días de diagnosticados, aunque no se visualicen los desgarros y reservar los
drenajes y las vitrectomías para más adelante dependiendo de las posibilidades
de visión y de si son ojos únicos o no (56-60).
El drenaje del fluido subretiniano debe ser analizado por Citología,
procurando que la aguja de 30 G conectada a una jeringa de insulina sin el
compresor, haga un túnel escleral y drene pasivamente fuera de la órbita para
no contaminar el campo quirúrgico por la posible siembra. El control con
oftalmoscopia indirecta y la manipulación cuidadosa con mínima movilización
son fundamentales durante el vaciamiento.
Si la citología es positiva conviene enuclear en 24-48 horas y vigilar
exhaustivamente al niño en los meses sucesivos.
En la literatura Lim y Robertson operaron a las 8 semanas de diagnosticado el
desprendimiento uno de los cinco casos de su casuística con 5 meses de
inactividad. En los restantes, el tiempo de seguimiento fue mayor e incluso
tuvieron un niño con 6 meses perfectamente consolidado, que tras la cirugía,
se activó y aparecieron nuevos tumores rápidamente. Hay igualmente descritos
recidivas de retinoblastomas a los 3-4 años de haberse radiado, significando un
alto riesgo su manipulación. El romper la barrera protectora de las cubiertas
oculares en este tipo de cirugías, nos mantiene expectantes durante muchos
años (53).
¿Cuándo se hacen vitrectomías?
Si se confirma la inactividad clínica de los procesos, la necesidad de
operar con vitrectomía se realiza con extracción de muestras que se envían a
Patología y Citología (53,58).
Con 4 años de edad, 3 meses puede ser el tiempo prudencial de espera. Por
debajo de esa edad es muy difícil evaluar la respuesta y evolución de las
tumoraciones existiendo muchas variables que interfieren. La mayoría de los
pacientes han sido seguidos durante varios años antes de presentarse la
complicación. Los agujeros retinianos según Baumal (58) sólo se hacen
visibles durante la aspiración directa sobre el agujero. La vitrectomía
permite eliminar las tracciones sobre los desgarros. Para Madreperla y
Hungerford (49) a veces es preciso realizar retinotomías. Usaron silicona como
taponamiento, no existiendo en la literatura experiencia con perfluorocarbonos.
Hay muchos casos de síndromes de enmascaramiento por leucemias,
endoftalmitis, Coats etc., en que se realizó vitrectomía y terminaron
enucleándose por retinoblastomas. Por el contrario son muy pocos y muy
específicas las vitrectomías realizadas en retinoblastomas confirmados que no
pudieron ser resueltos en sus DR por procedimientos clásicos (53). Las
hemorragias vítreas, opacidades y leucomas corneales y los restos de cápsula
artefactan la cirugía (61). Las lentes intraoculares hacen muy difícil el
control evolutivo de los retinoblastomas.
La enucleación debe realizarse en 24-48 horas si la confirmación
histológica es tumoral.
BIBLIOGRAFÍA
- Doz F, Neusenschwander S, Plantaz D. Etoposide and carboplatin in
extraocular retinoblastoma: a study by the Societé Francaise d'Oncologie
Pediatrique. J Clin Oncol 1995; 13: 902-909.
- Dudgeon J. Retinoblastoma. Trends in conservative management. Br J
Ophthalmol 1992; 79: 104.
- Pratt CB, Crom DB, Howarth C. The use of chemotherapy for extraocular
retinoblastoma. Med Pediatr Oncol 1985; 13: 330-333.
- Saarinen UM, Sariola H, Hovi L. Recurrent disseminated retinoblastoma
treated by high-dose chemotherapy, total body irradiation and autologous bone
marrow rescue. Am J Pediatr Hematol Oncol. 1991; 13: 315-319.
- Doz F, Khelfaoui F, Mosseri V. The role of chemotherapy in orbital
involvement of retinoblastoma: the experience of a single institution with 33
patients. Cancer. 1994; 74: 722-732.
- Gallie BL, Budning A, DeBoer G. Chemotherapy with focal therapy can cure
intraocular retinoblastoma without radiotherapy. Arch Ophthalmol 1996; 114:
1.321-1.328.
- Murphree AL, Villablanca JG, Deegan WF III. Chemotherapy plus local
therapy in the treatment of intraocular retinoblastoma. Arch Ophthalmol 1996;
114: 1.348-1.356.
- Shields CL, De Potter P, Himelstein BP. Chemoreduction in the initial
management of intraocular retinoblastoma. Arch Ophthalmol 1996; 114:
1.330-1.338.
- Greenwald MJ, Strauss LC. Treatment of intraocular retinoblastoma with
carboplatin and etoposide chemotherapy. Ophthalmology 1996; 103: 1.989-1.997.
- Kingston JE, Hungerford JL, Madreperla SA, Plowman PN. Results of
combined chemotherapy and radiotherapy for advanced intraocular retinoblastoma.
Arch Ophthalmol 1996; 114: 1.339-1.343.
- Shields CL, Shields JA, Needle M. Combined chemoreduction and adjuvant
treatment for intraocular retinoblastoma. Ophthalmology 1997; 104: 2.101-2.111.
- Imhof SM, Mourits MP, Hofman P. Quantification of orbital and midfacial
growth retardation after megavoltage external beam irradiation in children with
retinoblastoma. Ophthalmology 1996; 103: 263-268.
- Eng C, Lin FP, Abramson DH. Mortality from second tumors among long-terms
survivors of retinoblastoma. J Natl Cancer Inst 1993; 85: 1.121-1.128.
- Abramson DH, Frank CM. Second nonocular tumors in survivors of bilateral
retinoblastoma; a possible age effect on radiation-related risk. Ophthalmology
1998; 105: 573-580.
- Ellsworth RM. The practical management of retinoblastoma. Trans Am
Ophthalmol Soc 1969; 67: 462-534.
- Hungerford JL, Toma NMG, Plowman PN, Kingston JE. External beam
radiotherapy for retinoblastoma, I. Br J Ophtalmol 1995; 79: 109-111.
- Chan HSL, DeBoer G, Thiessen JJ. Combining cyclosporin with chemotherapy
controls intraocular retinoblastoma without requiring radiation. Clin Cancer Res
1996; 2(9): 1.499-1.508.
- Murphree AL, Stout AU, Szirth B. Carboplatin and laser generated
hypertermia: preliminary results in the treatment of focal intraocular
retinoblastoma. Invest Ophthalmol Vis Sci 1992; 34: 68-77.
- Lueder GT, Goyal R. Visual function after laser hypertermia and
chemotherapy for macular retinoblastoma. Am J Ophthalmol 1996; 121: 582-584.
- Singh AD, Shields JA. Comunicación personal. International Congress on
Ocular Tumors. Philadelphia, 1999.
- Abramson DH. Comunicación personal. International Congress on Ocular
Tumors. Philadelphia, 1999.
- Mendelson ME, Abramson DH, Madden T. Intraocular concentrations of
chemotherapeutics agents after sistemic or local administrative. Arch Ophthalmol
1998; 116: 1.209-1.212.
- Kaneko A. Comunicación personal. International Congress on Ocular
Tumors. Philadelphia, 1999.
- Shields JA, Parsons H, Shields CL, Giblin ME. The role of cryotherapy in
the management of retinoblastoma. Am J Ophthalmol 1989; 108: 260-264.
- Abramson DH, Ellsworth RM, Rozakis GW. Cryotherapy for retinoblastoma.
Arch Ophthalmol. 1982; 100: 1.253-1.256.
- Journee-de Korver JG, Oosterhuis JA, Kakebeeke-Kemme HM, De
Wolf-Rovendaal D. Transpupillary thermotherapy (TTT) by infrared irradiation of
choroidal melanoma. Doc Ophthalmol 1992; 82: 185-191.
- Journee-de Korver JG. Transpupillary Thermotherapy: Tesis. The Hague, The
Netherlands: Kugler Publications; 1998; 1: 116.
- Kaneko A. Conservative therapy of retinoblastoma using hypertermia. CRC.
1993; 2: 178-184.
- Lagedijk J. Microwave applicator for hyperthermic treatment of
retinoblastoma. Natl Cancer Inst Monogr 1982; 61: 469-471.
- Oosterhuis JA, Journee-de Korver JG, Keunen JEE. Transpupillary
thermotherapy: results in 50 patients with choroidal melanoma. Arch Ophthalmol
1998; 116: 157-162.
- Shields CL, Shields JA. Recent developments in the management of
retinoblastoma. J Pediatr Ophthalmol Strabismus 1999; 36: 8-18.
- Shields JA, Shields CL, Parsons H, Giblin ME. The role of
photocoagulation in the management of retinoblastoma. Arch Ophthalmol 1990; 108:
205-208.
- Shields Cl, Shields JA, Kiratli H. Treatment of the retinoblastoma with
indirect ophthalmoscope laser photocoagulation. J Pediatr Ophthalmol Strabismus
1995; 32: 317-322.
- Shields Cl, Shields JA, De Potter P. Plaque radiotherapy in the
management of retinoblastoma: use as a primary and secondary treatment.
Ophthalmology 1993; 100: 216-224.
- Freire JE, De Potter P, Brady LW, Longton WA. Brachitherapy in primary
ocular tumors. Seminar Surg Oncol 1997; 13: 167-176.
- Finger PT. Palladium-103 plaque radiotherapy for choroidal melanoma.
Results of a 7 year study. Ophthalmology 1999; 106: 606-613.
- Zoografos L, Bercher L, Chamot L. Cobalt-60 treatment of choroidal
hemangiomas. Am J Ophthalmol 1996; 121: 190-199.
- Noorani HZ, Khan HN, Gallie BL, Detsky AS. Cost comparison of molecular
versus conventional screening of relatives at risk for retinoblastoma. Am J Hum
Genet 1996; 59: 301-307.
- Toma NMG, Hungerford JL, Plowman PN. External beam radiotherapy for
retinoblastoma: Lens sparing technique. Br J Ophthalmol. 1995;79:112-117.
- Schipper J. An accurate and simple method for megavoltage radiation
therapy of retinoblastoma. Radiother Oncol 1983; 1: 31-41.
- Svitra PP, Budenz D, Albert DM, Koehler AM, Gragoudas E. Proton beam
irradiation for treatment of experimental human retinoblastoma. Eur J Ophthalmol
1991; 1: 57-62.
- Hannouche D, Frau E, Desjardins L. Eficacy of proton therapy in
circunscribed choroidal hemangiomas associated with serous retinal detachment.
Ophthalmology 1997; 104: 1.780-1.784.
- Krengli M, Liebsch NJ, Hug EB. Review of current protocols for proton
therapy in USA. Tumori 1998; 84: 209-216.
- Shields CL, Shields JA, Shah P. Retinoblastoma in older children.
Opthalmology 1991; 98: 395-399.
- Shields JA. Retinoblastoma in an 18 year old male. Arch Ophthalmol 1976;
13: 274-277.
- Takahashi T. Retinoblastoma in a 26 year-old adult. Ophthalmology 1983;
90: 179-183.
- Grossman SA, Peyman GA. Long term visual results after pars plicata
lensectomy-vitrectomy for congenital cataracts. Br J Ophthalmol 1988; 72:
601-606.
- Messmer EP, Fritze H, Mohr C et al. Long-term treatment effects in
patients with bilateral retinoblastoma: ocular and mid-facial findings.Graefes
Arch Clin Exp Ophthalmol 1991; 229(4): 309-314.
- Madreperla SA, Hungerford JL. treatment for retinoblastoma. Am J
Ophthalmology 1984; 98: 473-477.
- Brooks HL, Meyer D, Shields JA. Removal of radiation induced catarats in
patients treated for retinoblastoma. Arch Ophthalmol 1990; 108(12): 1701-1708.
- Portellos M, Buckley EG. Cataract surgery and intraocular lens
implantation in patients with retinoblastoma.Arch Ophthalmol 1998; 116(4):
449-452.
- Schipper J, Tan K, Van Peperzeel HA. Treatmentof retinoblastoma by
precision megavoltage radiation therapy. Radiother Oncol 1985; 3: 117-132.
- Lim TH, Robertson DM. Presumed rhegmatogenous retinal detachment in
patients with retinoblastoma. Retina 2000; 20: 22-27.
- Madreperla SA, Hungerford JL, Cooling RJ, Sullivan P. Repair of late
retinal detachment after successful treatment of retinoblastoma. Retina 2000;
20: 28-32.
- Mullaney PB, Abboud E, Al Mesfer SA. Retinal detachment,associated with
type III retinoblastoma regresion after cryotherapy and external-beam
radioteherapy. Am J Ophthalmol 1997; 123(1): 1.140-1.142.
- Buzney SM, Pruett RC, Regan CD et al. Surgical repair of rhegmatous
retinal detachment after treatment for retinoblastoma. Am J Ophthalmology 1984;
98: 473-477.
- Lincoff H, Kreissing I. The mechanism of the cryosurgical adhesion. Mod.
Problem. Ophthal 1972; 10: 99-106.
- Baumal CR, Shields CL, Shields JA, Tasman WS. Surgical repair of
rhegmatous retinal detachment after treatment for retinoblastoma. Ophthalmology
1998; 105: 2,134-2,139.
- Pruett RC. Scleral buckling in retinoblastoma:case report.Annals
Ophthalmology 1975; 1.115-1.120.
- Spaulding AG, Fuhs JC. Retinoblastoma and retinal detachment. Surv
Ophthalmol 1968; 13: 152-156.
- Stevenson KE, Hungerford J, Garner A. Local extraocular extension of
retinoblastoma following intraocular surgery. Br J Ophthalmology 1989; 73:
739-742.
|