|
RADIOTERAPIA EN EL RETINOBLASTOMA
Hasta los años 70, el tratamiento del retinoblastoma consistía en la
enucleación del ojo afecto para los casos unilaterales. En los casos
bilaterales se enucleaba el ojo con enfermedad más avanzada (1-3), y al ojo
contralateral se le aplicaba irradiación u otro tratamiento. Actualmente se
extreman las indicaciones de tratamiento conservador en lo posible, habiendo
mejorado considerablemente el pronóstico para la visión.
El tratamiento local con braquiterapia estaría indicado como tratamiento
único en tumores pequeños, unilaterales y en niños de mas de 2 años, con
mínimo riesgo de enfermedad multifocal (1,2,4,5). En niños con alto riesgo de
enfermedad multicéntrica en los cuales los focos tumorales pueden aparecer de
forma aleatoria en ambos ojos (6,7), no siempre simultáneamente (incluso meses
después del tratamiento de la primera lesión), sólo podría estar justificado
en aquellos pacientes que puedan ser sometidos a un seguimiento estrecho y a
repetidos tratamientos locales o con irradiación externa en caso de recaídas.
En general, en niños con enfermedad multifocal o con alto riesgo de padecerla,
así como en tumores grandes, el tratamiento local no es aconsejable, y se debe
utilizar con cautela (1,2,4).
RADIOTERAPIA EXTERNA
La irradiación externa fue utilizada en el tratamiento del retinoblastoma
por primera vez por Hilgartner en 1903 (8). Una de las primeras técnicas de
radioterapia externa para el retinoblastoma con una unidad de ortovoltaje fue
desarrollada en 1930 por Reese (9). Con esta energía el hueso absorbía una
dosis alta produciéndose grandes deformidades en los pacientes. Con la
introducción de aparatos de megavoltaje, y el refinamiento de las técnicas de
tratamiento se consiguen mejores resultados con una tasa aceptable de
complicaciones. Debido a que el retinoblastoma es poco frecuente, y requiere una
radioterapia de gran precisión, con planificación y ejecución muy laboriosas,
los niños deberían ser referidos a centros especializados con suficientes
medios técnicos y experiencia que aseguren un tratamiento adecuado.
INDICACIONES
1. Tumores con diámetro basal mayor de 15 mm y/o altura superior a 10 mm, o
cercanos a mácula o papila, que no son candidatos para tratamiento local, 2.
Tumores múltiples, 3. Siembra vítrea extensa, y 4. Afectación residual del
nervio óptico tras enucleación y extensión orbitaria.
Algunos autores aconsejan enucleación en enfermedad unilateral por el riesgo
de carcinogénesis radioinducida. Sin embargo, un 10 a 20% de los pacientes,
especialmente aquellos con historia familiar de retinoblastoma, menos de 12
meses, o con más de un foco tumoral, desarrollarán enfermedad en el otro ojo,
por lo que si son enucleados, el ojo contralateral quedaría expuesto a la
aparición de nuevos focos, accidentes u otras enfermedades. Además, en
enfermedad unilateral, no hereditaria, la incidencia de tumores no oculares
radioinducidos es muy baja (5,10,11). Actualmente, en los casos unilaterales con
visión útil no se aconseja el tratamiento quirúrgico. En los bilaterales
todavía hay autores que defienden la enucleación sistemática en grupo V de
Reese y Ellsworth (12,13), pero en los casos en que exista algún potencial
visual, incluso con enfermedad avanzada, deberá intentarse radioterapia externa
sobre los dos ojos (1,14,15).
TÉCNICA
Existe un punto de conflicto entre la necesidad de tratar toda la retina y el
deseo de proteger el cristalino y la cámara anterior, que sólo está
parcialmente resuelto con una gran precisión en la aplicación del tratamiento.
Esto se debe a que en el niño hay una separación aproximada de 1 mm entre la
cara posterior del cristalino y la ora serrata. Se deben verificar en cada
paciente las dimensiones intraoculares axiales con ecografía, TAC ocular y
examen bajo anestesia en posición de tratamiento. En general, la ora serrata de
un bebé, está en el canto externo o muy cerca de él, a 6 ó 7 mm del limbo
corneal. Esas medidas deberán ser comprobadas rutinariamente durante el tiempo
de irradiación externa (1,2,5,16). Hay descritas una gran variedad de técnicas
de irradiación, que tienen como requisito común la necesidad de una rígida
inmovilización con sedación y/o anestesia si es preciso, y como finalidad
común asegurará el tratamiento de la totalidad de la retina, evitando irradiar
el ojo contralateral si está sano y limitando la dosis en los tejidos sanos
adyacentes. Cada especialista debe elegir la técnica que, cumpliendo los
criterios anteriores, mejor se adapte a su contexto, equipamiento y experiencia.
Campo/s lateral/es: La mayoría de los autores utilizan un campo lateral
conformado en forma de «D», para los tratamientos unilaterales y campos
laterales, paralelos y opuestos para los bilaterales (9,17-22). Este campo en
forma de «D», ha sido diseñado para incluir la superficie retiniana completa
y el vítreo así como 10 mm del nervio óptico adyacente al globo ocular,
protegiendo a la vez el cristalino, la cámara anterior, la hipófisis y las
raíces dentarias. Cuando el ojo contralateral no ha sido enucleado, el haz se
puede angular posteriormente, para evitar que atraviese el cristalino
contralateral. El tratamiento puede realizarse con fotones sólo o puede hacerse
de forma mixta con fotones y electrones.
Beam-splitting: Algunos autores (1), usan la técnica de
«beam-splitting» o haz dividido; en estos casos, los campos de un tamaño de
3,5 ´
7 cm son reducidos por su mitad a 3,5 ´
3,5 cm. Con ello se evita la divergencia del haz en su límite anterior y el
cristalino recibe menos del 10% de la dosis administrada. Sin embargo, la ora
serrata recibe sólo el 50% por lo que cuando existe extensión anterior del
tumor, el límite anterior del campo debe ser adelantado 1-2 mm para aumentar la
dosis en ese nivel, aunque se aumenta ligeramente la dosis en el cristalino.
(Con estas técnicas de campo/s lateral/es, existe un riesgo potencial de
recidivas en el límite anterior del tumor. En cualquier caso los fracasos
anteriores pueden tratarse adecuadamente con crioterapia y salvo cuando haya
enfermedad macroscópica cerca de la ora serrata, esta técnica puede ser
adecuada) (2,9,17,18,22).
Técnicas de alta precisión:
Schipper y col. en Utrecht (23), diseñaron
una técnica de alta precisión mediante un haz lateral, y con fijación del ojo
en posición central, usando una lente de contacto de vacío, unida junto a una
escala milimétrica al chasis del colimador. Con ella se sitúa el límite
anterior del campo justamente detrás del cristalino. Esta técnica ha sido
usada también en el Hospital St. Bartholomew (20) y otros centros (5).
Campos anteriores:
Otros autores prefieren utilizar un campo directo
anterior con Cobalto 60 o acelerador lineal (8,9,24-30). Esta técnica incluye
todo el ojo y protege el contralateral. Sin embargo, no protege el cristalino y
la formación de catarata es segura, tampoco protege las glándulas lacrimales
disminuyéndose la producción de lágrimas, y el haz de salida produce una
irradiación no deseada de parte del cerebro. La gran ventaja es que es de muy
fácil realización y reproductibilidad e irradia de forma homogénea la retina
y el vítreo en su totalidad. Debido a que la catarata requiere tiempo para su
formación y puede ser tratada satisfactoriamente de forma quirúrgica, estos
autores no consideran esta complicación como contraindicación de esta
técnica.
Campos anterior y lateral:
Se pueden utilizar dos campos de fotones, uno
lateral y otro anterior con protección del cristalino mediante un bloque de
plomo (4,22). Como alternativa se pueden utilizar electrones en el campo
anterior y fotones en el lateral, protegiendo el cristalino con un blindaje de
plomo montado sobre una lente de contacto, pero si se producen aunque sean
pequeños movimientos de la lente de contacto, se afectará significativamente
la dosis a través del campo anterior (6,9,27-29).
DOSIS:
Es difícil valorar una relación dosis-respuesta en el
tratamiento del retinoblastoma con irradiación externa, debido a la diversidad
de técnicas utilizadas y a la multitud de tratamientos empleados, en ocasiones
en un mismo paciente. Entre un gran número de esquemas, la dosis/fracción,
varía desde 1,8 a 3,8 Gy, y la dosis total entre 30 y 60 Gy (2,14,18,31-36).
Los fraccionamientos que utilizan dosis diarias de 2,5 a 3,5 Gy intentan
reducir el número de sesiones cuando es necesaria anestesia general (1,14,22),
que no se considera necesaria por otros que tratan a los niños después de
haber comido, con o sin sedación (17,37,38). Puesto que se considera que dosis
de más de 2 Gy diarios pueden ser críticas para estructuras tales como el
nervio óptico y la retina cuando se alcanzan dosis totales de 50 Gy
(5,28,29,37), y dados los avances actuales en técnicas de anestesia, hoy día
no parecen aconsejables fraccionamientos superiores a 2 Gy diarios con los que
conseguiríamos una mejor tolerancia de las estructuras oculares, especialmente
en pacientes que reciben adicionalmente fotocoagulación, crioterapia,
quimioterapia o braquiterapia.
En la mayoría de los centros se administran dosis totales de 35-50 Gy.
Aunque algunos autores (2,39) consideran que 35 Gy son efectivos para el control
tumoral, otros aconsejan 50-56 Gy (1,16,40). En algunas series no se encuentra
una relación dosis-respuesta según tamaño tumoral, siendo igual de efectivos
40 Gy para tumores de cualquier grupo de la clasificación de Reese- Ellsworth
(9), sin embargo otros aconsejan dosis más altas (50 Gy) en el grupo V (16,26).
Según estos datos, la mayoría de los clínicos eligen una dosis diaria de
1,8-2,0 Gy, administrados 5 días por semana hasta un total de 40-45 Gy,
aconsejándose en algunos casos para tumores grandes y/o con siembra vítrea,
48-50 Gy (2,26,41).
Por último, los pacientes con afectación del nervio óptico, invasión
coroidea o extensión orbitaria del tumor evidenciadas tras la enucleación,
deberían recibir irradiación orbitaria a dosis de 50-54 Gy con fraccionamiento
convencional (1-2,4-5). La irradiación cráneo-espinal estaría indicada en los
casos de extensión cerebral o meníngea.
COMPLICACIONES: Howarth (42), realizó una evaluación clínico
patológica de 100 ojos enucleados por retinoblastoma, 21 de los cuales habían
sido irradiados. El examen microscópico, mostró cambios como sinequias en el
ángulo, atrofia, adelgazamiento y degeneración hialina de los vasos de la
retina, esclerosis y estrechamiento de los vasos coroideos. Esos cambios
estuvieron presentes en 10 de 14 ojos (71%) que habían recibido dosis totales
de 84 Gy, y sólo en 1 de 7 ojos que recibieron 37,5 Gy. Similares resultados
fueron observados en estudios con animales (43), demostrando la relación entre
dosis y complicaciones.
Catarata.
Es una complicación frecuente en el tratamiento con
radioterapia externa, teniendo hoy día fácil manejo quirúrgico (2,4-5,44). La
dosis mínima cataratogénica según varias series (5,45,46) oscila entre 8 y 20
Gy, aumentando la probabilidad de aparición y la intensidad de la misma con la
dosis absorbida por el epitelio germinal del cristalino y la extensión del
mismo incluida en el volumen de irradiación (5,47). Todo esto se relaciona con
la técnica de radioterapia: con un campo directo anterior se debe esperar una
catarata radioinducida en la totalidad de los pacientes (1,2,4,5), disminuyendo
la proporción en pacientes tratados con campo lateral exclusivo (5,45,48). El
período de latencia entre la irradiación y la formación de catarata es
variable y dosis dependiente, acortándose cuando se aumenta la dosis de
irradiación.
Retinopatía radiactiva.
Es, junto a la neuropatía óptica, la secuela
más importante de la irradiación externa. Se caracteriza por la aparición de
telangiectasias, edema retiniano, exudación y oclusión de los vasos de la
retina, lo cual puede llevar a neovascularización prerretiniana y hemorragia
vítrea y puede ocurrir desde los 6 meses hasta varios años después del
tratamiento (1,2,4,5,42,49). El umbral de dosis necesario para producir daño en
la retina varía según los diferentes autores: Ellsworth (50), demostró
retinopatía en el 10% de los niños tratados con 35 Gy, en 66% con 45 Gy y en
el 100% con 80 Gy. Schipper (45), con 45 Gy, observa daño retiniano en 3/54
pacientes y todos retuvieron visión útil. Otros encuentran efectos adversos
sobre la retina con 50 Gy (28,29,37). Sin embargo, según otros se pueden
tolerar bien dosis de 50 ó 56 Gy (1,16) con fraccionamiento convencional.
Resumiendo, el riesgo de daño vascular de la retina aumenta con la dosis, así,
dosis de 45 Gy conllevan un pequeño riesgo, pero con 50 a 60 Gy el riesgo de
retinopatía y de hemorragia vítrea aumenta, y con dosis mas de 65 Gy el riesgo
de daño retiniano es importante (45,51). La fotocoagulación repetida
incrementa el riesgo de daño vascular retiniano (5,48).
Neuropatía óptica.
La patogénesis exacta de la radionecrosis del
nervio óptico no se conoce, si bien la mayoría de los autores piensan que la
neuropatía óptica deriva de un daño vascular (1,5). El período de latencia
tras radioterapia puede variar desde varios meses a varios años y la dosis
umbral relacionada con daño del nervio óptico varía con los autores. Edgbert
(48) describe un niño que recibió dos ciclos de irradiación externa, con un
total de 96 Gy y que sufrió atrofia óptica a los 16 años del tratamiento.
Abramson (10) encontró algún grado de afectación del nervio óptico sólo en
aquellos pacientes que recibieron también dos cursos de irradiación, con dosis
totales comprendidas entre 54 y 165 Gy. La mayoría de los autores coinciden en
que son necesarias dosis elevadas, al menos 65-68 Gy, para producir lesiones
importantes del nervio óptico (1,2,4,5, 51-52). Cuando se añade quimioterapia
a la irradiación, las complicaciones sobre la retina y el nervio óptico son
más frecuentes que con irradiación exclusiva y pueden aparecer a dosis más
bajas (45,53).
Hipoplasia ósea.
El retraso en el crecimiento de las estructuras óseas
irradiadas resultando en malformaciones faciales, fue un significativo efecto
colateral en el pasado, debido a la alta absorción por el hueso de la
irradiación de ortovoltaje y a las altas dosis utilizadas en un principio (54).
Con megavoltaje y disminución de dosis a 35 a 50 Gy en 3,5 a 5 semanas, esta
complicación no es un gran problema hoy día, siendo similar al producido por
la enucleación (1,2,4,5,12,13). Se puede resolver con cirugia si constituye un
grave problema (55).
Otras complicaciones.
Otras complicaciones menos importantes son el ojo
seco, queratoconjuntivitis, y pérdida de las pestañas.
RESULTADOS:
En retinoblastomas, además de conseguir unas cifras
adecuadas de supervivencia y control local, es importante la conservación del
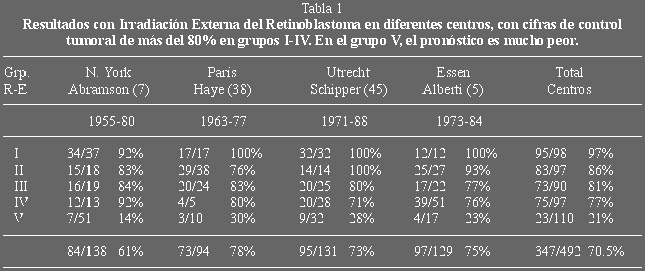
ojo con una visión útil. En la tabla 1, se muestran los resultados de
diferentes centros con cifras de control tumoral de más del 80% en grupos I-IV.
Si excluimos los ojos del grupo V, de muy mal pronóstico, se conservaron el 85%
(326/382) de los ojos. Muchos ojos requerirán tratamientos complementarios,
crioterapia, fotocoagulación o placas radiactivas, sea por persistir enfermedad
residual o recurrente o por la aparición de nuevos tumores en áreas de la
retina previamente indemnes. El porcentaje de pacientes que recibieron
fotocoagulación varió desde un 25% para Abramson y col. (9), un 54% para
Schipper y col. (45) y un 74% para Alberti y col. (5). Otras razones para el uso
de la fotocoagulación fueron dudas en el control tumoral tras la radioterapia
externa y/o porque los pacientes procedían de lugares lejanos y no era posible
un estrecho seguimiento.
Resultados del tratamiento según las diferentes técnicas:
Bedford y
col. (24) trataron 133 pacientes mediante un campo directo anterior. La
enucleación se llevó a cabo en el 10% de los pacientes por complicaciones del
tratamiento y en el 6,8% por enfermedad no controlada. McCormick y col. (28)
analizaron los resultados obtenidos en el tratamiento de 170 niños mediante dos
técnicas diferentes; un campo anterior de electrones con protección del
cristalino y una técnica de campo lateral modificada mediante tres haces, uno
lateral de electrones y dos haces de fotones laterales oblicuos con cuñas,
superior e inferior. Para los ojos con enfermedad de los grupos I-III, con la
primera técnica se obtuvo un control local del 33%, comparado con el 83% de los
ojos tratados con la técnica lateral modificada (p=0,006). La mayoría de los
fallos pudieron ser tratados satisfactoriamente con fotocoagulación o placas
radiactivas. Cinco ojos requirieron enucleación, todos ellos tratados con la
técnica de protección del cristalino con campo anterior. En este grupo
aparecieron 6 cataratas y en el segundo grupo ninguna, pero es preciso mayor
seguimiento. Para los casos de los grupos IV-V, no hubo diferencias
significativas respecto al control local o enucleaciones entre las dos
técnicas. Messmer y col. (16), compararon los resultados obtenidos en 127 ojos
tratados con dos técnicas diferentes; 73 ojos fueron tratados con un campo
lateral conformado en forma de «D», con el límite anterior en el canto
externo del ojo y 53 con la técnica de Schipper. La aparición de tumores
nuevos o recurrentes fue menor con la técnica de Schipper (22% vs 48%).
Schipper y col. (45) trataron 39 niños con retinoblastoma, 54 de los 73 ojos
afectos fueron tratados con la técnica de alta precisión descrita por él
mismo (23). De los 54 ojos 322 recibieron tratamiento complementario con
fotocoagulación o crioterapia por sospecha de enfermedad residual (29 casos),
recidiva tumoral (1 caso) o nuevo tumor (3 casos); 10 de ellos fueron finalmente
enucleados. El 95% de los ojos conservados tenían visión útil. Dieciocho ojos
desarrollaron una catarata detectable clínicamente que fue aspirada en cinco
casos.
TÉCNICAS DE RADIOTERAPIA. CLÍNICA PUERTA DE HIERRO
Como norma general, el tratamiento empleado en el Servicio de Oncología
Radioterápica de la Clínica Puerta de Hierro en pacientes con retinoblastoma
ha sido la irradiación externa (56-63). En un pequeño grupo se han utilizado
placas de Cobalto-60. Los pacientes enucleados en los que la extensión del
tumor primitivo, la proximidad del mismo a los bordes de resección o la
infiltración de éstos, condicionaba un alto riesgo de recidiva local,
recibieron irradiación postoperatoria empleando las mismas técnicas que en la
irradiación externa exclusiva. En los últimos años se sugiere que el uso de
quimioterapia seguida de algún tipo de tratamiento local que evite o retrase la
necesidad de radioterapia externa podría ser beneficioso, manteniendo las
cifras de supervivencia y control local, y disminuyendo la toxicidad asociada a
la radioterapia externa (64-67).
RADIOTERAPIA EXTERNA
En los primeros años de este estudio, el tratamiento con irradiación
externa se realizaba mediante una unidad de Cobalto-60 con una distancia
fuente-piel de 80 cm. Posteriormente, con la puesta en marcha del Acelerador
Lineal en el año 1980, comenzaron a utilizarse haces de electrones de 9 y 13
MeV procedentes de esta unidad, bien de forma exclusiva o en combinación con
fotones de la unidad de Cobalto-60, o procedentes de un Acelerador lineal
(56-58) (figura 1).

Figura 1. Radioterapia externa. Manejo, utilización y
complicaciones.
La técnica de tratamiento en la mayoría de los casos ha sido la
irradiación del volumen tumoral empleando un campo único directo anterior
sobre el globo ocular, sin protección central, con una angulación externa de
cinco grados.
Otras técnicas empleadas han sido la utilización de un campo lateral, sea
único o combinado con otro campo anterior. El campo lateral es un campo
conformado en «D», cuyo límite anterior es el canto externo y el límite
posterior se sitúa en aquel punto en el cual queda incluida toda la retina
además de los 10 mm de la porción anterior del nervio óptico. En los casos de
enfermedad bilateral se han utilizado dos campos laterales, paralelos y
opuestos, en ocasiones combinados con sendos campos anteriores de electrones
sobre cada ojo.
El fraccionamiento de la dosis administrada también ha variado con el
tiempo. En los primeros años de la serie se utilizaban fracciones de 300 ó 350
cGy administradas tres veces por semana, posteriormente este esquema se
modificó a fracciones diarias de 180, 200 ó 250 cGy durante cinco días a la
semana. La dosis total administrada ha sido de 40 Gy con pocas variaciones a lo
largo del tiempo.
La introducción de la TAC en la planificación de los tratamientos con
radiaciones ionizantes ha contribuido de forma eficaz a facilitar la elección
del volumen blanco, permitiendo identificar diversas estructuras (borde
posterior del cristalino, ora serrata y otros puntos de referencia de interés),
que facilitan el diseño del campo de tratamiento adecuado a cada caso,
asegurando una distribución dosimétrica adecuada en todo el tumor y áreas de
riesgo, evitando la irradiación de otras estructuras oculares.
Para una correcta realización del tratamiento, es de máxima importancia la
inmovilización del paciente, con fijación absoluta de la cabeza y del globo
ocular. Dada la corta edad de los mismos la única forma de fijación posible,
en la mayoría de los casos, fue mediante alguna forma de anestesia. En los
primeros años se utilizaba Pentobarbital sódico (Nembutal®) por vía rectal a
dosis de 10 mg/kg, con los inconvenientes de una absorción lenta e irregular.
Más adelante se utilizaron enemas de Hidrato de Cloral al 10% (Dosis: 0,5
cc./kg) con similares problemas de absorción y de inducción hepática.
Posteriormente y hasta la actualidad los niños son anestesiados mediante
Ketamina (Ketolar ®) por vía i.v. o i.m. (Dosis: 2-4 mg/kg) de acción corta y
buena tolerancia.
QUIMIOTERAPIA SEGUIDA DE RADIOTERAPIA EXTERNA
Queremos analizar la evolución de una serie de pacientes tratados
recientemente con quimioterapia y remitidos desde la Unidad de Retinoblastoma
del Hospital Infantil «La Paz» para irradiación externa, cuyas
características se resumen en la tabla 2. Entre junio de 1996 y marzo de 1999
hemos tratado 9 pacientes (5 niños y 4 niñas) con una edad media de 18,8 meses
(11 a 37 meses). En el momento de acudir a nuestro servicio. 5 pacientes tenían
enfermedad unilateral y 4 bilateral, con lo que se han tratado un total de 11
ojos (uno había sido enucleado y otro tratado con rutenio previamente). La
distribución por grupos de Reese-Ellsworth es la que sigue: Grupo IB: 1 ojo.
IIA: 2. VA: 1, y VB: 7. El tumor se situaba en el ojo derecho en 6 pacientes, y
en el izquierdo en 5. La quimioterapia consistió básicamente en una
combinación de carboplatino y VP16, observándose tras la misma persistencia
tumoral en 4 pacientes y progresión de la enfermedad en los 7 restantes.

La irradiación se efectuó en decúbito supino, con inmovilización mediante
máscara de termoplástico y anestesia general en la totalidad de los pacientes.
Se utilizaron campos anterior u oblicuo en 7 ojos, y una combinación de campos
laterales (Cobalto 60) y anteriores (e-) en 4 ojos (afectación bilateral). Se
utilizó una combinación de fotones y electrones (9-10 MeV) en 8 ojos, y
electrones de forma exclusiva en 3 (9-5 MeV). La dosis total administrada fue de
43 Gy (40 a 46,6 Gy), con un fraccionamiento que osciló entre 180 y 200
cGy/día (Cobalto60) y 250 cGy/día con electrones. La duración del tratamiento
osciló entre 25 y 38 días.
La tolerancia ha sido buena con problemas leves de queratoconjuntivitis,
particularmente en aquellos pacientes tratados de forma exclusiva con
electrones.
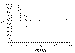
Figura 2. Supervivencia libre de recidiva local (n = 11 ojos). |
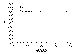
Figura 3. Supervivencia libre de enucleación (n = 11 ojos). |
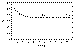
Figura 4. Control local. Grupo VB de Reese-Ellsworth. Modificado de
A. Hervás (56). |
Con un período de seguimiento medio de 13 meses (5-38 meses), hemos
evidenciado recidiva local en cuatro ojos de la serie, que se manifestó entre 5
y 10 meses tras el tratamiento. La supervivencia libre de recidiva actuarial es
del 59% a los 12 meses, manteniéndose en esa cifra hasta el final del
seguimiento (figura 2). De las cuatro recidivas, dos casos pudieron rescatarse
con crioterapia (añadiendo quimioterapia en uno de ellos), una fue sometida a
tratamiento con placa oftálmica de Rutenio y termoterapia, y en la cuarta se
optó directamente por la enucleación.
Hasta la fecha ha sido necesaria la enucleación de 2 ojos, a los 5 y 7 meses
respectivamente (uno de ellos por recidiva tras radioterapia externa y tras el
rescate ulterior con crioterapia). La probabilidad actuarial de conservar el ojo
afecto es del 81% a partir de los doce meses (figura 3).
Si comparamos las tasas de recidiva local en esta limitada serie de
pacientes, con el grupo de peor pronóstico (VB) de nuestra serie anterior,
observamos que no han mejorado añadiendo quimioterapia, así frente al 59% de
supervivencia libre de recidiva actuarial a los 12 meses del grupo tratado con
quimioterapia e irradiación externa, obteníamos más del 80% de control local
al año, y cifras del 71% a los 5 y 10 años (figura 4) (56,59,60).
Tampoco hemos encontrado ventajas en cuanto al número de enucleaciones
posteriores al tratamiento: Se han enucleado por recidiva 2/11 ojos en los
pacientes tratados con la combinación de quimioterapia y radioterapia externa,
en tanto que si revisamos las enucleaciones tras radioterapia externa de nuestra
serie histórica observamos un total de 9 enucleaciones en 47 ojos (hay que
destacar que sólo en tres de los nueve casos se comprobó histopatológicamente
recidiva del retinoblastoma, en otras tres enucleaciones por supuesta recidiva
no se confirmó la misma en el estudio anatomopatológico, y las tres restantes
lo fueron por toxicidad) (56,63).
La totalidad de los pacientes de la serie están vivos al finalizar el
período de seguimiento. Como secuelas tardías destacamos 2 casos de leucoma
corneal (leve y grave respectivamente) y la aparición de catarata en tres de
los ojos, todas ellas operadas satisfactoriamente.
Hay que hacer notar lo desfavorable de la serie que presentamos, todos ellos
pacientes con falta de respuesta tras la quimioterapia inicial y/o de
posibilidad de tratamientos locales, a la hora de analizar el papel de la
quimioterapia en el tratamiento del retinoblastoma. Aquellos pacientes con
respuestas adecuadas y/o posibilidad de tratamiento local no han sido
contemplados y el grupo que se presenta es el más desfavorable de todos.
Igualmente, el escaso número de enfermos de la serie hace que las comparaciones
que se pudieran establecer con nuestra serie histórica o con otras de la
literatura deban ser interpretadas con la cautela necesaria.
Actualmente, las supervivencias logradas en retinoblastoma exceden el 90% de
los casos, por lo que el peso de las secuelas a largo plazo es mucho mayor. Debe
por tanto mantenerse el creciente interés en el desarrollo de esquemas y
técnicas de tratamiento que nos permitan por una parte aumentar la eficacia de
nuestros tratamientos y por otra evitar dichas secuelas. Una de las vías sería
intentar eliminar en aquellos casos en que sea posible, o retrasar en aquellos
en que no lo sea, el uso de radioterapia externa. El empleo de quimioterapia de
inducción con nuevos fármacos con mayor penetración en sistema nervioso
central se espera que demuestre una eficacia similar a la evidenciada en niños
con otros tumores del sistema nervioso. Con esto se mejora rían las condiciones
locales de los tumores, lo que permitiría el empleo, y una mayor eficacia, de
los tratamientos locales posteriores (láser, crioterapia, braquiterapia...) y
en consecuencia evitar la radioterapia externa y/o la enucleación en buena
parte de los pacientes. Este planteamiento tan atractivo desde un punto de vista
teórico puede ser difícilmente demostrable dado lo poco frecuente de estos
tumores, y la dificultad para reclutar un número de enfermos que permita la
adecuada valoración de las series.
BIBLIOGRAFÍA
- Donaldson SS, Egbert PR, Lee W. Retinoblastoma. In: Pizzo PA, Poplack DG,
editors. Principles and Practice of Pediatric Oncology, 2nd. edition.
Philadelphia. J.B. Lippincot. 683-696, 1993.
- Halperin EC, Constine LS, Tarbell NJ, Kun LK. (eds.) Retinoblastoma. In:
Pediatric Radiation Oncology, 2nd Edition. Raven Press. New York, 1994.
- Kock E, Rosengren B, Tengroth B, Trampe E. Retinoblastoma Treated with a
Co-60 Applicator. Radiother. Oncol. 7: 19-26, 1986.
- Shields JA, Shields CL. Intraocular Tumors. A Text and Atlas. WB Saunders
Company, Philadelphia, 1992.
- Alberti WE, Sagerman RH. Diagnosis and Management of Retinoblastoma. In:
Alberti WE, Sagerman RH eds.: Radiotherapy of Intraocular Tumors.
Springer-Verlag. Berlin Heidelberg, 1993.
- Abramson DH. Retinoblastoma: Diagnosis and Management. CA 32: 130-140,
1982.
- Abramson DH, Ellsworth RM, Tretter P, et al. Simultaneous Bilateral
Radiation of Advanced Bilateral Retinoblastoma. Arch. Ophthalmology 99:
1763-1766, 1981.
- Hilgartner HL. Report of a Case of Double Glioma Treated by X-Rays. Tex.
Med. J. 18: 322, 1903.
- Abramson DH. Treatment of Retinoblastoma. In: Blodi F.C. ed. Contemporary
Issues in Ophthalmology, vol. 2: Retinoblastoma. New York: Churchill
Livingstone, 63-93, 1985.
- Abramson DH, Ellsworth RM, Kitchin FD, et al. Second Nonocular Tumors in
Retinoblastoma Survivors. Are they Radiation-Induced?. Opthalmology 91:
1351-1355, 1984.
- Abramson DH, Ellsworth RM, Rosemblat M, Tretter P, Jereb B, Kitchin FD.
Retreatment of Retinoblastoma with External Irradiation. Arch. Ophthalmol. 100:
1257- 1260, 1982.
- Howarth C, Meyer D, Hustu O, Johnson WW, et al. Stage-Related Combined
Modality Treatment of Retinoblastoma. Cancer 45: 851-858, 1980.
- Zelter M, Gonzalez G, Schwartz L, et al. Treatment of Retinoblastoma.
Results Obtained From a Prospective Study of 51 Patients. Cancer 61: 153-160,
1988.
- Amendola BE, Markoe AM, Augsburger JJ, et al. Analysis of Treatment
Results in 36 Children with Retinoblastoma Treated by Scleral Plaque Radiation.
Int. J. Radiat. Oncol. Phys. 17: 63-70, 1989.
- Abramson DH, Ellsworth RM, Tretter P, et al. Simultaneous Bilateral
Irradiation for Advanced Bilateral Retinoblastoma. Arch. Ophthalmol. 99:
1763-1766, 1981.
- Messmer EP, Sauerwein W, Heinrich T, et al. New and Recurrent Tumor Foci
Following Local Treatment as Well as External Beam Irradiation in Eyes of
Patients with Hereditary Retinoblastoma. Graefes Arch. Clin. Exp. Ophthalmol.
228: 426-431, 1990.
- Cassady JR, Sagerman RH, Tretter P, Ellsworth RM. Radiation Therapy in
Retinoblastoma. Radiology 93: 405-409, 1969.
- Ellsworth RM. The Practical Management of Retinoblastoma. Trans. Am.
Ophthalmol. Soc. 67: 462-534, 1969.
- Bagshaw MA, Kaplan HS. Supervoltage Linear Accelerator Radiation Therapy
VIII: Retinoblastoma. Radilogy 86: 242-246, 1966.
- Harnett AN, Hungerford JL, Lambert GD, et al. Improved External Beam
Radiotherapy for the Treatment of Retinoblastoma. Br. J. Radiol. 60: 753-760,
1987.
- Tretter P. Radiotherapy of Ocular and Orbital Tumors. In: Reese A.B. ed.:
Tumors of the Eye, pp 373-377, New York, Harper & Row, 1976.
- Weiss DR, cassady JR, Peterson R. Retinoblastoma: A Modification in
Radiation Therapy Technique. Radiology 114: 705-708, 1975.
- Schipper J. An Accurate and Simple Method for Megavoltage Radiation
Therapy of Retinoblastoma. Radiother. Oncol. 1: 31-41, 1983.
- Bedford MA, Bedotta C, Mac Faul PA. Retinoblastoma: A Study of 139 Cases.
Br. J. Ophthalmol. 55: 19-27, 1971.
- Eng C, Li FP, Abramson DH, Ellsworth RM. et al. Mortality From Second
Tumors Among Long-Term Survivors of Retinoblastoma. Journal of the National
Cancer Institute. 85: 1121-1128, 1993.
- Foote RL, Garretson BR, Svhomberg PJ, et al. External Beam Irradiation
for Retinoblastoma: Patterns of Failure and Dose-Response Analysis. Int. J.
Radiat. Oncol. Biol. Phys. 16: 823-830, 1989.
- Abramson DH, Jereb B, Ellsworth RM. External Beam Radiation for
Retinoblastoma. Bull N. Y. Acad. Med. 57: 787-803, 1981.
- Mc Cormick B, Ellsworth RM, Abramson D, et al. Radiation Therapy for
Retinoblastoma: Comparison of Results with Lens-Sparing Versus Lateral Beam
Techniques. Int. J. Radiat. Oncol. Biol. Phys. 15: 567-574, 1988.
- Mc Cormick B, Ellsworth RM, Abramson D, et al. Results of External Beam
Radiation for Children with Retinoblastoma: A Comparison of Two Techniques. J.
Pediatr. Strabismus 26: 239-243, 1989.
- Brooks HL, Meyer D, Shields JA, Nelson LB, Fontanesi J. Removal of
Radiation- Induced Cataracts in Patients Treated for Retinoblastoma. Arch.
Ophthalmol. 108: 1701- 1708, 1990.
- Mahoney MC, Burnett WS, Majerovics A, Tanenbaum H. The Epidemiology of
Ophthalmic Malignancies in New York State. Ophthalmology 97: 1143-1147, 1990.
- Kingston J, Plowman PN, Hungerford JL. Ectopic Intracranial
Retinoblastoma in Chilhood. Br. J. Ophthalmol. 69: 742-748, 1985.
- Redler LD, Ellsworth RM. Prognostic Importance of Choroidal Invasion in
retinoblastoma. Arch. ophthalmol. 90: 294-296, 1973.
- He W, Hashimoto H, Tsuneyoshi M, et al. A Reassessment of Histologic
Classification and An Immunohistochemical Study of 88 Retinoblastomas. Cancer
70: 2901-2908, 1992.
- Ellsworth RM. Treatment of Retinoblastoma. Trans. New Orleans Acad.
Ophthalmol 34: 55-59, 1986.
- Migdal C. Bilateral Retinoblastoma: The Prognosis for Vision. Br. J.
Ohthalmol. 67: 592-595, 1983.
- Amendola BE, Lamm FR, Markae AM, Karlsson UL, Shields J, Shields CL,
Augsburger J, Brady LW, Woodleigh R, Miller C. Radiotherapy of Retinoblastoma: A
Review of 63 Children Treated With Diferent Irradiation Techniques. Cancer 66:
21-26, 1990.
- Haye C, Schlinger P, Calle R, et al. Traitement Conservateur des Tumeurs
de la Rétine a L´Institut Curie. Bull. Cancer 73: 260-270, 1986.
- Stallard HB. The Treatment of Retinobalstoma. Mod. Probl. Ophthalmologica
7: 149-173, 1968.
- Thompson RW, Small RC, Stein JJ. Treatment of Retinoblastoma. Am. J.R.
114: 16-23, 1972.
- Messmer EP, Heinrich T, Höpping W, DE Sutter E, Havers W, Sauerwein W.
Risk Factors for Metastases in Patients with Retinoblastoma. Ophthalmology 98:
136-141, 1991.
- Howarth GM. Ocular Effects of Radiation and Photocoagulation. Arch.
Ophthalmol. 76: 7-10, 1966.
- Alberti W, El-Hifnawi S, Foerster MH, Bornfeld N. Late Effects After
Fractionated External Beam Therapy of Minipig Eyes in the Retina and Optic
Nerve. Int. J. Radiat. Oncol. Biol. Phys. 19: 158-159, 1990.
- Albert, DM. Historic Review of Retinoblastoma. Ophthalmology 94: 654-662,
1987.
- Schipper J, Tan K, Van Peperzeel H. Treatment of Retinoblastoma by
Precision Megavoltage Radiation Therapy. Radiother. Oncol. 3: 117-132, 1985.
- Merrian GR, Focht EF. A Clinical Study of Radiation Cataracts and the
Relationship to Dose. Am. J. Roentgenol 77: 759-785, 1957.
- Mc Faul PA, Bedford MA. Ocular Complications After Therapeutic
Irradiation. Br. J. Ophthalmol. 54: 237-247, 1970.
- Egbert PR, Donaldson SS, Moazed K, Rosenthal AR. Visual Results and
Ocular Complications Following Radiotherapy for Retinoblastoma. Arch.
Ophthalmology 96: 1826-1830, 1978.
- Egbert PR, Fajardo LF, Donaldson SS, et al. Posterior Ocular
Abnormalities After Irradiation for Retinoblastoma: A Histopsthological Study.
Br. J. Ophthalmol. 64: 660-665, 1980.
- Ellsworth RM. Retinoblastoma. Mod. Probl. Ophthalmol. 18: 94-100, 1977.
- Shukovsky W, Fletcher GH. Retinal and Optic Nerve Complications in a High
Dose Irradiation Technique of Ethmoid Sinus and Nasal Cavity. Radiology 104:
Ellsworth R.M. 629-634, 1972.
- Parsons J, Fitzgerald CR, Hood CI, et al. The Effects of Irradiation on
the Eye and Optic Nerve. Int. J. Radiat. Oncol. Biol. Phys. 9: 609-622, 1983.
- Chan RC, Shukovsky LJ. Effects of Irradiation on the Eye. Radiology 120:
673-675, 1976.
- Reese AB, Merriam GR, Martin HE. Treatment of Bilateral Retinoblastoma by
Irradiation and Surgery. Am. J. Ophthalmol. 32: 175-190, 1949.
- Cohen SR, Bartlett SP, Whitaker LA. Reconstruction of Late Craniofacial
Deformities After Irradiation of the Head and Face During Chilhood. Plastic
Reconstr. Surg. 86: 229-237, 1990.
- A Hervás Morón. Retinoblastoma: Influencia de los factores clínicos y
terapéuticos en el control local, supervivencia y conservación de la visión.
Tesis Doctoral. Universidad Autónoma de Madrid, Facultad de Medicina. 1995.
- A Hervás, A de la Torre, F Valcárcel, MI González García-Cuéllar, E
Polo, MC Paredes, G Aragón. Conservative treatment of the retinoblastoma with
irradiation. Radiotherapy and Oncology 1996, 40:s202.
- A Hervás, F Valcárcel, A de la Torre, G Aragón. Tratamiento
conservador del retinoblastoma con irradiación. Oncología 1996, 19:57-104
(Abstr nº O-23).
- A Hervás, A de la Torre, F Valcárcel, MI González García-Cuéllar, E
Polo, L Núñez, G Aragón. Retinoblastoma: Local control and prognostic
factors. Radiotherapy and Oncology 1996, 40:s202.
- A Hervás, F Valcárcel, A de la Torre, G Aragón. Retinoblastoma:
control local y factores pronósticos. Oncología 1995, 18:396-458 (Abstr nº
70).
- A Hervás, A de la Torre, F Valcárcel, G Aragón. Retinoblastoma:
supervivencia y factores pronósticos. Oncología 1995, 18:396-458 (Abstr nº
71).
- A Hervás, F Valcárcel, A de la Torre, G Aragón. Complicaciones a largo
plazo del tratamiento en el retinoblastoma. Oncología 1996, 19:57-104 (Abstr
nº P-22).
- A Hervás, A de la Torre, F Valcárcel, G Aragón. Conservación del
globo ocular y agudeza visual tras el tratamiento del retinoblastoma con
irradiación. Oncología 1995, 18:396-458 (Abstr nº 72).
- Gallie BL, Budning A, DeBoer G, et al. Chemotherapy with focal therapy
can cure intraocular retinoblastoma without radiotherapy. Arch. Ophthalmol.
1996, 114:1321-1328.
- Kingston JE, Hungerford JL, Madreperla SA, Plowman PN. Results of
combined chemotherapy and radiotherapy for advanced intraocular retinoblastoma.
Arch. Ophthalmol. 1996, 114:1339-1343.
- Murphree AL, Villablanca JG, Deegan WF III, et al: Chemotherapy plus
local therapy in the treatment of intraocular retinoblastoma. Arch. Ophthalmol.
1996, 114:1348-1356.
- Shields CL, De Potter P, Himelstein BP, Shields JA, Meadows AT, Maris JM.
Chemoreduction in the initial management of intraocular retinoblastoma. Arch.
Ophthalmol. 1996, 114:1330-1338.
|