|
INTRODUCCIÓN
El retinoblastoma puede originarse de cualquiera capa de la retina sensorial
y en su desarrollo puede presentar diferentes patrones.
Retinoblastoma Endofítico:
El tumor crece hacia el interior del globo
ocular hacia la cavidad vítrea (figuras 1A y 1B) y generalmente la retina no
está desprendida.

Figura 1. A) Aspecto macroscópico de un retinoblastoma endofítico.
B) Imagen microscópica de un retinoblastoma de crecimiento endofítico. H.E.
(15x).
Retinoblastoma Exofítico:
el crecimiento se realiza hacia el espacio
subretinal y desprende la retina (figuras 2A y 2B).
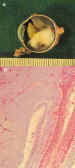
Figura 2. A) Aspecto macroscópico de un retinoblastoma exofítico
con desprendimiento total de retina. B) Confirmación histológica de este
patrón. GFAP (60x).
Retinoblastoma Mixto:
la mayoría de los tumores adoptan este patrón,
combinanado ambos patrones de crecimiento.
Retinoblastoma Infiltrativo difuso:
El tumor en su crecimiento produce un
engrosamiento difuso de la retina sin que se observen masas tumorales.
Frecuentemente sobretodo en un Retinoblastoma endofítico se produce una
diseminación vítrea que puede empeorar el pronóstico (figura 3).

Figura 3. Imagen macroscópica de un retinoblastoma endofítico con
diseminación vítrea.
Citológicamente en el retinoblastoma se encuentran 2 tipos de células
diferenciadas e indiferenciadas que configuran distintos patrones histológicos
que tienen repercusión pronóstica.
El Retinoblastoma indiferenciado está compuesto por una proliferación
difusa en sábana de células semejantes a las de la retina embrionaria que no
muestran evidencia de maduración. Son células pequeñas, redondas o
poligonales, con núcleos hipercromáticos, irregulares frecuentemente en
mitosis a veces de carácter atípico y escaso citoplasma (figura 4).

Figura 4. Retinoblastoma indiferenciado. Proliferación celular
difusa con atipia citológica y ausencia de diferenciación. H.E. (400x).
El Retinoblastoma diferenciado es menos frecuente y casi nunca es una forma
pura, la diferenciación se traduce no sólo en la formación de rosetas que
representan una diferenciación hacia fotorreceptores sino también en la
aparición de células semejantes a las células bipolares. Muchos autores
admiten que los retinoblastomas diferenciados tienen un mejor pronóstico (1).
En las rosetas de Flexner-Wintersteiner se observan células cuboideas o
columnares que rodean una luz central que contiene glicosaminoglicanos,
delimitada por una membrana eosinófila retráctil, que ultraestructuralmente
son barras terminales semejantes a la membrana limitante externa de la retina
normal. Los núcleos de las células son basales y se orientan hacia la luz
(figura 5).
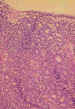
Figura 5. Retinoblastoma diferenciado con presencia de rosetas de
Flexner-Wintersteiner.
Menos frecuentemente se forman rosetas desprovistas de luz (rosetas de
Homer-Wright), donde las células tumorales rodean una malla fibrilar (figura
6), son menos especificas que las anteriores, pues aparecen en neuroblastomas y
meduloepiteliomas.
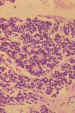
Figura 6. Rosetas de Homer-Wrigh desprovistas de luz central. H.E.
(400x).
En algunos Retinoblastomas bien diferenciados se observan un fallo en la
diferenciación de fotorreceptores que en lugar de delimitar estructuras
circulares, aparecen en una disposición li neal, que se asemeja a un «ramo de
flores», «fleurettes», son estructuras eosinófilas compuestas por grupos de
células tumorales con prolongaciones eosinófilas en forma de pera que se
proyectan hacia una membrana fenestrada (figura 7).

Figura 7. Grupo de células tumorales con prolongaciones
eosinófilas que se agrupan en «fleuretes». H.E. (400x).
La pseudoroseta es un término confuso que no tiene valor pronóstico. Las
células presentan una disposición semejante a las rosetas, y pueden
corresponder a:
— Células viables alrededor de vasos.
— Focos de tejido necrótico, con masas de células viables.
— Formas incompletas de rosetas de Flexner-Wintersteiner.
Otro tipo peculiar de diferenciación célular descrita más recientemente
(1) es una célula de tamaño un poco mas grande, de núcleo pequeño redondo y
central, con citoplasma amplio y poligonal, que se asemeja a la célula bipolar
de la retina normal y se dispone en grupos o nidos. Estas células como los
rosetas de Flexner-Wintersteiner indicarían una marcada diferenciación (figura
8).
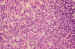
Figura 8. Células de citoplasma claro, semejantes a las células
bipolares de la retina H.E. (400x).
Los retinoblastomas diferenciados, suelen expresar positividad para la
sinaftofisina (figura 9).

Figura 9. Retinoblastoma diferenciado con presencia de rosetas y
sinaptofisina intracitoplásmica positiva. SNS (400x).
La mayoría de los tumores muestran amplias áreas de necrosis, causadas por
isquemia o respuestas inmunológicas, que frecuentemente se acompañan de
calcificaciones (figura 10).

Figura 10. Áreas de necrosis en un retinoblastoma no tratado H.E.
(150x).
El retinoblastoma puede extenderse a lo largo del nervio óptico, hacia el
cerebro, o las células neoplásicas pueden penetrar a través del espacio
subaracnoideo que rodea al nervio. La infiltración neural puede ser
pre-laminar, laminar o post-laminar.
El riesgo de metástasis es elevado si la invasión del nervio es
post-laminar (figura 11) (2,3).

Figura 11. Infiltración postlaminar del nervio óptico. Tricrómico
de Masson (150x).
También puede producirse una diseminación extra-ocular a través de los
canales esclerales que contienen vasos y nervios. La invasión focal de la
coroides no parece modificar el pronóstico si la invasión es masiva lo empeora
(4) (figura 12).

Figura 12. Infiltración focal de la coroides. H.E. (30x).
MATERIAL Y MÉTODO
Se estudian 13 casos de retinoblastoma (dos de ellos pertenecen a un mismo
paciente), tratados con quimioterapia y terapias asociadas, que fueron
enucleados por complicaciones derivadas del tratamiento.
En todos los casos se estudió el porcentaje de tumor viable, después del
tratamiento y en el caso de persistencia tumoral el grado de diferenciación.
Se valoró la intensidad de la necrosis, la presencia de calcificaciones y la
existencia de fibrosis que sustituye al tejido tumoral. Asimismo también se
estudió la proliferación glial acompañante y la presencia de histiocitos en
los focos de fibrosis.
En los tumores indiferenciados se valoró el grado de atipia citológica y el
número de las mitosis y en los tumores diferenciados las rosetas de Flexner
Winterteiner, las rosetas de Homer-Wright, las «fleuretes», la diferenciación
bipolar y la existencia de pseudo-rosetas.
En cada caso se estudió la proporción de diferenciación o
indiferenciación tumoral y algunos fueron seleccionados para estudios
inmunohistoquímicos de: sinaptofisisna (SNS), enolasa neuronal específica (NSE),
S100, y proteina glio-fibrilar (GFAP). En todos los casos se estudió el índice
de proliferación celular utilizando el anticuerpo MIB-1 que reacciona con el
antígeno nuclear Ki-67.
Se estudió el nervio óptico para valorar la existencia de infiltración
preliminar, laminar o post-laminar y también fueron revisadas las envolturas
oculares para localizar infiltraciones tumorales.
Los ojos enucleados mostraron diferentes patrones de regresión y fueron
agrupados según el siguiente esquema (tabla 1).

Regresión total:
No existe tumor viable en la masa tumoral. Pueden
existir tumores múltiples microscópicos a través de la retina que fueron
etiquetados como Regresión tipo X. En casos negativos se tipifica la lesión
como Regresión Tipo 0.
Regresión parcial:
Existe tumor viable en una proporción del 10-20%, la
regresión se acompaña de fibrosis, calcificaciones, proliferación glial y
presencia focal de histiocitos en algunos casos, la necrosis es mínima o no
existe.
— RPD: El tumor persistente está diferenciado.
— RPID: El tumor persiste indiferenciado.
— RPO: No existen tumores microscópicos múltiples.
— RPX: Existen tumores microscópicos múltiples.
Regresión mínima:
El tumor persiste en mayor proporción y se acompaña
de abundante necrosis y calcificaciones, no existe o es mínima la fibrosis, la
proliferación glial y la presencia de histiocitos.
El tumor puede ser diferenciado (D), indiferenciado (ID), con tumores
múltiples microscópicos (X) o sin éstos (O).
Regresión combinada:
Se combinan diferentes patrones bien en la misma
masa tumoral o en distintas proliferaciones tumorales.
RESULTADOS
La regresión total, con ausencia de tumor viable, sólo se observó en un
caso (caso n.º 9). La regresión fue total pero se observaron tumores
multicéntricos en el resto de la retina que no respondieron al tratamiento y
que no mostraron rasgos de diferenciación, observándose a este nivel un
elevado índice de proliferación celular con el Ki-67. Por el contrario la masa
tumoral fue absolutamente negativa con el Ki-67 y marcadamente positiva con la
proteina gliofibrilar (figuras 13, 14A, 14B y 15).

Figura 13. Regresión total tumoral existiendo en su lugar un tejido
conjuntivo con marcada fibrosis y presencia de calcificaciones (caso n.º 9)
H.E. (15x).
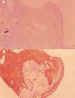
Figura 14. A) La ausencia de tumor viable se confirma con la
negatividad del marcador de proliferación celular (caso n.º 9). Ki 67 (60x).
B) La proliferación glial acompañante presenta positividad con la técnica de
proteína ácida gliofibrilar (caso n.º9).

Figura 15. Foco de retinoblastoma multicéntrico microscópico a
nivel de retina (caso n.º 9). H.E. (200x).
En 5 retinoblastomas se observó regresión parcial. El tumor persistió en
una proporción del 10-20% y mostró signos de diferenciación en 4 de ellos
(casos 2, 3, 4, 11) (figuras 16A, 16B y 17); en los 3 primeros se observaron
crecimientos múlticentricos microscópicos. Sólo en un caso (caso 5), el tumor
fue totalmente indiferenciado y también presentó un patrón de crecimiento
multicéntrico.
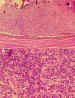
Figura 16. A) Regresión incompleta parcial del tumor. Se observa
persistencia del retinoblastoma con áreas de diferenciación (caso n.º 3).
H.E. (400x). B) A mayor aumento se observan rosetas de Flexner-Wintersteiner
(caso n.º3). H.E. (400x).
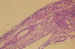
Figura 17. En áreas focales se identifican histiocitos de
citoplasma espumoso (caso n.º2). H.E. (200x).
Cinco casos respondieron al tratamiento con predominio de la necrosis, en
algunos existían calcificaciones, pero la fibrosis y otras respuestas
acompañantes eran mínimas. Este tipo de regresión es el que hemos llamado
mínima, en la que existe tumor viable, en mas del 20%. En todos el tumor es
indiferenciado y presenta un marcado índice de proliferación celular con el
Ki-67 (figuras 18 y 19). Dos de los casos (casos 10 y 13), mostraron un
crecimiento masivo, ocupando el tumor la totalidad de la cámara vítrea, y en
ambos casos infiltraban el nervio óptico, pre-laminar en el caso 10 y
post-laminar en el caso 13, en éste último existía infiltración coroidea. En
los 3 casos restantes (casos 1, 7 y 12) el crecimiento no era masivo, pero
existía tumor viable en porcentaje elevado y tumores microscópicos
multicéntricos que tampoco respondiera al tratamiento, y uno de los casos (caso
n.º 7) existía infiltración prelaminar del nervio óptico e infiltración
escleral.
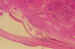
Figura 18. Retinoblastoma masivo que ocupa la cámara vítrea con
mínima regresión (caso n.º10). H.E. (15x).

Figura 19. Retinoblastoma indiferenciado que muestra un elevado
índice de proliferación celular. Ki 67 (400x).
En dos casos se encontró el tipo de regresión que hemos llamado combinada,
se trataba de casos que mostraban los patrones descritos anteriormente. En el
caso n.º 6 existían dos masas tumorales (figura 20), una de ellas no
respondió al tratamiento, sólo se observó necrosis, la otra presentó una
regresión total con negatividad del Ki 67 (figuras 21A y 21B). Por tanto se
combinó un patrón de regresión mínima con otro de regresión total. En el
caso n.º 8 se combinó una regresión parcial del tipo mínima. En ambas masas
tumorales el tumor persistio indiferenciado y existían tumores multicéntricos
múltiples (figura 22).

Figura 20. La regresión es total en la masa tumoral situada a la
izquierda de la fotografía, la masa tumoral situada a la derecha corresponde a
un retinoblastoma que no muestra signos de regresión (caso n.º 6) H.E. (15x).
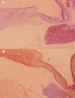
Figura 21. A) La masa tumoral que ha regresado es negativa con el
marcador de proliferación tumoral, por el contrario la masa tumoral viable es
intensamente positiva. Ki 67 (400x). B) El marcador de la proliferación glial
ofrece resultados inversos (caso n.º6) GFAP (30x).

Figura 22. Focos multicéntricos indiferenciados a nivel de la
retina (caso n.º8) H.E. (15x).
La tabla 2 adjunta muestra los resultados globales de los casos revisados.

DISCUSIÓN
Los patrones de regresión clínicos tras el tratamiento con radioterapia
están ampliamente descritos en la literatura, tanto con la braquiterapia en
placas epiesclerales como en la radioterapia externa. Por el contrario, los
resultados histológicos obtenidos tras el tratamiento quimioterápico son
escasos, y salvo el trabajo de Bechrakis (5), no han sido publicados.
Creemos que el estudio de series más amplias, la valoración del tumor
viable mediante marcadores de proliferación celular y la utilización de
tratamientos locales para tumores residuales, pueden contribuir al avance del
tratamiento del retinoblastoma.
BIBLIOGRAFÍA
- Wei H, Hashimoto H, Tsuneyoshi M. A reassessment of histologic
classification and an inmunohistochemical study of 88 retinoblastomas. Cancer
1992; 70: 2901-2908.
- Shields C, Shields JA, Baez K, Cater JR, Depotter P. Optic nerve invasion
of retinoblastoma. Metatasis potential and clinical risk factors. Cancer 1994;
73: 692-698.
- Khelfaqui F, Validire P, Auperin A, Quintana E et al. Histopathologic risk
factors in retinoblastoma. Cancer 1996; 77: 206-1213.
- Yanoff M, Fine BS. Retinoblastoma. Ocular pathology. Lippincott Company
1994; 18: 684-704.
- Bechrakis NE, Bornfeld N, Schuler A, Coupland MBS, Henze G, Foerster MH.
Clinipathologic features of retinoblastoma after primary chemoreduction. Arch
Ophthalmol, 1998; 116: 887-893.
|