|
EVOLUCIÓN HISTÓRICA Durante muchos años se han estudiado varios productos para inyectar en los músculos extraoculares como una alternativa a la corrección quirúrgica del estrabismo. Se utilizó el alcohol, los anestésicos locales, la alfabungarotoxina, el aminobarbital, el DFP y la toxina botulínica A (TBA). Unos tras otros fueron abandonándose, unas veces debido a que el efecto era muy débil o pasajero, y otras debido a su toxicidad local o sistémica. Finalmente se eligió la toxina botulínica A, debido a su gran potencia paralizante, y a la facilidad de su aislamiento y manipulación. En la actualidad continúan los estudios para la utilización de otros serotipos de toxina botulínica y de otros productos como por ejemplo la lidocaína o la colagenasa, entre otros. La técnica de inyección de la TBA para el tratamiento del estrabismo fue introducida, de manera experimental, por Alan Scott, en 1973 (74). Los primeros resultados se presentaron en monos. En 1976 se inyectó por primera vez en el hombre y es en 1981 cuando se aprobó por la FDA y la NEI como tratamiento para el estrabismo (77), el blefaroespasmo (1,2,17,79), y las parálisis oculomotoras (3,5,6,16,23,25,27,28,67, 80). Posteriormente se han aprobado nuevas indicaciones terapeúticas en oftalmología y en otras disfunciones musculares no oculares (10,13,14, 19-22,24,49,56). La aplicación práctica en la clínica oftalmológica se desarrolla en la década de los 80 y 90. Al principio se utilizó en todo tipo de estrabismos, obteniéndose una eficacia bastante deficiente. Poco a poco se fue analizando la validez en distintos tipos de estrabismo, a distintas edades, y se fue mejorando la técnica, obteniéndose unos resultados mucho más prometedores. Actualmente se ha convertido en una técnica adicional en el manejo del estrabismo y de las parálisis oculomotoras (48).
FARMACOLOGÍA La toxina botulínica A es una de las 8 neurotoxinas producidas por el clostridium botulinum. Se utiliza ésta porque es más fácil de aislar y cristalizar, por su potencia y por su gran eficacia en el hombre. La molécula tiene dos cadenas, una ligera y una pesada, unidas por un puente disulfuro. La subunidad H1 es la que se une a la terminación nerviosa, a un receptor específico para la toxina botulínica. La subunidad H2 tiene capacidad antigénica, pero no tóxica (7,74). La TBA actúa sobre cada terminación nerviosa. A los 20 a 90 minutos se produce un proceso de endocitosis de una parte de la TBA y, tras esto, se inhibe la liberación del neurotransmisor (acetilcolina) de las vesículas en la terminación nerviosa. Posteriormente se produce una disminución gradual de los potenciales terminales. En el mercado hay dos tipos de TBA. La primera fabricada fue la tipo Wisconsin, creada por el Prof. Schantz del U.S. Army Chemical Warfare Department, actualmente comercializada por el Laboratorio Allergan (Botox) (72). Posteriormente, el Laboratorio Porton desarrolló la toxina «Porton Down» (Dysport) (61), actualmente comercializada por el laboratorio Ipsen Pharma. Las dos TBA se purifican por técnicas ligeramente distintas y, aunque ambas tienen semejante dosis letal media o DL/50, en la práctica clínica tiene mayor toxicidad la de tipo Wisconsin, de manera que 1 unidad Botox equivale a 4 unidades Dysport (70). La TBA se distribuye congelada y así puede durar hasta 3-4 años. Para inyectarla, se reconstituye con solución salina. Se aconseja utilizarla en las primeras 6 horas, ya que, posteriormente, empieza a perder actividad. De todas formas, hay estudios en los que se demuestra que se puede mantener durante 15 días en la nevera sin que pierda eficacia. Otros encuentran una disminución progresiva de la potencia a partir de las 12 horas de la elaboración de la dilución, siendo la pérdida de aquélla, a las dos semanas, del 68,9% (30) (figuras 1 y 2).
La DL/50 de la TBA para un hombre de 70 Kg es de 5.000 Unidades, es decir, 50 viales. La dosis que se utiliza para el tratamiento del estrabismo dista mucho de producir toxicidad. Se utiliza una pequeña fracción del vial, generalmente entre 2,5 y 10 Unidades. El efecto de la TBA sobre las terminaciones nerviosas se puede antagonizar con la asparagina, la aminopiridina, el hidrocloruro de guanidina, y el zinc. Incluso se ha fabricado una antitoxina (81,86), que bloquea casi completamente el efecto de la TBA si se inyecta en los 30 minutos siguientes a la administración de la toxina y que, actualmente, puede aplicarse en casos concretos.
MECANISMO DE ACCIÓN EN EL ESTRABISMO A los 1-3 días de la inyección de la TBA se produce una parálisis muscular transitoria. Progresa hasta un máximo que se encuentra hacia los 10 días. El efecto parético dura entre uno y tres meses. Al cabo de este tiempo, el músculo recupera lentamente su función contráctil y comienza a estabilizarse el resultado en los cuadros de estrabismo. El tiempo de duración del efecto es variable de un paciente a otro, en función del tipo de estrabismo, de la dosis que se utilice, así como de si se inyecta en un solo ojo o en los dos simultáneamente (33,34) (figuras 3 y 4).
Al inyectar TBA en un músculo extraocular se induce un desequilibrio de fuerzas entre los músculos antagónicos. Este desequilibrio es transitorio. Se produce una hipercorrección de la desviación, también transitoria, que poco a poco va disminuyendo a medida que el músculo recupera la actividad contráctil. Este periodo de hipercorrección es fundamental para la resolución del estrabismo. Si ha sido suficientemente duradero, se obtiene un buen resultado en un porcentaje elevado de casos (33,34,36). En otros, vemos que la alineación es pasajera y que recidiva el ángulo aunque, en general, en menor cuantía que al principio. En ese momento se debe plantear si se debe reinyectar o corregir el defecto residual mediante cirugía. Al principio se pensaba que el efecto se basaba, exclusivamente, en modificaciones mecánicas, y que la relación dosis-respuesta debería ser bastante lineal. Hoy pensamos que influyen varios factores en cada individuo y, por ello, la respuesta puede ser variable: • Factores mecánicos: durante el periodo de hipercorrección, el músculo inyectado está relajado y elongado, y el antagonista, contraído. Este desequilibrio temporal puede inducir cambios de fuerzas, de la relación longitud-tensión, incluso con reorganización ultraestructural de las sarcómeras. Estas modificaciones pueden ser variables en cada caso, en función de varios factores: la duración de la hipercorrección, el grado de contractura o espasmo inicial, el grado de fibrosis, la edad del individuo y el tipo de músculo (recto medio, recto lateral, etc.). • Factores sensoriales: modificaciones que se inducen durante el periodo de hipercorrección y que varían según el tipo de trastorno oculomotor. • Factores propioceptivos. • Factores individuales de respuesta frente a la TBA.
TÉCNICA DE INYECCIÓN 1. Información al paciente y consentimiento informado El paciente (o sus padres o familiares) que va a ser sometido a tratamiento mediante TBA, debe ser informado con anterioridad de las características de dicho tratamiento. Es un aspecto importante al que dedicamos más tiempo que en los casos de cirugía. Se debe explicar en qué consiste la técnica, si se va a realizar en quirófano, el tipo de anestesia que se va a usar, cuándo comienza el efecto, las molestias pasajeras que se pueden producir y la posibilidad de reinyección. En general, se deben indicar las ventajas e inconvenientes, así como los efectos indeseables (43,69,88). Se debe incidir en: • Los efectos sensoriales pasajeros: El paciente tiene problemas de desorientación y diplopía. En adultos suele durar un mes y lo suelen tolerar bastante mal, mientras que en los niños dura pocos días y en la mayoría no plantea problemas. A los adultos hay que avisarles que tendrán problemas para conducir durante un mes. • Los efectos estéticos pasajeros: la hipercorrección es necesaria y además debe ser duradera; la ptosis palpebral es pasajera. Para disminuir los problemas sensoriales y estéticos, así como para prevenir la ambliopía, indicamos a los pacientes que es muy probable que tengan que ir con un ojo tapado durante un mes, por regla general. • Las complicaciones: pequeñas hemorragias subconjuntivales por el paso de la aguja a través de los tejidos y que se resuelven sin tratamiento; hemorragias retrobulbares, con muy baja frecuencia (0,5 por mil pacientes); perforación ocular, también con muy baja frecuencia (0,5 por mil); así como desviaciones verticales inducidas por la inyección, que pueden ser muy duraderas y que, en rara ocasión, requerirán una cirugía.
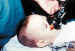
2. Material (figura 5)
• Electromiógrafo o amplificador de electromiografía (EMG). Se debe probar el EMG y la punta de los electrodos. Hay autores que no lo utilizan. Los grandes aparatos de EMG son mejores que los pequeños amplificadores pero, desde el punto de vista práctico, la mayoría utilizamos el amplificador de EMG (43,52,66,89). • Electrodos para el EMG. • Agujas especiales de EMG: 27 G, monopolares. En el caso de no usar EMG, se hace con agujas de insulina (figura 6).
• Jeringas de insulina. • TBA: criofilizada. Los viales de Botox contienen 100 unidades internacionales (UI) y, los de Dysport, 500 UI. Se pueden inyectar varios enfermos en una misma sesión (30). • Solución salina al 0,9%, sin conservantes. • Separador palpebral de colibrí. • Pinzas con dientes. Recientemente ha aparecido una pinza especial para sujetar el músculo (figura 7) (61).
• Anestésico (tópico o general). • Fenilefrina: hay autores que instilan una gota de fenilefrina antes de la inyección para producir una vasoconstricción y tener menor sangrado. Al principio la instilábamos siempre pero, actualmente, sólo lo hacemos en pacientes con ojos muy hiperémicos.
3. Anestesia La anestesia puede ser tópica o general. La elección depende de la edad y de la colaboración del paciente. A partir de los 6-7 años hay niños que pueden colaborar sin necesidad de anestesia general. Nosotros, como norma, utilizamos la anestesia tópica a partir de los 9-10 años y, por debajo de esta edad, empleamos la anestesia tópica y la general. La elección depende de cada especialista y de cada caso. Si se va a hacer con anestesia local, se necesita demostrar confianza, explicar al paciente cada paso, según vamos actuando, demostrarle que se le puede tocar sin hacerle daño. Por debajo del año de edad, hay facultativos que tampoco usan anestesia general y sujetan al niño de la misma manera que se hace en los sondajes de la vía lagrimal (58). En el caso de hacerlo en niños pequeños sin anestesia general, se aconseja no utilizar el separador de párpados; un ayudante nos los abrirá con sus manos (43). • Anestesia tópica: Se utiliza clorhidrato de tetracaína, o proparacaína: 1 gota cada 5 minutos, 3 a 4 veces, en ambos ojos. • En pacientes con grandes cicatrices y músculos fibróticos, a pesar de la anestesia tópica, la inyección es más dolorosa. En estos casos se puede instilar primero anestésico tópico y, posteriormente, 0,1-0,4 ml de lidocaína subconjuntival en el área perimuscular. Esta inyección no afecta a la calidad del registro EMG, ni tampoco al efecto de la TBA. • Anestesia general: Se deben utilizar productos que no relajen el músculo oculomotor, si se quiere usar el electromiógrafo. Es aconsejable asociar anestesia tópica, a pesar de realizar la inyección mediante anestesia general, ya que así disminuyen los estímulos dolorosos y se requiere menor profundidad anestésica. Los productos que se utilizan son los siguientes:
Cuando inyectamos TBA bajo anestesia general, los pacientes tendrán un control electrocardiográfico y deberán ser atropinizados previamente. Otros autores no atropinizan y canalizan una vía endovenosa de manera sistemática. En pacientes adultos muy aprensivos, en ocasiones hemos prescrito un ansiolítico previo a la inyección.
4. Técnica de inyección (figura 9)
Es importante tener todo el material preparado, la dosis diluida, y el protocolo del músculo que se piensa inyectar. El ambiente debe ser relajado. Si se va a inyectar con anestesia tópica, el paciente se puede tumbar en una camilla, o bien puede hacerse en el sillón de exploración de la consulta, reclinado: — Se colocan los electrodos en la frente del paciente y se engancha la aguja en el terminal del EMG. Se puede limpiar previamente la frente con alcohol, o añadir pasta de contacto en algún caso para mejorar la adhesión. Con ciertos aparatos de EMG se debe colocar el electrodo en el centro de la frente para inyectar el músculo recto medio, y en la zona frontoparietal para inyectar el músculo recto lateral homolateral. En otros se utilizan dos electrodos, uno a cada lado de la frente. — Se coloca el colibrí. Para inyectar los músculos rectos verticales y el músculo oblicuo inferior, es mejor que un ayudante abra el párpado manualmente. También en niños pequeños es preferible, en ocasiones, no utilizar el separador. — Si el paciente está despierto, se le pide que mire en dirección opuesta al músculo que se va a inyectar. Si el procedimiento se realiza con anestesia general, cogemos una buena presa de conjuntiva y hacemos el mismo movimiento, de forma pasiva. Se introduce la aguja a través de la conjuntiva, tangente al globo, en dirección a la pared orbitaria, por encima o por debajo del reborde muscular, para tener menor resistencia. Cuando se han vencido las resistencias de la cápsula de Tenon, se pide al paciente que mire al frente (en el caso de anestesia general soltamos la pinza que nos mantenía el ojo en la dirección contraria), e inclinamos la aguja hacia el fondo de la órbita apuntando al músculo, buscando el registro del EMG. Sus modificaciones se comprueban solicitando al paciente que dirija la mirada hacia los campos de acción del músculo a inyectar y de su antagonista, momento en el cual aumenta o disminuye dicho registro, respectivamente. Cuando la aguja está situada en el punto deseado, se inyecta el líquido lentamente, manteniendo unos segundos la punta en su posición, para evitar la difusión del líquido y, finalmente, se retira la aguja con lentitud.
La inyección de los músculos verticales se hace de manera parecida: • El músculo Recto Superior se puede inyectar por vía transpalpebral o transconjuntival. Cuando se inyecta, se produce una ptosis palpebral muy duradera. • Con el músculo Oblicuo Superior se tiene muy poca experiencia. Produce mucha ptosis y poco efecto (50). • Para inyectar el músculo Recto Inferior se puede escoger la vía transconjuntival o la transpalpebral. Si hay gran restricción es más fácil hacerlo por vía transpalpebral. Es importante diferenciarlo del músculo oblicuo inferior, que está muy próximo. El músculo recto inferior se localiza más posterior, dirigiendo la aguja ligeramente en sentido nasal, para evitar también al músculo recto lateral. Una vez que obtenemos el registro EMG, solicitamos al paciente que dirija su mirada hacia abajo, con lo que debemos notar un aumento del registro, mientras que, al mirar hacia arriba, éste disminuirá. Por el contrario, en el caso del músculo oblicuo inferior, el aumento y la disminución de la amplitud del registro se obtienen al hacer los movimientos contrarios. Inyectaremos la TBA suavemente para producir la menor difusión posible, manteniendo un tiempo la aguja para que el líquido bajo presión no difunda al retirarla. • El músculo Oblicuo Inferior se inyecta generalmente por vía subconjuntival, por el cuadrante inferotemporal. En este cuadrante lo encontramos en la zona anterior. Si profundizamos más con la aguja llegamos al músculo recto inferior. Se debe comprobar el registro EMG para diferenciar ambos músculos. También es aconsejable dejar un tiempo la aguja, por el mismo motivo citado.
4.1. Músculo que se inyecta En las endotropías del niño se inyecta, generalmente, en los dos músculos rectos medios. En el adulto, sólo en un músculo recto medio. Si hay un ojo en hipotropía es preferible inyectar el músculo recto medio de ese ojo. En las exotropías se inyecta en uno o en los dos músculos rectos laterales. En los estrabismos verticales se inyecta en el músculo recto superior, recto inferior, oblicuo inferior, o combinaciones de estos músculos, en función de cada cuadro. Hasta la fecha casi nadie aconseja inyectar en el músculo oblicuo superior.
4.2. Dosis Las dosis que empleamos con mayor frecuencia son de 2,5 a 5 UI de Botox®. En casos concretos utilizamos dosis inferiores o superiores. En general, para el tratamiento del estrabismo, el objetivo es obtener una hipercorrección duradera, por lo cual utilizamos dosis elevadas. En las parálisis oculomotoras en las que se quiera obtener un efecto muy suave y más llevadero, se puede inyectar menor cantidad, aunque tengamos que repetir la inyección.
4.3. Lugar de inyección en el músculo El lugar donde se debe poner la inyección en el músculo es motivo de debate. El mayor efecto se obtiene cuanto más próximos estamos a la unión neuromuscular, es decir, la unión del tercio medio con el tercio posterior del músculo. Sin embargo, las inyecciones posteriores tienen mayores efectos secundarios, debido a la difusión. Por ello, hay autores que prefieren ponerlas más anteriores.
4.4. Valor del electromiógrafo Otro motivo de debate es la necesidad o no de usar un EMG. Con el EMG localizamos mejor en el músculo el área de proximidad de la terminación nerviosa. El inconveniente es el coste del aparato. De todas formas, como se produce difusión alrededor del punto de inyección, probablemente con colocarlo en la zona sea suficiente, sobre todo para ciertos músculos como el recto medio, el cual, por otra parte, es más fácil de localizar una vez que se tiene experiencia. Para los demás músculos consideramos el EMG de gran utilidad. Se han ideado alternativas para inyectar sin EMG: • Técnica cerrada sin EMG: Con una torunda o esponjita empapada en anestésico se frota la conjuntiva en la región donde está el músculo y, finalmente, podemos «verlo» bajo transparencia (62). • Técnica abierta sin EMG: Inyección bajo visualización directa, haciendo un pequeño ojal en la conjuntiva (73).
INDICACIONES GENERALES Las indicaciones generales de la TBA son, fundamentalmente, los estrabismos no restrictivos y las parálisis oculomotoras (32-43). Cuando tengamos pacientes con músculos inelásticos o fibróticos, o cuando haya grandes cicatrices quirúrgicas, la indicación suele ser quirúrgica, ya que es más difícil de modificar la curva de elongación-tensión con la TBA y, si bien podría obtenerse una mejoría, se necesitaría repetir muchas veces las inyecciones. La indicación de TBA o de cirugía depende de varios parámetros: A) En los pacientes con estrabismo no paralítico el resultado depende fundamentalmente de la edad, del tipo de estrabismo y de la magnitud de la desviación inicial. Hay otros muchos factores que también se tienen en cuenta (tabla 1). La TBA es más eficaz en las endotropías que en las exotropías, y en los niños de menor edad que en los mayores. Ofrece mejores resultados cuanto menor es la magnitud del estrabismo. En grandes desviaciones se pueden obtener buenos resultados, pero para ello se necesita repetir más veces las inyecciones, con lo que se alarga el periodo de tiempo hasta obtener el resultado final.
B) En el tratamiento de las parálisis oculomotoras, la evolución del cuadro y el resultado dependen de la etiología, de la severidad de la afectación, del estadio evolutivo en que se encuentre, de si se trata de un cuadro unilateral o bilateral, del nervio afectado, y de los factores citados para los estrabismos no paralíticos (3,16,25,27,31) (tabla 1). Los cuadros agudos de etiología vascular o inflamatoria se vigilan por un periodo de 2 a 4 semanas. Si comienza una recuperación progresiva, se tendrá una actitud expectante. Si no se observa mejoría, se inyectará TBA en el músculo antagonista, para evitar contracturas y obtener una recuperación más precoz. Si la parálisis es de etiología traumática y el cuadro es más severo, la recuperación es mucho más lenta y suele apreciarse un deterioro progresivo. En estos casos tratamos con TBA desde el principio. En las parálisis subagudas y crónicas, la actitud que vamos a tener depende del grado de limitación, del tipo de parálisis, así como de otros factores, como son, el riesgo de isquemia del segmento anterior. Estos aspectos se tratarán en el capítulo dedicado a las parálisis oculomotoras. En el resto del presente capítulo daremos cierto protagonismo a las indicaciones de la TBA en las endotropías, por tratarse de la actuación terapéutica botulínica más frecuente, con diferencia, en el campo de los estrabismos no paralíticos ni restrictivos (11,32-43,55), si bien el apartado de «complicaciones» puede hacerse extensivo a toda la gama de aplicaciones. En los capítulos correspondientes a las otras formas de estrabismo, como las exotropías, las desviaciones verticales, o las reintervenciones, entre otras, se incidirá en el papel que juega la toxina en cada caso. Igualmente, al estudiar, pormenorizadamente, los diversos subtipos de endodesviación, en capítulos siguientes, se hará lo propio, de forma más específica.
INDICACIONES EN LAS ENDOTROPÍAS En diferentes estadísticas sobre la inyección de TBA en las endotropías, se obtiene un buen resultado en un 55-85% de los pacientes inyectados. La inyección bimedial de toxina botulínica corrige una media de 11,9±8,5° de la desviación de lejos y 13,4±7,8° de la desviación de cerca. Los resultados varían en función de las características del paciente y de la técnica de inyección (32-43,83). Es una técnica eficaz para el tratamiento del estrabismo concomitante; en aquellos casos en los que no se obtiene un buen resultado, el fracaso casi siempre es debido a una hipocorrección. Es muy infrecuente que el paciente quede hipercorregido, sucede en menos del 1%, cifra muy inferior al porcentaje que se obtiene con la cirugía. Esta ventaja existente frente a la cirugía es importante para ciertos cuadros, como las hipermetropías altas, las reintervenciones, las endotropías consecutivas, así como los cuadros en los que hay mayor riesgo de divergencia a corto o a largo plazo.
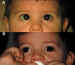
1. Endotropía congénita (figuras 10 y 11)
La TBA es una técnica muy eficaz para la corrección de este tipo de estrabismo en edades precoces de la vida (4,32-43,44,45,58). Para algunos, sólo está indicada si se aplica por debajo de los 6 meses de edad pero, para la mayoría, entre los cuales nos incluimos, también es eficaz en niños en edades más avanzadas. Para nosotros, la indicación de TBA va a depender de la edad del niño, de la magnitud de la desviación, de la refracción, y de la presencia de un estrabismo vertical asociado que deba ser intervenido quirúrgicamente. Nuestro protocolo actual es el siguiente: • Endotropía congénita en niños por debajo de los 18 meses de edad: Aconsejamos TBA frente a cirugía, siempre y cuando no tengan una desviación vertical importante que precise una cirugía vertical posterior, y se utilicen bajas dosis (2-2,5 UI). La inyección la indicamos a partir de los 3-4 meses de vida, siempre que se haya visto que se trata de una desviación permanente y/o progresiva. • A partir del año y medio-dos años: La indicación de TBA o cirugía depende de la magnitud del estrabismo horizontal, así como de la coexistencia de un estrabismo vertical que requiera cirugía:
• A partir de los 5-6 años: Las indicaciones de la TBA en la endotropía congénita se reducen a casos concretos y, en general, se indica la cirugía (18). • A veces encontramos situaciones intermedias, como por ejemplo estrabismos horizontales, con desviaciones verticales no muy intensas, en los que indicamos TBA. Con frecuencia, el estrabismo vertical puede compensarse, una vez que se ha corregido la desviación horizontal. Otra indicación para el uso de la TBA es la de pacientes con desviaciones verticales difíciles de evaluar, cuando van asociados a grandes desviaciones horizontales y tortícolis complejos, en los que podemos tratar en primer lugar con la TBA la desviación horizontal y, posteriormente, podemos plantear el cuadro vertical aislado, de una manera más precisa. La inyección en los pacientes con endotropía congénita la hacemos siempre bilateral, en el músculo recto medio de ambos ojos (32-35). La dosis más apropiada es motivo de debate. Cuando utilizamos dosis altas (5 UI) se obtiene una hipercorrección grande en cuanto a magnitud, que dura al menos 3-4 meses, lo que produce mejor resultado, horizontalmente. En cambio, dosis elevadas suelen provocar mayores efectos secundarios por difusión, y actualmente estamos estudiando el comportamiento de la desviación vertical disociada (DVD) en función de la dosis y el número de inyecciones que se aplican a cada edad. McNeer, en sus series, presenta menor incidencia de DVD, utilizando menor dosis en las inyecciones. Nosotros hemos utilizado generalmente 5 UI por músculo aunque, como hemos dicho, ahora nos inclinamos por disminuir sensiblemente la dosis en edades muy bajas (32-35,43). Una vez que el paciente vuelve a la ortoposición, se debe vigilar si recidiva la endotropía y reinyectar si aparece una endotropía superior a 4-5° antes de los 6 meses de evolución. Es importante repetir la refracción cuando recidiva la desviación, para valorar si la causa de la descompensación es un factor acomodativo asociado. Con frecuencia, la refracción ha variado en estos meses de desarrollo ocular y el factor acomodativo puede tener también mayor repercusión. Encontramos pacientes con pequeñas hipermetropías que, aparentemente, no modifican la refracción cuando existe una gran endotropía y que, posteriormente, tras la inyección de TBA precisan corrección óptica para vencer la desviación residual. Finalmente, encontramos cuadros de endotropía congénita que, tras la inyección de TBA o la cirugía de los músculos rectos medios, corrigen la desviación en posición de lejos, presentando una incomitancia lejos-cerca residual, con índice elevado de convergencia acomodativa-acomodación, que posteriormente se corregirá. También es importante vigilar la evolución de la DVD o de las disfunciones de los músculos oblicuos asociadas a la endotropía congénita y valorar la necesidad de una cirugía. La DVD es un trastorno oculomotor que acompaña a la mayoría de las endotropías congénitas. En distintas estadísticas se valora su frecuencia entre el 40 y el 95% de los casos. Nosotros la encontramos en la mayoría de los enfermos, aunque sea de forma leve. La DVD va manifestándose a lo largo de la evolución del niño, unas veces más pronto que otras, siendo en ocasiones difícil de evaluar y cuantificar en un niño pequeño con una gran desviación horizontal. En nuestros pacientes tratados con TBA hemos visto que, posteriormente, hemos necesitado operar la DVD en el 35-40% de los casos. En el caso de que la DVD sea severa, vigilamos un tiempo su evolución y, si se mantiene, se debe corregir quirúrgicamente, ya que si no, con frecuencia acaba descompensando también el estrabismo horizontal.
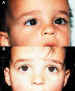
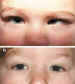
2. Endotropía adquirida (figuras 12 y 13)
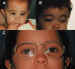
La TBA es de gran utilidad en las endotropías adquiridas, y el tratamiento de algunas de sus formas ofrece resultados que superan a los de la endotropía congénita. En distintos estudios en los que analizamos su eficacia, los resultados en cuanto a corrección horizontal oscilaban entre el 70 y el 85% de los casos (29-32-43). Nuestras indicaciones actuales son las siguientes: • Endotropía adquirida en niños de hasta 3-4 años, si la desviación es inferior a 20°. • De los 4 a 6 años, si la desviación es de hasta 15°, sobre todo si tienen un componente acomodativo asociado. • A partir de esta edad, la indicamos en desviaciones de hasta 8-10°, o en pacientes en que, por motivos especiales, no queramos plantear una cirugía. • Si hay un estrabismo vertical y horizontal, y el vertical es leve o moderado, éste se compensa con frecuencia cuando se corrige el horizontal con TBA. Esto suele suceder en las hiperacciones de los músculos oblicuos inferiores y, en menor grado, en la DVD o en las hiperacciones de los músculos oblicuos superiores. Si la alteración vertical es severa o el patrón alfabético es muy marcado, la alteración vertical se compensa en menor grado. En estos casos planteamos cirugía horizontal y vertical, simultáneas. • Si el niño presenta un componente acomodativo marcado, unido a una fuerte hipermetropía, preferimos indicar TBA, en lugar de cirugía, a pesar de que la desviación sea superior a los márgenes indicados anteriormente. La TBA ofrece resultados variables en los distintos tipos de endotropía adquirida: • Si existe cierto grado de visión binocular, los resultados son superiores (8,87). • Cuando existen restricciones o limitaciones en los movimientos oculares, se obtienen peores resultados y es necesario inyectar en más ocasiones. • Las microtropías que se descompensan en endotropía, tras una oclusión prolongada, responden con gran éxito a la inyección de la TBA (figura 14).
• Obtiene peores resultados en los ángulos muy variables, en las grandes incomitancias lejos-cerca. En cambio, en las incomitancias lejos-cerca pequeñas, sí se obtienen buenos resultados (figura 15).
• Ofrece peores resultados en las ambliopías muy profundas, aunque en estos casos tiene ventajas frente a la cirugía, sobre todo en los niños (figura 16).
• En las endotropías de los cuadros sensoriales (catarata congénita unilateral, patología del nervio óptico), aconsejamos inyección de TBA. No hay mucha experiencia al respecto. Aunque las series publicadas son muy pequeñas, puede presentar ventajas frente a la cirugía en niños, aunque parece que el ángulo residual es inestable. • En las endotropías de los niños con déficit psicomotor o enfermedades sistémicas tiene también su utilidad, ya que la evolución de la endotropía es muy variable en el tiempo. En estos cuadros la actitud terapeútica depende del tipo de estrabismo y del nivel de afectación físico y psíquico. La técnica de inyección es semejante a la de las formas congénitas. Las inyecciones son también bimediales. La dosis suele ser algo inferior y, en general, precisan menor número de inyecciones (repeticiones). En los adultos, la inyección se tolera peor. La diplopía y los problemas de proyección perturban más que en los niños. Por esta razón se administra la toxina en un solo ojo. También es importante revisar la refracción una vez que están alineados, para evitar la recidiva de la desviación (43).
3. Endotropías residuales (figura 17)
La TBA puede ser de utilidad en el ajuste postoperatorio precoz o tardío. La cirugía puede quedar con un estrabismo residual de forma inmediata, o aparecer como una descompensación a corto, medio, o largo plazo. Esta desviación puede ser del mismo tipo de estrabismo o en forma de hipercorrección. En el tratamiento, volvemos a tomar el caso como si se tratara de un paciente nuevo, pero con algunas precisiones. Se valora de nuevo la refracción y se analiza si la endotropía o la exotropía tienen limitaciones musculares a la elongación o ducción (42,43,57). • Fracaso quirúrgico inmediato (0-3 meses): Valoramos si el fracaso se debe a un protocolo quirúrgico incorrecto, a una impotencia muscular por deslizamiento o a una restricción exagerada debido a una resección excesiva.
• Cuando ha pasado mucho tiempo desde la cirugía: Puede tratarse de un estrabismo hipo o hipercorregido desde el principio, o de una descompensación tardía.
4. Indicación en otros procesos que pueden o suelen cursar con endodesviación Incluimos en este apartado un grupo de estrabismos y de pacientes cuyas características nos hacen adoptar decisiones particulares en cada momento. • Tratamiento crónico con TBA. En adultos con múltiples cirugías y estrabismos complicados, hay series de pacientes tratados con un número de entre 8 y 20 inyecciones y se ve que este proceder aumenta el tiempo entre las recurrencias. • Pacientes con diplopía tras la cirugía oftalmológica. En general los resultados son variables: En la cirugía de desprendimiento de retina, Scott refiere una incidencia de buenos resultados del 60% (84), y Petito y Buckley del 80%, debiendo inyectar con frecuencia 2 músculos. En la diplopía tras la inyección retrobulbar para la cirugía de la catarata, la inyección del músculo recto inferior ofrece alrededor del 60% de buenos resultados en algunas series (46,52,67). • En la oftalmopatía tiroidea, se administra en la fase aguda, con el objetivo de disminuir la diplopía y evitar que el músculo se retraiga aunque, cuando inyectamos el músculo recto inferior, el paciente se encuentra más incómodo. En la fase crónica el efecto es menor. Evita la cirugía hasta en el 25-30% de los casos (figura 18) (26,51,53,54,78).
• Pacientes con defectos psicomotores: Son enfermos en los cuales el estrabismo se modifica a lo largo de la infancia, la cirugía es menos predecible y, la anestesia general, en ocasiones con intubación, es problemática. En casos en los cuales creemos que se debe corregir el estrabismo en la infancia, aconsejamos la inyección de TBA (figura 19).
• Hemos utilizado TBA en el Síndrome de Duane con endotropía en niños pequeños. La endotropía se ha compensado durante un tiempo, pero al final la mayoría precisaron cirugía. • Pacientes con miastenia gravis. Tradicionalmente, la TBA estaba contraindicada por los neurólogos. Actualmente hay breves referencias con buena respuesta a la TBA. • Inyección de TBA como diagnóstico. En casos complejos de pacientes con una desviación horizontal y vertical grande con cirugías previas, el estudio de la desviación vertical se explora mejor, en ocasiones, tras la corrección horizontal con TBA. También la hemos utilizado como diagnóstico en pacientes con nistagmus y tortícolis complejos, horizontales y torsionales en los que, al paralizar una dirección de la mirada (por ejemplo el tortícolis horizontal), se evalúa la influencia sobre el otro componente (el torsional), y se puede plantear así la mejor forma de corregirlo (figura 20).
• En pocas ocasiones la hemos utilizado como diagnóstico de diplopía (65,88). • Como «demostración»: En algún paciente hemos observado cómo cambiaba su actitud frente a la cirugía. De una postura reticente, estando el paciente francamente obsesionado por el riesgo de la diplopía, pasaba a una actitud solícita, al verse los ojos rectos, con o sin diplopía, queriéndose operar a pesar de que pudiera existir aún el riesgo de visión doble.
COMPLICACIONES Los efectos secundarios y complicaciones que hemos encontrado en nuestras series, así como aquéllos que hemos podido obtener de la bibliografía pertinente, se describen a continuación:
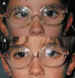
1. Ptosis palpebral (PP) (figura 21)
Se produce por difusión de la TBA hacia el músculo elevador del párpado superior (EPS). La frecuencia en la literatura oscila entre el 4,5% y el 53% (15). En nuestra serie —los porcentajes y sensibilidades estadísticas son similares—, ha sido la complicación más frecuente. Se presentó en el 36,11% de las inyecciones (147/407) (43). La PP se inicia entre los días 1 y 25 post-inyección (media de 4,6±4 días), pero en general se produce entre el 2° y el 4° día. Puede ser variable en cuanto a intensidad, pero un tercio de ellas son severas. La duración media es de aproximadamente un mes (33±20 días, rango de 2 a 95 días). Se han descrito PP de hasta 8 meses de duración. La aparición de PP, en general, no depende de una inyección incorrecta, sino de otros factores:
Hay otros factores que pueden tener importancia en la aparición de la ptosis palpebral, como son: incorporar o no lo más pronto posible al paciente, dejar la aguja en el lugar de la inyección unos segundos para evitar la difusión, las maniobras de inyección en la órbita, incluso la calidad de la TBA que contiene cada vial, si bien éstos son factores difíciles de cuantificar. En todos los pacientes la PP se recuperó hasta su situación inicial. Solamente hemos encontrado un paciente descrito con una PP residual ligera tras la inyección del músculo recto superior. Es importante observar y registrar fotográficamente a los pacientes antes de la inyección ya que, con frecuencia, los pacientes tienen una pequeña asimetría entre las hendiduras palpebrales que puede pasar desapercibida, sobre todo cuando el estrabismo es de gran magnitud. El mayor problema que produce la PP es el factor estético transitorio. Para evitarla se ha utilizado antitoxina, pero de momento no ha dado resultado ya que disminuye el efecto terapéutico en el estrabismo. Si la PP dura mucho, de forma ocasional se puede utilizar fenilefrina diluida. En los niños se indican oclusiones para prevenir la ambliopía. En nuestras series no se ha producido ninguna ambliopía definitiva. La oclusión es alterna, simétrica o asimétrica, en función de la dominancia, de la agudeza visual y de la edad. La aparición de PP no empeoró el resultado del estrabismo. Al contrario, los pacientes con PP tuvieron mayor corrección de grados de desviación ya que, entre otros factores, en ellos se utilizó mayor dosis (R=0,35) (P<0,001).
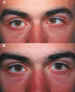
2. Alteraciones verticales Las alteraciones verticales constituyen una complicación frecuente cuando se utiliza la TBA. A esta complicación le damos mucho valor sobre todo en pacientes con cierto grado de visión binocular. En nuestros estudios se produjo entre el 29,59% 59 y 33,9% de los pacientes. Se produce por difusión a los músculos de acción vertical, pero también puede ser debido a la descompensación de un factor vertical preexistente o a la influencia internuclear de la paresia del músculo recto medio sobre otros músculos (recto superior). La alteración vertical suele ser más frecuente al inyectar los estrabismos convergentes que los divergentes, en los pacientes de menor edad y al utilizar dosis y volúmenes más elevados. No es debido a una mala inyección del músculo diana, siendo incluso mayor la corrección en estos pacientes (figura 22).
El tipo de alteración vertical más frecuente en los estrabismos convergentes ha sido la hipertropía por difusión al músculo recto inferior (58/66), aunque encontramos también hipotropías por difusión al músculo recto superior (8/66) o a otros músculos. En los estrabismos divergentes es ligeramente más frecuente la hipotropía (figura 23).
La recuperación de la alteración vertical suele ser lenta. En el 17% de los pacientes persistió más de 6 meses. En la mayoría de los casos desaparece, aunque en un 2% de los casos puede ser permanente.
3. Dolor En algunas ocasiones los pacientes se quejan de dolor. Unas veces se produce en el momento de la inyección y otras persiste, aunque con menor intensidad, durante 1-2 días. Hay varias maniobras que son dolorosas, como coger la carúncula con la pinza para inyectar, introducir la aguja en pacientes operados, con tejidos fibróticos o con gran contractura muscular, rozar el periostio con la aguja, o inyectar el líquido de manera muy brusca. Aconsejamos introducir la aguja lateralmente al músculo, evitar las zonas de cicatrices en los pacientes operados, e inyectar el líquido lentamente. También se puede inyectar una pequeña cantidad de lidocaína subconjuntival antes de administrar la TBA, para que ésta sea menos dolorosa en pacientes con muchas cicatrices.
4. Cefalea Algún paciente ha tenido cefalea de corta duración, pero esto es muy infrecuente. Probablemente sea debido a la irritación de las terminaciones nerviosas con la aguja o con el líquido de inyección, o a factores tensionales.
5. Desvanecimiento En algún paciente se ha producido un desvanecimiento tras la inyección. Se atribuye fundamentalmente a factores vagales y de estrés del momento. Un paciente, de nuestras series, sufrió un desvanecimiento antes de iniciar la sesión.
6. Sequedad ocular Se produce con mayor frecuencia al tratar pacientes con blefaroespasmo que en el estrabismo. Depende de varios factores: el efecto de la TBA sobre el ganglio ciliar, la disminución de la motilidad al inyectar el músculo orbicular, el anestésico tópico que instilamos... Para evitar esta molestia, en los pacientes con blefaroespasmo recomendamos utilizar lágrimas artificiales.
7. Hemorragia subconjuntival Se produce al introducir la aguja. Otras veces la provocamos con la pinza. Se resuelve en pocos días y no precisa tratamiento.
8. Hemorragia retrobulbar (figura 24)
Es una complicación más severa. Aparece en el 0,2% de los casos. La mayoría se produce por maniobrar en exceso con la aguja en la órbita, normalmente para obtener mejor sonido con el EMG. Cuando nos ocurrió, la hemorragia cesó en poco tiempo, aplicando hielo y con un vendaje. Sin embargo, en estos casos no obtuvimos el efecto terapéutico deseado.
9. Perforación ocular Es la complicación más importante desde nuestro punto de vista. Es muy infrecuente, ya que se presenta en un porcentaje inferior al 1/1000. Nosotros la hemos tenido en 2 pacientes (sobre un número superior a los 5000 pacientes inyectados). No suele plantear problemas residuales, pero los pacientes deben ser vigilados.
10. Diplopía y desorientación Aparece a los pocos días de la inyección, cuando se obtiene la hipercorrección, pero no todos la refieren con la misma intensidad. Los padres refieren que el niño se frota o guiña un ojo. Los niños se adaptan muy rápido y es raro que se quejen, pero en adultos es bastante molesta y genera problemas, sobre todo en la conducción. Avisamos al paciente y a los familiares antes de inyectar la TBA, de que probablemente deberá llevar ocluido un ojo, al menos de manera parcial. En nuestros casos no ha sido permanente. A cambio, puede servirnos de prueba diagnóstica de diplopía en los adultos.
11. Tortícolis Se produce al buscar una posición de mayor confort visual, de cierta unión o visión binocular, al huir de la zona de parálisis muscular, o al fijar con el ojo en parálisis.
12. Hipercorrecciones Se producen con muy baja frecuencia, muy inferior a la incidencia quirúrgica. En general, han ocurrido en pacientes en los que previamente se había hecho una cirugía de retroinserción bimedial, o bien en pequeñas desviaciones a las cuales se les inyectó una dosis elevada. A veces son hipercorrecciones duraderas que tardan más tiempo en regresar. Es necesario esperar más de un año antes de tomar una nueva actitud terapéutica.
13. Manifestaciones generales No se han descrito efectos sistémicos por la utilización de la TBA en los músculos extraoculares. Se han realizado estudios inmunológicos en pacientes tratados en otras distonías musculares, donde la dosis es entre 2 y 100 veces superior a la usada en el estrabismo, y no se han encontrado anticuerpos frente a la TBA (9). Nosotros hemos tenido dos niños con una fiebre etiquetada como gripal, al tercer día de la inyección, que cedió enseguida. La relación con la inyección es discutida.
BIBLIOGRAFÍA
|