|
INTRODUCCIÓN
El ultrasonido se viene utilizando en oftalmología desde sus más tempranas
aplicaciones en medicina. La primera aplicación clínica fue llevada a cabo en
modo A por Okasala en 1957. En 1958 Baum y Greenwood utizaron por primera vez el
modo B, y es en la década de los 70 cuando se desarrolla plenamente la
ecografía en tiempo real, que se ha visto complementada más recientemente con
los equipos duplex-Doppler color. En la actualidad se considera la primera
modalidad de imagen en el diagnóstico y seguimiento de la patología ocular. En
algunas situaciones como en presencia de un medio opaco (opacificación corneal,
hifema, miosis, catarata o hemorragia vítrea) representa el único método para
obtener información sobre el estado del globo ocular y en otras constituye una
exploración complementaria al examen clínico y oftalmológico. Resulta algo
más limitada para el estudio de la patología orbitaria, especialmente en
aquellos procesos que producen invasión de las estructuras óseas (neoplasias,
infecciones...) o a distancia, cuya valoración definitiva debe realizarse
mediante TC o RM. Esto no significa que no sea una modalidad de primer orden en
la práctica diaria. Existen diversas situaciones clínicas en las que la
ecografía proporciona el diagnóstico definitivo, en especial si se dispone de
equipos de última generación en los que se han perfeccionado considerablemente
las distintas modalidades de Doppler color y pulsado. En los casos en los que no
es capaz de ofrecer un diagnóstico específico, a menudo permite excluir
ciertas patologías o categorizar la lesión en un grupo específico de
alteraciones (lesión quística, vascular...).
La ecografía en modo B debe ser la primera modalidad de imagen utilizada
para el despistaje de cualquier alteración orbitaria sospechada clínicamente.
Permite evaluar de forma rápida y fiable las características de la lesión,
tanto topográficas como morfológicas y cuantitativas: localización,
extensión, contornos, estructura interna, reflectividad y atenuación del
sonido. El examen topográfico ayuda a ubicar la lesión en relación al globo
ocular y a los huesos de la órbita, así como a los músculos extraoculares y
al nervio óptico. El análisis de la ecoestructura permite establecer su
naturaleza (sólida, quística, mixta, calcificaciones...) (1,2,3). El Doppler
color proporciona información adicional sobre el estado de los vasos orbitarios
y la vascularización de los procesos patológicos, y el Doppler pulsado añade
a las imágenes en escala de grises información sobre la dirección y velocidad
del flujo sanguíneo, difíciles de obtener por otras modalidades de imagen (4).
La ecografía es, así mismo, una herramienta de gran valor en el seguimiento
evolutivo de lesiones benignas (cambios de tamaño, aparición de
complicaciones...) y en la valoración de la respuesta al tratamiento de
cualquier tipo de patología. Su inocuidad, rapidez y bajo precio unido a que no
precisa anestesia ni sedación, permiten repetirla cuantas veces sea necesario.
Esto es de especial relevancia en pacientes con procesos crónicos de larga
duración, en los que las técnicas de imagen que implican utilización de
radiaciones ionizantes pueden acarrear graves consecuencias en su vida adulta.
Recientemente se está empleando con éxito en la planificación de la
radioterapia del retinoblastoma mediante la colocación de placas
intraorbitarias, tanto para calcular el tamaño que debe tener la placa
radioterápica como su potencia.
Otro nuevo campo que se está abriendo lleno de posibilidades para apoyar la
cirugía de la órbita es la ecografía tridimensional de tejidos superficiales
y en concreto la técnica de «fusión 3D». La «fusión 3D» es una nueva
tecnología de procesamiento de imágenes, actualmente en fase de desarrollo,
que genera imágenes Doppler color tridimensionales de estructuras vasculares
sobreimpuestas a las imágenes 3D en escala de grises, de forma parecida a las
que se obtienen actualmente mediante TC y RM. Esta técnica, inicialmente
empleada en el estudio de tejidos superficiales (mama y tiroides), permite
analizar las características hemodinámicas de los procesos patológicos con
mayor precisión, proporciona mayor seguridad en la cuantificación de las
lesiones (cálculos de volumen de masas más seguros, relaciones anatómicas...)
y mejora la simulación y seguimiento después del tratamiento. Los resultados
preliminares de estudios en masas orbitarias resultan esperanzadores.
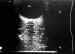
Figura 1. Anatomía ecográfica: Corte longitudinal de una órbita
derecha normal. OG (globo ocular), SRM (músculo recto superior), IRM (músculo
recto inferior), ON (nervio óptico), OW (pared de la órbita).
En el Hospital Infantil La Paz todas las exploraciones ecográficas se
realizan en tiempo real, con sonda lineal de 7,5 MHz y sonda sectorial de 5 MHz
para estudiar adecuadamente el espacio retroocular. El transductor se coloca
directamente sobre el párpado, con el paciente en decúbito supino y el ojo
cerrado, usando abundante gel a fin de obtener una imagen adecuada sin necesidad
de presionar. Inicialmente deben realizarse cortes longitudinales y
transversales de todas las estructuras oculares y orbitarias en modo B.
Ocasionalmente puede ser necesario efectuar una exploración dinámica,
indicando al paciente que mueva los ojos en todas las direcciones para evaluar
el desplazamiento de determinadas lesiones con los movimientos oculares. El
duplex Doppler color se utiliza en nuestro hospital en todos los casos de
patología vascular y tumoral desde 1991. Se realiza con una sonda de 7,5 MHz
empleando la máxima ganancia posible sin ruido y ajustando la velocidad, el
filtro de pared y el PRF a los valores mínimos que permite el equipo. El
análisis del flujo mediante Doppler pulsado ha de hacerse con un pequeño
volumen de muestra. Por convención universal, el flujo que se dirige hacia el
transductor aparece en color rojo y el que se aleja del transductor en color
azul (4).
La ecografía en modo B en la órbita permite la visualización de las
paredes óseas, la grasa retrobulbar, los músculos y el nervio óptico (figura
1). Las paredes orbitarias aparecen como bandas hiperecogénicas con sombra
acústica posterior, simétricas y a ambos lados; la grasa retrobulbar se
identifica como un área hiperecogénica homogénea detrás del globo; los
músculos extraoculares tienen una configuración fusiforme e hipoecoica desde
el globo al vértice de la órbita, y el nervio óptico aparece como una banda
hipoecoica triangular en el centro de la grasa retrobulbar hiperecogénica que
se extiende desde la pared posterior del globo al ápex orbitario (5,6,7).
Mediante el duplex Doppler color se identifica la arteria oftálmica y sus ramas
(ciliar, lacrimal, supraorbital y supratroclear), la arteria y vena central de
la retina, las arterias ciliares posteriores, la vena oftálmica superior y las
venas vorticosas (4,8). La arteria oftálmica se localiza fácilmente medial al
nervio óptico, aproximadamente 15 mm por detrás del globo ocular. La
morfología de la onda en el Doppler pulsado es típica de una arteria de alta
resistencia, con un elevado pico sistólico inicial seguido de una incisura y un
relativamente bajo flujo diastólico. La vena oftálmica superior se localiza en
cortes transversales en la región orbitaria nasal superior. La morfología de
la onda es variable, pudiendo mostrar modificaciones car día cas y
respiratorias (9).
En este capítulo se describen los hallazgos ecográficos de aquella
patología orbitaria susceptible de ser diagnosticada mediante ultrasonidos, ya
sea en modo B o mediante duplex Doppler color. Se analizan las situaciones en
las que la ecografía es suficiente para llegar al diagnóstico y aquéllas en
las es necesario realizar otras modalidades de imagen (TC, RM...).
PATOLOGÍA INFLAMATORIA
La enfermedad inflamatoria orbitaria suele manifestarse como una inflamación
aguda que afecta a la grasa, el nervio óptico, el músculo o varios de estos
elementos. Puede ser causada por bacterias, hongos o estar asociada a una
enfermedad sistémica. Existe un tercer grupo de etiología desconocida que es
conocido como pseudotumor. A diferencia de la ecografía en modo B, el papel del
Doppler color y pulsado en la valoración de la enfermedad inflamatoria
orbitaria es limitado. Puede utilizarse para tratar de identificar la causa,
monitorizar la respuesta al tratamiento y vigilar la aparición de
complicaciones asociadas como trombosis de la vena oftálmica superior o
flebitis del seno cavernoso. Cuando el proceso inflamatorio de cualquier
estructura orbitaria tiene una evolución tórpida todos los componentes de la
órbita pueden llegar a afectarse incluido el globo ocular y en los casos más
severos se forma un absceso. El proceso se conoce como panoftalmitis.
Celulitis orbitaria
Es generalmente secundaria a procesos inflamatorios o infecciosos de
estructuras adyacentes tales como senos paranasales, cavidad nasofaríngea y
estructuras craneales y faciales. Este proceso afecta fundamentalmente a la
grasa retrobulbar y suele manifestarse clínicamente en forma de edema orbitario
y limitación de los movimientos oculares acompañado de síntomas generales
(fiebre, leucocitosis...). La ecografía pone de manifiesto un moteado difuso de
baja ecogenicidad que invade la grasa retrobulbar (10,11) o bien una o más
lesiones sólidas, bien delimitadas, con bordes irregulares e hipoecoicas
respecto a los tejidos circundantes (figura 2). Una buena respuesta al
tratamiento con antibióticos y corticoides ayuda al diagnóstico. En los casos
localizados puede afectarse una cualquiera de las partes de la grasa orbitaria
permaneciendo el resto normal. Cuando se produce un absceso suele aparecer un
área sonolucente multilocular, separada por una densa interfase acústica
correspondiente a tejido conectivo u otros tejidos blandos orbitarios sanos.

Figura 2. Celulitis: Áreas focales hipoecoicas en la grasa
retroocular (flechas) que corresponden a la inflamación.
Neuritis óptica
Es un proceso inflamatorio circunscrito al nervio óptico, que aparece en la
ecografía engrosado y con una doble línea característica que corresponde a la
inflamación de la vaina nerviosa (12,13) (figura 3).
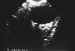
Figura 3. Neuritis óptica: doble línea (flechas) debida al
engrosamiento edematoso del nervio óptico.
Escleritis
Representa la inflamación de la esclera con aparición de pliegues
coroideos. La ecografía revela engrosamiento de la esclera y una línea
hipoecoica paralela a la pared posterior del globo ocular (figura 4) que
corresponde a la cápsula de Tenon. Esta cápsula no es visible ecográficamente
en condiciones normales (13). Se acompaña frecuentemente de desprendimiento de
retina ó desprendimiento coroideo.
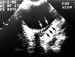
Figura 4. Escleritis: banda hipoecoica (flechas negras) paralela a
la pared posterior del globo ocular (flechas blancas).
Miositis
Cuando la inflamación se localiza en uno o más de los músculos
extraoculares el proceso se conoce como miositis. La ecografía típicamente
demuestra un engrosamiento tanto del músculo afecto como del tendón de
inserción. Ambos se hacen globulosos e hipoecoicos debido al edema (14) (figura
5), aunque en fase aguda el hallazgo más llamativo puede ser únicamente el
engrosamiento del tendón. La miositis frecuentemente se asocia a escleritis
posterior en la zona próxima a la inserción del tendón.
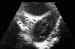
Figura 5. Miositis: Corte transversal de la órbita izquierda.
Aumento de tamaño del músculo recto lateral (flechas) con disminución global
de su ecogenicidad respecto al músculo recto medial (cabezas de flecha) que es
normal.
Pseudotumor orbitario
Es predominantemente una enfermedad de adultos aunque también sucede en
niños. Se trata de un proceso no neoplásico ni granulomatoso de etiología
desconocida que clínica y ecográficamente puede simular una neoplasia (13,16).
El proceso puede ser agudo o crónico y no se asocia a enfermedad sistémica.
Los hallazgos ecográficos son muy variados, aunque frecuentemente se presenta
como una masa sólida hipoecoica o anecoica, irregular, pobremente definida, que
infiltra la grasa retrobulbar. Esta masa avanza desde la periferia y puede
confluir con los músculos extraoculares, la esclera o el nervio óptico. En
otras ocasiones se presenta como una lesión multifocal de bordes irregulares
(16,17). El diagnóstico diferencial se plantea fundamentalmente con el linfoma
y las metástasis. La imagen ecográfica no permite hacerlo, siendo difícil
incluso con TC y RM. Una buena respuesta a los corticoides ayuda a confirmar el
diagnóstico de pseudotumor (15) (figura 6). La biopsia puede estar indicada en
ciertas circustancias, particularmente cuando la respuesta a los esteroides
sistémicos es pobre o cuando la enfermedad recurre después del tratamiento.
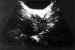
Figura 6. Pseudotumor inflamatorio: masa sólida heterogénea que
ocupa toda la órbita. Un mes después del tratamiento con corticoides la
lesión se hizo mucho más pequeña.
PATOLOGÍA QUÍSTICA Y VASCULAR
Se agrupan en este apartado una serie de entidades que, debido a su
naturaleza, presentan un aspecto quístico o un patrón de predominio quístico
en el estudio ecográfico. Todas ellas son benignas. El Doppler está muy
indicado para el estudio de las anomalías vasculares por tratarse de una
exploración relativamente fácil de realizar, no invasiva y capaz de medir la
velocidad y dirección del flujo en los vasos, difícil de precisar por
cualquier otro método.
Quiste dermoide
Es el tumor orbitario más frecuente en la infancia, representando el 32% de
todos ellos. Aunque se trata de un tumor congénito de origen ectodérmico,
menos del 25% de los casos se descubren al nacimiento debido a que crecen muy
lentamente a medida que se van rellenando con sebo y queratina. En la edad
pediátrica es más frecuente el crecimiento hacia afuera en el párpado. El
examen ecográfico pone de manifiesto una masa bien definida, encapsulada y
heteroecogénica, con un componente quístico variable dependiendo de su
contenido (15,18). Debido a la retención anormal de derivados ectodérmicos
pueden contener colesterol, grasa, secreciones sebáceas e, incluso en algunos
casos, pelos (figura 7). Ocasionalmente pueden identificarse niveles líquidos.
No es raro que produzcan excavación en el hueso orbitario adyacente, para cuya
valoración es preciso realizar TC. Estas lesiones se muestran avasculares en el
estudio Doppler.

Figura 7. Quiste dermoide: corte transversal donde se observa una
masa bien delimitada de ecogenicidad heterogénea (flechas) que produce discreta
compresión sobre el globo ocular.
Mucocele
El mucocele es un quiste que generalmente se produce en el seno frontal o
etmoidal y suele estar asociado a enfermedad respiratoria crónica (inflamación
u obstrucción mecánica al drenaje del seno). El acúmulo de moco y debris
produce el crecimiento del quiste que erosiona y rompe la pared del seno,
extendiéndose hacia la órbita. En ecografía aparece como una masa homogénea
e hipoecoica debido a su contenido mucoso y el estudio Doppler muestra ausencia
de vascularización. Los grandes mucoceles pueden causar desplazamiento
importante del globo ocular (19,20) (figura 8). La erosión ósea no puede ser
correctamente valorada por ecografía y es imprescindible realizar TC.
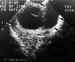
Figura 8. Mucocele: masa hipoecoica de naturaleza líquida en la
pared inferior de la órbita (flechas) que produce desplazamiento del globo
ocular.
Quiste retroocular
Es una anomalía del desarrollo del globo ocular producida por un fallo en el
cierre de la cisura embrionaria durante la invaginación del tallo y la
vesícula óptica. Debido a que contiene sustancia vítrea conlleva
microftalmia. Ecográficamente se trata de una formación quística re don deada
u oval, con pared lisa y bien delimitada, localizada en el espacio retrobulbar.
Puede ser única o múltiple y guarda relación con el globo ocular
microftálmico (22,23) (figura 9). El proceso es bilateral en el 20% de los
casos. El diagnóstico diferencial con otras lesiones quísticas de la órbita
se hace en base al menor tamaño del globo (al menos 3 mm de diferencia con el
ojo normal) (21).

Figura 9. Quiste retroocular: Se observan dos imágenes quísticas
retrobulbares (flechas), la mayor de ellas de 1 cm de diámetro, con un globo
ocular microftálmico (14 mm).
Angioma cavernoso
Es un tumor orbitario frecuente que representa el 12-15% de todas las masas
orbitarias en adultos, aunque en la edad pediátrica es menos común. La lesión
es por lo general intracónica y produce un exoftalmos lentamente progresivo. Su
ecoestructura es regular y está bien delimitado debido a que posee una cápsula
que se independiza fácilmente de otras estructuras orbitarias a las que puede
desplazar (21) (figura 10). Este tumor vascular típicamente produce una
atenuación del sonido moderada a severa lo que puede ocasionar una mala
visualización de la superficie posterior. El estudio Doppler muestra una señal
ausente o muy pobre, de predominio venoso (24,25,26).
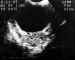
Figura 10. Hemangioma cavernoso: Masa hiperecogénica intraconal
(flechas) que no se origina en los músculos rectos ni en el nervio óptico.
Angioma capilar
Es el tumor vascular orbitario más común en la infancia. Se trata de un
hamartoma congénito que suele estar presente al nacimiento, crece rápidamente
durante los primeros seis a 12 meses de vida y con frecuencia involuciona y
regresa espontá neamente antes de los siete años. Generalmente se localiza en
la parte anterior de la órbita aunque puede ser posterior. La ecografía
demuestra una masa mal circunscrita de alta ecogenicidad debido al predominio de
capilares (figura 11). El estudio Doppler es bastante característico con un
flujo interno muy abundante que va disminuyendo con la edad (15,21,27) (figura
12). La ecografía además sirve para controlar la evolución de los angiomas
capilares sometidos a tratamiento.
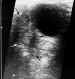
Figura 11. Angioma capilar: Niña de tres meses de edad con una masa
bien definida (flechas) de ecogenicidad heterogénea, localizada en la región
supero-medial de la órbita.
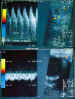
Figura 12. Angioma palpebral: a y b) El estudio Doppler demuestra
abundante vascularización arterial y venosa con flujo de alta velocidad.
Linfangioma
Es un tumor cóngenito de crecimiento lento formado por elementos vasculares
abortivos que arborizan entre las estructuras normales. Se trata de un hamartoma
de los canales venoso-linfáticos. La edad media de presentación es a los seis
años aunque en algunos casos se descubre al nacimiento. Puede estar confinado a
la órbita ó afectar incluso la conjuntiva y el párpado (28, 29, 30). En la
ecografía tiene una ecoestructura interna irregular de predominio quístico con
bordes infiltrativos. Son frecuentes las hemorragias internas y las celulitis
asociadas que conducen a proptosis agudas (figura 13). Si predomina el
componente linfático son fundamentalmente sonolucentes como cualquier quiste,
mientras que cuando ha sufrido una hemorragia reciente presenta conglomerados
hiper ecogénicos o nivel líquido (31,32). El linfangioma frecuentemente
presenta extensión extraconal, lo que hace imprescindible realizar CT o RM.

Figura 13. Linfangioma quístico: masa heterogénea con componente
quístico y calcificación (flechas) como consecuencia de una antigua
hemorragia, en la porción inferior de la órbita.
Variz orbitaria
Es una malformación venosa que produce proptosis intermitente que aumenta
con las maniobras de Valsalva. Se trata de canales venosos dilatados que afectan
sobre todo la vena oftálmica superior y se cree que representan el espectro
final de las anomalías venosas del desarrollo. En la ecografía la variz se
presenta como una estructura anecoica de forma tubular u oval (20,33,34). Cuando
está colapsada puede no ser visible, en tanto que cuando sufre trombosis
aparecen en su interior ecos de alta reflectividad que pueden simular una masa
tumoral (figura 14). El estudio Doppler es muy demostrativo ya que revela flujo
venoso que característicamente aumenta con las maniobras de Valsalva (35).

Figura 14. Variz orbitaria parcialmente trombosada: imagen tubular
con un componente líquido y otro sólido de alta ecogenicidad que corresponde
al trombo (flechas).
Fístula carótido-cavernosa
Las conexiones entre el sistema arterial y venoso pueden producirse de manera
espontánea como resultado de trombosis o hemorragia, pero por lo general son de
origen traumático. En la órbita la mayoría de las fístulas comunican el seno
cavernoso o las venas durales con la arteria carótida. El efecto sobre los
tejidos orbitarios resulta de la transmisión retrógrada de la presión venosa
y el volumen aumentados del seno cavernoso. La exploración clínica es bastante
característica con vasos epiesclerales muy dilatados, aumento de la presión
intraocular y exoftalmos pulsátil. La imagen ecográfica es también típica
con dilatación de la vena oftálmica superior (figura 15) que suele ser
indetectable en las órbitas normales. En cortes transversales la vena aparece
serpiginosa y se extiende desde la órbita temporal posterior hasta la órbita
nasal. El Doppler es de gran utilidad pues demuestra flujo arterializado con
turbulencias y velociodades muy altas (36,37,38). Una velocidad de flujo elevada
con inversión en la dirección del flujo, pulsaciones arteriales y dilatación
de la vena oftálmica superior son hallazgos característicos. Esta vena puede
trombosarse espontáneamente o por el tratamiento, por lo que deben realizarse
exploraciones seriadas para valorar la respuesta al tratamiento. La evaluación
dinámica de la velocidad de flujo en la fístula mediante compresión
carotídea puede resultar muy útil.

Figura 15. Fístula Carótido-cavernosa: El estudio Doppler color
muestra una vena oftálmica superior dilatada.
PATOLOGÍA TUMORAL
El Doppler puede ser útil en la evaluación de los tumores orbitarios, tanto
para la caracterización tisular como para la identificación del aporte
vascular, planificación de la intervención quirúrgica y seguimiento seriado
de las lesiones benignas. A pesar de ello el CT y la RM son las exploraciones de
elección, pues la infiltración tumoral y su extensión fuera de la órbita son
difíciles de determinar con ultrasonidos.
Rabdomiosarcoma
Es la neoplasia mesenquimal más frecuente de la órbita en la edad
pediátrica, representando aproximadamente el 4% de todas las masas orbitarias
infantiles. El 90% aparecen en niños menores de 15 años. Puede afectar a uno o
más músculos o desarrollarse independientemente de ellos, con un crecimiento
generalmente muy rápido. La ecografía muestra una masa generalmente alargada,
heterogénea, de ecogenicidad media-baja que se delimita bastante bien aunque
sus contornos son irregulares (figura 16) (39,40). Es frecuente la invasión de
paredes óseas y tejidos blandos ya que es un tumor muy agresivo (13,15). El
diagnóstico diferencial debe hacerse fundamentalmente con el pseudotumor
inflamatorio y el linfoma. El estudio Doppler no es concluyente ya que el grado
de vascularización puede variar significativamente de un tumor a otro, si bien
suele encontrarse menos vascularizado dichas lesiones. Es imprescindible
realizar CT y RM como en todos los tumores orbitarios.
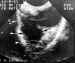
Figura 16. Rabdomiosarcoma: corte transversal de una masa sólida e
hipoecoica que se origina en el músculo recto lateral. La pared orbitaria es
irregular (cabeza de flechas) comparada con la contralateral.
Glioma del nervio óptico
Los tumores neurogénicos son característicamente tumores orbitarios bien
delimitados. El glioma del nervio óptico es comúnmente un astrocitoma
pilocítico juvenil benigno que en el 10% de los casos se asocia con
manifestaciones cutáneas de la enfermedad de Von Recklinghausen. Los pacientes
suelen ser menores de diez años con mayor incidencia en mujeres que en varones.
La morbilidad y mortalidad es debida al crecimiento local, siendo la proptosis y
pérdida de visión las primeras manifestaciones clínicas. En la ecografía se
presenta como una masa bien delimitada, homogénea y de ecogenicidad media que
no se independiza del nervio óptico (figura 17) (41). Puede llegar a ocupar
todo el cono orbitario y extenderse al quiasma óptico (42,43) por lo que la
extensión real del tumor debe ser precisada con CT o RM. No suele tener
vascularización demostrable en el estudio Doppler.
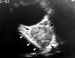
Figura 17. Glioma del nervio óptico: masa bien definida y
homogénea localizada en el cono orbitario (flechas). Pared de la órbita
(cabezas de flecha).
Meningioma intraorbitario
Es un tumor de la vaina del nervio óptico cuyas manifestaciones clínicas
iniciales son similares a las del glioma y que también se asocia frecuentemente
a la neurofibromatosis. Aunque habitualmente se presenta en la cuarta década de
la vida, puede aparecer en la edad pediátrica. En el 5% de los casos es
bilateral. Este tumor produce ensanchamiento del agujero óptico al igual que el
glioma, pero su aspecto ecográfico es bien distinto, ya que el meningioma
presenta una ecogenicidad más bien baja y unos bordes muy irregulares (3,15)
(figura 18). En algunas ocasiones aparecen focos hiperecogénicos dentro de la
masa hipoecoica que indican la presencia de calcificación intratumoral (20,44).
El estudio Doppler revela una muy pobre o ausente vascularización intratumoral.

Figura 18. Meningioma de la órbita: masa (flechas) en contacto con
el nervio óptico que en el estudio dinámico demuestra ser independiente del
mismo.
Linfoma
La afectación de la órbita ocurre en el 8% de las leucemias y el 3-4% de
los linfomas pediátricos, excepto en el linfoma de Burkitt en el que puede ser
incluso la primera manifestación. Este tumor se presenta en la ecografía como
una masa única o múltiple, hipoecoica, con bordes infiltrativos, mal
diferenciada del resto de los elementos orbitarios (20). El estudio Doppler
muestra abundante vascularización tanto arterial como venosa (figura 19). El
diagnóstico diferencial con el pseudotumor es difícil con ecografía, y para
ello resulta de gran utilidad la RM (45). Igualmente la evolución clínica y
respuesta a los corticoides ayudan al diagnóstico (3).
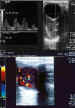
Figura 19. Infiltración linfomatosa de la órbita: a) El espacio
retroocular está ocupado por una masa pobremente definida, hipoecoica respecto
a la grasa orbitaria, con flujo arterial de alta velocidad. b) Doppler color de
otra masa linfomatosa que demuestra abundante vascularización intratumoral.
Metástasis
El neuroblastoma es el tumor que más frecuentemente metastatiza en la
órbita en la edad pediátrica, aunque pueden hacerlo muchos otros. La
metástasis puede ocurrir también por contigüidad a partir de un tumor de los
senos paranasales, estructuras faciales y cráneo. Desde el punto de vista
ecográfico se aprecian masas únicas o múltiples de tamaño y ecogenicidad
variables y bordes infiltrativos (20,43) (figura 20). Nuevamente la ecografía
no es capaz de establecer la extensión tumoral y hay que realizar TC o RM.

Figura 20. Metástasis de neuroblastoma: masa sólida (flechas) que
ocupa la mayor parte de la órbita en un niño de tres años con neuroblastoma.
Retinoblastoma
La utilidad de la ecografía en el estudio de este tumor ha sido ampliamente
discutida en otro capítulo. Únicamente añadir que recientemente se está
empleando con éxito en la planificación de la radioterapia de las recidivas
tumorales, mediante la colocación de placas intraorbitarias. La ecografía
resulta doblemente útil en esta aplicación. Por una parte permite conocer con
exactitud el tamaño de la tumoración, tanto su base de implantación en la
pared del globo como su altura, lo que es necesario para calcular el tamaño que
debe tener la placa radioterápica y su potencia. Es de suma importancia ajustar
el tamaño de la placa al de la masa porque una placa demasiado grande produce
irradiación innecesaria de estructuras oculares diferentes al tumor, en tanto
que una placa de menor tamaño deja parte de la masa sin tratamiento con la
consiguiente reducción de la eficacia terapeútica. El conocimiento exacto de
la altura de la masa tumoral es necesario pues de ésta depende la potencia de
irradiación de la placa. Por otra parte, una vez colocada la placa, la
ecografía resulta útil para controlar su correcta ubicación detras del tumor
(figura 21).

Figura 21. Retinoblastoma tratado con placa intraorbitaria: En el
globo ocular se observa una masa calcificada (cabeza de flecha) que corresponde
al retinoblastoma. Por detrás del globo se visualiza una imagen hiperecogénica
lineal (flechas) correspondiente a la placa de radioterapia.
Traumatismos y cuerpos extraños
La ecografia del traumatismo ocular y orbitario suele ser laboriosa tanto por
las dificultades para explorar un ojo doloroso y poco móvil, como por la
complejidad de las lesiones que se producen. A pesar de estas dificultades, la
ecografía es un examen obligado ante todo traumatismo ocular (6,7). Existen
tres grandes tipos de traumatismos oculares que pueden darse asociados o
aisladamente: contusiones simple o complicadas con rotura de las paredes del
globo, heridas del globo simples o perforantes, y cuerpos extraños. En cada
caso es importante evaluar la existencia de hemorragia vítrea, desprendimiento
de retina, desprendimiento coroideo, alteraciones de la ecogenicidad y posición
de la lente y engrosamiento o ruptura de la pared ocular. En el espacio
retroocular es necesario evaluar la existencia de hematomas o complicaciones
vasculares secundarias como una fístula carótido-cavernosa o una fístula de
la vena angular (figura 22), integridad del nervio óptico y de los músculos
oculares. El Doppler color es de especial utilidad en la valoración de los
vasos orbitarios, lo que es particularmente importante en pacientes con hematoma
orbitario (20).

Figura 22. Fístula arterio-venosa postraumática de la vena
angular: El estudio Doppler color demuestra flujo arterial con alta velocidad
sistólica.
La ecografía permite la detección de cuerpos extraños en el 95% de los
alojados en el globo y en el 50% de los localizados en la órbita. El cuerpo
extraño ya sea metálico, vegetal o de otra naturaleza se presenta
habitualmente como un foco hiperecogénico (debido a la gran diferencia de
impedancia acústica entre el medio ocular y el cuerpo extraño) con artefacto o
verdadera sombra posterior (8). Es necesario localizar con precisión el cuerpo
extraño (meridiano, pared, papila...) y establecer su movilidad dentro del
globo mediante un estudio dinámico. Los cuerpos extraños localizados en la
órbita deben ser estudiados por CT para definir su relación con las
estructuras orbitarias y el estado del suelo y paredes de la órbita y senos
paranasales.
BIBLIOGRAFÍA
- Berges O, Torrent M. Echographie de l’oeil et de l’orbite. Vigot ed.
Paris 1986.
- Kanski JJ. Clinical Ophthalmology. Butterworth and Co. 1984.
- Restori M, McLeod D, Wrigth JE. Diagnostic Ultrasound in Ophthalmology.
Edimburg. Barnett and Morley P. Blackwell 1980.
- Belden CJ, Abbitt PL, Beadles KA. Color Doppler US of the orbit.
RadioGraphics 1995; 15: 589-608.
- De Orbe A. Ultrasonografía Ocular y Orbitaria. En: Neuroultrasonografia
Clinica. Ediciones Norma. 1990.
- De Orbe A. Ultrasonografia en Oftalmologia Pediátrica. M.D.I. 1988; 2: 7,
57-69.
- Wong AD, Munk PL, Cooperberg PL. Status of Ultrasound of the eye and
Orbit. Ultrasound Quarterly 1994. 12: 105-115.
- Guthoff RF, Berger RW, Winkler P, Helmke K, Chumbley LC. Doppler
ultrasonography of the ophthalmic and central retinal vessels. Arch Ophthalmol
1991; 109: 532-536.
- Berges O. Colour Doppler flow imaging in the orbital veins. Acta
Ophthalmol 1992; 204(suppl): 55-58.
- Guthooff R. Ultrasound in Ophthalmologic Diagnosis. New York. Thieme
Medical Publishers, Inc. 1991.
- Gómez Campdera JA, Navarro Gómez ML, García-Mon Maranes F, Aranguez
Morena G, Casanova Morcillo A,. Orbital and periorbital cellulitis in chilhood.
A review of 116 cases. Ann Esp Pediatr 1996; 44: 29-34.
- Skalka HW. Ultrasonography of the optic nerve. Neuro-Ophthalmol 1981; 1:
261-264.
- Levine RA. Orbital Ultrasonography. Radiologic Clinics oh North America
1987; 25;3: 447-469.
- Shibata H, Misuyama Y, Mishimoto Y, Savada A. Echography in orbital
myositis. Doc Ophthalmol Ser 1981; 29: 343-347.
- Byrne SF, Green RL. Ultrasound of the eye and orbit. Mosby-Year Book,
Inc. 1992.
- Goes F, Rijckaert S, Gelisken O, Hanssens M. Ultrasonographic and
clinical characteristics of orbital pseudotumor. Bull Soc Belge Ophtalmol 1986;
213: 99-107.
- Weber AL, Jakobiec FA, Sabates NR. Pseudotumor of the orbit. Neuroimaging
Clin North Am 1996; 6: 73-92.
- Bonavolonta G, Tranfa F, de Conciliis C, Strianses D. Dermoid cysts:
16-year survey. Ophthal Plast Reconstr Surg 1995; 11: 187-192.
- Hasenfratz G, Ossoining KC: The diagnosis of orbital mucoceles and
pyoceles with standardized echography. In: Hillman JS, LeMay MM: Ophthalmic
Ultrasonography. Dordrecht, Dr W Junk. 1984.
- Berrocal T, de Orbe A, Prieto C, Al-Assir I, Izquierdo C, Pastor I,
Abelairas J. US and color Doppler imaging of ocular and orbital disease in the
pediatric age group. RadioGraphics 1996; 16: 251-272.
- Lieb WE, Cohen SM, Merton DA, Shields JA, Mitchell G, Goldberg BB. Color
Doppler Imaging of the Eye and Orbit 1991; 109: 527-531.
- Fledelius HC. Ultrasonic evaluation of microphthalmos and coloboma. Acta
Ophthalmol Scan 1996; 74: 23-26.
- Harris GJ, Dolman PJ, Simons KB. Microphthalmos with cyst. Ophthalmol
Surg 1992; 23: 432-433.
- Ruchman MC, Flanagan J. Cavernous hemangioma of the orbit. Ophthalmology
1983; 90: 1.328.
- Erickson SJ, Hendrix LE, Massaro BM, Harris GJ, Lewandowski MF, Foley Wd,
Lawson TL. Color Doppler Flow Imaging of the Normal and Abnormal Orbit.
Radiology 1989; 173: 511-516.
- Hashimoto M, Ohtsuka K, Nakamura Y, Nakagawa T. Diagnostic imaging of
orbital cavernous hemangioma. Jpn J Clin Ophthalmol 1997; 51: 1.613-1.617.
- Gundalp I, Gunduz K. Vascular tumors of the orbit. Doc Ophthalmol 1995;
89: 337-345.
- Jerry A, Shields M.D. Diagnosis and management of intraocular tumors.
Saint Louis. The C.V. Mosby Co, 1983.
- Poujol J. Intraocular tumor. In: Handbook of clinical ultrasound. New
York Ed. M. de Vlieger and al. Wiley and Sons. 1978.
- Coleman DJ, Lizzi FL, Jack RL. Foreign bodies. In: Ultrasonography of the
eye and orbit. Philadelphia. Lea and Febiger, 1977.
- Graeb DA, Rootman J, Robertson WD, Lapointe JS, Nugent RA, Hay EJ.
Orbital Lymphangiomas: Clinical, Radiologic and Pathologic Characteristics.
Radiology 1990; 175: 417-421.
- Katz SE, Rootman J, Vangveeravong S, Graeb D. Combined venous-lymphatic
malformations of the orbit (so-called lymphangiomas). associated with
noncontiguous intracraneal vascular anomalies. Ophtalmology 1998; 105: 176-184.
- Lieb WE, Merton DA, Shields JA, Cohen SM, Mitchell DD, Goldberg BB. Color
Doppler imaging in the demostration of an orbital varix. Br J Ophthalmol 1990;
74: 305-308.
- Wildenhain PH, Lehör SC, Dastur KJ, Dodd GD. Orbital Varix: Color flow
imaging correlated with CT and MR studies. J Comput Assisted Tomography 1991; 15
(1): 171-173.
- Luxenberg MN. Color Doppler Imaging of Superior Ophthalmic Vein
Thrombosis. Arch Ophthalmol 1991; 109: 582-583.
- Guthoff RF, Berger RW, Winkler P, Helmke K, Chumbley LC. Doppler
Ultrasonography of the Ophthalmic and Central Retinal Vessels. Arch Ophthalmol
1991; 109: 532-536.
- Flaharty PM, Lieb WE, Sergott RC, Bosley TM, Savino PJ. Color Doppler
Imaging. A new noninvasive technique to diagnose and monitor carotid-cavernous
sinus fistulas. Arch Ophthalmol 1991; 109: 522-526.
- Kotval PS, Weitzner I, Tenner MS. Diagnosis of carotid-cavernous fistula
by periorbital color Doppler imaging and pulsed Doppler volume flow analysis. J
Ultrasound Med 1990; 11: 101-106.
- Sohaib SA, Moseley I, Wright JE. Orbital rhabdomyosarcoma. The radiologic
characteristics. Clin Radiol 1998; 53: 357-362.
- Vade A, Armstrong D. Orbital rhabdomyosarcoma in childhood. Radiol Clin
North Am 1987; 25: 701-714.
- Barnes PD, Robson CD, Robertson RL, Poussaint TY. Pediatric orbital and
visual pathway lesions. Neuroimaging Clin North Am 1996; 6: 179-198.
- Byrne SF, Glaser JS. Orbital tissue Differentiation with standarized
echography. Ophtalmology 1983; 90: 1.071-1.090.
- Berges O, Vignaud J, Aubien ML. Comparison of Sonography and Computed
Tomography in the study of Orbital Space Occupying Lesions. AJNR 1984; 5:
257-251.
- Oritz O, Schochet SS, Kotzan JM, Kostick D. Radiologic-pathologic
correlation. Meningioma of the optic nerve sheath. Am J Neuroradiol 1996; 17:
901-906.
- Gufler H, Laubenberger J, Gerling J. MRI of lynphomas of the orbits and
paranasal sinuses. J Comput Assist Tomogr 1997; 21: 887-891.
|