|
La órbita posee un armazón óseo formado por los huesos craneales, faciales
y nasales. En el borde anterior de la órbita el periostio desarrolla una
lámina de tejido conjuntivo denso (el septum orbitario) que se extiende hasta
la inserción de los párpados, su parte posterior forma parte también de la
órbita.
En los huesos que la configuran existen canales, a través de los cuales
penetran vasos y nervios en el interior de la órbita.
El interior está ocupado por el globo ocular, el nervio óptico con su
recubrimiento meningeo, la cápsula de Tennon, los músculos extraoculares,
tractos nerviosos que los inervan, la glándula lagrimal, vasos sanguíneos y
tejido fibroadiposo que sirve de soporte a estas estructuras.
En los tejidos blandos orbitarios también podemos encontrar fascículos de
fibras musculares lisas y una pequeña estructura cartilaginosa, la troclea que
envuelve fascículos de fibras musculares estriadas del músculo oblicuo
superior.
En la órbita podemos encontrar lesiones pseudotumorales y auténticos
tumores derivados de los tejidos blandos orbitarios, de las estructuras óseas,
del nervio óptico y también tumores secundarios originados en las estructuras
vecinas que por extensión o metástasis infiltran la órbita.
Las anomalías en el desarrollo de los elementos que componen la órbita dan
lugar a un alto porcentaje de lesiones pseudotumorales orbitarias.
La presencia de canales linfáticos en la órbita está en discusión y en la
actualidad se admite que los linfangiomas traducen alteraciones del sistema
venoso orbitario por lo que se debería sustituir el término de linfangioma por
el de anomalía orbitaria venosa (1).
En la órbita no existe tejido linfoide. A partir del infiltrado linfoide que
generalmente existe en la lagrimal es de donde se originan los linfomas y
pseudolinfomas.
La propia glándula lagrimal puede ser causa de procesos neoplásicos
(excepcionales en la infancia), por el contrario anomalías en su desarrolllo,
crecimiento ectópico o hiperplasias pueden observarse en esta edad.
LESIONES PSEUDOTUMORALES
Las causas más frecuentes de lesiones pseudotumorales son los procesos
inflamatorios que producen celulitis orbitaria que generalmente
son secundarias a sinusitis paranasales, procesos inflamatorios de dientes o del
saco lagrimal. Estas celulitis son la causa más frecuente de la proptosis en la
infancia. El patólogo no suele tener biopsia de esta clase de patología, pues
el diagnóstico es fundamentalmente clínico. Su etiología puede ser
bacteriana, micótica o parasitaria, siendo estas últimas muy infrecuentes y
suelen originar problemas de diagnóstico diferencial con auténticos tumores.
El quiste hidatídico en nuestro país puede plantear esta problemática.
El término pseudotumor inflamatorio de la órbita es ambiguo (2) y
contribuye a la confusión en el manejo y diagnóstico de los enfermos. Durante
muchos años bajo este término se han incluido diferentes entidades y se han
clasificado según su localización anatómica; miositis (músculo estriado),
dacriocistitis (glándula lagrimal), periescleritis (cápsula de Tenon),
perineuritis (nervio); según el cuadro clínico (aguda, subaguda y crónica),
por su patrón radiográfico (infiltrativo o no infiltrativo) y por su
etiología (traumática, inflamatoria, neoplásica, vascular, endocrina o
inmunológica). Sólo una vez que se han excluido factores etiológicos locales
o sistémicos podremos hablar de un pseudotumor inflamatorio idiopático cuya
base anatomopatológica es una inflamación crónica no granulomatosa.
Las técnicas modernas de biología molecular y la tipificación celular
mediante la inmunohistoquímica nos permiten excluir las lesiones
linfoproliferativas monoclonales que más dificultad presentan a la hora de
hacer un diagnóstico diferencial.
El pseudotumor inflamatorio en patología pediátrica presenta una frecuencia
que oscila entre el 8% y el 16% (3-5). La mayoría de estas lesiones tienen como
substrato un infiltrado inflamatorio crónico inespecífico compuesto por
células plasmáticas, linfocitos, macrófagos y ocasionales eosinófilos, sobre
un estroma fibroso denso en el que se puede observar ocasionales folículos
linfoides (figura 1).

Figura 1. Pseudotumor inflamatorio idiopático. Infiltrado
inflamatorio con formación de folículos linfoides y ligera fibrosis del
estroma conectivo.
Existen variantes histológicas del pseudotumor inflamarorio:
— Lipogranulomatosa: producida por una necrosis del tejido adiposo.
— Fibroblástica: con diferenciación de colágena que suele asociarse
con fibrosis retroperitoneal y mediastínica
— Mixoides:
representan variedades mixoides de fascitis nodular.
Las anomalías en el desarrollo
de las estructuras orbitarias
configuran otro grupo de lesiones pseudotumorales en la infancia. Son
congénitas y se caracterizan por alteraciones en el tamaño, localización,
organización o proporción de los tejidos presentes en la órbita (tabla 1)
clasificándose en:

1. Coristomas:
Es el crecimiento excesivo de un tejido
histológicamente normal que durante el desarrollo se desplaza hacia una región
anatómica en la que normalmente no existe este tejido.
Los coristomas orbitarios se originan de células embrionarias que quedan
atrapadas en situación anómala por un fallo en la separación en los tejidos
óseos o por un secuestro. Suelen ser quísticos y contienen células que
derivan de una sola capa germinal.
Se clasifican en:
* Quistes dermoides: Se encuentran revestidos por un epitelio
estratificado queratinizante con anejos dérmicos (folículos y glándulas
sebaceas) en su pared (figura 2). La aparición ocasional de elementos
mesodérmicos (cartílago) no modifica el concepto de quiste dermoide.
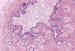
Figura 2. Quiste dermoide. La pared del quiste muestra un
revestimiento por epitelio escamoso queratinizante y contiene glándulas
sebáceas y estructuras pilosas.
* Quistes epidermoides: Presentan un epitelio poliestratificado
queratinizante sin anejos en su pared (figura 3).

Figura 3. Quiste epidermoide. En la pared no existen anejos y
está revestido por epitelio escamoso queratinizante.
Ambas lesiones suelen aparecer en los primeros meses de vida en forma de
nódulos subcutáneos situados sobre el anillo orbitario, aunque a veces
también existen en zonas más profundas de la órbita. Son lesiones benignas
que no infiltran las estructuras adyacentes y se tratan con extirpación
quirúrgica simple. Lesiones quísticas idénticas pueden desarrollarse
secundariamente por implantación traumáticas o yatrogénica.
Los quiste dermoides conjuntivales (6,7) se originan por un secuestro de la
conjuntiva durante la vida embrionaria. Se encuentran revestidos por un epitelio
escamoso no queratinizante con células caliciformes y anejos en su pared (figura 4). Si no poseen anejos se denomina quistes simples que suelen ser
secundarios y aparecer meses o décadas después del trauma o cirugía.

Figura 4. Quiste conjuntival. El epitelio que lo reviste es
escamoso no queratinizante con presencia de células caliciformes.
* Dermolipomas: Son dermoides sólidos compuestos por tejido adiposo,
epitelio estratificado y anejos epidérmicos. Son coristomas congénitos que
generalmente aparecen en el cuadrante superior temporal y pueden extenderse
posteriormente hacia la órbita. Son frecuentes en el síndrome de Goldenhar.
2. Hamartomas:
Es el crecimiento excesivo de un tejido
histológicamente normal en su localización habitual. Los hemangiomas para
muchos autores son un ejemplo de hamartoma.
3. Microftalmia con quiste:
Es una lesión malformativa, poco
frecuente, producida por un cierre incompleto de la hendidura colobómica. A
través de este defecto protuye el tejido retino-glial y se desarrolla el
quiste. A veces es tan grande la lesión quística que el globo ocular
microftálmico es difícil de encontrar y plantea el diagnóstico diferencial
con un tumor de partes blandas.
Histológicamente el globo ocular puede estar bien o mal organizado y
presentar lesiones intraoculares secundarias como displasia retiniana o
aparición de otros tejidos (adiposo, óseo o cartilaginoso). El quiste puede
estar delimitado por retina gliótica o puede estar totalmente ocupado por una
proliferación glial que simula una neoplasia y plantea el diagnóstico
diferencial con un astrocitoma (figura 5).

Figura 5. Microftalmía con quiste colobomatoso. El quiste
está delimitado por retina gliótica y focalmente aparece un área de
proliferación glial.
La mayoría de los casos son unilaterales y esporádicos pero se están
empezando a conocer casos asociados a anomalías genéticas (trisomía parcial
del cromosoma 22) (8) y síndromes sistémicos.
En la actualidad (9) según su etiología se clasifican en Genéticos
(monogénico y cromosómico), adquiridos prenatales (agentes teratógenos y
malformativos intrauterinos) y sindrómicos (asociados a otras malformaciones)
4. Cefaloceles:
En este tipo de malformación se produce una
herniación de las meninges (meningocele), encéfalo (encefalocele) o de ambos
(meningoencefalocele) hacia la órbita, con cierre posterior del orificio de
comunicación.
5.
Anomalías de la glándula lagrimal: La presencia de
una glándula lagrimal ectópica o su crecimiento hiperplásico también puede
producir una lesión pseudotumoral en la órbita.
Lesiones tumorales orbitarias
Las neoplasias orbitarias pueden ser:
a) Primarias:
A partir de las diferentes estructuras de la órbita se
desarrollan tumores que suelen ser benignos y en un 90% de naturaleza vascular.
A la cabeza de los tumores malignos primarios de la órbita (tabla 2) se
encuentran los rabdomiosarcomas.

b) Secundarias:
Se desarrollan a partir de las estructuras vecinas e
infiltran la órbita o bien son de naturaleza metastásica (tabla 3).

TUMORES ORBITARIOS PRIMARIOS
1. T. vasculares
Las lesiones vasculares de la órbita son difíciles de clasificar pues
cumplen criterios tanto de neoplasias (proliferación celular en los
hemangiomas) como de hamartoma (con predominio en la infancia y capacidad de
regresión).
En los hemangiomas infantiles se han descrito tres fases de crecimiento (10),
una fase proliferativa, que dura aproximadamente un año, seguida de una fase
involutiva que oscila entre 1 y 5 años, al cabo de 6-12 años se puede
encontrar totalmente involucionado el hemangioma.
Otro problema de su clasificación es la confusión que existe entre
malformación vascular y neoplasia vascular. Mulliken (11) diferencia los
hemangiomas de las malformaciones vasculares en base a que estas últimas son la
consecuencia de una alteración en la morfogénesis vascular durante la vida
embrionaria, y por tanto son lesiones congénitas, que pueden aumentar de
tamaño por fenómenos ectásicos secundarios a cambios de presión en el flujo
vascular o linfático pero que nunca se acompañan de proliferación de células
endoteliales a diferencia de los hemangiomas.
Por último, como ya hemos mencionado, los hemangiomas para algunos autores
(1) representan una anomalía del sistema venoso orbitario que junto a las
varices deberían ser consideradas como malformaciones venosas. Otros autores no
están de acuerdo y prefieren mantener los dos términos (2,12).
Recientemente (13) los miembros de la Sociedad Orbitaria Internacional han
adoptado una clasificación de las malformaciones vasculares orbitarias basadas
en sus repercusiones hemodinámicas. Esta clasificación no se aplica en
aquellas lesiones que producen expansión por proliferación celular (H.
capilar, H. cavernosos y neoplasias vasculares de células fusiformes).
Hemangioma capilar
Es el tumor vascular más frecuente en la infancia. Puede observarse en el
nacimiento o más tarde y frecuentemente afecta a la porción cutánea de los
párpados lo que hace más fácil el diagnóstico que cuando se localizan en las
porciones superficiales o profundas de la órbita. La imagen histológica
(figura 6) corresponde a numerosos capilares con proliferación de células
endoteliales. Al involucionar la proliferación capilar es sustituida por tejido
adiposo. El tratamiento está en función del tamaño y recientemente se está
utilizando el interferón para inhibir la angiogénesis en aquellos casos que no
han respondido a los corticoides (14).

Figura 6. Hemangioma capilar. Se observa una proliferación
de vasos capilares con células endoteliales prominentes.
Hemangioma cavernoso
Histológicamente la lesión corresponde a vasos dilatados ectásicos,
revestidos por un endotelio aplanado y rodeado por una gruesa cápsula de tejido
conectivo fibroso. Su etiopatogenia está en discusión, para algunos equivale a
una malformación vascular con aspecto esponjoso, para otros sería un
hemangioma en fase involutiva que adopta esta morfología. Este tipo de
hemangioma es la lesión más frecuente en la edad adulta.
Hemangiopericitoma
Es un tumor vascular de partes blandas que a veces afecta de forma primaria o
secundaria a la órbita. Se localiza más frecuentemente en la mitad superior de
la órbita y es infrecuente en la edad infantil. El patrón básico es una
proliferación de espacios vasculares rodeados de una proliferación de células
fusiformes (pericitos). Su comportamiento es difícil de precisar y no existen
criterios histológicos para definir su benignidad o malignidad (15).
Malformaciones vasculares
* Malformación linfática-venosa: La mayoría de las lesiones son
visibles desde el nacimiento o aparecen en los primeros años de vida y pueden
sufrir un aumento del tamaño por fenómenos hemorrágicos. Se tratan de
lesiones desprovistas de cápsula y compuestas por canales de diferentes
diámetros lo que les da un aspecto esponjoso. Los canales presentan paredes
finas revestidas por endotelio, que contienen sangre o líquido seroso. Se
encuentran incluidos en un estroma fibroso y a veces se observan infiltrados
linfocitarios focales (figura 7).
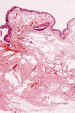
Figura 7. Malformación linfática-venosa. Se observan
canales vasculares con aspecto esponjoso sobre un estroma fibroso. En las luces
vasculares puede existir material hemático o líquido seroso.
* Varices orbitarias: Es una malformación venosa en la que se
produce la dilatación de una o varias venas que conduce a una proptosis
intermitente en función del aumento de la presión venosa.
2. T. musculares
Los tumores con diferenciación de músculo liso, tanto benignos (leiomiomas)
como malignos (leiomiosarcoma) son infrecuentes y aparecen en la edad
adulta.
Los tumores con diferenciación hacia músculo estriado de comportamiento
benigno; rabdomiomas son poco frecuentes (16).
Los rabdomiosarcoma, a pesar de su rareza, son los tumores orbitarios
malignos primarios más frecuentes en los niños y el sarcoma más frecuente de
partes blandas en la infancia (17-19). La edad más frecuente de aparición es
entre los 7 y 8 años y el 90% de los casos aparecen antes de los 16 años.
Se trata de un tumor de localización unilateral, de crecimiento rápido que
produce proptosis y desplazamiento del globo ocular. La introducción de la
quimioterapia y la radioterapia como tratamiento coadyuvante a la cirugía ha
mejorado llamativamente el pronóstico que anteriormente era infausto (20).
De los patrones histológicos descritos en el rabdomiosarcoma por Horn y
Enterline (21) en 1958, embrionario-alveolar-botrioide-pleomórfico, son
preferentemente los dos primeros los que aparecen en la órbita. Actualmente se
utiliza una nueva clasificación realizada por el instituto nacional del cáncer
(19) clasificándose en rabdomiosarcoma embrionario, en el que se identifican
cuatro variantes —convencional, convencional con áreas de citología
agresiva, leiomiomatoso y convencional con areas pleomórficas—,
rabdomiosarcoma alveolar; con dos variantes —convencional y sólido—; R
pleomórfico y una última categoría correspondiente a otros sarcomas
indiferenciados. El R. embrionario, con todas sus variantes, constituye el tipo
más frecuente. Está formado por células musculares embrionarias,
rabdomioblastos, en diferentes estadios de diferenciación. Podemos observar
células redondeadas indiferenciadas y células maduras de morfología
fusiforme, citoplasma abundante e intensamente eosinófilo donde a veces se
pueden reconocer estriaciones transversales. Estas células se encuentran
inmersas en un estroma que con frecuencia tiene características mixoides
(figuras 8 y 9). Es importante destacar la variante leiomiomatosa (figura 10)
por ser la que mejor pronóstico presenta. El R. alveolar convencional es
de peor pronóstico y se caracteriza por la presencia de septos fibroso que
delimitan espacios alveolares donde se encuentran «flotando» las células
tumorales que son rabdomioblastos totalmente indiferenciados. Aquí se observa
un mayor grado de pleomorfismo, con presencia de células gigantes
multinucleadas, y un mayor índice mitótico, lo que traduce su mayor
agresividad (figura 11). Existe una variante de nueva aparición, Alveolar de
patrón sólido (19), que presenta las mismas características citológicas con
ausencia del patrón morfológico alveolar y que tiene el mismo mal pronóstico
(18) (figura 12).

Figura 8. Aspecto macroscópico de un rabdomiosarcoma primario
de la órbita.

Figura 9. Rabdomiosarcoma embrionario convencional. La
neoformación está compuesta por células fusiformes de citoplasma ovoides que
a veces muestran diferenciación miógena.

Figura 10. Rabdomiosarcoma embrionario leiomioma toso. Las
células son más fusiformes y se parecen a células musculares lisas, pero
existen áreas de aspecto convencional.

Figura 11. Rabdomiosarcoma alveolar convencional. La
proliferación de células rabdomioblásticas está delimitada por septos
conectivos, por lo que adopta un aspecto alveolar. A veces se identifican
rabdomioblastos multinucleados.

Figura 12. Variante sólida de rabdomiosarcoma alveolar. El
patrón alveolar no existe pero las características celulares, son idénticas a
las del convencional.
3. T. adiposos
Los tumores benignos, lipomas, a pesar de su rareza representan el 2%
de algunas series de tumores orbiculares pediátricos (22). Se encuentran bien
delimitados, con una apariencia lobular, y se encuentran constituidos por tejido
adiposo adulto, bien diferenciado. Es difícil establecer el diagnóstico
diferencial con los prolapsos de la grasa orbitaria (figura 13).

Figura 13. Lipoma. Se caracteriza por una proliferación
lobular de tejido adiposo adulto. En el polo superior de la microfotografía se
observan lóbulos de la glándula lagrimal.
Los malignos, liposarcomas, son raros y los pocos casos descritos
aparecen en la edad adulta.
4. T. fibroblásticos o fibrohistiocitarios
Los tumores fibrohistiocitarios benignos y malignos (fibrohistiocitomas), y
los que presentan diferenciación fibroblástica, existen en la órbita de
individuos adultos pero son excepcionales en la edad infantil (23,24).
5. T. con diferenciación neural
Constituyen el 4% de los tumores orbitarios (25). El 2% se corresponde a
neurofibromas y el otro 2% a neurinomas, siendo excepcionales los
neurofibrosarcomas.
*
Neurofibroma: Es el tumor más frecuente de las vainas nerviosas
periféricas de la órbita. Existen tres patrones de crecimiento: plexiforme,
difuso y localizado (o circunscrito). El primero es el que aparece en la edad
pediátrica, frecuentemente afecta los párpados y es patognomónico de las
neurofibromatosis (25). Histológicamente no están encapsulados y presentan un
aspecto organoide, observándose una proliferación de células de Schwann,
fibroblásticas y perineurales que engloban los axones (figura 14).

Figura 14. Neurofibroma plexiforme. Englobando los axones se
observa una proliferación de células de Schwann y fibroblastos.
El tratamiento es quirúrgico y algunos autores recomiendan un tratamiento
agresivo desde el principio para evitar múltiples intervenciones (26).
*
Neurinoma: Clínicamente son indistinguibles de los
neurofibromas solitarios de los que se diferencian por encontrarse encapsulados
y por estar constituidos por proliferaciones de células de Schwann que adoptan
un patrón sólido en empalizada (Antoni A) o un patrón mixoide (Antoni B)
(figura 15).

Figura 15. Neurinoma. Se identifican células fusiformes con
núcleos en empalizada que constituyen los cuerpos de Verocay que se observan en
el tipo A de Antoni.
* Neurofibrosarcoma:
Son los tumores malignos de las vainas periféricas
y son infrecuentes en niños.
6. T. del n. óptico
Pueden localizarse a nivel de la cabeza (melanocitoma, meduloepitelioma y
hemangioma) o en la porción retrobulbar (glioma y meningioma).
*
Gliomas: Aparecen en la primera década, alrededor de los 5 años.
Probablemente la mayoría son congénitos y sólo se diagnostican cuando dan
síntomas. Son astrocitomas de bajo grado de malignidad de crecimiento lento. Se
originan a partir de astrocitos fusiformes (pilocíticos) que proliferan y
expanden los septos piales que permanecen intactos (figura 16). No suelen
existir atipias citológicas ni mitosis y es frecuente la aparición de fibras
de Rosenthal. Se suelen acompañar de una proliferación reactiva, que a veces
es tan intensa que plantea el diagnóstico diferencial con un meningioma (27).

Figura 16. Glioma del nervio óptico. La neoformación está
compuesta por una proliferación de astrocitos pilocíticos que se aconpañan de
una proliferación reactiva de los septos piales.
Un alto porcentaje de casos aparece igual que el meningioma en enfermos con
neurofibromatosis.
* Meningiomas: Los meningiomas primarios orbitarios derivan de células
mesodérmicas que quedan incluidas dentro del espacio subaracnoideo del nervio
óptico. Adoptan idénticos patrones que los intracraneales (fibroblástico,
angioblástico, meningotelial o transicional) existiendo un predominio del
meningotelial con aparición de cuerpos de psamoma y disposición celular en
capas concéntricas (figura 17).

Figura 17. Meningioma. Las células meningoteliales adoptan
un patrón concéntrico característico del meningioma tipo meningotelial.
Son tumores fundamentalmente de adultos pero el 20% de los casos aparecen
antes de los 10 años (28).
Son de crecimiento lento, localmente invasivos pero no metastatizantes. En
niños son más agresivos que en los adultos (29) y la supervivencia es más
larga en los meningiomas primarios que en los secundarios (extensión a órbita
de un meningioma intracraneal).
* Meduloepitelioma: Es un tumor que aparece fundamentalmente en la
primera década (30) y que se origina de células que recuerdan al epitelio
medular que reviste el tubo neural. Se localizan preferentemente en cuerpo
ciliar pero también se han descrito a nivel del nervio óptico (31).
Histológicamente posee dos componentes: Cordones epiteliales que a veces
delimitan estructuras rosetoides y un estroma mixoide que recuerda al
mesénquima embrionario (figura 18). Existe una variedad teratoide, en la que
existen componentes heterólogo, cartílago y músculo estriado (32).
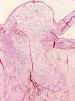
Figura 18. Meduloepitelioma. A nivel de la cabeza del nervio
óptico, se observa una proliferación cordonal de células epiteliales, con
disposición rosetoide que están incluidas en un estroma mixoide.
La mayoría son benignos o localmente agresivos pero cuando existen criterios
histológicos de malignidad pueden metastatizar (33).
7. T. de células germinales
* Teratoma: Es un tumor congénito poco frecuente (34) que se origina
de una célula embrionaria pluripotencial capaz de desarrollar tejidos que
derivan de las tres capas germinales: ectodermo (piel anejos dérmicos y
derivados neuroectodérmicos), endodermo (epitelio gastrointestinal y
respiratorio) y mesodermo (cartilago, hueso, músculo, tej. Adiposo y
conectivo).
Pueden ser quísticos o sólidos, generalmente son congénitos o aparecen en
la infancia, suelen ser unilaterales, de crecimiento rápido y no se asocian a
otras anomalías.
Se comportan como tumores benignos aunque en un bajo porcentaje de teratomas
existe un comportamiento maligno tipo tumor del seno endodérmico, que también
puede aparecer «de novo» en la edad adulta sin que exista un teratoma
acompañante, en este caso es de mal pronóstico por tener un comportamiento muy
agresivo.
Histológicamente se clasifican en maduros e inmaduros. Los inmaduros pueden
presentar amplias áreas neuroectodérmicas, que plantean el diagnóstico
diferencial con neuroblastomas y retinoblastomas, o mesenquima inmaduro tipo
blastema metanéfrico o diferenciación rabdomioblástica.
Los teratomas Maduros contiene estructuras ectodérmicas (epitelio escamoso,
pelos y glándulas sebáceas, tej. nervioso, pexos coroides) y mesodérmicas
(cartílago, hueso, etc) (figura 19).

Figura 19. Teratoma. La presencia de estructuras maduras
derivadas de las tres hojas blastodérmicas justifica el diagnóstico de
teratoma.
8. T. de origen neuroepitelial
El T. Neuroectodérmico melanocítico es poco frecuente, generalmente
benigno, se presenta en el primer año de la vida y es también conocido bajo
los nombres de tumor de anclaje retiniano o progonoma melanocítico. Es un tumor
derivado de la cresta neural con marcada diferenciación hacia epitelio
pigmentario y escasa maduración del componente neuroblástico (35). Ocurre
preferentemente en el maxilar (36) y puede infiltrar secundariamente la órbita
(37) aunque tambien se ha descrito su localización primaria en la órbita (39).
Histológicamente está compuesto por túbulos o cordones de células
pigmentadas, a veces con luces centrales, generalmente ocupadas por nidos de
células pequeñas neuroblásticas. Esta población celular está incluida en un
estroma conectivo denso (figuras 20 y 21).

Figura 20. Tumor neuroectodérmico melanocítico. Sobre un
estroma conectivo denso se observa una proliferación epitelial que se dispone
en nidos, cordones o túbulos.
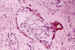
Figura 21. Tumor neuroectodérmico melanocítico. A mayor
aumento se observa una cavidad delimitada por epitelio pigmentado, que contiene
granos intracelulares de melanina, en cuyo interior se identifican células
neuroepiteliales indiferenciadas.
El T. Neuroectodérmico periférico (PNET) comparte anormalidades
géneticas y moleculares con el Ewing extraesquelético del que sólo se
diferencia por presentar diferenciación neural. En la actualidad se consideran
extremos polares de un mismo grupo tumoral.
Histológicamente el PNET está compuesto por una proliferación de células
redondeadas con escaso citoplasma y núcleos redondeados de cromatina dispersa
finamente granular. En ocasiones diferencian estructuras rosetoides semejantes
al neuroblastoma (figuras 22 y 23). Con inmunohistoquímica las células
expresan positividad para marcadores neurales: neurofilamentos, sinaptofisina y
cromogranina.
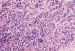
Figura 22. Tumor neuroectodérmico periférico.
Proliferación celular de aspecto neuroblástico, positiva con marcadores
neurales.

Figura 23. Tumor neuroectodérmico periférico. Positividad
celular para la sinaptofisina.
9. T. pigmentario
En el epitelio conjuntival existe una población de melanocitos que pueden
proliferar y dar lugar a nevus. Como sucede en la epidermis los nevus
pueden ser junturales, compuestos o mixto. Los nevus conjuntivales presentan
peculiaridades histológicas que los diferencian de los epidérmicos, se
acompañan en su crecimiento de células epiteliales de reserva que pueden
madurar como células escamosas o mucosas, cuando proliferan estas últimas
delimitan estructuras pseudoglandulares (pseudoglándulas de Henle) que a veces
configuran auténticos quistes (figura 24). La proliferación epitelial puede
ser tan intensa que enmascare la proliferación névica. En algunos nevus
conjuntivales existe una marcada infiltración linfocitaria alrededor de esta
proliferación juntural.
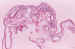
Figura 24. Nevus melanocítico con marcada proliferación de
estructuras glandulares.
Los melanomas conjuntivales en niños son muy raros (39) y de mal
pronóstico.
10. T. hematopoyéticos
Los tumores de origen hematopoyético son raros y representan el 2,5 en
algunas series antiguas (22,42). En series recientes se ha observado un notable
aumento de procesos linfoides tumorales del adulto con nula incidencia en la
edad pediátrica (29,43). Las leucemias pueden aparecer en los niños como
tumores de partes blandas de situación orbitaria o palpebral y reciben el
nombre de sarcoma mieloide, sarcoma granulocítico o cloroma, a veces preceden
en semanas o meses a la infiltración de la médula osea (44,45).
Histológicamente aparece una proliferación difusa de células de pequeño o
mediano tamaño, con núcleos ovoides, a veces ligeramente lobulados y
frecuentemente en mitosis, poseen citoplasmas acidófilos, a veces ligeramente
granular (figuras 25 y 26) y expresan positividad con el antígeno leucocitario
común (LCA) y la mieloperoxidasa.

Figura 25. Sarcoma granulocítico. Se observa un crecimiento
difuso de células mieloides muy inmaduras, a veces con núcleos lobulados.

Figura 26. La positividad con la técnica inmonohistoquímica de
mieloperoxidasa confirma la naturaleza mieloide del tumor.
11. T. óseos
La F. osificante psamomatoide es un tumor óseo que hay que distinguir
clínica e histológicamente de otras lesiones fibro-óseas, tales como
displasia fibrosa, fibroma osificante y fibroma cementante. Clínicamente tiene
un comportamiento agresivo y puede erosionar e invadir los tejidos circundantes
con una marcada predilección por los huesos orbitarios (frontal y etmoidal).
Suele aparecer en las primeras décadas y como tratamiento se aconseja una
extirpación quirúrgica completa (46). Histológicamente se observa un estroma
muy celular con estructuras esféricas de colágeno calcificado semejantes los
cuerpos de psamoma (figura 27).

Figura 27. Fibroma osificante psamomatoide. Sobre un estroma
fibroso muy vascularizado, se observan calcificaciones concéntricas que se
parecen a los cuerpos de psamomas.
La displasia fibrosa del hueso puede ser monostótica o poliostótica.
La lesión orbitaria suele ser monostótica y aparece en las tres primeras
décadas de la vida, en su crecimiento puede producir un estrechamiento del
canal del nervio óptico y alteraciones del drenaje del conducto lagrimal (47).
Histológicamente se observan las consecuencias de un paro de la maduración del
tejido óseo, con presencia de trabéculas de tejido óseo inmaduro a veces
curvilíneas incluidas en un estroma fibroso muy vascularizado (figura 28).

Figura 28. Displasia fibrosa. Se identifican trabéculas de
hueso inmaduro, con frecuencia curvilíneas, que están incluidas en un estroma
fibroso
El Sarcoma de Ewing primario de órbita es muy infrecuente (48) y
siempre es obligatorio descartar un tumor metastásico (49). Histológicamente
existe una proliferación de células pequeñas, basófilas, indiferenciadas que
a veces muestran citoplasmas vacuolados PAS positivos que ocupan los espacios
intertrabeculares (figura 29).

Figura 29. Sarcoma de Ewing. Los espacios intertrabeculares
están ocupados por células pequeñas, basófilas, indiferenciadas que a veces
presentan citoplasmas vacuolados.
La histiocitosis X (granulomatosis de Langerhans) tiene, clínicamente
tres formas de presentación: granuloma eosinófilo monostótico, enfermedad
ósea multifocal (enf. Hand-shüller-Christian) y la enfermedad diseminada con
afectación visceral (Enf. de Letterer-Siwe).
Todos tienen en común la proliferación de histiocitos especializados en la
presentación de antígeno (células de Langerhans). En la órbita puede
manifestarse como una lesión solitaria o difusa.
Histológicamente se observa una proliferación de histiocitos con núcleos
hendidos o lobulados con citoplasma eosinófilo, a veces ligeramente granular,
que expresan positividad con la tinción de inmunohistoquímica de la proteína
S-100 y con el antígeno CD-1a (figuras 30 y 31). A veces se observa la
presencia de células gigantes multinucleadas y de ocasionales eosinófilos.

Figura 30. Granuloma eosinófilo. Está constituido por una
proliferación histicitaria difusa. Los histiocitos suelen presentar nucleos
plegados o hendidos.

Figura 31. Estos histiocitos expresan positividad para la proteína
S100.
El sarcoma osteogénico puede aparecer en pacientes que han sufrido
radiaciones orbitarias (sobre todo en retinoblastomas).
TUMORES ORBITARIOS SECUNDARIOS
En los niños las metástasis se localizan más frecuentemente en la órbita
que en el globo ocular a diferencia de en los adultos donde la localización
más frecuente es en la coroides
El neuroblastoma es el tumor metastásico más frecuente en esta
localización en la edad pediátrica (50). Se han descrito neuroblastomas
orbitarios primarios en adultos pero no se ha publicado ninguno en niños (51).
Cuando metastatizan en la órbita ya se conoce la localización primaria del
tumor por lo que no se suelen biopsiar.
Las leucemias, sobre todo la leucemia linfoblástica aguda (22), en fases
avanzadas también metastatizan en la órbita. Los infiltrados orbitarios
primarios (sarcomas granulocíticos) ya han sido comentados anteriormente.
CASUÍSTICA
Hemos revisado 159 estudios anatomopatológicos de lesiones tumorales y
pseudotumorales orbitarias pediátricas recogidas durante el período
comprendido entre 1967 y 2000 procedentes del servicio de oftamología de la
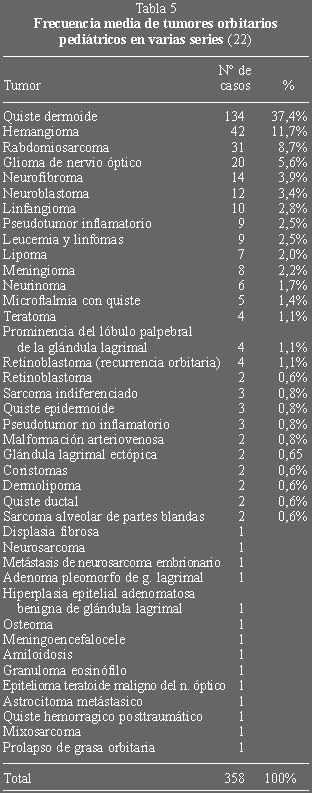
ciudad sanitaria La Paz (tabla 4). En la tabla 5 se puede realizar un estudio
comparativo basado en una recopilación de distintas series (22).
Hemos excluido las lesiones inflamatorias agudas y las crónicas
inespecíficas incluyendo solo aquellas lesiones inflamatorias que desde el
punto de vista clínico o anatomopatológico planteaban el diagnóstico de un
proceso neoplásico.
Lesiones pseudotumorales inflamatorias
Dentro de estos hemos encontrado 10 lesiones inflamatorias pseudotumorales
(6,2% del total) que se distribuyen de la siguiente manera:
— Quiste hidatídico: 2 casos.
— Pseudotumor inflamatorio: 3 casos.
— Pseudotumor lipogranulomatoso: 5 casos.
Lesiones pseudotumorales por anomalías del desarrollo
Un total de 49 lesiones quedan incluidas en este apartado (30% del total) y
su distribución es la siguiente:
— Dermoides:
* Quísticos: 18 casos.
* Sólidos: 7 casos.
* Dermolipomas: 1 caso.
* Conjuntivales: 4 casos.
— Q. Epidermoides: 10 casos.
— Microftalmía con Q. Colobomatoso: 4 casos.
— Anomalías de G. Lacrimal:
* Hiperplasia: 1 caso.
* Q. Ductal: 4 casos.
Como en todas las series revisadas, los dermoides son lo más frecuentes
(22,40) sus porcentajes oscilan entre el 30% y el 5% de todas las lesiones
orbitarias. La mayoría de ellos corresponden a lesiones quísticas y uno de
nuestros siete casos de dermoides sólidos formaban parte de un síndrome de
Goldenhar.
En cuatro casos las anomalías del desarrollo ocular dieron lugar a una
microftalmia con quiste colobomatoso, unilateral en todos los casos y no
existían otras malformaciones asociadas. Sólo uno de los casos no fue
diagnosticado clínicamente y planteó el diagnóstico diferencial con una
neoformación orbitaria.
Como ejemplo de encefalocele hemos encontrado una heterotopía glial a nivel
de la órbita en la que clínicamente no se demostró orificio de comunicación.
Una marcada hiperplasia de la glándula lacrimal, planteó en uno de nuestros
casos el diagnóstico diferencial con una neoplasia orbitaria. En cuatro casos
la patología lacrimal consistía en una dilatación quística del conducto que
podría corresponder a glándulas lacrimales ectópicas con fenómenos
ectásicos.
Tumores orbitarios primarios
Hemos identificado 94 lesiones primarias de la órbita. El rabdomiosarcoma es
el proceso neoplásico más frecuente en la órbita, tanto en nuestro material
(20 casos, 12,5%) como en las diferentes series publicadas (42). Según la nueva
clasificación del Instituto Nacional del Cáncer (18) los hemos reclasificado
en:
— Rabdomiosarcoma embrionario (15 casos):
a) Convencional:11 casos
b) Áreas de Citología agresiva: 3 casos
c) Células fusiformes: 1 caso
— Rabdomiosarcoma alveolar (5 casos):
a) Convencional:3 casos
b) Sólido: 2 casos
En 5 de nuestros casos hemos estudiado el tumor primario y la recidiva (1 R.
alveolar y 4 R. embrionarios, uno de éstos mostraba áreas de agresividad
citológica). Los rabdomiosarcomas convencionales mostraban en las recidivas
amplias zonas de diferenciación celular. En otros dos casos no hemos tenido
acceso al tumor primario por lo que sólo hemos estudiado las recidivas, una de
ellas presentaba una marcada diferenciación celular, en el segundo caso
existían amplias zonas de citología agresiva.
El segundo grupo en frecuencia lo constituyen los tumores pigmentarios, 9
lesiones (11,9%) que se distribuyen en nevus conjuntivales (5 casos) y nevus
compuestos los restantes 14 casos. En ninguno de nuestros casos existían nevus
displásicos ni melanomas.
Se han observado 16 casos de tumores con diferenciación vascular (10%), 10
de los cuales pertenecen a hemangiomas capilares en fase proliferativa, 4 casos
presentaban una imagen de malformación linfática-venosa y 2 correspondían a
hemangiomas cavernosos o a hemangiomas capilares en fase involutiva.
En 8 casos de nuestro material hemos encontrado diferenciación neural, 7
correspondían a neurofibromas de patrón plexiforme y los enfermos presentaban
un cuadro de neurofibromatosis. Hemos encontrado 1 caso de neurinoma pero no
tenemos ningún neurofibrosarcoma orbitario en la edad pediátrica.
A nivel del N. óptico hemos encontrado 4 tumores (2,5%), meduloepiteliomas 2
casos, glioma 1 caso y meningioma 1 caso.
Diferenciación adiposa existió en 7 casos de nuestro material, en todos
existía tejido adiposo maduro y diferenciado. Uno de los casos se acompañaba
de prolapso de la grasa orbitaria.
Encuadrables como tumores óseos hemos encontrado 10 casos (6,3%), 7
corresponden a granulomas eosinófilos monostóticos, y los restantes eran
sarcomas osteogénicos postradiación de retinoblastoma, Ewing primario de
órbita y fibrosis osificante psamomatoide.
Los tumores hematopoyéticos primarios orbitarios han resultado poco
frecuentes en nuestro material existiendo únicamente un sarcoma granulocítico.
Como tumor germinal hemos encontrado un solo caso de teratoma diferenciado en
el que no encontramos áreas de tumor del seno endodérmico.
Como tumores de origen neuroepitelial hemos incluido 2 casos de tumor
neuroectodérmico melanocítico y un caso de tumor neuroectodérmico periférico
de localización orbitaria.
Por último hemos incluido 4 lesiones epiteliales correspondientes a
papilomas conjuntivales que también planteaban problemas con neoplasias
orbitarias
Tumores orbitarios secundarios
1. Por extensión: En tres casos la órbita estaba infiltrada por un
retinoblastoma, previamente a todos se les había extirpado el globo ocular y en
dos de ellos, en la pieza quirúrgica, se comprobó infiltración del nervio
óptico.
Uno de nuestros casos presentaba la órbita infiltrada secundariamente por un
rabdomiosarcoma alveolar originado en región malar (figura 32).

Figura 32. Infiltración orbitaria secundaria por un rabdomiosarcoma
de maxilar. Imagen macroscópica de la pieza quirúrgica.
A nivel de la lámina cribosa de fosa nasal existía en uno de nuestros casos
un estesioneuroblastoma que igualmente infiltraba la órbita.
2. Metastásicos: Sólo hemos encontrado un caso de metástasis de
neuroblastoma que planteó diagnóstico diferencial con una neoplasia orbitaria
primaria.
BibliografÍa
- Wright JE, Sullivan TJ, Garner A, et al. Orbital venous anomalies.
Ophthalmology 1997; 104: 905-913.
- Rootman J. Why «orbital pseudotumor» is no longer a useful concept. Br J
Ophthalmol 1998; 82: 339-340.
- Grouteau E, Chaix Y, Armbruster V, et al. Arch Pédiatr 1998; 5: 153-158.
- Belmekki M, El Bakkali M, Abdellah H, et al. Epidemiology of orbital
processes in children. 54 cases. J Fr Ophthalmol 1999; 22 (3): 394-398.
- Mottow-Lippa L, Jakobiec FA, Smith M. Idiopathic inflammatory orbital
pseudotumor in childhood. II. Results of diagnostic tests and biopsies.
Ophthalmology 1981; 88: 565-574.
- Martinez LM, Cohen KL. Conjunctival dermoid cyst seen on examination as a
chronically red eye. Arch ophthalmol 1998; 116: 1.109-1.111.
- Goldstein MH, Soparkar CN, Kersten R, et al. Conjunctival cysts of the
orbit. Ophthalmology 1998; 105 (11): 2.056-2.060.
- Kodama T, Shibuya Y, Setogawa T et al. A case of microphthalmos with cyst
and partial trisomy 22. Ophthalmic Genetics 1998; 19(2): 93-97.
- Warburg M. Classification of microphthalmos and coloboma. J Med Genet
1993; 30: 664-669.
- Takahashi K, Mulliken JB, Kozakewich HP et al. Cellular markers that
distinguish the phases of hemangioma during infancy and childhood. J clin Invest
1994; 93: 2.357-2.364.
- Mulliken JB. Classification of vascular birthmarks. In: Mulliken JB,
Young AE, editors. Vascular birthmarks: hemangiomas and malformations.
Philadelphia: WB Saunders; 1988; 24-37.
- Katz SE, Rootman J, Vangueeravong S et al. Combined Venous lymphatic
malformations of the orbit (so-called lymphangiomas). Ophthalmology 1998;
105(1): 176-184.
- Harris G. Orbital vascular malformations: a consensus statement on
terminology and its clinical implications. Am J Ophthalmol 1999; 127(4):
453-455.
- Bilaniuk LT. Orbital vascular lesions. Radiol Clin North Am 1999; 37(1):
169-183.
- Croxatto JO, Font RL. Hemangiopericytoma of the orbit: A
clinicopathologic study of 30 cases. Hum Pathol 1982; 13 (3): 210-218.
- Hatsukawa Y, Furukawa A, Kawamura H et al. Rhabdomyoma of the orbit in a
child. Am J ophthalmol 1997; 125 (1): 146-147.
- Mafee MF, Pai E, Philip B. Rhabdomyosarcoma of the orbit. Evaluation with
MR imagin and CT. Radiol Clin North Am 1998; 36(6): 1.215-1.227.
- Cooffin CM. The new international rhabdomyosarcoma clasification, its
progenitors, and considerations beyond morphology. Adv in Anat Patholol 1997; 4
(1): 1-16.
- Tsokos M, Weber BL, Parham DM, et al. Rhabdomyosarcoma. A new
clasification scheme related to prognosis. Arch Pathol Lab Med 1992; 116:
847-855.
- Kodet R, Newton WA, Hamouidi AB, et al. Orbital rhabdomyosarcomas and
related tumors in childhood: relationship of morphology to prognosis-And
intergroup rhabdomiosarcoma study. Med Pediatr Oncol 1997; 29: 51-60.
- Horn R, Enterline HT. Rhabdomyosarcoma, a clinico-pathological study and
classification of 39 cases. Cancer 1958; (11): 181-199.
- Sternberg SS. Diagnostic surgical pathology (vol. 1). Baltimore: Williams
& Wilkins. Lippincott. 1999; 975-1.007.
- Dalley RW. Fibrous histiocytoma and fibrous tissue tumors of the orbit.
Radiol Clin North Am 1999; 37 (1): 185-194.
- Font RL, Hidayat AA. Fibrous histiocytoma of the orbit: A
clinicopathologic study of 150 cases. Hum Pathol 1982; 13: 199-209.
- Carrol GS Haik BG, Fleming JC et al. Peripheral nerve tumors of the orbit
. Radiol Clin North Am 1999; 37 (1): 195: 202-213.
- Jackson IT, Carbonel A, Potparic Z et al. Orbitotemporal
neurofibromatosis. Clasification and treatment. Plast Reconstr Surg 1993; 92: 1.
- Marquardt MD, Zimmerman LE. Histopathology of meningiomas and gliomas of
the optic nerve. Hum Pathol 1982; 13: 226-235.
- Albert DM, Jakobiec FA. Principles and practice of Ophthalmology. 2nd ed.
Philadelphia: Saunders; 1994; 2.359-2.370.
- Margo C E, Mulla ZD. Malignant tumors of the orbit. Analysis of the
Florida Cancer Registry. Ophthalmology 1998; 105(1): 185-190.
- Shields JA, Eagle RC, Shield CL et al. Congenital neoplasm of the non
pigmented ciliary epithelium (medulloepithelioma). Ophthalmology 1996; 103:
1.998-2.006.
- Abelairas JM, Perera A, Regules E, et al. Meduloepitelioma (dictyoma) del
nervio óptico. Arch Soc Esp Oftal; 1990; 58: 385-392.
- Zimmerman LE, Font RL, Anderson SR. Rhabdomisarcomatous differentiation
in malignant intraocular medulloepitheliomas. Cancer 1972; 30 (3): 817-835.
- Apple DJ, Rabb MF. Ocular pathology. Clinical applications and
selff-assessment. Mosby Year Book. 1991; 246-248.
- Sreenan C, Johnson R, Rusell L et al. Congenital orbital teratoma. Am J
Perinatol 1999; 16(5): 251-255.
- Pettinato G, Manivel JC, D'Amore ES, et al. Melanotic neuroectodermal
tumor of infancy. A re-examination of a histogenetic problem based on
inmunohistochemical, flow citometry, and ultrastructural study of 10 cases. Am J
of Surgical Pathology 1991; 15: 223-245.
- Kapadia SB, Frisman DM, Hitchcock CL et al. Melanotic neuroectodermical
tumor of infancy. Clinicopathological, inmunohistochemical, and flow cytometric
study. Am J Surg Pathol 1993; 17 (6): 566-573.
- Galera-Ruiz H, Gómez-Ángel D, Vázquez-Ramírez FJ et al. Fine needle
aspiration in the preoperativbe diagnosis of melanotic neuroectodermal tumor of
infancy. Journal of Laringology and Otology 1999; 113: 581-584.
- Lamping KA, Albert DM, Lack E, et al . Melanotic neuroectodermical tumor
of the infancy (retinal anlage tumor). Ophthalmology 1985; 92: 143-148.
- Croxatto JO, Iribarren G, Ugrin C, et al. Malignant melanoma of the
conjuntiva. Report of a case. Ophthalmology 1987; 94: 1.281-1.285.
- Kiratli H, Bilcic S, Gedikoglu G, et al. Primitive neuroectodermic tumor
of the orbit in an adult. Ophthalmology 1999; 106: 98-102.
- Arora R, Sarkar C, Betharia SM. Primary orbital primitive neuroectodermal
tumour with immunohistochemical and electron microscopic confirmation. Orbit
1993; 12: 217-221.
- Jakobiec FA, Ocular and adnexal tumors, Birminghan, Alabama. Aesculapius
Publishing Co, 1978; 669-684.
- Reddy EK, Bhatia P, Evans R. Primary orbital lymphomas. Int J Radiation
Oncology biol phis 1988; 15(5): 1.239-1.241.
- Stockl FA, Dolmetsch AM, Saornil MA, et al. Orbital granulocytic sarcoma.
Br J Ophthalmol 1997; 81: 1.084-1.988.
- Puri P, Grover AK. Granulocytic sarcoma of the orbit preceding acute
myeloid leukaemia: a case report. Eur J Cancer Care 1999; 8(2): 113-115.
- Harstein ME, Grove AS, Woog JJ et al. The multidisciplinary management of
psamomatoid ossifying fibroma of the orbit. Ophthalmology 1998; 105 (4):
591-595.
- Katz BJ, Nerard JA. Ophthalmic manifestations of fibrous dysplasia: a
disease of children and adults. Ophthalmology 1998; 105: 2.207-2.215.
- Lam DS, Li CK, Cheng LL, et al. Primary orbital Ewing`s sarcoma: report
of a case and review literature. Eye 1999; 13(1): 38-42.
- Chynn EW, Rubin PA. Metastatic Ewing cell sarcoma of the sinus and
osteoid osteoma of the orbit. Am J Ophthalmol 1997; 123(4): 565-569.
- Miller NR, ed. Walsh and Hoyt's neuro-ophthalmology. 4 th ed. Baltimore:
Williams & wilkins; 1988; vol. 3: 1.296-1.300.
- Bittinger A, Rossberg C, Rodehüser M. Primary malignant ectomesenchymoma
of the orbit. Gen Diagn Pathol 1996/97; 142: 221-225.
|