
Principios y técnicas básicas. Substitutos vítreos
B. Corcóstegui, C. Mateo
La cirugía intravítrea se ha convertido en uno de los abordajes más comunes quirúrgicos en la oftalmología. Los objetivos generales de la vitrectomía son aclarar las opacidades, extraer tejidos o materiales extraños y favorecer la curación de la retina y su mantenimiento estable. También nos da acceso directo sobre la retina pudiéndola reponer o extraer membranas y tejidos que entorpezcan su reextensión. Podemos coagular vasos o roturas e introducir líquidos o gases para tener efectos ulteriores.
La indicación de esta cirugía se basa en la valoración del estudio del ojo preoperatorio y la función que se espera después de la intervención, y el riesgo que la propia intervención que se somete al ojo. En general de acuerdo con la intervención ocular se espera un mantenimiento visual del proceso o una mejoría.
ANATOMÍA QUIRÚRGICA
Para entender la cirugía intraocular por la pars plana hay que conocer las interrelaciones entre las capas internas y externas del ojo (1). La referencia usada para las medidas en la vitrectomía por la pars plana es el limbo. El ojo adulto se alcanza a los 7-8 años y la ora serrata esta entre 6 a 7del limbo en la zona nasal y entre 6 a 8,5en la zona temporal. Esta distancia es algo menor en los hipermétropes siendo mayor en los miopes y esta en general en relación con su grado de ametropía. El cuerpo ciliar ocupa unos dos milímetros posterior al espolón escleral en los 360° y posterior a el, esta la pars plana. Así tiene una extensión anteroposterior de 4-5y por tanto las esclerotomías de entradas se realizan sobre ella a 3-4del limbo detrás del cuerpo ciliar. La pars plana está exenta de vasos retinianos pero no coroideos y se halla en la parte anterior de la base del gel vítreo (2).
El gel vítreo es una matriz tridimensional de fibras de colágeno y ácido hialurónico. En el estado normal la superficie externa de este gel se halla íntimamente unida a la cara interna de la retina, la pars plana, cuerpo ciliar y cara posterior del cristalino. Tiene un volumen aproximado de unos 4 ml en los ojos emétropes y anatómicamente contiene una porción interna llamada gel vítreo y otra externa que es denominada como cortex. En el centro del espacio del gel existe un vestigio del sistema hialoideo vascular que se denomina canal de Cloquet, que se extiende desde el centro del disco óptico hasta la cara posterior del cristalino (3,4). El cortex tiene una superficie más fibrosa y gruesa. Estas fibras están firmemente unidas a la lámina basal de la periferia de la retina y al epitelio de la pars plana en la llamada base del vítreo. La base del vítreo mide entre 3,2 a 4,5en su extensión anteroposterior. Se extiende de 0,5 a 1,5anterior a la ora serrata y de 1,8 a 3mm posterior a la ora serrata. El cortex vítreo además está más firmemente adherido en el margen de la papila y sobre los vasos retinianos y la mácula. Algunos otros anclajes firmes pueden ser hallados en la retina (5) (fig. 1).
La separación del vítreo posterior se produce por una degeneración y liquefacción en forma de lagunas en el gel vítreo. Estas lagunas tienden a pasar por aberturas en el cortex y separando de sus uniones más débiles. Con el colapso anterior del vítreo tiende el gel a desplazarse anteriormente y se puede separar completamente. Con una separación completa el vítreo puede quedar unido solo a la base del vítreo. Con separaciones incompletas el gel vítreo puede quedar unido a la retina en puntos de fuerte junción o en proliferaciones fibrosas o fibrovasculares, que pueden ser secundarias a inflamaciones, trauma u otras alteraciones. Estas uniones anómalas pueden crear tracción sobre la retina y sus vasos, pudiendo condicionar rupturas retinianas, avulsión de los vasos o rupturas vasculares con hemorragia en el vítreo. Dependiendo de los puntos de anclaje del cortex vítreo la configuración del gel es diferente y puede condicionar el planteamiento quirúrgico dependiendo de la patoanatomía.
ENTRADAS AL OJO
Los instrumentos son inspeccionados y probados previamente a introducirlos en el ojo, observando que el líquido pasa por las vías de aspiración y la cánula de infusión esta abierta.
La luz de la fibra óptica ha sido encendida y el movimiento X-Y del microscopio cumple en la situación correspondiente al ojo. La silla del cirujano debe estar a una altura confortable para mover los pedales que han sido apropiadamente dispuestos.
ABERTURA CONJUNTIVAL
Si se plantea colocar un procedimiento de indentación escleral se realiza una disección de la conjuntiva en los 360°. A 2-2,5del limbo se diseca la conjuntiva y la cápsula de Tenon dejando completamente la esclera al descubierto. Los puntos sangrantes conjuntivales deben ser cauterizados utilizando una pinza de diatermia bipolar. En las reintervenciones la manipulación de la conjuntiva tiende a ser dolorosa y puede suplementarse con infiltraciones de anestesia con Mepivacaina al 2%. Los cuatro músculos rectos deben ser cazados con un gancho fenestrado colocando un hilo de seda de 4-0 alrededor de su inserción para poder movilizarlo. Después se precolocarán las suturas esclerales para emplazar el procedimiento de indentación. Si no se prevé colocar procedimientos esclerales solo será necesario realizar una disección conjuntival en la zona temporal entre las 11 a 4 horas para emplazar las esclerotomías y otra pequeña incisión nasal para realizar la esclerotomía nasal.
ESCLEROTOMÍAS
Las esclerotomías deben estar emplazadas lo más cercanas a los meridianos horizontales para que nos permitan el acceso con los instrumentos tanto a la periferia retiniana superior e inferior. La vía de infusión la emplaza inferior al meridiano de la inserción del músculo recto. Especialmente elegimos la posición que coincida con el canto externo que en ojos con hendidura palpebral pequeña nos puede beneficiar en el desplazamiento del globo. Las esclerotomías para los instrumentos activos se sitúan justamente superior al meridiano de los músculos rectos con una separación de 160-170°, en una situación apropiada que no moleste la movilidad de los instrumentos con la cánula de infusión y el separador (6). Los vasos epiesclerales son coagulados con diatermia utilizando la diatermia bipolar coaxial que cierra los vasos epiesclerales. En el lugar donde se va a emplazar la cánula de infusión extendemos la zona de diatermia y suturamos con nylon 5-0 a 1a cada lado de donde va a ir emplazada la esclerotomía para colocar la cánula de infusión (fig. 2). La coagulación diatérmica de los vasos epiesclerales y de la conjuntiva evita el paso de sangre a la superficie corneal y una adecuada visualización durante la vitrectomía.
La distancia de la esclerotomía-limbo depende de si el ojo es fáquico, pseudofáquico o afaco. En el ojo fáquico se coloca a 4del limbo para evitar que los movimientos de los intrumentos puedan lesionar el cristalino. En el caso de pacientes afáquicos, pseudofáquicos o que vamos a extraer el cristalino lo podemos realizar a 3 mm. La incisión escleral se realiza con un cuchillete cortante por ambas partes que se denomina estilete para microvitreorretina (MVR). Este cuchillete MVR tiene un diámetro de 1,4de anchura para conseguir un diámetro de abertura de 0,89que corresponda a los instrumentos del calibre 20 (6). De esta manera el vástago de los instrumentos cierra la esclerotomía y se consigue dentro del ojo un compartimento completamente estanco. El cuchillete MVR cuando hacemos la incisión debe dirigirse hacia el centro del globo ocular e introducirlo unos 5 ó 6 mm. Normalmente es observado su paso a través del eje visual (7). La primera esclerotomía practicada es la correspondiente a la cánula de infusión y se introduce inmediatamente después de la esclerotomía. Se comprueba que fluya líquido a través de ella y posteriormente es insertada en el espacio intraocular con el paso de líquido cerrado. Una cánula de 4,0de longitud es utilizada comúnmente, pero si la coroides se halla engrosada o la pars plana se halla cubierta por tejido denso sanguineo o fibrótico es preferible utilizar una cánula de 6que profundizará más en el espacio vítreo (7). La cánula es introducida y fijada a la esclerótica mediante la sutura prefijada de nylon. Si la punta de la cánula no es visible, realizando una presión sobre ella hacia el centro del globo e iluminándola con una fibra óptica, una infusión subretiniana puede aparecer al pasar líquido. Si la punta queda ocultada debe ser identificada antes de que la infusión de líquido sea abierta. En estos casos una aguja del calibre 20 con infusión es introducida por otra esclerotomía y abieto el paso del líquido en el espacio intravítreo. La cánula de infusión es presionada hacia el centro del globo y si observamos tejido sobre ella es disecado con la aguja de infusión del calibre 20. El ayudante puede enfocar la cánula de infusión con una fibra óptica a través de la pupila (fig. 3). Cuando queda completamente liberada de tejido puede abrirse la cánula de infusión (8).
La esclerotomía nasal es practicada normalmente después, y se emplaza la fibra que es encendida para iluminar las estructuras endoculares. La última esclerotomía suele ser la temporal y es introducido el vitrectomo por ella. Aunque puede cambiarse la posición de los instrumentos activos durante la intervención para la vitrectomía es preferible colocar el vitrectomo por la esclerotomía temporal ya que la movilización por esta vía suele ser algo mayor que por la nasal debido a las condiciones anatómicas del reborde orbitario y la nariz del paciente. Los instrumentos son dirigidos en principio al centro de la cavidad vítrea existiendo una distancia de unos 1,6mm entre el vastago de los instrumentos y la cápsula del cristalino en las esclerotomías a 3y de 2,8 en las esclerotomías a 4 (fig. 4) (6).
LENTES PARA LA VISUALIZACIÓN
Para el examen de las estructuras del fondo del ojo es necesario interponer lentes precorneales (tabla 1). Estas lentes pueden ir encajadas en un anillo que se soporta a la esclerotomía o soportados mediante un mango por el ayudante. Si las lentes están sujetadas por el anillo confieren una mayor estabilidad y una menor dependencia del ayudante. Este anillo se sutura a la esclerótica a 2 mm del limbo con suturas de nylon de 5-0 colocadas 180° una opuesta de la otra. La posición habitual de las suturas del anillo de soporte es a las 12 y 6 horas, aunque en pacientes intervenidos de catarata recientemente con incisiones superiores o de cirugía filtrante puede colocarse en meridianos horizontales. La posición del anillo debe estar perfectamente centrado con el limbo corneal para alcanzar la mejor eficacia en la visualización.

Existe una variedad grande de lentes para la cirugía vítreorretiniana. Las convencionales incluyen una para observar la mácula, su entorno y las arcadas vasculares, alcanzando zonas más periféricas cuando el globo se desplaza (9). Las lentes prismáticas de diferente potencia que se utilizan para observar zonas periféricas del fondo (10,11). También lentes con un doble espejo con alta inclinación pueden ser utilizados especialmente para examinar la parte más periférica de la retina (12). Las lentes de contacto con superficie altamente convexa han sido popularizadas en los últimos años y proveen una mayor visión panorámica del fondo del ojo que puede alcanzar hasta la ora serrata (13). Requieren colocar un inversor en el cuerpo del microscopio para que el cirujano reciba la imagen con apariencia recta (14). Estas lentes pueden ser integradas fácilmente en los anillos de soporte para las lentes convencionales y neutralizar el astigmatismo corneal. Inclinándola ligeramente puede aumentarse el grado de visualización en la periferia con mínima aberración óptica (13). Requieren estas lentes un ayudante entrenado a sujetarlas y recordar que los movimientos X-Y del microscopio deben ser revertidos durante el uso de estos sistemas. Estas lentes tienen campo de visualización de 68° para trabajar en la mácula y las arcadas vasculares y de 130° que permite trabajar en la periferia del fondo de ojo inclinando la lente. Las lentes que proveen 160° no tienen ventajas ópticas sobre las de 130° y crean bastantes aberraciones ópticas cuando se trabaja en periferia extrema.
Existen otros medios de visualización panorámica utilizando sistemas sin contacto corneal. El BIOM que es el Binocular Indirecto Oftalmo-Microscopio (15). Es un sistema óptico que esta suspendido bajo la óptica del microscopio y alineado coaxialmente con el microscopio quirúrgico. Durante la cirugía extraocular el BIOM es desplazado de la zona de observación y requiere una imagen recta como las lentes de campo amplio, la observación es invertida y para obtener una imagen recta requiere un inversor en el cuerpo del microscopio. Una variante al sistema BIOM es el llamado EIBOS que significa Erecto Indirecto Binocular Oftalmoscopio Sistema, que proporciona una imagen practicamente idéntica al BIOM y no requiere inversión de imagen ya que la inversión se realiza directamente en le propio sistema mediante unos espejos. Estos sistemas sin contacto requieren trabajar muy cerca de la cornea para obtener un buen campo de trabajo y en ocasiones durante la irrigación corneal puede ensuciarse la óptica. No requieren contacto corneal, permiten un buen desplazamiento del globo y requiere poco entrenamiento el personal ayudante para su uso.
Ambos sistemas de campo amplio de contacto o no son elegidos en general por las preferencias del cirujano y por su lugar de formación y entrenamiento. Todos ellos tienen unas indudables ventajas respecto a las lentes convencionales como son la observación panorámica del fondo, la visualización mejor con pupilas estrechas, y mejor visión en caso de opacificación corneal y opacidad del cristalino. Son actualmente obligadas para tener una buena visualización después del intercambio líquido-aire, especialmente en los pacientes fáquicos. Las lentes biconcavas de alto poder dióptrico tienen un pequeño campo de visión con gas y han quedado completamente abandonadas para la maniobra de intercambio líquido-aire especialmente en fáquicos (11).
VITRECTOMÍA BÁSICA
Los instrumentos son tomados por los dedos índice y pulgar de ambas manos estabilizándolos apropiadamente para movilizarlos confortablemente. Todos los movimientos en dirección antero-posterior y horizontal deben poder ser realizados. En los ojos con prominente reborde orbitrario o más hundidos en la órbita pueden estar más comprometidos los movimientos. Los movimientos son ejercidos con igual fuerza en ambos instrumentos evitando una fuerza desigual en cada instrumento que provoque deformación de la cornea con un compromiso de la visualización. Utilizando las lentes convencionales posteriores o prismáticas con ambos instrumentos debemos desplazar el globo ocular para acceder a un tejido. Utilizando los sistemas de visualización panorámica mediante lentes de campo amplio no se requiere desplazamiento del globo para acceder a un tejido y rotando los instrumentos en las esclerotomías y desplazándolos podemos acceder a ellos (figs. 5 y 6).
Al inicio de la vitrectomía introducimos la endosonda de iluminación unos 3 mm en la cavidad vítrea y el vitrectomo es desplazado de la parte anterior hacia el centro de la cavidad vítrea. Normalmente seleccionamos un nivel de corte entre 600 y 800 por minuto y una presión máxima de aspiración de 125-150 mmHg. El vitrectomo en cuanto es observable en el campo de trabajo debemos fijarnos su eficacia en el nivel de corte y aspirado y si alguna función es inadecuada, detener las maniobras intraoculares y detectar donde esta el fallo del sistema.
Si el instrumento esta trabajando apropiadamente el vitrectomo debe moverse en la cavidad vítrea central para ir buscando el gel vítreo desde la parte central y posterior hacia las zonas periféricas en los 360° (6). El reenfoque del microscopio y los movimientos X -son constantes para mantener los instrumentos centrados en la imagen. La abertura del vitrectomo debe orientarse hacia el tejido que vamos a extraer y movilizarlo hacia él. No se debe mover el gel vítreo traccionándolo de su posición a la abertura del vitrectomo.
El gel vítreo escindido desde la parte central debe reconocer la hialoides posterior y cortarse en un lugar que este alejada de la retina y posteriormente se amplía esta abertura hasta poner en evidencia la retina. Desde ese punto y en movimientos de rotación espirales extraemos el gel vítreo en zonas más periféricas (fig. 7). Para extraer el vítreo en las zonas periféricas la endosonda de luz puede dirigirse hacia la parte posterior y buscar su reflectancia para poder ser iluminada, o bien iluminarse la cara posterior del cristalino para poder proveer luz en el gel periférico (fig. 8). El intercambio de posición en los instrumentos nos permite extraer el gel vítreo practicamente en los 360°. La iluminación directa atravesando con la fibra óptica por dentro del cristalino al gel vítreo periférico es normalmente peligroso y poco eficaz poniendo en riesgo el cristalino de un posible contacto con el vástago del instrumento (fig. 9). Mediante indentación escleral asistida por el ayudante podemos acceder muchas veces mejor a la periferia de la retina. En intercambio de mano de los instrumentos de iluminación y vitrectomía nos beneficia en el acceso del gel vítreo en las zonas periféricas. Con el instrumento de vitrectomía podemos extraer el gel periférico en la hemicircunferencia donde el vitrectomo se halla introducido. En la zona inferior más distal debemos asistirnos de presión escleral para poder extraer el gel periférico (fig. 10).
MANTENIMIENTO DE LA PRESIÓN OCULAR
La presión intraocular durante la intervención no solo se remite a mantener la presión constante por la reposición del volumen ocular extraído por un líquido sino también por la necesidad de variar la presión en diferentes momentos de la vitrectomía. Realizar isquemia por aumento tensional en pacientes con sangrado e hipertensión arterial o pacientes que presentan cornea con endotelio debilitado que requieren una relativa hipotensión para mantener la transparencia corneal.
La presión intraocular depende de la presión de infusión de líquido intraocular restando la aspiración que realizamos y posibles pérdidas de líquido a través de las esclerotomías o de los propios instrumentos.
Existen dos sistemas para mantener la presión infundiendo líquido de manera constante dentro del ojo: Por presión hidrostática y utilizando la bomba de aire en el sistema de infusión.
PRESIÓN HIDROSTÁTICA
La diferencia de altura entre la botella de líquido infusión y el ojo del paciente crea un gradiente de presión que se transmite al interior del ojo. Dependiendo de la altura de la botella de infusión respecto al ojo tendremos diferente presión ocular en un sistema cerrado, es decir sin ninguna pérdida (tabla 2). Normalmente la botella de infusión debe ser colocada entre 25 y 35 cm por encima del globo obteniendo una presión constante (16). Hay que poner atención cuando la botella de infusión tenga poco líquido para no crear una disminución de la presión ocular de forma severa. Ante posible sangrado o necesidad de incrementar la presión de forma rápida subimos la botella de infusión a altos niveles de presión.

CONTROL DE LA PRESIÓN DE INFUSIÓN DE LíQUIDO CON LA BOMBA DE AIRE
Mediante este sistema la bomba de aire envía presión a la botella de infusión. El aire de la botella mantiene una tensión que hace enviar al globo ocular una presión constante. La botella de infusión debe colocarse a la altura de la cabeza del enfermo para no adicionar la presión hidrostática levantando la botella. Los primeros sistemas de control de la presión por la bomba de aire inyectaban el aire en la parte inferior de la botella de infusión y hacía que la recuperación tensional fuera muy lenta (17). Los nuevos sistemas conectan a través de una cánula larga con la parte de aire de la botella de infusión. Con los nuevos mecanismos el control de la presión ocular es bastante preciso y al descender la presión de la bomba de aire disminuye la presión en el globo ocular.
En los casos de intercambio líquido aire el mantenimiento de la presión es necesario realizando a través de una bomba de aire que envía aire filtrado hasta un nivel preseleccionado de la presión. Son bombas inyectoras de presión dependientes que cuando alcanzan la presión establecida evitan que pase más volumen dentro del ojo.
La presión de infusión intraocular normalmente debe mantenerse entre 20-30 mmHg. Las situaciones sostenidas de hipertensión ocular puede producir edema corneal con mala visualización, posible isquemia de nervio óptico con lesiones campimétricas secundarias y posibles rupturas retinianas por enclavamiento en las esclerotomías al retirar los instrumentos en situaciones de hipertensión ocular. La hipotonía ocular tiende a producir queratopatía estriada, tendencia a la miosis y sangrado retiniano. La presión ocular es más difícil de mantener en situaciones de infusión no convencionales como las cánulas de calibre 23 o los sistemas de irrigación con fibra de iluminación en su interior. En ambos casos existe una disminución del flujo de infusión y es por esto, la dificultad de mantener la presión con estos sistemas.
ILUMINACIÓN ENDOCULAR
La iluminación que proveemos al interior del globo podemos hacerla a través de una luz externa que atraviesa los medios transparentes del globo ocular y enfoque las estructuras internas o bien introduciendo fibras ópticas a través de las esclerotomías que iluminen directamente los tejidos.
Externamente tiene la desventaja que tenemos que atravesar los medios oculares y la propia lente interpuesta, y alcanzar de forma precisa los tejidos que queremos manipular. Tiene la ventaja de que dentro del ojo podemos manipular con cualquier instrumento ya que la iluminación se provee desde el exterior. En el pasado se utilizó la lámpara de hendidura que proveían luz endocular a través del microscopio quirúrgico, pero en la actualidad están casi abandonadas. Si se requiere iluminación externa nosotros la realizamos a través de una fibra óptica endocular colocada en la superficie de la lente pero esta maniobra es realizada ocasionalmente para trabajar bimanualmente en la periféria de la retina en pacientes con membranas en vitreorretinopatías proliferativas anteriores.
La iluminación endocular directa es la más comúnmente utilizada y puede realizarse de tres maneras:
1) Sondas de endoiluminación. 2) instrumentos activos con luz y 3) sistemas de irrigación asistidos de luz.
1. Las sondas de endoiluminación las más comúnmente utilizadas para iluminar la cavidad intravítrea. Son las fibras cortada su terminal perpendicular o el tipo bala (bullet type). Las cortadas perpendiculares su punta son las convencionales y proveen una luz concentrada en un área y dependiendo de su localización tienen un cierto efecto de lámpara de hendidura y puede distinguirse muy eficazmente el gel vítreo periférico. Dependiendo de la distancia que nos pongamos al tejido que trabajamos tenemos mayor o menor campo de iluminación. El tipo bala que su punta tiene una forma de bala tiene una tendencia a dispersar la luz y son muy adecuadas para proveer una iluminación difusa del fondo del ojo. Son útiles cuando se trabaja en el fondo del ojo con sistemas de campo amplio ya que ilumina una extensa área pero al tener tan poca concreción su luz, en ocasiones, pierde el contraste capaz de diferenciar el gel periférico y otros detalles. Además la luz puede reflejar hacia el eje visual entorpeciendo la calidad de visión. Estas fibras se utilizan fundamentalmente en videos de carácter docente o promocional
Las fibras ópticas pueden tener en su punta espátulas y picas que podrán asistirnos a la disección de tejidos en ciertas maniobras quirúrgicas. También pueden tener tubo de infusión-aspiración ayudándonos a infundir ó aspirar fluidos de la cavidad ocular en algunas circunstancias. El manipulador de tejidos (18) es una fibra óptica de iluminación con otros elementos adicionados que puede aspirar e infundir líquidos y realizar diatermia bipolar. Su calibre es del 19 ó 20 y lleva un tubo aislado del calibre 30 en su interior. Por este tubo y por la pared de la fibra óptica se puede transmitir la corriente de radiofrecuencia diatérmica para coagular los tejidos por el tubo puede aspirarse líquidos o tejidos traccionando de ellos. El manipulador ha sido ideado básicamente para el trabajo en las proliferaciones fibrovasculares retinianas como son la retinopatía diabética, pero puede ser válido en otras circunstancias en la manipulación de tejidos.
2. Los instrumentos activos con luz son básicamente las tijeras y las pinzas. En ambos instrumentos una fibra óptica suplementaria es introducida a través del vástago de la tijera ó la pinza y la punta de la fibra termina encima de la zona activa del instrumento.
3. Los sistemas de irrigación asistidos con luz se han prodigado extraordinariamente durante los últimos años. Consiste en una cánula de infusión con paredes adelgazadas a la cual se le ha añadido en su interior una fibra óptica. Así desde la parte superior iluminaremos el campo de trabajo sobre la retina. Con este sistema nos permite utilizar cualquier instrumento para realizar cirugía bimanual por las otras esclerotomías. Tiene la desventaja que al estar disminuido su flujo de infusión por su fibra óptica interna el mantenimiento de la presión intraocular se hace más difícil. Es conveniente utilizar niveles más bajos de aspiración durante la vitrectomía para extraer más lentamente los tejidos endoculares. También incrementamos algo el nivel de presión de base para evitar las hipotensiones oculares durante la operación. También pueden producir sombra con los propios instrumentos sobre la retina, situación que puede mejorarse deslizando la fibra óptica al campo de trabajo. También adicionando un instrumento activo con iluminación solventamos este problema (figs. 11 y 12).
El sistema MIS (Multiport Illumination System) consiste en unas pequeñas cánulas -trocar que se sujetan en cada entrada y que esta provista en su pared de pequeñas fibras ópticas capaces de iluminar desde la propia entrada. La posición de la iluminación puede variarse y a través de estas cánulas puede introducirse instrumentos convencionales del calibre 20 (19,20). El MIS tiene algunas limitaciones como la introducción de algunos instrumentos angulados como tijeras de ángulo recto, solo pueden utilizarse instrumentos del calibre 20 y la incisión escleral que requieren es notablemente mayor que las convencionales.
La cantidad de luz que llega al interior del ojo depende de varios factores como son, las fuentes de iluminación el tipo de fibra óptica y su calidad de transmisión. La cantidad de luz que llegue a la retina tiene que ser la mínima para poder hacer el trabajo correcto, el exceso de luz especialmente el espectro azul provoca lesiones retinianas. Cualquier tipo de luz cercano a la retina puede producir una lesión de tipo fotóxico (21,22,23) sobre retina aplicada fundamentalmente aunque también se ha descrito en casos con desprendimiento de la retina (24). Algunas medidas debemos aplicar siempre para evitar estas complicaciones como; enfocar la mácula con el endoiluminador el menor tiempo posible, especialmente sino se trabaja sobre ella. Utilizar la mínima luz que permitan un trabajo correcto. Utilizar fuentes de luz con filtro para el azul. Si existe hemorragía prerretiniana aspirarla al final del procedimiento porque supone un excelente filtro retiniano de protección.
LENSECTOMÍA
Se denomina como lensectomía la extracción del cristalino llevado a cabo por la pars plana. Se realiza cuando esta opaco limitando las maniobras endoculares, aunque también se extrae el transparente en ocasiones para acceder a la periferia en la retina. Típicamente las opacidades subcapsulares posteriores decrecen enormemente la visualización y la decisión es tomada preoperatoriamente. Raramente el cristalino se opacifica duramente la intervención salvo en lesiones accidentales de la cápsula posterior. En ocasiones es también necesario extraer el cristalino transparente para poder trabajar adecuadamente en la periferia de la retina y extraer el gel periférico y que no queden remanentes para producir ulteriores tracciones postero-anteriores. Clasicamente requiere extracción del cristalino claro en casos con vítreorretinopatía proliferativa anterior severa, traumatismo severos oculares y en algunos casos de desgarro gigante. La dureza del núcleo es gradada de 0 a +4 y la dureza +4 típicamente corresponde a un núcleo brunescente. Normalmente todos los núcleos pueden ser extraídos por la pars plana pero en casos de extrema dureza tiene que ser desplazado a cámara anterior y extraído por el limbo.
Si la visualización esta comprometida para quitar el gel vítreo la lensectomía será la primera maniobra. Si la visualización es posible extraemos primero el gel vítreo evitando que el gel vítreo se mezcle con el material cristaliniano ante una posible ruptura accidental capsular.
Por la esclerotomía nasal introducimos una aguja doblada unos 45° del calibre 20 para crear una infusión de líquido dentro del cristalino (25). Por la esclerotomía nasal introducimos el facofragmentador y comenzamos la lensectomía. El material nuclear es extraído utilizando pulsos cortos de facofragmentación evitando el calor generado por una prolongada exposición a los ultrasonidos. La aguja introducida intracristaliniana sujeta el núcleo evitando su desplazamiento e irriga líquido que beneficia en evitar el calentamiento de la punta y en favorecer la absorción del material fragmentado. El núcleo es extraído totalmente dentro del espacio con la potencia de ultrasonido mínima que haga fragmentar el material y un nivel de aspiración entre 100 y 150 (fig. 13). En núcleos más blandos puede ser utilizado el vitrectomo que no genera calor y corta las fibras vítreas ante posibles incarceraciones del gel en el saco cristaliniano. De hecho con el vitrectomo pueden extraerse con más lentitud casi todos los cristalinos incluso con el núcleo endurecido. Con la aguja de infusión empujamos el material a la boca del vitrectomo y lo extraemos. La extracción del núcleo con el vitrectomo supone habitualmente un daño al sistema de corte y requiere desecharlo después de la lensectomía y extraer el gel vítreo con otro vitrectomo con un sistema de corte intacto. El cortex periférico es aspirado desde detrás del iris en la parte posterior de la cápsula anterior hacia la zona central del espacio cristaliniano. Esta maniobra puede hacerse con el vitrectomo colocando la boquilla del vitrectomo lateralmente para no dañar la cápsula anterior. Normalmente con 6 u 8 maniobras de aspiración puede succionarse todo el material cortical (fig. 14).
Cuando solo queda las cápsulas, la cápsula posterior puede extraerse con el vitrectomo y si decidimos introducir una lente intraocular dejamos la cápsula anterior para poder introducir una lente intraocular en el sulcus a través de una incisión limbar. Solamente es aplicada esta técnica en algunos casos de retinopatía diabética, membrana epirretiniana macular y agujero de la mácula principalmente. En la mayoría de los casos la cápsula es extraída totalmente tomándola con una pinza y traccionándola hacia el centro del globo y cortando con el vitrectomo en los 360° (fig. 15) (26).
Si la cápsula es rasgada durante la maniobra de extracción del núcleo el material cortical puede dislocarse hacia la parte posterior. Si se ha practicado vitrectomía previa puede elevarse con el facofragmentador el material corticonuclear al centro de la cavidad del vítreo y ser fragmentado y aspirado. Si la vitrectomía no ha sido realizada es mejor extraerlo con el vitrectomo ayudados con el iluminador empujando pequeños fragmentos nucleares en la boquilla del vitrectomo (fig. 16). Con esta maniobra no es infrecuente la oclusión de la vía de aspiración a nivel del vitrectomo quedando parada la posibilidad de aspiración. Esta eventualidad es más infrecuente con el instrumento de ultrasonidos. Si la línea de aspiración esta obstruida es necesario extraer el instrumento de la cavidad vítrea y refluir líquido a alta presión a través de una llave de tres pasos, pasando el líquido con una jeringa a alta presión. El reflujo de la propia máquina suele ser insuficiente para esta maniobra.
DISECCIÓN DE MEMBRANAS
Es la separación del tejido proliferativo que ha crecido anómalamente sobre la superficie interna de la retina; dependiendo de la naturaleza de las membranas realizaremos diferentes maniobras básicas como pelado, segmentación o delaminación.
PELADO DE LAS MEMBRANAS
Significa la separación de una membrana por tracción mecánica y a través de esta fuerza ejercida. Típicamente el pelado es realizado en los casos de membrana epirretiniana macular y los casos de desprendimiento de la retina con vítreorretinopatía proliferativa, aunque en otras muchas circunstancias puede encontrarse este tipo de membrana.
Con la retina aplicada se toma la membrana con una pica y se crea una zona de separación para después extraerla con una pinza. Las primeras picas utilizadas eran agujas convencionales desechables del calibre 20 ó 21 dobladas. El material de estas agujas podía hacer desprender pequeños fragmentos metálicos quedando en el espacio vítreo. Hoy son más comúnmente utilizado los cuchilletes MVR de las esclerotomías con su punta doblada apropiadamente para enganchar la membrana. Se han diseñado juegos de picas y espátulas con angulaciones y formas diferentes de bordes no cortantes para tomar las membranas epirretinianas. Estos juegos de picas son capaces de separar las membranas pero solo si tienen ya un borde levantado. Actualmente están muchas de ellas provistas de fibras con iluminación (27,28). Normalmente creamos una abertura con el cuchillete MVR y después con la pinza tomamos de la base de la membrana separándola de la retina. Hay una importante variedad de pinzas en diferentes tamaños y formas pero para agarrar las membranas las cubiertas con polvo de diamante o materiales similares rugosos evitan que se deslice la membrana agarrada al hacer el movimiento de separación. Este movimiento de separación debe ser lento y tangente como cuando quitamos un esparadrapo de la superficie cutanea (figs. 17 y 18).
Cuando la retina esta desprendida las membranas son levantadas con ganchos provistos de iluminación y después su borde agarrado con una pinza de superficie rugosa. Los puntos de unión entre la retina y la membrana pueden ser ayudados mecánicamente a separarse con la pica o espátula con iluminación. En ocasiones directamente con una pinza de punta muy fina puede ser tomada la membrana y separada de la retina. El uso de perfluorocarbono líquido puede simplificar en ocasiones la disección de las membranas y es discutido en detalle en otro capítulo (figs. 19 y 20).
SEGMENTACIÓN DE MEMBRANAS
El tejido fibrovascular que se encuentra como consecuencia de una retinopatía diabética u otras vasculopatías proliferativas tienen normalmente fuertes epicentros fibrovasculares de unión que no pueden ser separados de la retina por pelado, ya que se producirá una ruptura retiniana y sangrado en el arrancamiento. Otras membranas se hallan extendidas más o menos ampliamente y unidas por los epicentros vasculares.
La segmentación se denomina al corte de estas membranas entre los epicentros vasculares. Este corte entre los epicentros clásicamente se realiza con una tijera de ramas paralelas introduciendo la parte inferior de la tijera entre la retina y la membrana seccionándola. Esta maniobra de corte puede realizarse también con otro tipo de tijera como curvado o de ángulo recto. Tanto usando las tijeras manuales como las mecánicamente accionados. Estas muchas veces son más fáciles de usar por el cirujano ya que evita el movimiento de la mano sobre el vástago del instrumento y evitan la incomodidad al moverlas. En algunos casos el tejido entre los epicentros se halla elevado y puede segmentarse utilizando el vitrectomo. Los epicentros residuales pueden ser sangrantes y requieren la coagulación de los vasos (figs. 21 y 22).
DELAMINACIÓN DE LAS MEMBRANAS
Las proliferaciones fibrovasculares pueden ser extraídas totalmente por la técnica de delaminación que consiste en realizar cortes en los puntos de unión fibrovasculares dejándolos libres de la retina. Mediante esta técnica introducimos instrumentos entre la membrana cortando en ese espacio.
Con un solo instrumento puede realizarse la delaminación. Una tijera curvada o de ángulo recto debe ser introducida en los epicentros de unión elevando discretamente la tijera antes de realizar el corte para evitar el daño del tejido propio de la retina y de sus vasos (fig. 23). La resección en bloque es la misma técnica de delaminación aprovechando la tracción anteroposterior ejercida por la hialoides que eleva los epicentros. Con dos instrumentos pueden ser extraídos los epicentros de forma más precisa. Con una tijera levantamos el tejido proliferativo y exponemos el epicentro y con la tijera cortamos la unión proliferativa. Para esta maniobra bimanual puede suplirse la iluminación utilizando un sistema de irrigación con luz, una tijera o pinza con iluminación o el manipulador de los tejidos (fig. 24). Cada uno de los sistemas tiene una diferencia en la iluminación, la infusión con iluminación provee luz en toda el área de trabajo pudiendo producir sombra sobre los tejidos que se trabajan. La luz proveída a través de la pinza o la tijera endocular su capacidad de iluminación es limitada por una parte al campo de la propia fibra y por otra a su posición respecto al campo de trabajo. El manipulador de tejidos su iluminación esta limitada a la pequeña distancia entre la punta de la fibra y la proliferación que debe ser cortada. El manipulador de tejidos tiene la posibilidad de coagulación ante el eventual sangrado después del corte de la proliferación.
Ambas técnicas de segmentación y delaminación son utilizadas conjuntamente en los casos de retinopatía diabética proliferativa (29,30,31,32).
INTERCAMBIO DE LÍQUIDO-AIRE-TAPONADOR
El intercambio de líquido por aire tiene por objeto el rellenar el ojo de aire y posteriormente inyectar un taponador interno como una mezcla de gas o aceite de silicona. También el aire puede ayudarnos a extraer el fluido subretiniano desplazando hacia la parte inferior y extrayendo el líquido por un desgarro posteriorde esta manera hacemos una extensión pneumática de la retina. También en estos casos podemos detectar remanente de tracciones en la retina después del intercambio de líquido por aire. El aire también nos permite obtener una mejor visualización en algunas circunstancias como hemorragias después de cirugía vítreorretiniana. El aire desplaza la sangre sobre la retina posterior y rápidamente es concentrada y aspirada sobre la superficie retiniana. También en casos de sangrado profuso puede realizarse el intercambio de líquido por aire y coagular los vasos sangrantes sin exterderse la sangre en el espacio vítreo lleno de líquido (fig. 25) (33).
Los instrumentos necesarios para el intercambio de líquido por aire incluyen una bomba de infusión de aire (34,35,36), una fibra óptica para iluminación endocular y una cánula de aspiración del líquido. Esta cánula es mejor que esté conectada al sistema de aspiración y puede tener en su terminal posibilidad de diatermia bipolar. Para visualizar las estructuras endoculares es mejor utilizar los sistemas de campo amplio que proveen un excelente campo de visión, a diferencia de las lentes bicóncavas de alta potencia que su campo es muy reducido.
El perfluorocarbono líquido es utilizado para extender la retina desplazando el líquido subretiniano desde la parte posterior a la anterior. El aire contrariamente al perfluorocarbono líquido desplaza el líquido subretiniano desde la parte anterior a la posterior secando completamente la retina. Normalmente precolocamos la bomba de infusión de aire a 35 mmHg, colocamos una lente de campo amplio y accionamos el inversor en el microscopio. Con la cánula de aspiración colocada detrás del cristalino comenzamos la inyección del aire. Desplazamos la cánula de aspiración de la parte anterior a la posterior con un nivel máximo de aspiración entre 100-125 mmHg. El líquido de irrigación es rápidamente aspirado pero los líquidos pesados requieren un nivel de aspiración algo mayor. El menisco posterior del perfluorocarbono y el aire es identificado en la cánula de aspiración. Cuando el menisco desaparezca nos acercamos cuidadosamente, nuevamente nos introducimos dentro del líquido hasta que estamos encima de la papila donde extraemos todo el líquido existente. Un reflejo del aire sobre la superficie de la retina tiene que aparecer. En los casos de desprendimiento de la retina alguna cantidad de líquido residual puede aparecer en la parte posterior en el espacio subretiniano. Si existe una ruptura posterior puede adicionalmente extraerse a través de esa ruptura. Si la cantidad de desprendimiento no es significativa es dejado para su reabsorción espontanea en el postoperatorio (figs. 26 y 27). Raramente en la actualidad es preferido el realizar una retinotomía posterior de drenaje del fluido subretiniano.
Después de un intercambio completo de líquido por aire vuelve a acumularse líquido en el polo posterior sobre la retina y el disco óptico, esto es debido al drenaje progresivo del vítreo periférico y a la producción constante de humor acuoso. Unos mililitros son drenados colocándose sobre la retina después de esperar unos minutos después del intercambio de líquido por aire y antes de poner el taponador. Esto se ha puesto de manifiesto claramente en la cirugía del agujero macular.
El aire solo se mantiene durante pocos días en la cavidad vítrea y por ello no suele ser seleccionado en los casos de desprendimiento de la retina y vitreorretinopatía proliferativa o agujeros de la mácula. Una mezcla de aire con gas de más larga permanencia es realizada comúnmente en estos casos. Sin embargo el aire es útil en los casos que deseemos realizar un taponamiento de solo unos 5-6 días como puede ser desprendimientos de la retina sin proliferación o taponamientos preventivos. La decisión del gas a utilizar esta en razón del taponamiento efectivo que deseemos producir al ojo. Así el SF6 al 20% con aire realiza un taponamiento efectivo de unos 12 días y el C3F8 al 15% produce un taponamiento de más de un mes. Estas proporciones de gas son las habitualmente consideradas no expansibles.
El cambio del aire por la mezcla gas-aire se realiza al final de la intervención cuando vamos a suturar la última esclerotomía. Para ello rellenamos una jeringa de 50 de gas puro para después vaciar una cantidad de gas, hasta dejar la proporción preestimada al aspirar nuevamente el aire. Así si cargamos 60 ml de SF6, después vaciamos hasta dejar 12 ml y aspiramos nuevamente aire en la jeringa hasta 60 ml de tal manera que obtenemos una proporción del 20%. Es importante recordar que la aspiración de gases debe ser realizada a través de dos filtros Milipore de 0,22 m (Millex-GS) para gases y que cuando se realice la aspiración del aire la posición de la jeringa debe tener el embolo hacia abajo para que estos gases por su alto peso no tiendan a perderse. Los filtros deben desecharse en cada aspiración. El gas es inyectado lentamente en el ojo y el aire es desplazado espontáneamente por una de las esclerotomías que ya esta presuturada. Si la esclerotomía tiende a ocluirse por remanentes de gel vítreo puede introducirse en la cavidad vítrea una cánula para facilitar el intercambio. Pasando 25de la mezcla de gas sabemos que practicamente todo el gas se ha reemplazado por la mezcla de aire-gas. Dejamos una cantidad de gas en la jeringa para realizar la maniobra de sutura de la esclerotomía. Previa a la extracción de la cánula de infusión comprobamos la tensión ocular, presionando la pared del globo con un instrumento. Si esta hipotónico reinyectamos una pequeña cantidad y procedemos a la extracción de la cánula. Una vez extraída la cánula debemos realizar una rápida sutura de la esclerotomía y evitar compresiones al ojo para no perder efectividad en el volumen de la mezcla no expansible de gas introducida.
FOTOCOAGULACIÓN Y CRIOTERAPIA
La fotocoagulación en el espacio vítreo se aplica con una sonda que es introducida a través de una esclerotomía y esta conectada a la fuente luminosa. Se utiliza para tratar roturas retinianas o realizar panretinocoagulación o coagular vasos sangrantes. El primer endocoagulador que se realizó era a partir de una fuente de luz de xenon (37). Dado que la luz de xenon es bastante divergente tenía una fibra óptica corta y la punta de la endosonda debía acercarse a 0,5 mm de la retina para conseguir una coagulación eficaz. La luz emitida por el arco de xenon es multicolor y es absorbido por todos los pigmentos retinianos y puede causar efectos indeseables especialmente en los vasos retinianos. En la actualidad no existe ningún filtro de protección para colocar en los microscopios para los fotocoaguladores de xenon, y han sido discontinuados.
La luz emitida por una fuente de láser es unidireccional y tiene menor divergencia lo que permite transmitirlo a través de una fibra óptica y puede realizarse fotocoagulación retiniana a cierta distancia de la retina, por ello es el sistema de elección (39,40). Si queremos producir una quemadura más pequeña en la retina debemos acercarnos la punta de la endosonda a la retina y disminuir la potencia seleccionada. Si queremos realizar impactos más grandes podemos alejarnos. Normalmente obtenemos tamaños de impacto entre 500-800 mm, la forma del impacto sobre la retina también depende de la posición de la punta de la fibra respecto a la retina. Así si esta orientada perpendicularmente conseguiremos un impacto redondeado pero si la punta de la fibra esta oblicua el impacto aparecerá elíptico (fig. 28). Especialmente notables son los impactos elípticos producidos en la periferia de la retina cuando la fibra esta muy tangencial a la retina. Las fibras con forma curvada permiten la colocación perpendicular a la retina especialmente en zonas periféricas y alcanzar fácilmente desde una esclerotomía toda la extensión retiniana. Esto es especialmente interesante para los ojos fáquicos que podemos aprovecharnos de la curvatura de la sonda para evitar el daño de la cara posterior del cristalino (fig. 29). Otras sondas para fotocoagulación están provistas de luz y permiten tener iluminación en la misma sonda de láser. Esta doble función de la sonda de endofotocoagulación le permite al cirujano maniobra con la otra mano por ejemplo realizando aspiración o indentación escleral. Las sondas de láser con una vía de aspiración son útiles para eliminar líquidos residuales y secan completamente la retina para practicar inmediatamente la fotocoagulación después de intercambios de líquido por aire. Especialmente ocurre en pacientes con desprendimiento de la retina y alta miopía y rupturas posteriores (fig. 30). Las sondas deben estar bien limpiadas antes de realizar la fotocoagulación ya que restos de cualquier tejido en su punta puede hacer ineficaz la fotocoagulación. Para obtener una buena transmisión de la luz del láser se utilizan fibras ópticas de 1,5 de longitud y desechables de tal manera que la pérdida transmitida a través de la fibra óptica sea pequeña.
Se pueden utilizar endofotocoaguladores de argón azul-verde, verde, kripton y diodo, produciendo todos ellos quemaduras válidas para sellar rupturas y buena panretinocoagulación. Los diferentes tipos de luz emitida requieren un filtraje para evitar el deslumbramiento y posible daño en la retina del cirujano y sus ayudantes (tabla 3).

Los láseres de diodo emiten en un rango cercano al infrarrojo y producen quemaduras más profundas. La consola de estos láseres tiene un sistema muy sencillo de funcionamiento con poco costo de mantenimiento lo que ha popularizado su utilización en la endofotocoagulación. Todos estos tipos de longitud de onda pueden ser transmitidos en el líquido de infusión, en ojos llenos de aire o gases, en ojos con perfluorocarbono líquido y en ojos llenados de aceite de silicona. En los ojos llenos de aire o gas el efecto del láser se intensifica y tenemos más riesgo de producir hemorragias o rupturas. El gas aísla al tejido retiniano de la conducción de la energía luminosa fuera de la zona del impacto con lo que intensificamos el tratamiento y prolongamos el tiempo de exposición al tratamiento. El tratamiento intenso con láser bajo cualquier elemento puede producir rupturas retinianas pero esto es más fácil en pacientes con aire ó gas endocular. En general es mejor aplicar impactos con baja potencia y mayor tiempo de exposición para evitar los efectos explosivos en los tejidos de la retina. Menor potencia será necesaria cuando realizamos endofotocoagulación en pacientes con mayor pigmentación. En pacientes poco pigmentados es suficiente el lograr un discreto blanqueamiento retiniano y es muy peligroso intentar conseguir una coagulación profundamente blanca como en los ojos pigmentados.
La fotocoagulación a través del oftalmoscopio binocular indirecto se hace cada día más práctico en la patología vítreorretiniana. Es útil muchas veces para completar la fotocoagulación en periferia al final de la operación, para tratar zonas de isquemia en enfermedades proliferativas como la retinopatía diabética isquémica o proliferativa y en la retinopatía de la prematuridad. También lo utilizamos para fotocoagular alrededor de las rupturas cuando realizamos cirugía convencional del desprendimiento de la retina después de colocar los elementos de indentación. El láser atravesará los medios transparentes e impacta en el tejido diana. Si hacemos indentación el contacto del epitelio pigmentado con la retina sensorial se hace más prominente y la quemadura puede ser más intensa debiendo disminuir la potencia del láser, para evitar efectos explosivos. La fotocoagulación con el oftalmoscopio binocular indirecto es especialmente útil utilizando el láser de diodo que emite en los 810 nm, ya que atraviesa muy bien las opacidades corneales, cristalinianas y vítreas induciendo pocas complicaciones. El tamaño de la quemadura variará en dependencia de la potencia seleccionada en la consola, de la lente condensadora utilizada para el examen, de la distancia del cirujano a la lente y del estado de los medios transparentes.
La criocoagulación es comúnmente utilizada mediante sondas aplicadas en la pared de la esclera y que son capaces de producir una congelación de los tejidos endoculares que van a inducir a cicatrices coriorretinianas. La aplicación de crioterapia a través de una criosonda endocular esta reservada exclusivamente a algunos procedimientos que la cicatriz coriorretiniana no es posible realizarla con la fotocoagulación como son rupturas retinianas en pacientes con atrofia del epitelio pigmentado o pacientes afectos de enfermedades sin melamina que la cicatriz con el láser se hace muy difícil como son los albinos. Con la punta de la criosonda se contacta la retina con el epitelio pigmentado y se produce una coagulación rápida en la punta. No es necesario esperar que se extienda la congelación como cuando se aplica a través de la esclerótica. La presión de compresión del óxido nitroso debe ajustarse a esta criosonda, que es inferior a las que se utilizan para la criocoagulación transescleral (40).
ENDOSCOPIA
La endoscopia se ha popularizado estos últimos años con el desarrollo de instrumentos más miniaturizados, aunque se utilizó antaño con el propósito de ver en casos de medios opacos y poder extraer cuerpos extraños (41,42,43) con instrumentos que tenían más de 1,7de diámetro (43).
En la actualidad se han desarrollado endoscopios en el calibre 19 y 20 y fundamentados en dos tipos:
Normalmente en cirugía vitreorretiniana cuando la visualización se halla comprometida por la opacidad de los medios transparentes es solventado durante la intervención. Típicamente la catarata es extraída para devolvernos la visión precisa de las estructuras del fondo. La cornea puede volverse edematosa durante la intervención pero se puede mejorar. Para ello descendemos la presión del ojo, secamos el epitelio y regularizamos las estrías corneales con viscoelástico. Los sistemas de visualización con campo amplio sin contacto corneal (14,15) o con contacto (13) permiten visualizar notablemente a través de corneas con cierta opacidad. La pupila pequeña puede reabrirse ocasionalmente con retractores flexibles del iris que son de nylon. Si la cornea esta definitivamente opacificada la combinación con la extracción de la cornea, la colocación de una queratoprótesis temporal y después una cornea definitiva es lo más apropiado.
La endoscopia en cirugía vitreorretiniana esta indicada en algunas situaciones que el acceso del fondo del ojo no sea posible realizarlo a través de la pupila, como en pacientes con opacidades corneales transitorias que requerimos practicar una vitrectomía. Típicamente en las endoftalmitis con rápida opacidad corneal puede ocurrir esta situación y realizamos la vitrectomía endoscópica e inyectamos los antibióticos apropiados en el espacio vítreo. Pero la situación en la que la endoscopia es más útil es el examen de la pars plana, cuerpo ciliar y en general las estructuras de detrás del iris. Nosotros podemos observar mediante este método tracciones antero-posteriores del gel vítreo, enclavamiento de tejidos, restos de materiales capsulares, ápticos de lentes descolocados y otras lesiones imposibles de acceder con los sitemas de visualización convencionales o de campo amplio. Este tipo de alteraciones se presenta especialmente en casos de desprendimientos de la retina con vitreorretinopatía proliferativa (45) en algunos casos de retención de restos de fragmentos en las lentes intraoculares (46) y para reposición y sutura de lentes intraoculares (47). Se esta estudiando su uso para cirugía submacular (48).
El uso del endoscopio requiere un aprendizaje y entrenamiento. Es tal la practica que tenemos con la visión directa que al principio resulta difícil acostumbrarse y se recomienda utilizarlo en casos con buena visualización hasta que podamos trabajar solamente mediante endoscopia. Por una de las esclerotomías superiores introducimos el endoscopio y por la otra el instrumento activo. El endoscopio lo introducimos solo unos milímetros y colocamos la imagen en la posición que se nos presenta en el microscopio. Con la otra mano introducimos el vitrectomo u otro instrumento activo recortando todos los tejidos que producen tracción sobre la retina. El endoscopio provee luz e imagen, y puede adicionarse fotocoagulación con láser de diodo y aspiración-infusión en algunos modelos. Con el endoscopio obviamente se pierde sensación de profundidad y es difícil al comienzo hacer una situación precisa de los instrumentos activos (fig. 32).
SUBSTITUTOS VÍTREOS. MANIPULADORES
Llamamos a substitutos vítreos manipuladores a los elementos que son introducidos en la cavidad vítrea para manipular o maniobrar intraoperatoriamente los tejidos. Existe fundamentalmente el ácido hialurónico y sus deribados y los perfluorocarbonos líquidos.
ÁCIDO HIALURÓNICO
El ácido hialurónico tiene una gran viscosidad y es algo más pesado que el líquido de infusión. Es hidrosoluble y no presenta una tensión interfacial con los líquidos de infusión lo que lo hace ineficaz para el taponamiento de las roturas. El ácido hialurónico se dispersa en la cavidad vítrea pasando a través de las rupturas y se disuelve en el espacio vítreo pudiendo favorecer a la inflamación ocular. Sin embargo la gran viscosidad ha hecho que inyectado en la cavidad vítrea desplace temporalmente la retina hacia la pared del globo ocular lo que podía beneficiar en algunos desprendimientos de la retina.
Su uso es muy extendido en los problemas del segmento anterior especialmente en la cirugía de la catarata y la queratoplastia. En la cirugía vitreorretiniana se emplea especialmente para desplazar sangre en la cámara anterior, también para crear un espacio y liberar sinequias posteriores. Al inyectar mejorará, la midriasis y muchas veces evita el desplazamiento de aceite de silicona a la cámara anterior o la devuelve al espacio vítreo si ha pasado a la cámara anterior. En los afáquicos con ojos llenos de aire la queratopatía estriada puede regularse utilizando el ácido hialurónico extendido en el endotelio.
La metilcelulosa al 2% es utilizado en ocasiones como elemento viscoso teniendo unas características cercanas al ácido hialurónico pero su menor viscosidad no mantiene los espacios tan firmemente como el ácido hialurónico. Actualmente la utilizamos como protector del endotelio corneal durante la intervención y para la colocación de lentes precorneales en la intervención.
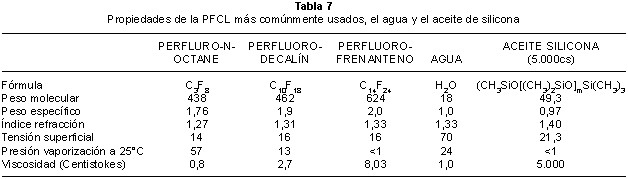
PERFLUOROCARBONOS LÍQUIDOS (PFCL)
Los perfluorocarbonos líquido son líquidos pesados con propiedades físicas que favorecen el empuje y la reaplicación de la retina en posición supino del paciente (49) y su uso ha sido descrito en una serie de condiciones (tabla 4) (50,51,52,53,54).

Los perfluorocarbono líquidos tienen un peso específico que varía de 1,76 a 2,0 y son por tanto el doble de pesados que el agua, en consecuencia tiende una fuerza para empujar la retina y desplazar el líquido subretiniano. La tensión interfacial con el agua es similar a la que presenta la silicona líquida siendo algo menor de la que presenta el gas. Esta relativamente elevada tensión inferfacial tiende a mantener el PFCL en un sola burbuja con cierta resistencia a pasar a través de una ruptura retiniana. (tablas 5 y 6). Los PFCL, a diferencia de la silicona líquida, tiene una baja viscosidad (2 a 3 centistokes) ya que sus moléculas tienen poco rozamiento y son inyectadas y aspiradas fácilmente a través de cánulas. Los PFCL son también ópticamente claros pero su índice de refracción son diferente a las soluciones salinas (con características físicas como el agua), lo que favorece su visualización más durante la cirugía. Por otra parte el poder refractivo del ojo no se altera y en consecuencia nos permite la disección de membranas sin aberraciones ópticas utilizando las lentes convencionales (54). Los PFCL no absorben las radiaciones que se utilizan para la endofotocoagulación entre 488 a 810 nm y por lo tanto permite realizarla sin ninguna problemática (55).


Existen muchos tipos de PFCL estudiado su uso para la cirugía y todos ellos tienen una alta estabilidad de las moléculas carbofluoradas lo que les hace virtualmente inertes biológicamente a diferencia con aquellos que además tienen átomos de otra naturaleza como el nitrógeno y el oxígeno. Cualquier contenido en hidrógeno en la molécula de PFCL representa una incompleta fluorización de los hidrocarburos precursores y en consecuencia puede llevar a la reacción tisular, y una mayor tendencia a la emulsificación. Muchos PFCL han sido utilizados en estudios para su uso en la clínica, pero de todos ellos los que se utilizan en la actualidad son el Perfluoro-N-octano, el Perfluorodecalin y el Perfluorofenantreno.
El más conveniente probablemente es el Perfluoro-N-octano (PFO) que se obtiene más fácilmente altamente purificado por su falta de polaridad que impide la atracción de moléculas impuras. El PFO no tiene cambios en su estructura química cuando es expuesto al paso de luz de láser, la endoiluminación o la diatermia. El PFO por su índice de refracción de 1,27 con el agua es fácilmente visible en la solución salina. El PFO tiene un menor punto de ebullición y una alta presión de vaporización lo que hace que en contacto con el aire pueda desaparecer pequeñas cantidades de PFO después de intercambio de líquido por aire (tabla 7).
Tiene considerable interés el uso de PFCL como taponador inferior en algunos casos de rupturas inferiores retinianas. Estudios clínicos no han demostrado efectos adversos dejando perfluorofenantreno durante varias semanas. En el postoperatorio estos pacientes deben mantener una posición supino para evitar el contacto del PFCL con la cornea (56). La dispersión del PFCL ha sido aportada como incidente sin importancia en estos casos utilizando como taponador pero la extracción del PFCL pero la extracción del PFCL dispersado puede ser mucho más difícil quedando restos de él pese a una meticulosa extracción. De cualquier manera se desconocen los resultados a largo plazo del taponamiento prolongado con PFCL y probablemente por su poca viscosidad tienen una mayor movilidad dentro del ojo y tienden a producir reproliferación por su irritación constante a los tejidos. Por otra parte el peso tan grande que tiene el PFCL respecto a los elementos naturales produce lesiones retinianas por presión sobre los vasos y las células retinianas. La tendencia a la dispersión de todos los PFCL tiende a producir dispersión y es lógico pensar que pueda ocluir el trabeculo induciendo a glaucoma. La presencia de PFCL en contacto con la cara posterior del cristalino tiende a inducir a catarata y a edema corneal por alteración en el metabolismo de las células endoteliales. Probablemente utilizando PFCL con alta viscosidad como es el perfluropolieter líquido. Se ha observado que tiene menos capacidad de dispersión en modelos animales. Otra potencial complicación del uso del PFCL es el paso al espacio subretiniano a traves de las rupturas. La extracción de este PFCL es necesaria ya que la burbuja de PFCL en el espacio subretiniano tiene efectos tóxicos sobre las células fotorreceptoras (57). Es de gran importancia cuando los restos están en la zona foveolar.
Una posible solución para los casos que se necesite un taponamiento prolongado superior e inferior es llenar la cavidad vítrea dejando una parte de aceite de silicona que tapona la parte superior por su menor peso específico y otra con un PFCL de alta viscosidad que tapone la parte inferior (58,59,60). Hay poca experiencia en la clínica de este tipo de taponamiento y requiere mayor estudio para ser aplicado de forma generalizada.
SUBSTITUTOS VÍTREOS. TAPONADORES
Al final de las intervenciones de cirugía vítreorretiniana muchas veces se introduce en el ojo un elemento que tapone las roturas evitando que pase líquido al espacio subretiniano y produciéndose una cicatriz alrededor de la rotura que hemos practicado la coagulación. El aire es probablemente el gas más utilizado, pero otros gases como el hexafloruro de azufre (SF6) o el octofloruropropano (C3F8) se utiliza mezclados con el aire para que permanezcan más tiempo dentro del ojo. En situaciones concretas el aceite de silicona puede utilizarse como taponador permanente.
GAS INTRAOCULAR
El uso de gas intraocular fue reportado al principio de siglo por Ohm (61) que consiguió reaplicar algún desprendimiento de la retina mediante la inyección de aire. Posteriormente Rosengren (62) hallo el concepto de taponamiento interno relacionando la apropiada posición de la cabeza y la localización del desgarro. Posteriormente la cirugía escleral expandida en la década de los 40 y 50 desplazaba la utilización de la inyección de gas intraocular. El interés del gas fue reconocido nuevamente por Norton (63) que utilizando aire para mover los desgarros gigantes y otros desprendimientos de la retina. Con la evolución de la cirugía vitreorretiniana introducida por Machemer se aumenta el reconocimiento del valor de los gases intraoculares y se descubre la dinámica del gas intraocular especialmente del hexafloruro de azufre (64). Independientemente Lincoff estudia las propiedades de los gases perflurocarbonados que con sus cadenas pesadas descubre la capacidad de expansión de estos gases y su longevidad (65,66). Domínguez (67) y posteriormente Hilton (68) utilizan el gas para producir un taponamiento y después retinopexia evitando el colocar indentación escleral en casos seleccionados de desprendimiento de la retina. En los últimos años la expansión de las indicaciones en la cirugía vitreorretiniana ha hecho incrementar el uso del taponamiento interno para manejar casos complejos de desprendimiento de la retina con vitreorretinopatía proliferativa, desgarro gigante o rupturas posteriores han incrementado su uso.
Función de los gases: Una burbuja de gas intraocular actúa en la reaplicación de la retina en dos sentidos. En primer lugar la superficie de la interfase del gas actúa como un tapón en la rotura retiniana y en consecuencia evita el paso de fluido al espacio subretiniano aspirándose el líquido reaplicándose la retina. En segundo lugar el menor peso del gas tiende a flotar en el espacio vítreo y emplazar la retina hacia el epitelio pigmentado es la fuerza de flotación propia del gas. La presión ejercida sobre la retina puede así mismo estirar pliegues en un procedimiento escleral o en los márgenes de un desgarro. Para aplicar estas funciones correctamente el paciente debe tomar una posición apropiada de la cabeza para situar la burbuja en el lugar que quiera más realizar una adecuada coriorretinopexia. Cuando una burbuja ocupa un 25% de la cavidad vítrea tiene un arco de contacto de unos 120° de arco si ocupa el 50% tendrá un contacto de 180° y si el volumen es del 75% será del 240°, así según el nivel de ocupación sabemos el área efectiva en las diferentes posiciones (fig. 33) (69).
Dinámica de los gases: Los gases utilizados en la cirugía vítreorretiniana son de alto peso molecular y tienden a transferir elementos desde la sangre en tres fases: Expansión, equilibramiento y disolución de la burbuja (70,71). Durante la fase de expansión pasa nitrógeno y otros gases para el espacio de la burbuja expandiéndose. La velocidad de expansión máxima es en las 6-8 primeras horas. El volumen máximo que se alcanza con un volumen de SF6 puro a las 24 a 48 horas después de la inyección, y alcanza una expansión de 1.9 a 2 veces su volumen (70). El C3F8 se expande su volumen 4 veces y tarda en alcanzarlo entre 72 a 96 horas (66,71) (tabla 8). En la fase de equilibramiento hay un intercambio en la burbuja especialmente de nitrógeno y las moléculas del gas mantienen una alta concentración, que paulatinamente comienzan a perder y que con la disolución de la burbuja pierden todos sus componentes. Así inyectando una cantidad determinada de gas puro en la cavidad del vítreo dependiendo del tipo de gas vamos a predecir una superficie de contacto y un tiempo de taponamiento determinado (fig. 34).
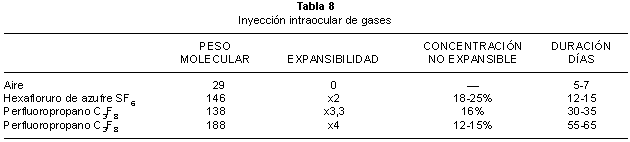
La propiedad de la permanencia de un gas viene definida por sus características físico químicas y antes de llenar el globo con una cantidad de gas debemos definir el tiempo que queremos que perdure ese gas y conocer la proporción exacta mezclada con aire que se pone, para no dejar posibilidades de expansión si el ojo esta completamente lleno de gas. El hexafloruro de azufre es utilizado normalmente al 20% con aire que perdura unos 12-15 días tiempo suficiente en el que se ha consolidado la cicatriz coriorretiniana de la fotocoagulación con láser. En casos más complicados de vitreorretinopatía proliferativa utilizamos una mezcla de C3F8 al 15% que el gas perdura durante más de 50 días periodo en el que suele pasar la fase activa de reproliferación (72,73).
El alto peso molecular de estos gases hace que ocupe la parte inferior de la burbuja y estará en contacto con la retina la parte de la burbuja donde más gases provenientes de los vasos se han intercambiado. Así la absorción del volumen final de la burbuja estará muy en dependencia del tipo y concentración del gas utilizado.
El uso de óxido nitroso durante la anestesia general esta contraindicado en los casos que se utilicen gas durante la operación. El óxido nitroso es un anestésico inhalado que aumenta enormemente las concentraciones de nitrógeno en la sangre (74,75). Si durante la cirugía escleral inyectamos una burbuja de gas y el paciente sigue inhalando óxido nitroso las altas concentraciones de nitrógeno en sangre pasan al globo y pueden crear una hipertensión ocular, que puede hasta producir una oclusión de la arteria central de la retina. Por el contrario si durante la vitrectomía después del intercambio líquido-aire-gas el paciente esta inhalando óxido nitroso y pasa a la cavidad vítrea el nitroso. Al final de la intervención este gas se volverá a descargar disminuyendo considerablemente el volumen efectivo del gas. El óxido nitroso se considera eliminado de la sangre en 10-12 minutos después de su inhalación por tanto este es el tiempo mínimo sin el que se requiere para su uso con fiabilidad y eficacia.
Las variaciones de la presión atmosférica también influyen en el volumen del gas. El paciente que ha sido intervenido a un nivel determinado de presión atmosférica mantiene un volumen de gas. Si variamos esta presión atmosférica rápidamente este volumen tiende a cambiar rápidamente. Así cuando disminuye la presión atmosférica el volumen de gas intraocular tiende a expandirse y esto es particularmente significativo cuando se viaja en avión o se sube a altitudes rápidamente (76,77). Durante los vuelos comerciales la presión en cabina a 8.000 pies es de 564 mmHg muy diferente a la existente al nivel del mar (760 mmHg). En altitudes por encima de 1.000-1.500 metros en diferencia respecto donde inyectó la burbuja, el aumento de volumen puede ser significativo y por tanto peligrosa la ascensión. En pacientes que su burbuja ocupa entre 20-25% o más del volumen de la cavidad vítrea puede ser poco recomendable el viaje en avión ya que la expansión rápida puede producirle una severa hipertensión ocular. Si se produce una disminución accidental de la presión en cabina la situación puede agravarse más. Si el paciente debe viajar a lugares de altitud se recomienda realizarlo paulatinamente haciendo paradas para permitir al gas una lenta expansión sin producir severos aumentos de la presión ocular.
Complicaciones de los gases: Los gases como principios químicos no son tóxicos para el ojo pero alguna de sus propiedades o efectos físicos pueden causar problemas al ojo (65,78). Una complicación frecuente de una burbuja intraocular grande es la inducción de opacidades en el cristalino. La posición boca abajo desplaza la burbuja de gas hacia atrás y es muy necesaria para la preservación del cristalino. La posición en niños y ancianos puede ser más difícil por su falta de cooperación o sus dificultades en el posicionamiento. Estas opacidades pueden hacerse más evidentes cuando el gas esta en 2/3 o más de la cavidad vítrea y se hacen más evidentes cuando más días están en contacto. Aparecen opacidades subcapsulares posteriores con vacuolas que adquieren forma estrellada en la cápsula posterior. En los ojos vitrectomizados este efecto es más llamativo ya que no existe el gel vítreo protegiendo de la alteración metabólica que produce el contacto con la burbuja. El cristalino mantiene su transparencia a partir de intercambios metabólicos a través de su cápsula posterior, en presencia de gas en contacto con la cápsula hace que se opacifique rápidamente. Cuando los cambios son pequeños la opacidad tiende a recuperarse cuando los cambios son grandes por prolongado contacto puede persistir la opacificación. En pacientes ancianos con esclerosis cristaliniana que han tenido gas en contacto con la cara posterior del cristalino tiende a avanzar su opacidad (79,80,81).
Si se inyecta una concentración de gas que sea expansible del tamaño de la burbuja debe ser seguido y tomada la tensión ocular. Una excesiva expansión de la burbuja puede llevar a un aplanamiento de la cámara anterior con bloqueo de la salida del humor acuoso e isquemia de la arteria central de la retina. Como el tiempo de expansión más rápido es pasado 6-8 horas es el periodo preferible para realizar la toma tensional (82). Es más preciso realizarlo con el aplanotonómetro que los tonómetros de indentación (83). Un aumento de la presión en estas primeras horas se presenta en muchos casos compensándose con la evacuación a través del trabéculo. Siempre que sospechamos la posibilidad de una hipertensión ocular por la mezcla inyectada, debe instilarse profilacticamente colirios betabloqueantes e inhibidores de la anhidrasa carbónica por vía oral. Si la hipertensión es por expansión excesiva de la burbuja del gas rápidamente tenemos que tomar una aguja del calibre 30 y aspirar el gas del espacio vítreo (78). Un error en la proporción del gas-aire puede hacernos inyectar un porcentaje excesivo del gas que provoca la hipertensión ocular por expansión excesiva, pero una proporción inferior hará que la burbuja desaparezca más rápidamente de lo previsto y que la adhesión coriorretiniana no sea firme y pueda tener un nuevo desprendimiento de la retina. Especial cuidado debe mantenerse durante las maniobras de llenado de la jeringa y el control de las proporciones previo a la insuflación instraocular.
La queratopatía ocurre entre el 6 al 33% de los ojos que se les inyecta gas perfluropropano. Los pacientes afáquicos son los de mayor riesgo ya que pueden tener la posibilidad de un contacto prolongado del gas con el endotelio, y especialmente en los ojos que han recibido intervenciones previas (84,85,86).
La inyección intraocular de gas esta asociado siempre de una respuesta de proteínas y células en la cámara anterior, consecuencia de la ruptura de la barrera hematorretiniana (81,86). Ha sido postulado que la reducción del espacio haga concentrarse las células dispersadas en la zona inferior, pero también parecería que la burbuja de gas por si misma impediría el paso de factores inflamatorios al espacio vítreo. Por tanto el gas debe permanecer en la cavidad vítrea el tiempo deseado para que produzca su efecto taponador y se realice la cicatriz coriorretiniana, pero no es necesario que se prolongué más de este periodo.
La presencia de gas en el espacio subretiniano puede ocurrir durante la retinopexia neumática u otros procedimientos que se utilicen gas como taponador previo a la pexia (87). Normalmente es consecuencia de la inyección lenta de pequeñas burbujas que pasan al espacio subretiniano. Si la burbuja de taponamiento es suficiente puede dejarse para realizar la retinopexia. Si el volumen de gas subretiniano es grande es recomendable realizar una vitrectomía con colocación de un procedimiento escleral de indentación y posterior extracción del gas mediante un intercambio de líquido por aire. En ojos vitrectomizados el gas puede pasar al espacio subretiniano en el postoperatorio normalmente en ojos con grandes rupturas que han tenido recurrencias de una proliferación. En estos casos una nueva vitrectomía es imprescindible. La burbuja de gas cuando ocupa la mitad o más del espacio vítreo interfiere con la visión del paciente y dificulta el realizar tratamientos adicionales especialmente con fotocoagulación transpupilar. La movilización de la cabeza puede ser beneficio dejando libre de gas en la zona a realizar tratamientos adicionales.
ACEITE DE SILICONA
La silicona líquida (polidimetilsiloxano) es usada intravítrea cuando se requiere un taponamiento prolongado intraocular para mantener la retina reaplicada. La inyección de silicona líquida es frecuentemente usada con otras técnicas quirúrgicas como la extracción de membranas epirretinianas, la colocación de procedimientos esclerales, la retinotomía y la endofotocoagulación. Se ha aplicado su uso en casos de severa vitreorretinopatía proliferativa, desprendimiento de la retina rhematógeno en la retinopatía diabética, traumatismos oculares y desgarros gigantes entre otros (tabla 9). Cada uno de estas indicaciones será discutida en detalle en su apartado correspondiente.

PROPIEDADES
La silicona líquida es transparente y tiene un índice de refracción de 1,4 que es bastante mayor que el agua y produce una hipermetropización en el paciente fáquico o el pseudofáquico. Contrariamente en el paciente afaco la curvatura anterior de la bola de silicona aumenta el poder dióptrico del reduciendo su hipermetropía. En estos pacientes al mover la cabeza la bola de silicona varía su curvatura y posición variando en varias dioptrías su estado refractivo. Por esto es difícil realizar la refracción a los pacientes afáquicos con aceite de silicona especialmente en los que su llenado sea incompleto que tienen una movilidad de la silicona mayor (fig. 35).
El aceite de silicona es más ligero que el agua teniendo un peso específico de 0,97, por tanto tiene una fuerza hacia arriba por su flotación. Esta fuerza de flotación es mucho más pequeña que la burbuja de gas aproximadamente es 1/30. La burbuja de gas ejerce su fuerza de taponamiento en la retina superior y posterior en la posición recta de la cabeza, mientras que la bola de aceite de silicona tiene muy poco efecto en la retina posterior en la misma posición y tamaño del taponador. La tensión interfacial del aceite de silicona es muy inferior de la del gas lo que unido a su menor fuerza de flotación hace que sea un taponador físicamente mucho más débil que el gas. El beneficio que produce el aceite de silicona sin embargo es que al ocupar permanentemente la mayor parte de la cavidad vítrea evita que el desprendimiento de la retina pueda extenderse y aumentar en volumen.
Los beneficios del aceite de silicona son especialmente útiles cuando existen roturas superiores pero contrariamente las proliferaciones epirretinianas aparecen más frecuentemente en la retina inferior. Por ello es especialmente necesario el emplazamiento apropiado de la indentación inferior para que contacte con la bola de silicona, especialmente si existen roturas o membranas inferiores (fig. 36). La lucha contra las reproliferaciones de membranas en la zona inferior es la causa más común del fallo en la vítreorretinopatía proliferativa y se debe evitar con la colocación de la indentación apropiadamente y el taponador. En el futuro agentes antiproliferativos inyectados en la propia silicona o en el interior del ojo pueden tener interés para evitar la reproliferación en pacientes con alto riesgo.
TÉCNICA DE INYECCIÓN
El aceite puede inyectarse después que la retina esta totalmente reaplicada y haber realizado el intercambio del líquido de infusión por aire. La forma y el volumen del ojo es mantenido en este momento mediante la bomba de aire manteniendo la presión en unos 20 mmHg. Por una de las esclerotomías se inyecta el aceite de silicona mediante una cánula metálica conectada a una bomba de infusión de líquidos viscosos. La silicona rellena todo el espacio vítreo con la retina reaplicada hasta alcanzar el nivel del iris, que tiene que tener una iridectomía. Apropiadamente realizada en la zona inferior antes del intercambio de líquido por aire. Cuando alcanzamos el plano del iris otra cánula es introducida para sobrepasar el nivel de las esclerotomías. (fig. 37). Estas mismas maniobras se pueden realizar inyectando el aceite de silicona por la cánula de infusión. La desventaja que tiene es que en el momento que cerramos el aire para inyectar el aceite el ojo tiende a colapsarse (fig. 38).
También puede realizarse el intercambio directo de PFCL por aceite de silicona. La inyección de silicona se realiza por la cánula de infusión y el PFCL es aspirado desde la parte anterior a la posterior. El beneficio que se obtiene en estos casos es el evitar el deslizamiento de la retina hacia la parte posterior ya que el aceite por sus características evita esta circunstancia. Por ello esta especialmente indicada en los desgarros gigantes de más de 180° (fig. 39).
COMPLICACIONES
Las complicaciones de uso del aceite de silicona son casi siempre mecánicas más que producidas por agentes químicos que produzcan intolerancia en el ojo. Se ha enfatizado el uso del aceite de silicona altamente purificado silicona pero la mayor parte de los problemas como queratopatía, bloqueo de pupila, glaucoma y catarata son secundarios muchas veces a complicaciones mecánicas o a una técnica quirúrgica inapropiada.
De cualquier manera el uso de aceite de silicona con componentes de bajo peso molecular conlleva a la toxicidad, la reacción monofagica y la emulsificación. Los aceites de silicona de mayor viscosidad (5.000 cs) tienen menos propensión a la producción de emulsificación y dispersión de la silicona que los de menor viscosidad (1.000 cs) induciendo menos el glaucoma tardío. Así los de alta viscosidad los inyectamos en casos de severa vítreorretinopatía proliferativa después de amplias retinotomías y especialmente en ojos con hipotonía y pueden ser dejados permanentemente en el globo ocular con más seguridad. El aceite de baja viscosidad es utilizado para ser extraído unas semanas después de la intervención. La menor viscosidad del aceite lo hace fácilmente inyectable y extraíble.
En los pacientes afáquicos el contacto del aceite con el endotelio corneal puede inducir a queratopatía, probablemente por un bloqueo del paso de nutrientes a través del endotelio. La cornea permanece clara mientras la silicona esta en la cámara anterior ya que no permite el paso del humor acuoso a través del endotelio que lo bloquea el propio aceite. La superficie del iris tiende a verse brillante ya que esta cubierto por el aceite de silicona. El paso de aceite de silicona a la cámara anterior puede ser consecuencia de un redesprendimiento de la retina siendo empujado el aceite hacia la cámara anterior, o bien consecuencia de un bloqueo de la iridectomía inferior que hace pasar el líquido acuoso a la parte posterior desplazando el aceite anteriormente. En caso de un desplazamiento de la silicona por redesprendimiento una nueva intervención es necesaria (fig. 40). La iridectomía inferior no es infrecuente (hasta un 20% de los casos de PVR), que pueden bloquearse por remanentes de la inflamación o progresiva fibrosis del iris. Si el bloqueo es reciente y existe fibrina en la cámara anterior una inyección de t-PA puede disolver la fibrina y pasar el aceite detrás del plano iridiano. Si el bloqueo esta establecido por cierre de la iridectomía una nueva iridectomía con láser de YAG es necesario (fig. 41). Si el ojo ha tenido hipertensión y su endotelio no esta en buenas condiciones puede aparecer un edema corneal al desplazarse nuevamente la silicona líquida al plano retroiridiano y el contacto del endotelio con el acuoso hace que se produzca el edema. Dependiendo de las posibilidades de recuperación endotelial habrá que actuar sobre el tejido corneal.
La formación de catarata es inevitable en los ojos fáquicos ya que el aceite evita el paso de nutrientes por la cara posterior del cristalino. De cualquier manera la evolución de la catarata puede retrasarse si durante el periodo que el paciente tiene el aceite en el espacio vítreo. Si mantiene una posición apropiada boca abajo. La catarata aparece entre 6 y 18 meses después de la cirugía y algunos cirujanos prefieren siempre extraer el cristalino. En general la práctica de la lensectomía va unida a la inyección del aceite de silicona pero si no la vamos a practicar lensectomía tendremos el aceite el menor tiempo posible y evitaremos la posición supino durante este periodo en estos pacientes.
El glaucoma tardío se produce por oclusión de la malla trabecular por pequeñas gotas de aceite de silicona emulsificado. Sin embargo puede existir una severa disminución en la producción del humor acuoso en los casos con severa vítreorretinopatía proliferativa anterior y esta dispersión no producen glaucoma. Aunque existe una considerable variación de unos pacientes a otros en cuanto la aparición del glaucoma la tendencia es al progresivo incremento en la presión ocular. Esto parece estar disminuido con el uso de aceites altamente purificados que tienen menor tendencia a la absorción de proteínas y fosfolípidos que pueden inducir en la formación de pequeñas gotas de aceite. En la formación de estas gotas también pueden influir factores necesarios de rozamiento de la bola de silicona con las irregularidades en la superficie endocular por las indentaciones y otros elementos de la anatomía ocular. La extracción del aceite evita que continúe el aumento de la presión ocular y en ocasiones puede existir un descenso tensional pero en general no se controla el glaucoma con su extracción.
La proliferación que ocurre en ojos llenos de aceite de silicona es uno de los problemas que tenemos en la actualidad por resolver. Algunos investigadores han reportado que la silicona no tiene influencia por si misma en la proliferación celular. Otros por el contrario creen que los ojos con silicona tienen un efecto sobre el epitelio pigmentado retiniano produciendo un efecto mitogénico sobre ellas. Las células proliferativas aparecen entre la bola de silicona y la superficie interna de la retina, pero la dependencia del crecimiento de esta proliferación sea de la silicona o de la superficie interna de la retina no esta clara. Probablemente ambos factores jueguen un papel a esta proliferación perisilicona. Esta proliferación es mucho más patente en la zona inferior rellena de líquido donde probablemente se acumulen células, factores quimiotácticos y mitogénicos que induzcan a la proliferación y en consecuencia a formar fuerzas traccionadas. La presencia de proliferaciones en otras regiones donde esta en contacto con la silicona son menos frecuentes pero también aparecen y muchas veces con firmes uniones entre la proliferación y la retina interna. Por ello estas membranas reproliferativas son más delicadas de extraer por sus firmes uniones.
TERMINACIÓN DEL PROCEDIMIENTO
Después que los instrumentos son extraídos de las esclerotomías con el ojo lleno de líquido debe examinarse la periferia de la retina. Clásicamente se colocan tapones esclerales para tapar las esclerotomías y mantener la presión del ojo. Con el oftalmoscopio binocular indirecto la periferia de la retina examinada practicando indentación escleral. Esta maniobra en la actualidad la realizamos con los sistemas de campo amplio iluminando la periferia de la retina a través de una esclerotomía e indentando con la otra mano en la periferia especialmente en la región correspondiente a las entradas al ojo.
La presión intraocular debe ser reducida para evitar la incarceración de tejido en las esclerotomías y estas deben ser cuidadosamente limpiadas con un vitrectomo. Se practica una sutura con un material de polyglactina de 7-0 (Vicryl), dejando el punto de anudamiento entre los labios de la esclerotomía (fig. 42). Después es extraída la cánula de infusión y la sutura del mismo material debe realizar una sutura rápida y sin presión del globo ocular para no perder eficacia en el volumen del taponador inyectado. Si esto ocurre se reabrirá la esclerotomía última e inyectamos más cantidad de taponador hasta dejar un volumen ocular aceptable. Después la conjuntiva es suturada con el mismo material. La aposición de los bordes conjuntivales debe ser muy preciso para que en el postoperatorio la superficie conjuntival sea regular. Una sutura de vicryl 7-0 es practicada realizando 4 o 5 puntos en cada cuadrante cuando la incisión es de 360°. Si las incisiones para el acceso a las esclerotomías realizamos puntos aislados deslizando la conjuntiva cubriendo las esclerotomías (fig. 43). Esto mejoraría en la inflamación superficial ocular, disminuye la presencia de defectos epiteliales corneales. Tardíamente la superficie del globo quedará descongestionada y el paciente no tenderá a tener secreciones crónicas. Desafortunadamente esta fase de la intervención es muy poco cuidada en general por el cirujano de retina y los ojos tienen muchas veces a congestiones crónicas por realizar suturas inapropiadas. Aunque este material de sutura es absorbible tarda varias semanas en producirse y suele ser retirado en 10 ó 12 días cuando la sutura es continua en casos de abertura conjuntival en 360°.
BIBLIOGRAFÍA