Dres. Bueno Lozano J1, Sánchez Pérez A1, Polo Llorens V2, Cuevas Andrés R2, Pinilla Lozano I1, Brito Suárez C1
Servicio de Oftalmología. Hospital Miguel
Servet. Zaragoza.
(1) Doctor en Medicina.
(2) Licenciada en Medicina.
Introducción
La queratoplastia penetrante es la técnica con mejores resultados en el transplante de córnea (1). Distintos trabajos han estudiado la supervivencia del injerto corneal estimando en un 90 a 100% de éxitos para los queratoconos (2-5), mientras para la queratopatía bullosa se estima en un 60-85% a los 2 años de la cirugía y en 50-80% a los 5 años (6,7). Más recientemente este rango de éxitos se ha ampliado a un 88-98% (2).
Khodadoust y col afirmaban que el rechazo inmune era la principal causa del fracaso del injerto mientras comprobaba cómo la presencia de vascularización profunda a nivel de estroma en la córnea receptora predisponía al fracaso del transplante (8).
En el presente estudio comparamos la supervivencia del injerto en diversas patologías durante un período de 4 años tras la cirugía del transplante de córnea y valoramos la causa del fracaso del injerto corneal.
Material y métodos
Se recogió información de los transplantes de cornea realizados en nuestro Servicio de Oftalmología del Hospital Miguel Servet de Zaragoza desde 1973 con un seguimiento para nuestro estudio de cuatro años.
Se practicó una exploración preoperatoria extensa donde se comprobó la presencia de vascularización superficial (grados de 0 a 2 según el número de cuadrantes afectados) o profunda (grados 3 y 4). Asimismo se destacó la asociación de factores de mal pronóstico como historia de inflamación previa, antecedente de cirugía ocular o presión intraocular superior a 25 mmHg.
Se realizaron controles postoperatorios a los 3, 6, 9, 12, 18, 24, 36 y 48 meses tras la cirugía. En cada tiempo exploratorio se analizó por biomicroscopia el estado del transplante (transparencia, aspecto de sutura, defecto de refracción...), tonometría de aplanación, estudio de fondo de ojo y controles fotográficos.
La técnica quirúrgica fue similar en todos los casos con sutura continua de nylon 10/0 y sutura radial de 8 puntos de prolene 10/0 enterrados en córnea receptora.
Se definió como fracaso del injerto al edema y pérdida de transparencia de éste, siendo previamente claro y transparente. En cuanto al tiempo de fracaso del injerto se consideró la primera exploración con pérdida irreversible de la transparencia. El rechazo se definió como la presencia de una línea (epitelial o endotelial) o la reacción unilateral en cámara anterior con precipitados endoteliales y pérdida de transparencia por edema corneal cuando previamente se encontró claro y trasparente. Como causas del fracaso del injerto se definió la descompensación endotelial como la pérdida de transparencia, de modo irreversible, sin la presencia de precipitados endoteliales, línea de rechazo endotelial o pliegues endoteliales severos.
Estudio estadístico
Se realizaron las curvas de supervivencia según Kaplan-Meier y su comparación se determinó con el test de Log-rank (9,10). Se obtuvo la curva media de supervivencia para dos grupos de riesgo:
Resultados
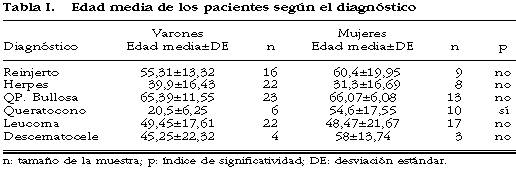
Se estudiaron un total de 153 pacientes de edad media 51,35±19,27 con un rango de 5-82 años, 93 varones (60,78%) y 60 mujeres (39,21%), distribuídos según su patología en: reinjertos (16,3%), herpes (19,6%), queratopatías bullosas (23,5%), queratocono (10,4%), leucoma de origen no filiado (25,4%), y descematoceles (4,57%). La edad media de los varones fue de 50,09±18,91 (8-82) y de 53,3±19,81 (5-81) para las mujeres, sin diferencia estadísticamente significativa entre ambos grupos. La tabla I muestra la edad media por grupo diagnóstico y su distribución según sexo.

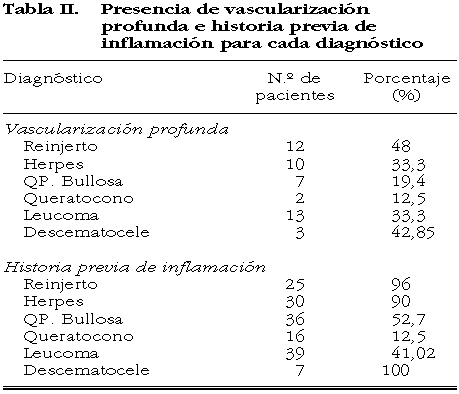
La tabla II muestra la distribución de la vascularización profunda (30,7%) (grados 3 y 4) y la historia previa de inflamación según el diagnóstico preoperatorio. El grupo con mayor frecuencia de vascularización profunda fueron los reinjertos (48%), mientras que únicamente el 12,5% de los queratoconos asociaron vasos en estroma profundo. La presencia de vascularización profunda preoperatoria incidió en el pronóstico visual final de modo significativo (p<0,05). Fue muy elevado el porcentaje de historia previa de inflamación en los reinjertos, herpes y descematoceles aunque no modificó de modo significativo la evolución al rechazo corneal.
La figura 1 muestra las curvas de supervivencia a los 4 años de los trasplantes de córnea en todos los grupos diagnósticos. El queratocono con el 87% de éxitos y el herpes con el 76% fueron los grupos con mejor porcentaje de transparencia del injerto de modo significativo (p<0,01) mientras que descematoceles (24%) y reinjertos (42%) tuvieron peor evolución a largo plazo. La figura 2 representa la curva media de supervivencia de los grupos de alto y bajo riesgo con diferencias estadísticas de modo significativo (p<0,001) (tabla III).

Considerando todos los grupos diagnósticos, un total de 60 pacientes sufrieron pérdida de transparencia del injerto y la causa más frecuente fue la descompensación endotelial (41,6%), seguida del rechazo (26,6%), hipertensión ocular (18,3%), patología de superficie (6,6%) y otras causas diversas (6,6%) (fig. 3).
Discusión
Desde las últimas cuatro décadas la queratoplastia pasó de ser un procedimiento con resultados muy pobres a ser una técnica de gran utilidad y de óptimos resultados (1). Esta modificación en la perspectiva a largo plazo de los trasplantados se debió a la mejora del tratamiento inmunológico, la aparición de nuevos fármacos tópicos, mejora del instrumental y técnica quirúrgica, y a la aparición de nuevos líquidos de conservación para las córneas donantes. Desde entonces se han modificado las indicaciones quirúrgicas de la queratoplastia. Antes de 1974, reinjertos y queratoconos fueron las principales causas de queratoplastia (11-13). Desde los años 70, el edema corneal secundario al implante de lente intraocular tras cirugía de catarata ha pasado a ser la principal indicación del trasplante de córnea (12,14,15). Estos resultados concuerdan con otros autores que confirman a la queratopatía bullosa como la principal causa de queratoplastia penetrante (16-18). En los últimos años, no obstante, se comprueba un descenso en las indicaciones de queratoplastia por queratopatía bullosa y leucomas secundarios a patología viral (19). En nuestro estudio, la queratopatía bullosa y los leucomas no filiados fueron la causa más frecuente de trasplante de córnea. La elevada incidencia de leucomas corneales no filiados se debe al ser un centro de referencia donde un elevado número de pacientes acude a nuestras consultas, por primera vez, sin conocer con exactitud su diagnóstico previo.
La presencia de historia previa de inflamación no parece asociarse a un empobrecimiento en nuestros resultados a largo plazo. Sin embargo, destacamos cómo la asociación de vascularización profunda empeora de modo significativo la supervivencia final del injerto (20). Se confirma al observar la supervivencia del injerto a los 4 años con una menor tasa de transparencia corneal en los reinjertos y descematoceles. Estos grupos de alto riesgo demuestran tener una supervivencia inferior (p<0,001) al resto de las patologías al asociar factores de mal pronóstico como la presencia de vascularización profunda que facilita la respuesta inmunológica (21). La presencia de estos grupos enmascara el resultado medio visual ya que aunque, en global, el 40% de los injertos se mantienen transparentes a los 4 años, la curva media de supervivencia para las patologías de bajo riesgo se puede considerar del 75% y 61% a los 3 y 4 años respectivamente. En particular el diagnóstico con mejores resultados a largo plazo es el queratocono (87%) seguido de la queratopatía herpética (76%).
Algunos autores confirman el rechazo inmunológico como la causa principal del fracaso corneal. En nuestra experiencia aplicamos de modo preventivo altas dosis de corticoides a nivel local y, en ocasiones, se adaptan lentes terapéuticas empleadas como reservorio medicamentoso (22). De esta manera la tasa de rechazo típico, con línea endotelial y/o precipitados endoteliales ha disminuido de manera importante. Lopatin y col demostraron experimentalmente cómo en cámara anterior se elevan las proteínas y los precipitados queráticos endoteliales como precursores del rechazo corneal (23). La reacción inmunológica se produce de manera progresiva; por ello al aplicar dosis de corticosteroides tópicos de modo continuo se consigue disminuir esta importante complicación.
La descompensación endotelial no se puede explicar como la reacción inmunológica del injerto y, por tanto, es una complicación difícil de prevenir y controlar. Únicamente estudios a largo plazo nos permitirá conocer la patogénesis de este mecanismo (técnica quirúrgica, inflamación crónica, viabilidad del tejido).
Podemos concluir, por tanto, afirmando que la supervivencia del injerto depende del diagnóstico previo, la asociación de factores de mal pronóstico prequirúrgicos y de un adecuado seguimiento y tratamiento de los pacientes para poder actuar de modo precoz ante cualquier complicación severa como el rechazo inmunológico.
Resumen
Objetivo: Se estudian y comparan las curvas de supervivencia del injerto corneal tras queratoplastia penetrante.
Método: Se han estudiado un total de 153 pacientes de edad media 51,35±19,27 (5-82), 60,78% varones y 39,21% mujeres. Se analizó en el preoperatorio la vascularización de la córnea receptora (grados 0-4), antecedentes de interés (historia de inflamación, PIO>25 mmHg...) y se realizaron valoraciones a los 3, 6, 9, 12, 18, 24, 36 y 48 meses de la transparencia corneal. En el análisis estadístico se emplearon las curvas de Kaplan Meier comparadas con test Logrank.
Resultados: Diagnóstico preoperatorio: reinjertos (16,3%), queratopatía herpética (19,6%), queratopatía bullosa (23,5%), queratocono (10,4%), leucomas (25,4%) y descematoceles (4,.57%). 30,7% asociaron vascularización profunda con mayor afectación en los reinjertos (48%). La historia previa de inflamación fue más frecuente en descematoceles y reinjertos (>95%). La supervivencia media del injerto, para el grupo de bajo riesgo, fue del 75% a los 3 años y del 61% a los 4 años. El queratocono (87%) y la queratopatía herpética (76%) tuvieron mejor pronóstico a los 4 años. La causa más frecuente de fracaso corneal fue la descompensación endotelial (41,6%).
Conclusiones: La vascularización profunda empeora el pronóstico visual final, la supervivencia del injerto depende del diagnóstico preoperatorio y de un adecuado seguimiento para poder actuar eficazmente ante las complicaciones como el rechazo.
Palabras claves
Curvas de supervivencia, queratoplastia, supervivencia del injerto.
Summary
Purpose: Studies were conducted to determine the corneal graft survival after penetrating keratoplasties.
Methods: 153 patients underwent penetrating keratoplasty, mean age 51.3±19.27 years (5-82), 60.78% males and 39.21% females. We evaluated preoperatively deep vascularization, a history of past inflammation...We evaluated on months 3, 6, 9, 12, 18, 24, 36 and 48 after surgery graft clarity. For the statistical analysis we employed Kaplan-Meier curves and Logrank test.
Results: Preoperatively diagnosis: regraft (16.3%), herpes simplex virus (19.6%), bullous keratopathy (23.5%), keratoconus (10.4%), corneal scars (25.4%) and active ulcer or perforations (4.57%). The most prevalent diagnosis for eyes with stromal vascularization was regrafts (48%) and history of past inflammation was highest in regrafts and active ulcer (>95%). The 3 and 4 year survival rates for grafts in the study were 75% and 61%, respectively. The keratoconus (87%) and herpes simplex virus (76%) had the highest 4 year survival rates. The most common cause of graft failure was endothelial failure (41.6%).
Conclusions: Deep vascularization is a risk factor for graft failure. Survival graft rate depends on preoperatively diagnosis and adequate tratment of the common complications like immunologic rejection.
Key words
Keratoplasty, graft survival, survival curves.
Bibliografía