 Fig. 1
Fig. 1Dres. Bueno Lozano J1, Fernández Tirado J1, Pueyo Subías M1, Sánchez Pérez A1, Gómez-Biedma Gutiérrez S2, Melcon Sánchez-Friera B3, Honrubia López FM1
Servicio de Oftalmología. Hospital Miguel
Servet. Zaragoza.
(1) Doctor en Medicina.
(2) Licenciado en Químicas.
(3) Licenciada en Medicina.
Introducción
Los procedimientos ciclodestructivos han demostrado su eficacia en la disminución de la presión intraocular (PIO) tanto en animales de experimentación, como en humanos (1-4). En los últimos años, se han publicado numerosos estudios utilizando láser Nd:YAG y láser de diodo en animales y en humanos (5-8). El mecanismo de acción de la fotocoagulación, aún en la actualidad, no es bien conocido y numerosos autores han valorado la destrucción directa de los procesos ciliares al focalizar el impacto a 0,5-1,5 mm del limbo visible (9-11).
Recientemente, algunos investigadores han comprobado cómo la fotocoagulación de la pars plana consigue disminuir la PIO (12-15). Por este motivo, se han implicado otros mecanismos asociados a la ciclodestrucción, como el flujo transescleral y el aumento del flujo uveoescleral secundario a la inflamación (16-18).
Realizamos un estudio experimental de fotocoagulación con láser diodo en la pars plicata y pars plana, valorando la respuesta inflamatoria con patrones clínicos y bioquímicos.
Material y métodos
Este estudio se realizó en las instalaciones del Laboratorio Experimental del Hospital Miguel Servet de Zaragoza, siguiendo la normativa 86/609 de la CEE sobre la regulación del uso de animales de experimentación.
Se emplearon un total de 90 conejos pigmentados de 1,5-3 kg de peso divididos de forma aleatoria en dos grupos de tratamiento.
El ojo adelfo, en todos ellos, no recibió ningún tratamiento y se consideró como grupo control.
Se anestesiaron los conejos con una inyección intramuscular de Xylacina (5 mg/kg) y ketamina (35 mg/kg). Tras abrir los párpados con blefarostato, se realizaron 15 aplicaciones con láser diodo (IRIS Medical Instruments, Oculight SLx) con una energía de 1,8 J (200 mW x 9.000 msg), distribuidas en 270°, a una distancia de 0 mm o 3,5 mm detrás del limbo visible según el grupo de tratamiento. La sonda se posicionó de modo perpendicular y con una ligera presión sobre la esclera midiendo la distancia al limbo con un compás de Castroviejo.
Estudio de la inflamación
Las exploraciones clínicas se realizaron los días 1, 3, 5 y 10 del postoperatorio y en cada observación se valoró:
Para el análisis bioquímico se estudiaron 9 conejos en los diferentes tiempos exploratorios. Tras la extracción del humor acuoso se sacrificaron los animales con una inyección intravenosa de pentobarbital sódico.
Se anestesiaron los animales y, tras la instilación tópica de anestésico en saco conjuntival, se procedió a la extracción del humor acuoso puncionando en limbo esclerocorneal con aguja de insulina estéril de 29 gauges. Se analizaron las proteínas totales con el Autoanalizador Synchron Clinical System de Beckman por formación de complejo proteína-rojo de pirogalol-molibdato (19,20). El recuento celular se efectuó en la cámara de Neibhauer con microscopio óptico a 100 y 400 aumentos. Las poblaciones celulares se identificaron con tinción de Azurll/eosina en tampón fosfato.
Estudio estadístico
Se compararon los resultados con test no paramétricos de Wilcoxon y la prueba U-de Mann-Whitney. Un valor de p<0,05 se consideró como significativo.
Resultados
Valoración clínica de la inflamación
La media del efecto Tyndall los días 1, 3, 5 y 10 postoperatorios para el grupo A era de 0,78, 0,65, 0,26 y 0, mientras para el grupo B era de 1,04, 1,22, 0,39 y 0,69. La media de la reacción conjuntival para el grupo A era de 2,21, 1,82, 1,26 y 0,40, mientras para el grupo B era de 2,56, 2,13, 1,47 y 0,69. Finalmente, la media de la hiperemia de iris para el grupo A era de 0,39, 0,30, 0,08 y 0, mientras para el grupo B era de 1,04, 0,36, 0,17 y 0,39.
Proteínas totales
En el grupo A se incrementaron inmediatamente tras la fotocoagulación con un valor de 4,25 gr/l a las 24 horas del tratamiento, disminuyendo sus cifras paulatinamente hasta alcanzar 0,62 gr/l en el día 10. Todos los valores fueron superiores, de modo significativo, al compararlos a su grupo control (fig. 1).
En el grupo B apenas se modificaron las cifras durante el estudio (fig. 2). Al comparar ambos grupos se demostraron cifras más elevadas en los ojos tratados a nivel de la pars plicata, con valor significativo en todos los tiempos excepto en el día 5 (fig. 3).
Recuento celular
En el grupo A se elevaron el número total de células en la cámara anterior a las 24 horas del tratamiento con una mayor proporción de la población leucocitaria (fig. 4).
La actividad en cámara anterior en aquellos ojos sometidos a fotocoagulación a 3,5 mm del limbo no se modificó de manera importante con un pequeño incremento al tercer día a expensas de la población leucocitaria (fig. 5).
La comparación de los resultados en el tratamiento a las diferentes distancias se expresan en la figura 6.
Discusión
Shubert y Federman (15) valoraron la inflamación secundaria al tratamiento con crioterapia y Nd:YAG aplicado en el limbo con patrones clínicos. También estudiaron el papel de la inflamación como mecanismo patogénico en la ciclodestrucción comparando los resultados obtenidos tras la aplicación de crioterapia a 6 mm del limbo, ciclofotocoagulación (CYC) Nd:YAG y la inyección intravítrea de una endotoxina (16).
Nassise y col valoraron la inflamación debida a CYC (3,5 J, 1 mm del limbo) los días 1, 3, 8 y 15. Los valores clínicos apenas se modificaron con una media del efecto Tyndall de 1,3, 1, 1,3 y 0,78. Las células se incrementaron de un modo progresivo, a expensas de los eritrocitos, con un pico al 8.º día. Resumió sus resultados afirmando que el número de eritrocitos era proporcional al daño ocasionado y a la alteración de la permeabilidad vascular (21).
Echelman y col analizaron los efectos adversos de la aplicación de la fotocoagulación en un breve tiempo de exposición (10 W x 0,2 sg). Valoraron la inflamación los días 1, 3 y 10 con patrones clínicos y bioquímicos obteniendo el pico de las proteínas totales a las 24 horas (22).
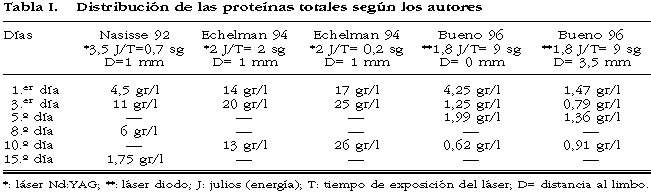
Hay pocos trabajos experimentales que valoren la inflamación. Todos los autores comprueban cómo el recuento celular (eritrocitos) es proporcional al daño tisular y a la alteración de la barrera hematoacuosa, mediada por PGs. Asimismo, las proteínas totales nos permiten conocer la magnitud del daño tisular ocasionado. Sin embargo, por falta de un protocolo común y estandarizado, nos encontramos con resultados tan contradictorios como los presentados por Nasisse y Echelman donde el nivel de proteínas es más elevado en los animales tratados con una menor energía (tabla I).
Se estima, en general, que el mecanismo fisiopatológico de la CYC es ciclodestructor puro, ya que se han practicado numerosos estudios histológicos, comprobando la lesión de los procesos ciliares (disrupción del epitelio pigmentario, necrosis coagulativa, ...) (10,21,24,25).
Algunos autores comenzaron a hablar de otros mecanismos implicados, ya que al aplicar el láser a Ž3 mm del limbo, con la pars plicata indemne, se mantenía la PIO reducida. Desde entonces, se ha implicado el mecanismo inflamatorio como factor asociado al incrementar el flujo uveoescleral, mediado por las PGs pudiendo ser beneficioso no inhibir este efecto (15-18). Sin embargo, por otro lado, se ha relacionado con efectos adversos, incluyendo: dolor postoperatorio, ptisis bulbi y desprendimiento de retina (14,21).
La CYC a nivel del limbo provoca la destrucción selectiva de los procesos ciliares con un importante compromiso vascular proporcional al nivel de proteínas y eritrocitos en cámara anterior (21). En nuestro estudio no encontramos un importante compromiso vascular debido a la aplicación del láser en un largo tiempo de exposición (9 sg). Se ha demostrado que la energía total aplicada en un espacio de tiempo prolongado, provoca menos complicaciones al evitar el efecto explosivo del tratamiento aplicado en menos de 1 segundo de tiempo de exposición (23). En nuestro modelo inflamatorio al fotocoagular la pars plana se evidencia una moderada respuesta inflamatoria con niveles bajos de proteínas y recuento celular total, a expensas de la población leucocitaria.
La respuesta irritativa ocular en conejos es considerablemente mayor a la de los humanos, existiendo además diferencias significativas en la anatomía de la vasculatura ciliar (26), por lo que la aplicación de estos resultados a humanos está sujeta a especulación. Aunque la magnitud de la respuesta es considerablemente mayor, es concebible que los resultados observados en humanos y en conejos compartan un mecanismo común.
Podemos concluir que, por tanto, el mecanismo principal en la fotocoagulación es la destrucción selectiva de los procesos cilares con la participación de mecanismos asociados como la inflamación que favorece el flujo uveoescleral de humor acuoso.
Resumen
Objetivo. El mecanismo de acción de la ciclofotocoagulación (CYC) no es bien conocido. Valoramos la participación de la inflamación al practicar CYC a 0 y 3,5 mm del limbo.
Método. Se ha aplicado CYC con láser diodo, 1,8 J (200 mW*9.000 msg) a 90 conejos, divididos aleatoriamente en 2 grupos de tratamiento: grupo A (a 0 mm del limbo) y grupo B (3,5 mm). El ojo contralateral no era sometido a tratamiento considerándose como grupo control. Se valoraba la inflamación con patrones clínicos (Tyndall, reacción conjuntival, hiperemia de iris) y bioquímicos (proteínas y recuento celular) los días 1, 3, 5 y 10 postoperatorios. En el análisis estadístico comparamos los resultados con el test de Wilcoxon y la U-Mann-Whiney con p<0,05 como valor significativo.
Resultados. Apenas se modificaban los patrones clínicos de inflamación con media Tyndall para el grupo B de 1,04, 1,22, 0,39 y 0,69. En el grupo A las proteínas se incrementaban a las 24 horas (4,25 gr/l), disminuyendo hasta 0,62 en el día 10 postoperatorio. En el grupo B apenas se incrementaban (1,47, día 1). En el grupo A las células alcanzaban 534 cels/mm3 en el día 1 con mayor proporción de leucocitos. Para el grupo B el nivel máximo se alcanzaba al 3.er día con 60 cels/mm3.
Conclusiones. El mecanismo principal de la fotocoagulación es la destrucción directa de los procesos ciliares con participación de mecanismos asociados como la inflamación.
Palabras claves
Ciclofotocoagulación, láser diodo, glaucoma.
Summary
Purpose. The mechanism of action of cyclophotocoagulation (CYC) is yet unknown. We evaluate the role of inflammatory reaction when performing CYC at 0 and 3.5 mm from the limbus.
Method. 90 rabbits underwent a CYC with diode laser. The rabbits were randomly divided into two groups: Group A (0 mm from limbusj and Group B (3.5 mm from limbus). The felow eye remained as untreated control. We evaluate inflammatory reaction with clinical (Tyndall, conjunctival reaction and iris hyperemia) and biochemical parameters (protein levels and celular counting) on days 1, 3, 5 and 10 after surgery. For the statistical analysis we employed the Wilcoxon test and Mann-Whitney test with p<0.05 as significant value.
Results. Clinical parameters were similar for both groups, with a mean value for tyndall of 1.04, 1.22, 0.39 and 0.69 in Group B. In Group A protein values increased 24 hours after surgery (4.25 gr/l) decending to 0.62 on day 10. In Group B there was a small increase (1.47 on day 1). Group A presented 534 cels/mm3 on day 1, with a higher proportion of leukocytes. Group B reached a maximum on day 3 after susgery, with only 60 cels/mm3.
Conclusions. The principal mechanism of photocoagulation is direct destruction of ciliary processes with participation of other factors such as inflammatory reaction.
Key words
Cyclophotocoagulation, diode laser, glaucoma.
Bibliografía