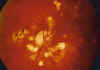
Fig. 1. Lesiones cicatriciales coriorretinianas sugerentes de coroidopatía punctata interna.
Dres. Pérez-Salvador García E1, Corcóstegui Cortina E2, Muniesa Royo MJ2, González Guijarro JJ1
Hospital Universitario La Princesa. Madrid.
(1) Doctor en Medicina y Cirugía.
(2) Licenciado en Medicina y Cirugía.
Introducción
La coroidopatía punctata interna, descrita por Watzke en 1984 afecta de forma bilateral aunque asimétrica, a mujeres en un 90%, jóvenes-adultas y más frecuentemente miopes moderadas. El pronóstico es bueno, dado el bajo índice de recurrencias, salvo en un 25% de los casos que evolucionan a MNVC normalmente en los primeros 6 meses.
El objetivo de la presente comunicación es presentar un caso típico de PIC que cursa con membrana, cuyo tratamiento dado la infrecuencia del caso, no está bien establecido, valorando las diferentes terapéuticas actuales.
Caso clínico
Presentamos a una mujer de 47 años, con AV: OD: 0,2 por atrofia macular hace 9 años y OI: 0,7, que refiere metamorfopsias en OI de 1 mes de evolución. La exploración del segmento anterior es normal, así como la PIO. En el fondo de ojo apreciamos unas lesiones cicatriciales peripapilares y en media periferia en AO con atrofia macular en OD, sin vitritis (fig. 1).

Fig. 1. Lesiones cicatriciales coriorretinianas
sugerentes de coroidopatía punctata interna.
En la AFG se pone de manifiesto una lesión redondeada hiperfluorescente precoz bien delimitada yuxtafoveal rodeada de halo hipofluorescente que aumenta su intensidad en tiempos tardíos (fig. 2). Además, lesiones peripapilares con hipofluorescencia precoz con impregnación escleral en tiempo venoso. Ante un cuadro aún con buena visión, barajamos la posibilidad de terapia con láser que ella rechaza por lo que se inicia una terapia corticoidea en pauta descendente comenzando con una dosis de 45 mg/d.
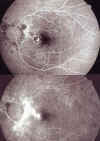
Fig. 2. AFG: a) tiempos precoces: lesión
redondeada hiperfluorescente bien delimitada yuxtafoveal; b) tiempos tardíos:
se objetiva fuga de la lesión.
A los 2 meses la AV ha caído a 0,2, apreciándose una MNVC de bordes nítidos que ha crecido haciéndose subfoveal con hemorragias profundas (fig. 3) por lo que se vuelve a introducir la terapia corticoidea 40 mg/d.
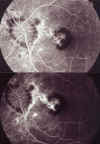
Fig. 3. AFG: MNVC de bordes nítidos que ha crecido
haciéndose subfoveal con hemorragias profundas.
La AV sigue siendo similar 0,25 a los 4 meses, tras haberse reabsorbido parcialmente la sangre y observarse cambios pigmentarios y atrofia (fig. 4). Se le plantea la cirugía, interviniéndose mediante vitrectomía con extracción de MNVC en el plazo de una semana.
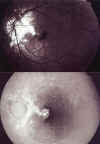
Fig. 4. Retinografía y AGF: reabsorción parcial
de la sangre con alteraciones del EPR.
Actualmente 8 meses tras la cirugía la AV: 0,5, sin apreciarse signos de actividad, ni progresión ni recurrencia de la MNVC (fig. 5).
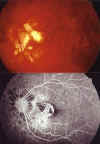
Fig. 5. Retinografía y AFG postoperatoria: no se
aprecian signos de actividad, progresión ni recurrencia de la MNVC.
Discusión
Ante un cuadro clínico como el anteriormente descrito, en primer lugar es necesario hacer el diagnóstico diferencial con aquellas entidades que pudieran desarrollar un cuadro similar (POHS, DFS, MPC, AMPPE, MEWDS, Birdshot, serpinginosa, neurorretinitis subaguda bilateral, sarcoidosis, tuberculosis,...), siendo la paciente sometida a todos los estudios pertinentes clínicos, sistémicos, que descartaron las entidades anteriormente mencionadas y que al no ser objeto del presente trabajo no incidiremos más sobre ese punto.
Tras este diagnóstico, nos planteamos el manejo terapéutico. Iniciamos el tratamiento corticoideo basándonos en estudios precedentes, aún encontrando una gran controversia entre diferentes autores. Mientras Morgan y Schatz (1) los consideran eficaces, Brown (2) cree que pueden ser útiles en MNVC <100 micras, aún con el sesgo que plantea que en estos casos se han observado regresiones espontáneas, lo cual pone en duda la eficacia real de esta terapia. Flaxel (3) encuentra resultados favorables en un porcentaje mayor que el resto de los grupos (50%) y lo relaciona con unos criterios de inclusión más rígidos (sólo si amenaza AV central, con fuga en AFG por MNVC subfoveal) y unas dosis de inicio de 1 mg/kg/peso más elevadas que la mayoría del resto de estudios. El mecanismo de actuación de estos fármacos sería mediante la reducción de la permeabilidad capilar y edema que interferiría en el paso de complejos inmunes a través de las membranas basales. Olsen (4) y Dreyer (5) comentan que eran eficaces en mejorar la AV y su sintomatología asociada sólo previamente a establecerse una MNVC, y Singerman (6) afirma que no son de ninguna utilidad, poniendo además de manifiesto la no exención de efectos secundarios. Hochman (7) aboga por introducir los corticoides previamente a la cirugía, con el objeto de reducir la reacción inflamatoria facilitando así el acto operatorio.
Para otros, el efecto beneficioso añadido de los corticoides sería la prevención de la fibrosis subretiniana, siendo la PIC y DFS dos entidades clínicas muy difíciles de diferenciar en sus estadios iniciales, teniendo la DFS un pronóstico infausto de no instaurar precozmente una terapia corticoidea a altas dosis (2).
En nuestro caso se instauró el tratamiento corticoideo en pauta descendente, con las pruebas previas habituales (radiografía de tórax, tuberculina, toxoplasmosis...).
Aparte de los corticoides, revisando la literatura, la talidomida, actualmente en estudio, se ofrece como otra posibilidad terapéutica en estos enfermos, aunque con escasa casuística para poder sacar alguna conclusión. (8)
En cuanto la terapia de fotocoagulación, dada la infrecuencia de la enfermedad y más aún en su asociación a membrana, la opinión de los autores es también controvertida. Nuestra paciente debutó con una membrana yuxtafoveal, y aún no existiendo criterios consensuados en la literatura en cuanto a la PIC, se ofreció a la paciente (AV: 0,6) terapia láser que fue rechazada por la misma.
Dado que en la evolución del caso la membrana se hizo subfoveal con una AV: 0,2, se consideró la cirugía la mejor alternativa terapéutica en ese momento, siguiendo los criterios de intervención de MNVC de Hochman (7). Es preferible intervenir quirúrgicamente en pacientes en los que no se haya fotocoagulado previamente, como es nuestro caso, ya que ésta aumenta la adhesión entre la MNVC y la retina neurosensorial complicando la cirugía.
También reseñar que la membrana extraída quirúrgicamente es mayor que la observada mediante AFG o funduscopia, por lo que existen mayores posibilidades de tratar toda la membrana con cirugía frente láser (7,9-10).
De acuerdo con la clasificación de Gass (4,11), nuestro caso se engloba dentro del tipo II. Gass subdividía las MNVC en tipo I (encontrándose bajo el EPR) como ocurre frecuentemente en la DMAE y tipo II (en el espacio neurorretiniano). Sin embargo, esta clasificación no es específica de las diferentes etiologías, teniendo relación con la edad y con la presencia o ausencia de distrofia difusa que afecte a la estructura coriocapilar-Bruch-EPR, apreciándose en un mayor porcentaje en personas mayores de MNVC subEPR y en las jóvenes de subneurorretiniana (7).
Hemos observado en nuestra paciente un halo pigmentado clínicamente (hipofluorescente en la AFG) evidencia de una hiperplasia de EPR reactiva inducida por los neovasos situados en el espacio subretiniano, confiriéndole un mejor pronóstico según algunos autores (2), frente a los casos en los que se comprueba mayor atrofia coriocapilar postquirúrgica asociada a alteración del EPR intraquirúrgica como pudo comprobar Ormerold (12) en algunos casos de DMAE con un peor resultado visual. Una hipótesis que se ha establecido sería el que dicho EPR protegería a modo de «manguito» envolviendo los neovasos, disminuyendo el fluido subretiniano e incluso inactivando la neovascularización (13). Ya en 1985, Campochiaro y Glaser (14) dedujeron que probablemente las células endoteliales de los capilares liberaran sustancias quimiotácticas que atrairían hacia ellas al EPR. Diferentes estudios experimentales abogan por la liberación por parte del EPR de factores inhibidores de la vascularización, jugando ésta por lo tanto un papel en la regresión de los neovasos (15).
Este tipo II se beneficia de un mejor plano de clivaje durante la cirugía por lo anteriormente mencionado y de una única zona de adhesión de la membrana a la coriocapilar que coincide con la zona de la cicatriz, permaneciendo indemnes las capas neurorretinianas suprayacentes y el complejo EPR-Bruch contiguo a la zona de ruptura.
En resumen, la mayoría de las características clínicas que, previamente a la cirugía, apoyarían la existencia de una MNVC en el espacio neuroretiniano, confiriéndole por tanto un mejor pronóstico, se cumplían en esta paciente, considerando como tales: edad menor de 50 años, halo pigmentado subretiniano o placa pigmentada alrededor de zona origen neovascularización y bordes definidos, afilados, con elevación del complejo MNVC, lo que ratifica la actitud terapéutica tomada en este caso.
Actualmente, a los ocho meses tras la cirugía, la paciente ha mejorado considerablemente alcanzando una AV: 0,5, no demostrando la AFG recidiva de la MNVC, siendo este porcentaje muy variable en los escasos artículos publicados, oscilando entre el 25% al 75% (4).
En conclusión, en esta infrecuente enfermedad, máxime si se asocia a MNVC, los corticoides no nos han demostrado su efectividad, habiendo obtenido muy buenos resultados con la cirugía, considerándola por tanto como la mejor opción terapéutica.
Resumen
Introducción: Variedad de la misma entidad clínica, junto con la Coroiditis Multifocal con Panuveítis y el Síndrome de Fibrosis Subretiniana Difusa (DFS). Se presenta de forma bilateral aunque asimétrica, afectando a mujeres jóvenes miopes. En el 25% de los casos puede complicarse con membrana neovasculares subretinianas.
Caso clínico: Mujer de 47 años, miope –7 dioptrías. Refiere escotoma central y metamorfopsias en OI. Su agudeza visual corregida (AV csc) es de OD: 0,21; OI: 0,7. En la funduscopia se objetivan cicatrices peripapilares en sacabocados en ambos ojos con atrofia macular en OD y membrana neovascular (MNVC) yuxtafoveal con exudación en OI. La AFG confirma el diagnóstico de MNVC. Debido al rechazo de la paciente a la fotocoagulación, se instauró tratamiento con prednisona oral durante 2 meses en pauta descendente. Durante su evolución la AV del OI disminuyó hasta 0,2 debido al crecimiento subfoveal de la membrana. La paciente fue sometida a una vitrectomía con extracción de la MNVC del OI, no presentando en la actualidad signos de actividad inflamatoria y AVcsc del OI: 0,5.
Discusión: Aunque la fotocoagulación con láser es el tratamiento de elección de las MNVC extrafoveales, presentamos un caso en el que se valoraron otras opciones terapeúticas, como la corticoterapia sistémica o la cirugía.
Palabras clave
Coroidopatía punctata interna, membrana neovascular, cirugía macular.
Summary
Introduction: Variety from the same clinical entity, together with Multifocal Coroiditis with Panuveitis and Diffuse Fibrosis Syndrome (DFS). It is presented bilaterally although asymmetrically, affecting myopic young women. In 25% of the cases it can be complicated with sub-retinal neovascular membranes.
Clinical case: Woman aged 47 years old, myopic – 7 dioptres. She has central scotoma and metamorphosias in left eye. Her corrected visual acuity (VA with glasses) is 0.21 in right eye and 0.7 in left eye. In the funduscopy peri-papillary scars are objectified in cavities in both eyes with macular atrophy in right eye and juxtafoveal neovascular membrane (NVM) with exudation in left eye. The AFG confirms the diagnosis of NVM. Due to the patient’s rejection of photocoagulation, treatment was established with oral prednisone for 2 months in a descending line. During its evolution the visual acuity of the left eye decreased to 0.2 due to the subfoveal growth of the membrane. The patient was submitted to a vitrectomy with extraction of the NVM from the left eye, currently not presenting any signs of inflammatory activity and with visual acuity with glasses of 0.5 in the left eye.
Discussion: Although photocoagulation with laser is the chosen, treatment for extrafoveal NVM, we present a case where other therapeutic options are assessed, such as systematic corticotherapy or surgery.
Key words
Internal punctate coroidopathy, neovascular membrane, macular surgery, corticoids.
Bibliografía
Morgan CM, Schatz H. Recurrent multifocal choroiditis. Ophthalmology 1986; 93: 1138-1147.
Brown J. Visual prognosis of Multifocal Choroiditis, Punctate Inner Choroidopathy, and the Diffuse Subretinal Fibrosis Syndrome. Ophthalmology 1996; 103: 1100-1105.
Flaxel CJ. The use of corticosteroids for choroidal neovascularization in young patients. Eye 1998; 12: 266-272.
Olsen TW. Subfoveal choroidal neovascularization in Punctate Inner Choroidopathy. Ophthalmology 1996; 103: 2061-2069.
Dreyer RF, Gass DJ. Multifocal Choroiditis and Panuveitis. A syndrome that mimics. Arch Ophthalmol 1984; 102: 1176-1184.
Singerman LJ. Letter. Ophthalmology 1986; 93: 1143-1147.
Hochman MA. Surgical management of choroidal neovascular membranes. Int Ophthalmol Clin 1999; 1: 303-315.
Gorin MB. Recurrence of a choroidal neovascular membrane in a patient with Punctate Inner Choroidopathy treated with daily doses of talidomida. Am J Ophthalmology 1996; 4: 594-595.
Lambert HM. Surgical excision of subfoveal neovascular membranes in age-related macular degeneration. Am J Ophthalmol 1991; 113: 257-262.
Berger AS. Clinical experience with the surgical removal of subfoveal neovascular membranes; short term postoperative results. Ophthalmology 1992; 99: 963-976.
Gass JD. Biomicroscopic and histopathologic consideration regarding the feasibility of surgical excision of subfoveal neovascular membranes. Am J Ophthalmol 1994; 118: 285-298.
Ormerod LD. Long-term outcomes after the surgical removal of advanced subfoveal neovascular membranes in age-related macular degeneration. Ophthalmology 1994; 101: 1201-1210.
Miller H. The role of retinal pigment epithelium en the resolution of subretinal neovascularization. Invest Ophthalmol Vis Sci 1986; 27: 1644-1652.
Campochiaro PA, Glaser BM. Platelet-derived growth factor is chemotactic for human retinal pigment epithelial cells. Arch Ophthalmol 1985; 4: 576-579.
Glaser BM, Campochiaro PA. Retinal pigment epithelial cells release inhibitors of neovascularization. Ophthalmology 1987; 94: 780-784.