Técnicas de exploración de la capa de
fibras nerviosas de la retina
GARCÍA FEIJÓO J, MARTÍNEZ DE LA CASA JM,
GARCÍA SÁNCHEZ J
Hospital Clínico San Carlos. Madrid.
Instituto de Investigaciones Ramón Castroviejo.
Universidad Complutense. Madrid.
En la actualidad el diagnóstico del glaucoma crónico simple se
basa en la demostración de los daños estructurales y/o funcionales que produce
la enfermedad. De este modo, si bien la presión intraocular es el factor de
riesgo más importante, su diagnóstico se puede hacer independientemente de la
cifra de presión. Por todo ello, se ha realizado un gran esfuerzo para mejorar
las técnicas de diagnostico del glaucoma. Este esfuerzo ha seguido
principalmente en dos vías, por un lado desarrollando nuevos test y
procedimientos perimétricos, fundamentalmente utilizando estímulos que
exploran vías específicas (por ejemplo la perimetría de parpadeo, azul
amarillo, PULSAR, etc) y por otro perfeccionando las técnicas que proporcionan
un análisis objetivo y más exacto de los posibles daños estructurales. La
perimetría, sin embargo es una prueba subjetiva y es precisa un cierto grado de
colaboración por parte del paciente por ello teoricamente podría ser más
facil detectar de una manera objetiva el daño estructural. Además el estudio
de daño estructural sobre la capa de fibras nerviosas tiene un gran interés ya
que trabajos clásicos han demostrado que pueden aparecer defectos detectables
en la capa de fibras nerviosas (CFN) hasta seis años antes de la aparición de
lesiones campimétricas en la perimetría convencional blanco-blanco (1,2). No
obstante el estudio clínico de la CFN es muy complicado y las técnicas
fotográficas tradicionales son laboriosas y para su correcta interpretación se
necesita un gran experiencia.
Por todo ello se trataron de desarrollar sistemas de estudio
sencillos, rápidos y sobre todo objetivos para el estudio detallado de la CFN.
Algunos de ellos como la polarimetría láser han sido diseñados para estudiar
específicamente la CFN y otros como el OCT, el RTA y el HRT parten de objetivos
globales (estudio de la topografía retiniana o del nervio óptico) pero
permiten además estudiar la CFN.
POLARIMETRÍA LÁSER
Esta técnica es la única que ha sido diseñada
específicamente para el estudio cuantitativo de la CFN. Se basa en las
propiedades polarizantes de la CFN y deduce su espesor a partir de los cambios
de polarización que se producen en un haz láser proyectado (3-5). Básicamente
y debido a dichas propiedades, un haz luminoso que atraviese la CFN ve
modificado su estado de polarización, teóricamente el cambio sufrido es
proporcional al trayecto de la luz por el medio polarizante (espesor del medio).
Este cambio del estado de polarización se denomina retraso. Además, existe una
relación lineal entre el espesor de la capa de fibras y el cambio de
polarización sufrido por el haz, por tanto, conociendo este último se puede
estimar el espesor de la CFN (3,4). Así teóricamente es posible determinar el
grosor en micras de la CFN en cualquier zona de la retina y específicamente la
región peripapilar. No obstante para que la técnica sea exacta se han de
cumplir los supuestos teóricos mencionados previamente y además la CFN en la
zona donde se realizan las medidas debe ser homogénea adoptando sus axones una
disposición paralela.
Aunque en las primeras versiones del instrumento la
reproducibilidad era limitada (6), el perfeccionamiento del instrumento y la
incorporación de nuevos algoritmos a los instrumentos actuales, ha permitido
obtener medidas reproducibles (7,8). Este instrumento se ha utilizado
principalmente para estudios transversales comparativos entre los espesores de
la CFN de glaucomatosos, HTO y controles (4,9,10). Con él se ha demostrado in
vivo la reducción del espesor de la CFN con la edad (11-13). Y también se ha
estudiado la relación entre la CFN con la sensibilidad retiniana con resultados
dispares (14-18).
En cuanto a su capacidad para diferenciar ojos normales de
glaucomatosos, en los estudios iniciales de Lemij et al (19) el instrumento
evidenció una elevada sensibilidad (96%) y especificidad (93%), sin embargo,
los resultados de estos trabajos no se han visto corroborados por los estudios
realizados con posterioridad (14,15,20-26). Posiblemente estas discrepancias se
deben al grado avanzado de defecto glaucomatoso de los pacientes seleccionados
por Lemij. Si analizamos su capacidad para detectar daño en HTO o glaucomas
incipientes su sensibilidad es del 56% y su especificidad del 93% (27). Si bien
estas cifras pueden parecer pobres, se refieren a pacientes con perimetría
blanco-blanco normal, por lo que sin duda la polarimetría láser aporta una
información adicional de extraordinaria utilidad. Por otra parte se ha podido
demostrar que los pacientes con sindrome de dispersión pigmentario tienen una
alteración de la CFN cuando se les comparada con sujetos sanos apareados con
edad, sexo y defecto refractivo (28) y que incluso un ascenso importante de la
PIO durante un periodo de tiempo corto pueden producir lesiones evidenciables en
la CFN (29,30).
Además también ha sido empleado en otras patologías y ha
demostrado su capacidad para evidenciar la alteraciones de la CFN despues de
traumatismos en el nervio óptico (31). También ha mostrado que no existen
diferencias en los parámetros de la CFN estudiados por polarimetría láser
entre ojos ambliopes por estrabismo o anisometropía y el contralateral (32).
Finalmente en los estudios comparativos con otras técnologías de analisis de
la CFN la polarimetría láser ofrece resultados similares o superiores a otros
instrumentos como el OCT y el HRT (33).
Sin embargo, los estudios con estas versiones del polarímetro
detectaron limitaciones técnicas importantes. En primer lugar la CFN no es la
única estructura birrefringente del ojo, por ello no todos los cambios sufridos
por el haz proyectado pueden atribuirse a la CFN. Entre ellas destaca la cornea
que además tiene un eje de birrefringencia por lo que puede afectar gravemente
las mediciones polarimétricas (34,35). Si bien otras versiones compensaban el
efecto de la polarización corneal mediante un algoritmo matemático, se en ese
momento se consideraba erroneamente que el eje y la magnitud de la
birrefringencia corneal su eran bastante constantes en todos los individuos.
Esto es una fuente de errores como quedo en evidencia en trabajos como el de
Jehn et al (36) y Weinreb et al (34). Por otra parte, las intervenciones
quirúrgicas sobre la cornea (37,38) e incluso la cirugía de cataratas modican
las propiedades birrefringentes del ojo y en estos casos es conveniente obtener
una nueva imagen basal de la CFN (39-41).
Por todo ello se desarrolló un nuevo modelo que trata de
mejorar los problemas detectados en las versiones previas del instrumento,
fundamentalmente las debidas a la birrefringencia corneal (42) y a la
intervención del explorador en la toma de las imágenes (fig. 1).

Fig. 1. El compensador corneal variable permite corregir adecuadamente los
artefactos producidos por la birrefringencia corneal. En este caso se muestran
las imágenes polarimétricas de un ojo al ser explorado con el instrumento
previo (arriba) y con el GDx-VCC (abajo). En la imagen superior se puede
apreciar la pajarita con eje vertical proyectada sobre la mácula (flecha) que
hace que aumente la medida obtenida sobre dicho eje. En este caso aumentaría la
medida del espesor de la CFN en el eje vertical.
El último modelo de analizador de la capa de fibras nerviosas
es el GDx-VCC (Laser Diagnostic Technologies, San Diego, CA, USA). Este modelo
se beneficia de las experiencias obtenidas con las versiones previas del
instrumento. Utiliza un láser de diodo de baja intensidad con una longitud de
onda de 780 nm. Básicamente, se proyecta un haz láser polarizado hacia la CFN
que modificará su estado de polarización tras atravesarla. Finalmente el haz
es reflejado de nuevo hacia el instrumento. Su cambio principal es la
introducción de un sistema variable de compensación de la birrefringencia
ocular (fundamentalmente corneal) determinando en cada paciente el componente
que se podría deber a otras estructuras oculares (la versión previa empleaba
un algoritmo de compensación igual para todos los pacientes).
El GDx-VCC es más compacto que las versiones comerciales
previas. Posee una pantalla de información con un monitor LCR que permite
seguir el examen y donde se presentan los resultados de la prueba. El protocolo
de examen de un paciente nuevo consta de dos fases, en la primera se realiza un
cálculo de la birrefringencia total del ojo para corregir los artefactos
producidos por las modificaciones en el estado de polarización del haz
proyectado por otras estructuras oculares que no sea la CFN. Esto se realiza
tomando una imagen macular, donde en condiciones normales la capa de Henle esta
intacta y es homogenea. De este modo la mácula es utilizada para calcular la
polarización corneal y su eje para compensar de un modo específico su cantidad
en cada caso estudiado. A continuación se realiza la medida de la CFN en la
región papilar. Dentro de las ventajas de la técnica tenemos que el proceso es
automático con sistemas de fijación interno y autoenfoque, por lo que la
intervención del explorador es mínima. Además posee un sistema automático de
localización y marcado de los borde del nervio óptico. Si bien el instrumento
también tiene un control de calidad de la imagen es conveniente que el
explorador confirme que la imagen tiene suficiente calidad y esta enfocada.
También se debe supervisar si el sistema automático localizó correctamente
los bordes de la papila y la situación del anillo de medición.
Finalmente en la ventana podemos comprobar los resultados que
proporciona el programa del instrumento sobre 14 parámetros de la CFN que
incluyen medidas directas [7], cocientes [6] y un número calculado por una red
neuronal. Además de las cifras brutas, el software permite también realizar la
comparación con una base de datos de controles indicando para cada parámetro
si se encuentra dentro del rango normal, es dudoso o patológico (figs. 2 y 3).
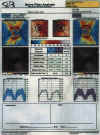
Fig. 2. Hoja de resultados del VCC-GDx. En este caso el resultado de la prueba
es normal. Se pueden apreciar que todos los índices que se muestran se
encuentran dentro de los límites normales (en verde).

Fig. 3. Resultados de la polarimetría. Se pueden apreciar los valores de los
parámetros en cada ojo y también los resultados comparativos (columna de la
izquierda).
Teóricamente este modelo ofrece mediciones más reproducibles
que los sistemas previos (43) y un mejor ajuste con la histología tanto en ojos
de primates sanos como en ojos de primate glaucomatosos (44). Los estudios
realizados utilizando el compensador corneal variable han mostrado que su
capacidad diagnóstica es mayor (45,46) e incluso mejora la correlación entre
los parámetros estructurales y la perimetria blanco-blanco (47,48) y con otros
instrumentos de análisis estructural como el OCT (49).
De todas maneras, no se debe olvidar que la polarimetría se
basa en la cuantificación de la capacidad polarizante de la capa de fibras
nerviosas y no mide directamente su espesor. Así, hay factores que pueden
modificar la medida extrapolada por el instrumento sin que reflejen exactamente
el espesor de la CFN sino por ejemplo cambios en su estructura (50). Por otra
parte, aunque la capacidad de medir del polarímetro se afecta menos por
opacidades en los medios oculares que el OCT o el RTA, deben tenerse en cuenta,
especialmente cuando son localizadas (51).
Pese a las grandes ventajas de ofrece este instrumento,
diseñado específicamente para estudiar la CFN tiene algunos problemas, así a
diferencia de los modelos previos, no se puede modificar la distancia del anillo
de medición con respecto al borde papilar, por lo que en algunos casos la
medida puede realizarse sobre areas de atrofía, la pantalla LCR no ofrece
imágenes del fondo del ojo y la luz de fijación del instrumento es interna,
por lo que no se puede controlar el centrado (lo que es importante por ejemplo
en niños u ojos únicos), no hay salida para exportar los datos a ordenadores
externos y la base de datos no incluye pacientes menores de 18 años. Además,
con el software actual el compensador variable se basa en las medidas obtenidas
sobre la macula, pero lógicamente ciertas enfermedades maculares pueden
modificar esta zona de referencia (52) No obstante, la mayoria de estos
problemas se solucionarán con el nuevo software que estará disponible a lo
largo del año 2004 (medida del anillo de medidas varible con tres opciones,
salida remota, base de datos infantil). Además se incluirá un nuevo programa
de seguimiento que incluye la opción de realizar tres medidas por sesión para
mejorar la reproducibilidad que pasa de las 10 micras cuando se realiza una
medida única a aproximadamente 6 micras.
Por todo ello, si se conocen las limitaciones de la técnica,
(medir en zonas de atrofia peripapilar o atrofía retino-coroidea, edema de
papila, edemas focales diabéticos, etc) y se tienen en cuenta otras causas de
descenso del espesor de la CFN (neuropatías ópticas, panfotocoagulaciones
retinianas) la polarimetría láser ofrece información muy útil para el
diagnóstico y seguimiento del glaucoma.
LÁSER CONFOCAL DE BARRIDO. HRT
El láser confocal de barrido permite estudiar el nervio optico
y analizar el anillo neuroretiniano y la excavación papilar. También facilita
datos sobre el espesor y la sección de la capa de fibras nerviosas (53,54). No
obstante, su mayor utilidad es el estudio estructural del nervio óptico.
A diferencia de los sistemas ópticos convencionales, en los
sistemas de barrido se utiliza un haz luminoso puntiforme que recorre o escanea
el objeto a estudiar, en este caso la retina. Durante el proceso el haz ilumina
cada punto de la retina un corto espacio de tiempo, y la luz reflejada desde la
retina es a continuación almacenada. Al repetir el proceso a lo largo de toda
la zona a estudiar mediante barridos horizontales sucesivos se logra construir
una imagen de toda la superficie explorada.
Actualmente el instrumento más difundidos es el HRT II
(Heidelberg Retina Tomograph, Heidelberg, Alemania). Emplean un sistema de
iluminación de la superficie de la retina mediante un láser de diodo (675 nm).
El principio de la imagen confocal se basa en la utilización de agujeros
estenopeicos conjugados. La retina se ilumina a través de un agujero
estenopéico, un segundo agujero estenopéico localizado en un plano
ópticamente conjugado con el primero, permite pasar únicamente la luz que
proviene del punto en el que el primero concentra la luz. Cualquier otro punto
que este situado por delante o detrás del foco queda extraordinariamente
atenuado dando como resultado un gran contraste y una mucho mejor resolución.
Por lo tanto, en cada corte óptico el sistema va a recoger únicamente
información procedente de un plano determinado, ya que la luz que procede de
otros planos es eliminada por el sistema óptico. Al realizar esta operación
sucesivamente en planos superpuestos, se va a obtener información de múltiples
planos. Con esta información el instrumento puede realizar una reconstrucción
tridimensional de la zona estudiada extrapolado los datos de las zonas entre las
secciones realizadas, de un modo análogo a lo que se hace con las
reconstrucciones realizadas a partir de la tomografía axial computerizada. En
el HRT II el area de examen esta prefijada en 15°. Su software incluye
fórmulas de análisis discriminante para facilitar la interpretación de los
resultados.
Por lo tanto, el instrumento permite una medida topografía de
la elevación de la CFN, sin embargo no mide el espesor real que corresponde a
la capa de fibras como hace el RTA, el OCT o la polarimetría láser, sino que
incluye espesores retinianos globales de los que ha de inferirse el espesor de
aquella.
En principio la técnica es reproducible, sin embargo, la
variabilidad es mayor en glaucomatosos, en pacientes con excavaciones que
presentan transiciones bruscas y sobre los vasos (53,55-57). Por todo ello es
muy importante la correcta delimitación de los limites del NO por parte del
explorador. También se ha demostrado que la edad es un factor a considerar a la
hora de evaluar los resultados. Su capacidad de discriminar entre normales y
glaucomatosos ha sido demostrada aunque los resultados de los diferentes autores
son variables según el tipo de análisis empleado y el tipo de pacientes y su
grado de glaucoma (su sensibilidad oscila entre 62 al 94% y su especificidad
entre el 68-96%) (33,58-60). Incluso ofreció peores resultados cuando se
comparó con la perimetría (utilizando la fórmula discriminante de Mikelberg)
(61). No obstante, Wollstein et al encontraron que su capacidad es similar o
superior al análisis papilar realizado por expertos (62). Pero todos estos
trabajos su capacidad de discriminación se basa en parámetros de nervio
óptico, especialmente los no dependientes del plano de referencia. Por otra
parte otros autores encontraron que fue capaz de detectar daño estructural con
anterioridad a la aparición de defectos en el campo visual (63). La técnica
también ha sido empleada para estudiar las relaciones estructura-función,
encontrándose relaciones estadísticamente significativas con algunos
parámetros de la perimetría convencional (64) y la perimetría automatizada de
longitud de onda corta (azul-amarillo) (65,66).
Por lo tanto, la evaluación del nervio óptico con el láser de
barrido permite obtener información objetiva sobre los daños estructurales que
se producen en él. Sin embargo, su utilidad para evaluar la CFN es menor que la
de otros instrumentos.
ANALIZADOR DE GROSOR RETINIANO
El Analizador de Grosor Retiniano (RTA, Talia Technology Ltd,
Mevaseret, Israel), fue desarrollado por Zeimer (67,68) a finales de los años
90. Desde su inicio ha sido utilizado fundamentalmente para el estudio de la
patología retiniana (69), pero las sucesivas mejoras en el software lo han
convertido en una herramienta más dentro del estudio estructural del glaucoma.
Utiliza un láser de Helio-Neón como fuente de luz con una longitud de onda de
543 nm que se encuentra dentro del espectro de luz verde. Esa luz es proyectada
hacia el fondo del ojo, siendo reflejada por la retina y captada con una cámara
que la digitaliza automáticamente. El estudio completo para los pacientes con
glaucoma se basa en 16 zonas de análisis. De esas dieciséis zonas, las cuatro
primeras son las utilizadas para reconstruir una imagen del nervio óptico (fig.
4). Las otras doce zonas permiten estudiar el grosor retiniano en la región
macular, el cual se ha mostrado útil en el diagnóstico de los pacientes con
glaucoma (fig. 5) (70). El software del aparato utiliza un algoritmo que detecta
la localización de la capa de fibras nerviosas y del epitelio pigmentario y
calcula el grosor de la retina como la distancia existente entre esas dos capas.
Los datos sobre el grosor retiniano se presentan como mapas bi o
tridimensionales en los que son fácilmente detectables adelgazamientos focales
o difusos sobre el patrón en forma de donut que aparece en los sujetos
normales. El aparato cuenta también con una base de datos de normalidad,
pudiendo comparar los obtenidos en cada paciente con lo que el software del
aparato considera como normal para cada una de las localizaciones.

Fig. 4. Análisis papilar realizado con el RTA. Se facilitan datos de la
morfología papilar y de la excavación así como del grosor retiniano
peripapilar.
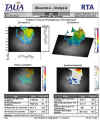
Fig. 5. Topografía macular realizada con el RTA. Se puede apreciar un
adelgazamiento de la zona temporal inferior.
Una vez obtenidas las dieciséis imágenes y, reconstruida la
imagen bidimensional de la papila a partir de las cuatro primeras imágenes, el
examinador ha de delimitar manualmente el margen de la papila para obtener los
resultados del análisis topográfico. Estos datos se presentan con la misma
denominación que en el tomógrafo retiniano de Heidelberg (HRT) y nos aportan
información sobre la morfología del anillo neuroretiniano y de la excavación:
área del disco, área del anillo, volumen del anillo, área de la excavación,
relación excavación/papila, volumen de la excavación, variación de altura
del contorno, profundidad máxima de la excavación, profundidad media de la
excavación y morfología de la excavación (CSM). Para realizar las medidas del
anillo neuroretiniano y de la excavación, este instrumento, al igual que el
HRT, coloca automáticamente un plano de referencia 50 micras por debajo del
contorno papilar fijado por el examinador. Este plano de referencia arbitrario
puede sufrir variaciones con la edad o con la progresión del daño
glaucomatoso, lo cual puede limitar su utilidad en el seguimiento de los
pacientes; sin embargo, esta variación del contorno queda minimizada con el
hecho de que, al igual que en el HRT II, el contorno papilar delimitado en la
primera exploración puede ser transferido a las siguientes revisiones para
detectar cambios sutiles en el anillo o la excavación.
La principal limitación que este aparato presenta en la
actualidad es la imposibilidad de disociar la fijación del paciente y el área
que queremos estudiar, de manera que es frecuente que cuando el paciente
localiza la fijación interna que se le muestra, el nervio óptico quede fuera
del cuadrado de análisis, imposibilitando la obtención de los datos. Esto
probablemente quedará pronto subsanado con las nuevas versiones del instrumento
que incluyen un sistema localizador de la papila, un nuevo sistema de fijación
y paquetes de análisis tridimensional. Estas novedades en principio estarán
disponibles a mediados de 2004. Por otra parte la posibilidad de incluir una
cámara de fondo de ojo en el equipo aumenta su flexibilidad.
Hasta el momento, son escasos los estudios sobre morfología
papilar realizados con el RTA. La reproducibilidad de las medidas parece ser
similar a la obtenida con el HRT (71). La correlación de los datos obtenidos
con los dos aparatos es buena en aquellos parámetros que aportan información
sobre la morfología de la excavación y que son independientes del límite de
la papila marcado por el examinador, mientras que en los parámetros en los que
influye el contorno papilar la correlación es prácticamente inexistente (72).
Los parámetros independientes del contorno de la excavación son los que se han
mostrado en los estudios realizados con HRT como más sensibles a la hora de
detectar el daño glaucomatoso (73-75), siendo asímismo los que muestran una
mejor correlación con las pruebas funcionales, tanto con la perimetría
convencional (76) como con la perimetría de longitud de onda corta (77). Por
tanto, en los parámetros que hasta el momento se han mostrado de mayor utilidad
en el estudio de la topografía papilar, el RTA se comporta y los cuantifica de
manera similar a como lo hace el HRT.
El otro aspecto que permite estudiar el RTA es el grosor
macular. En estudios con el tomógrafo de coherencia óptica (OCT) el grosor
macular se ha mostrado útil en el estudio de los pacientes glaucomatosos,
puesto que las células ganglionares y la capa de fibras nerviosas conforman la
tercera parte del grosor retiniano total a nivel de la mácula. Guedes (78)
estudió con el OCT relación entre el grosor retiniano y el estadío del
glaucoma encontrando una correlación adecuada, aunque concluye que el grosor de
la capa de fibras nerviosas sigue siendo un parámetro más sensible para
discriminar a los pacientes glaucomatosos que el grosor retiniano total.
Estudios similares han sido recientemente publicados utilizando el RTA (79).
Yang (80) también encontró en los pacientes glaucomatosos adelgazamientos
focales y difusos del grosor retiniano total en la región mácular, con
diferencias significativas con respecto a los controles normales. Sus resultados
otorgan al RTA una sensibilidad del 80,8% y una especificidad del 78,5% en la
detección del daño glaucomatoso utilizando el grosor macular.
En resumen, el RTA es un instrumento muy completo que combina
algunas de las capacidades de otros de los aparatos disponibles en el mercado
actualmente. Por un lado, permite un estudio detallado de la papila similar al
que se consigue con el HRT, al mismo tiempo se pueden realizar con él estudios
topográficos del área macular parecidos a los de la OCT y además obtener
mapas topográficos del polo posterior. Lo reciente de su aparición y la
escasez de publicaciones al respecto, hace que aún se deba esperar para
ubicarlo de forma precisa en el estudio estructural de los pacientes con
glaucoma.
TOMOGRAFÍA DE COHERENCIA ÓPTICA
La tomografía de coherencia óptica tradicionalmente ha sido
empleada en el estudio de la patología retiniana (81-83), pero en la actualidad
también permite hacer un análisis en los pacientes glaucomatosos.
El funcionamiento del aparato se basa en una técnica de
medición óptica denominada interferometría de baja coherencia (84) que
utiliza un haz de luz proyectado sobre la retina con una longitud de onda de 820
nm (infrarrojo cercano).
En la actualidad, el modelo comercializado es el OCT 3000
(Humphrey Zeiss Instruments, Dublin,CA), el cual permite adquirir y analizar
tomografías tanto para retina como para glaucoma con una resolución axial de
10 micras.
El software del aparato dispone de dieciocho protocolos de
examen, ocho de los cuales están específicamente diseñados para la detección
precoz y el seguimiento del glaucoma y que fundamentalmente se centran en el
análisis del nervio óptico y de la capa de fibras nerviosas. No requiere
dilatación si el tamaño de la pupila es suficiente para poder obtener una
iluminación homogénea del fondo (85). El tiempo empleado por el OCT 3000 en la
adquisición de una tomografía oscila entre 0,32 y 1,92 segundos, en función
del protocolo utilizado. En cada uno de los análisis, el aparato realiza entre
128 y 768 barridos, adquiriendo datos de 1024 puntos en cada uno de ellos con
una profundidad de 2 mm.
El estudio de los pacientes con glaucoma puede realizarse con
tres tipos diferentes de análisis que ofrecen información complementaria: 1.
Topografía del nervio óptico; 2. Grosor de la capa de fibras nerviosas y 3.
Grosor de la retina a nivel macular.
1. Análisis de la topografía del nervio óptico: sin ser
tan completo como el análisis que se puede obtener con el tomógrafo de
Heidelberg o con el analizador de grosor retiniano, ofrece datos importantes
sobre el tamaño del nervio óptico, del anillo neuroretiniano y de la
excavación. Presenta una importante ventaja sobre los dos instrumentos citados
anteriormente: la delimitación del nervio óptico es automática a partir de
los límites del epitelio pigmentario de la retina. Esto elimina en parte el
componente de subjetividad que puede introducir el examinador al establecer los
límites de la papila, aunque en ocasiones es necesario corregir manualmente el
contorno fijado por el aparato (fig. 6).
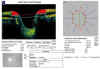
Fig. 6. Estudio de la papila con el OCT. El instrumento facilita datos sobre la
excavación, el anillo neurorretiniano y el tamaño papilar.
2. Grosor de la capa de fibras nerviosas de la retina: al
igual que la polarimetría láser, la OCT ofrece datos cuantitativos del grosor
de la capa de fibras nerviosas en la retina peripapilar. El examen de la capa de
fibras nerviosas se realiza gracias a un algoritmo de límites que determina los
bordes anterior y posterior de la capa de fibras, presentando el resultado de
grosor como el número de pixels comprendidos entre ambos. Las medidas se
realizan colocando alrededor del nervio óptico una circunferencia que podemos
variar de diámetro. Por defecto es de 3,4 mm, puesto que se ha demostrado que
es con la que se obtienen resultados más reproducibles (86). Una vez adquirida
la tomografía, los resultados se nos presentan con varios formatos: por un
lado, podemos ver una representación XY, que nos permite apreciar el patrón
clásico de doble joroba en el caso de pacientes normales. Desplazando el cursor
por este gráfico, podemos determinar el grosor de la capa de fibras en
cualquier punto. La representación numérica se nos muestra por cuadrantes y
por segmentos horarios. Los protocolos de análisis que presenta el aparato nos
permiten evaluar cambios en el tiempo de distintas tomografías, comparar los
dos ojos de un mismo paciente…, con representaciones gráficas y numéricas
(fig. 7).

Fig. 7. Anàlisis de la capa de fibras nerviosas
con el OCT. Por el momento sólo ofrece datos numéricos. También es posible
comparar la CFN en ambos ojos de un mismo paciente en busca de asimetrías, como
en este caso de glaucoma asimétrico donde se puede apreciar el aplanamiento de
la CFN del ojo izquierdo.
3. Grosor de la retina en la región macular: En la macula,
las células ganglionares y la capa de fibras nerviosas de la retina constituyen
aproximadamente un tercio del grosor retiniano total. Estudios recientes (87,88)
han puesto de manifiesto que, a medida que progresa la enfermedad glaucomatosa,
existe un adelgazamiento de la retina a nivel macular que se correlaciona
adecuadamente con los parámetros de campo visual y que puede ser medido con la
OCT. Esta determinación parece ser menos sensible que la medición de la capa
de fibras nerviosas a nivel peripapilar y es menos específica, puesto que el
grosor retiniano puede verse afectado por múltiples patologías.
La utilidad de la OCT, como la de cualquier otra herramienta de
análisis en el glaucoma, ha de establecerse en tres aspectos: el diagnóstico
precoz, la capacidad de discriminación entre sujetos normales y glaucomatosos,
y el seguimiento de la enfermedad para detectar la progresión del daño.
Nouri-Mahdavi (89) ha establecido la sensibilidad de la OCT en pacientes
sospechosos de glaucoma (nervio óptico alterado con perimetría blanco-blanco
normal) en un 71% con una especificidad del 90%. Otros autores también
defienden la capacidad de la OCT en la detección de los glaucomas
preperimétricos. Así, Bowd (90), encontró diferencias significativas al
comparar el grosor de la capa de fibras en pacientes normales e hipertensos
oculares. Mok (91) también encontró diferencias en el grosor de la capa de
fibras entre un grupo de controles y un grupo de pacientes sospechosos de
glaucoma con alteraciones en la perimetría azul-amarillo, concluyendo que la
OCT permite reconocer alteraciones estructurales tempranas antes de que
aparezcan defectos en la perimetría convencional.
El OCT permite discriminar pacientes normales de pacientes con
glaucomas incipientes o moderados con una sensibilidad entre 76 y 79% y una
especificidad entre el 68 y el 81% (92). Con una especificidad fija del 90%, la
sensibilidad para diferenciar sujetos normales de glaucomas incipientes se cifra
en el 85%.
La OCT también permite realizar un adecuado seguimiento del
paciente glaucomatoso (93) pues, a pesar de que no está disponible como tal un
software para detectar progresión, la elevada reproducibilidad de las medidas
permite detectar cambios sutiles en el grosor de la capa de fibras. En estos
cambios se ha de tener en cuenta el adelgazamiento que con la edad va a sufrir
la capa de fibras (94,95) y que no están contemplados a la hora de seguir en el
tiempo a un determinado paciente.
En resumen, la OCT es una herramienta útil en el diagnóstico
de los pacientes con glaucoma lo que, unido a sus restantes aplicaciones en
otros campos de la oftalmología, la convierte en una herramienta muy completa.
Sin embargo, su sofware debe ser mejorado, ya que tiene algunos problemas en la
determinación automática del contorno papilar en algunos casos. Esto puede
producir errores por ejemplo en la medida del anillo neuroretiniano. Por otra
parte carece de los algoritmos de análisis papilar de los que dispone el RTA y
el HRT y por el momento el análisis de la capa de fibras nerviosas es
subjetivo. Algunas de estas mejoras parecen estar próximas, incluyendo una base
de datos de normalidad que permitirá obtener más información de los datos que
aporta el aparato.
CONCLUSIONES
No cabe duda que las nuevas ténicas de análisis de la CFN
suponen una gran ayuda para el diagnóstico del glaucoma y sin duda poseen una
elevada capacidad de discriminación entre ojos normales y ojos con glaucoma
moderado o severo. En este momento todas ellas ofrecen ventajas específicas,
sin embargo ninguna de ellas aisladamente puede confirmar un diagnóstico de
glaucoma. Por otra parte no existen suficientes datos sobre la utilidad de estos
instrumentos en el seguimiento del glaucoma, entre otras razones por que las
constantes mejoras en el hardware y el sofware de los aparatos no han permitido
estudios de seguimiento a largo plazo fiables.
No obstante, no mejoran la capacidad diagnóstica de un experto
(96,97) y por todo ello todavía deben considerarse como pruebas diagnósticas
complementarias y cuya información diagnóstica debe ser evaluada dentro del
contexto clínico del paciente. Por lo tanto, en el año 2004 el diagnóstico de
glaucoma de cada paciente debe basarse en el estudio del campo visual, la
exploración clínica y/o instrumental del nervio óptico y la CFN, así como la
ponderación del resto de los hallazgos clínicos y de los factores de riesgo,
especialmente la presión intraocular.
BIBLIOGRAFÍA
-
Sommer A, Katz J, Quigley HA, Miller NR, Robin AL, Richter
RC, et al. Clinically detectable nerve fiber atrophy precedes the onset of
glaucomatous field loss. Arch Ophthalmol 1991; 109: 77-83.
-
Honrubia FM, Calonge B, Abecia E, Gomez ML. Correlación
entre los defectos en la capa de las fibras nerviosas de la retina y el
glaucoma. Arch Soc Esp Oftalmol 1992; 62: 107-112.
-
Dreher AW, Reiter K, Weinreb RN. Spacially resolved
birrefringence of the retinal nerve fiber layer assessed with a retinal
ellipsometer. Applied Optics 1992; 31: 3730-3749.
-
Weinreb R.N, Dreher A.W, Coleman A, Quigley H, Shaw B,
Reiter K. Histopathologic validation of Fourier-Ellipsometry measurements of
retinal nerve fiber layer thickness. Arch. Ophthalmol. 1990; 108: 557-560.
-
Weinreb RN, Shakiba S, Zangwill L. Scanning laser
polarimetry to measure the nerve fiber layer of normal and glaucomatous
eyes. Am J Ophthalmol 1995; 119: 627-636.
-
Swanson WH, Lynn JR, Fellman RL, Sarita RJ, Schumann SP,
Nusinowitz S. Interoperator variability in images obtained by laser
polarimetry of the nerve fiber layer. J Glaucoma 1995; 4: 414-418.
-
Waldock A, Potts MJ, Sparrow JM, Karwatowski WSS. Clinical
evaluation of scanning laser polarimetry: intraoperator reproducibility and
design of a blood vessel removal algorithm. Br J Ophthalmol 1998 ; 82 :
252-259.
-
Zangwill L, Berry C, Garden VS, Weinreb RN. Reproducibility
of retardation measurements with the nerve fiber analyzer II. J Glaucoma
1997; 6: 384-389.
-
Tjon Fo-Sang MJ, Vries J, Lemij HG. Measurements by Nerve
Fiber Analyzer of retinal nerver layer thickness in normal subjects and
patients with ocular hypertension. Am J Ophthalmol 1996; 122: 220-227.
-
Anton A, Zangwill L, Emdadi A, Weinreb RN. Nerve fiber layer
measurements with scanning laser polarimetry in ocular hypertension. Arch
Ophthalmol 1997; 115: 331-334.
-
Chi Q-M, Tomita G, Inamuzi K, Hayakawa T, Ido T, Kitazawa Y.
Evaluation of the effect of aging on the retinal nerve fiber layer thickness
using scanning laser polarimetry. J. Glaucoma. 1995; 4: 406-413.
-
García Feijoó J, García Sánchez J. Análisis de la
variación del espesor de la capa de fibras nerviosas con la edad utilizando
la polarimetría láser. Arch Soc Esp Oftalmol. 2001; 76: 477-484.
-
Bowd C, Zangwill LM, Blumenthal EZ et al Imaging of the
optic disc and retinal nerve fiber layer: the effects of age, optic disc
area, refractive error, and gender. J Opt Soc Am A Opt Image Sci Vis 2002;
19: 197-207.
-
García Sánchez J, García Feijoó J, Arias A: Correlation
Between the Nerve Fiber Layer Thickness and Visual Field in Glaucoma
Patients. LDT Scan News. 1994; 1: 3-3.
-
García Feijoó J. García Sánchez J. Correlación entre el
espesor de la capa de fibras nerviosas y el campo visual. Arch Soc Canar
Oftal 2001; 12: 3-9.
-
García Feijoo J. Análisis del espesor de la capa de fibras
nerviosas de la retina por polarimetría láser. Thesis doctoralis 1998.
UCM. Madrid.
-
Tannenbaum DP, Zangwill LM, Bowd C, Sample PA, Weinreb RN.
Relationship between visual field testing and scanning laser polarimetry in
patients with a large cup-to-disk ratio. Am J Ophthalmol 2001; 132: 501-506.
-
Weinreb RN, Shakiba S, Sample PA et al. Association between
quantitative nerve fiber layer measurement and visual field loss in
glaucoma. Am J Ophthalmol 1995; 120: 732-738.
-
Lemij HG, Tjon Fo-Sang MJ. Sensitivity and specificity of
nerve fibre measurements in glaucoma as determined with scanning laser
polarimetry. Am J Ophthalmol 1996; 122: 220-227.
-
García Sánchez J, García Feijoó J, González De La Rosa
MA, Arias Puente A. Métodos objetivos de la exploración de la capa de
fibras nerviosas de la retina. En: «Diagnóstico precoz del glaucoma».
Honrubia López F, García Sánchez J, Pastor Jimeno JC. Talleres gráficos
Edelvives. Zaragoza 1997.
-
García Sánchez J, García Feijoó J, Arias Puente A.
Estudio de las fibras nerviosas de la retina con polarimetría láser. En:
«Técnicas diagnósticas y tratamiento del glaucoma». Moreno Montañés J.
Ediciones Universidad de Navarra. Pamplona 1998.
-
Knighton RW, Huang XR, Greenfield DS. Analytical model of
scanning laser polarimetry for retinal nerve fiber layer assessment. Invest
Ophthalmol Vis Sci 2002; 43: 383-392.
-
Nicolela MT, Martinez-Bello C, Morrison CA et al Scanning
laser polarimetry in a selected group of patients with glaucoma and normal
controls. Am J Ophthalmol 2001; 132: 845-854.
-
Funaki S, Shirakashi M, Yaoeda K et al. Specificity and
sensitivity of glaucoma detection in the Japanese population using scanning
laser polarimetry. Br J Ophthalmol 2002; 86: 70-74.
-
Zangwill LM, Bowd C, Berry CC et al. Discriminating between
normal and glaucomatous eyes using the Heidelberg Retina Tomograph, GDx
Nerve Fiber Analyzer, and Optical Coherence Tomograph. Arch Ophthalmol 2001;
119: 985-993.
-
Weinreb RN, Zangwill L, Berry CC, Bathija R, Sample PA.
Detection of glaucoma with scanning laser polarimetry. Arch Ophthalmol 1998;
116: 1583-1589.
-
García Sánchez J, García Feijoó J, Arias Puente A,
Castillo Gómez A, Benítez del Castillo JM. Accuracy of the GDx system for
the diagnosis of glaucoma. Ophthalmol Vis Sci 1998; 39: S933.
-
Mocan MC, Bozkurt B, Irkec M, Orhan M, Karabulut E.The
evaluation of retinal nerve fiber layer in pigment dispersion syndrome and
pigmentary glaucoma using scanning laser polarimetry. Eur J Ophthalmol 2003;
13: 377-382.
-
Tsai JC, Chang HW. Scanning laser polarimetry in patients
with acute angle-closure glaucoma. Eye. 2004; 18: 9-14.
-
Lopes JF, Susanna R Jr. Scanning laser polarimetry and
progression of visual field defects after intraocular pressure increase.
Arch Ophthalmol 2003; 121: 1500-5101.
-
Miyahara T, Kurimoto Y, Kurokawa T, Kuroda T, Yoshimura
N.Alterations in retinal nerve fiber layer thickness following indirect
traumatic optic neuropathy detected by nerve fiber analyzer, GDx-N. Am J
Ophthalmol 2003; 136: 361-364.
-
Bozkurt B, Irkec M, Orhan M, Karaagaoglu E.Thickness of the
retinal nerve fiber layer in patients with anisometropic and strabismic
amblyopia. Strabismus. 2003; 11: 1-7.
-
Sanchez Galeana C, Bowd C, Blummental EZ et al. Using
optical imaging summary data to detect glaucoma. Ophthalmology 2001;
1621-1627.
-
Weinreb RN, Bowd C, Greenfield DS, Zangwill LM. Measurement
of the magnitude and axis of corneal polarization with scanning laser
polarimetry. Arch Ophthalmol 2002; 120: 901-906.
-
Knighton RW, Huang WR, Greenfield DS. Linear birrefringence
measured in the central cornea of a normal population. Invest Ophthalmol Vis
Sci 2002; 43: 82-86.
-
Jehn AB, Muri RM, Mojon DS. Influence of cycloversions
induced by head tilt on scanning laser polarimetry parameters
Ophthalmologica. 2003; 217: 311-314.
-
Hollo G et al. Influence of postLASIK corneal healing on
scanning laser polarimetry measurements of the RNFLT. Br J Ophthalmol 2002;
86: 627.
-
Kook MS et al. Effect of LASIK on RNFLT measurements by
scanning laser polarimetry. J Cataract Refract Surg 2002; 28: 670.
-
Park RJ, Chen PP, Karyampudi P, Mills RP, Harrison DA, Kim
J. Effects of cataract extraction with intraocular lens placement on
scanning laser polarimetry of the peripapillary nerve fiber layer. Am J
Ophthalmol 2001; 132: 507-511.
-
Gazzard G, Foster PJ, Devereux JG, Oen F, Chew PT, Khaw PT,
Seah SK.Effect of cataract extraction and intraocular lens implantation on
nerve fibre layer thickness measurements by scanning laser polarimeter (GDx)
in glaucoma patients. Eye 2004; 18: 163-168.
-
Kremmer S, Garway-Heath DF, De Cilla S, Steuhl KP, Selbach
JM.Influence of cataract surgery with implantation of different intraocular
lenses on scanning laser tomography and polarimetry. Am J Ophthalmol 2003;
136: 1016-1021.
-
Zhou Q, Weinreb RN. Individualized compensation of anterior
segment birefringence during scanning laser polarimetry. Invest Ophthalmol
Vis Sci 2002; 43: 2221-2228.
-
Choplin NT, Zhou Q, Knighton RW.Effect of individualized
compensation for anterior segment birefringence on retinal nerve fiber layer
assessments as determined by scanning laser polarimetry. Ophthalmology.
2003; 110: 719-725.
-
Weinreb RN, Bowd C, Zangwill LM.Scanning laser polarimetry
in monkey eyes using variable corneal polarization compensation. J Glaucoma
2002; 11: 378-384.
-
Weinreb RN, Bowd C, Zangwill LM.Glaucoma detection using
scanning laser polarimetry with variable corneal polarization compensation.
Arch Ophthalmol 2003; 121: 218-224.
-
Medeiros FA, Zangwill LM, Bowd C, Bernd AS, Weinreb RN.
Fourier analysis of scanning laser polarimetry measurements with variable
corneal compensation in glaucoma. Invest Ophthalmol Vis Sci 2003; 44:
2606-2612.
-
Greenfield DS, Knighton RW, Feuer WJ, Schiffman JC, Zangwill
L, Weinreb RN. Correction for corneal polarization axis improves the
discriminating power of scanning laser polarimetry. Am J Ophthalmol 2002;
134: 27-33.
-
Bowd C, Zangwill LM, Weinreb RN.Association between scanning
laser polarimetry measurements using variable corneal polarization
compensation and visual field sensitivity in glaucomatous eyes. Arch
Ophthalmol. 2003; 121: 961-966.
-
Bagga H, Greenfield DS, Feuer W, Knighton RW. Scanning laser
polarimetry with variable corneal compensation and optical coherence
tomography in normal and glaucomatous eyes. Am J Ophthalmol 2003; 135:
521-529.
-
Banks MC, Robe-Collignon NJ, Rizzo JF 3rd, Pasquale LR.
Scanning laser polarimetry of edematous and atrophic optic nerve heads. Arch
Ophthalmol 2003; 121: 484-490.
-
Pons ME et al. Vitreous opacities affect scanning laser
polarimetry measurements. Am J Ophthalmol 2001; 131: 511.
-
Bagga H, Greenfield DS, Knighton RW. Scanning laser
polarimetry with variable corneal compensation: identification and
correction for corneal birefringence in eyes with macular disease. Invest
Ophthalmol Vis Sci 2003; 44: 1969-1976.
-
Weinreb RN, Lusky M, Bartsch D et al. Effect of repetitive
imaging on topographic measurements of the optic nerve head. Arch Ophthalmol
1993; 111: 636-638.
-
Uchida H, Brigatti L, Caprioli J. Detection of structural
damage from glaucoma with confocal laser image analysis. Invest Ophthalmol
Vis Sci 1996; 37: 2393-2401.
-
Brigatti L, Weitzman M, Caprioli J. Regional test-retest
variability of confocal scanning laser tomography. Am J Ophthalmol 1995;
120: 433-440.
-
Zangwill L, Irak I, Berry CC et al. Effect of cataract and
pupil size on image quality with confocal scanning laser ophthalmoscopy.
Arch Ophthalmol 1007; 115: 983-990.
-
Mikelberg FS, Wijsman K, Schulzer M. Reproducibility of
topographic parameters obtained with the Heidelberg Retina Tomograph. J
Glaucoma 1993; 2: 101-103.
-
Wollstein G, Garway-Heath DF, Hitchings RA. Identification
of early glaucoma cases with the scanning laser ophthalmoscope.
Ophthalmology 1998; 105: 1557-1563.
-
Swindale NV, Stjepanovic G, Chin A et al. Automated analysis
of normal and glaucomatous optic nerve head topography images. Invest
Ophthalmol Vis Sci 2000; 41: 1730-1742.
-
Bathija R, Zangwill L, Berry CB et al. Detection of early
glaucomatous structural damage with confocal scanning laser tomography 1998;
7: 121-127.
-
Miglior S, Casula M, Guareschi M et al. Clinical ability of
Heidelberg Retinal Tomograph examination to detect glaucomatous visual field
changes. Ophthalmology 2001; 1621-1627.
-
Wollstein G, Garway-Heath DF, Fontana L et al. Identifiying
early glaucomatous changes:comparison between expert clinical assessement of
the optic disc photographs and confocal scanning ophtalmoscope.
Ophthalmology 2000; 107: 2272-2277.
-
Kamal DS, Viswananthan AC, Garway-Heath DF, Hitchings RA,
Poinoosawmy D, Bunce C. Detection of optic disc change with the Heidelberg
Retina Tomograph before confirmed visual field change in ocular
hypertensives converting to early glaucoma. Br J Ophthalmol 1998; 83:
290-294.
-
Anton A, Yamagishi N, Zangwill L, Sample P. Mappin
structural to functional damage in glaucoma with standard automated
perimetry and confocal scanning laser ophthalmoscope. Am J Ophthalmol 1998;
125: 436-446.
-
Teesalu P, Vihanninjoki K, Airaksinen PJ, Tuulonen A, Laara
E. Correlation of blue on yellow visual fields with scanning confocal laser
optic disc measurements. Invest Ophthalmol Vis Sci 1997; 38: 2452-2459.
-
Teesalu P, Vihanninjoki K, Airaksinen PJ, Tuulonen A.
Hemifield association between blue on yellow visual field and optic nerve
head topographic measurements. Graefe’s Arch Clin Exp Ophthalmol 1998;
236: 339-345.
-
Zeimer R, Shahidi M, Mod M, Zou S, Asrani S. A new method
for rapid mapping of the retinal thickness at the posterior pole. Invest
Ophthalmol Vis Sci. 1996; 37: 1994-2001.
-
Zeimer R. Application of the retinal thickness analyzer to
the diagnosis and management of ocular diseases. Ophthalmol Clin North Am.
1998;11: 359-379.
-
Asrani S, Zeimer R, Goldberg M, Zou S. Application of rapid
scanning retinal thickness analysis in retinal diseases. Ophthalmology.
1997; 104: 1145-1151.
-
Asrani S, Challa P, Herndon L, Lee P, Stinnett S, Allingham
RR. Correlation among Retinal Thickness, Optic Disc, and Visual Field in
Glaucoma Patients and Suspects: A Pilot Study. J Glaucoma 2003; 12: 119-128.
-
Itai N, Tanito M, Chihara E. Comparison of optic disc
topography measured by Retinal Thickness Analyzer with measurement by
Heidelberg Retina Tomograph II. Jpn J Ophthalmol 2003; 47: 214-220.
-
Martínez de la Casa JM, García Feijoo J, Castillo Gómez
A, García Sánchez J. Correlaciones entre el analizador del grosor
retiniano (RTA) y el láser confocal de barrido (HRT) en el estudio de la
papila. Arch Soc Esp Oftalmol 2004; 79: 21-26.
-
Uchida H, Brigatti L, Caprioli J. Detection of structural
damage from glaucoma with confocal laser image analysis. Invest Ophthalmol
Vis Sci 1996; 37: 2393-2401.
-
Mikelberg FS, Parfitt CM, Swindale NV, Grahan SL, Drance SM,
Gosine R. Abillity of the heidelberg retina tomograph to detect early
glaucomatous visual field loss. J Glaucoma 1995; 4: 242-247.
-
Bathija R, Zangwill L, Berry CC, Sample PA, Weinreb RN.
Detection of early glaucomatous structural damage with confocal scanning
laser tomography. J Glaucoma 1998; 7: 121-127.
-
Brigatti L, Caprioli J. Correlation of visual field with
scanning confocal laser optic disc measurements in glaucoma. Arch Ophthalmol
1995; 113: 1191-1194.
-
Teesalu P, Vihanninjoki K, Airaksinen PJ, Tuulonen A, Laara
E. Correlation of blue-on-yellow visual fields with scanning confocal laser
optic disc measurements. Invest Ophthalmol Vis Sci 1997; 38: 2452-2459.
-
Guedes V, Schuman JS, Hertzmark E et al. Optical Coherence
Tomography measurement of macular and nerve fiber layer thickness in normal
and glaucomatous human eyes. Ophthalmology 2003; 110: 177-189.
-
Tanito M, Itai N, Ohira A, Chihara E. Reduction of posterior
pole retinal thickness in glaucoma detected using the Retinal Thickness
Analyzer. Ophthalmology 2004; 111: 265-275.
-
Yang Z, Du S. Measurement of human retinal thickness at
posterior pole with retinal thickness analyzer in normal and glaucomatous
eyes. Chung Hua Yen Ko Tsa Chih 2000; 36: 124-128.
-
Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang
W, Hee MR, Flotte T, Gregory K, Puliafito CA: Optical coherence tomography.
Science 1991; 254: 1178-1181.
-
Hee MR, Puliafito CA, Duker JS, Reichel E, Coker JG, Wilkins
JR, Schuman JS, Swanson EA, Fujimoto JG: Topography of diabetic macular
edema with optical coherence tomography. Ophthalmology 1998; 105: 360-70.
-
Imai M, Iijima H, Gotoh T, Tsukahara S. Optical coherence
tomography of successfully repaired idiopathic macular holes. Am J
Ophthalmol 1999; 128: 621-627
-
Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang
W, Hee MR, Flotte T, Gregory K, Puliafito CA: Optical coherence tomography.
Science. 1991; 254: 1178-81.
-
Zafar S, Gurses-Ozden R, Vessani R, Makornwattana M,
Liebmann JM, Tello C, Ritch R. Effect of pupillary dilation on retinal nerve
fiber layer thickness measurements using optical coherence tomography. J
Glaucoma 2004; 13: 34-37.
-
Schuman JS, Pedut-Kloizman T, Hertzmark E, Hee MR, Wilkins
JR, Coker JG, Puliafito CA, Fujimoto JG, Swanson EA: Reproducibility of
nerve fiber layer thickness measurements using optical coherence tomography.
Ophthalmology 1996; 103: 1889-1898.
-
Greenfield DS, Bagga H, Knighton RW. Macular thickness
changes in glaucomatous optic neuropathy detected using optical coherence
tomography. Arch Ophthalmol 2003; 121: 41-46.
-
Guedes V, Schuman JS, Hertzmark E et al. Optical Coherence
Tomography measurement of macular and nerve fiber layer thickness in normal
and glaucomatous human eyes. Ophthalmology 2003; 110: 177-189.
-
Nouri-Mahdavi K, Hoffman D, Tannenbaum DP, Law SK, Caprioli
J. Identifying early glaucoma with optical coherence tomography. Am J
Ophthalmol 2004; 137: 228-235.
-
Bowd C, Weinreb RN, Williams JM, Zangwill LM. The retinal
nerve fiber layer thickness in ocular hypertensive, normal, and glaucomatous
eyes with optical coherence tomography. Arch Ophthalmol 2000; 118: 22-26.
-
Mok KH, Lee VW, So KF. Retinal nerve fiber layer measurement
by optical coherence tomography in glaucoma suspects with short-wavelength
perimetry abnormalities. J Glaucoma 2003; 12: 45-49.
-
Sanchez-Galeana C, Bowd C, Blumenthal EZ, Gokhale PA,
Zangwill LM, Weinreb RN. Using optical imaging summary data to detect
glaucoma. Ophthalmology 2001; 108: 1812-1818.
-
El Beltagi TA, Bowd C, Boden C, Amini P, Sample PA, Zangwill
LM, Weinreb RN. Retinal nerve fiber layer thickness measured with optical
coherence tomography is related to visual function in glaucomatous eyes.
Ophthalmology 2003; 110: 2185-2191.
-
Alamouti B, Funk J. Retinal thickness decreases with age: an
OCT study. Br J Ophthalmol 2003; 87: 899-901.
-
Kanamori A, Escano MF, Eno A, Nakamura M, Maeda H, Seya R,
Ishibashi K, Negi A. Evaluation of the effect of aging on retinal nerve
fiber layer thickness measured by optical coherence tomography.
Ophthalmologica 2003; 217: 273-278.
-
Greaney MJ, Hoffman DC, Garway-Heath DF, Nakla M, Coleman
AL, Caprioli J. Comparison of optic nerve imaging methods to distinguish
normal eyes from those with glaucoma. Invest Ophthalmol Vis Sci 2002; 43:
140-145.
-
Greenfield DS. Optic nerve and retinal nerve fiber layer
analyzers in glaucoma. Curr Opin Ophthalmol 2002; 13: 68-76.






