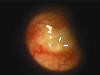
Fig. 1. Ampolla isquémica que provoca atalamia. Las flechas delimitan el área más adelgazada y transparente de la misma.
CASO CLÍNICO
PÉREZ SILGUERO D1, PÉREZ SILGUERO MA1, MÉNDEZ DE PANDO MD2, JIMÉNEZ GARCÍA MA2
(1) Doctor en
Medicina.
(2) Licenciado en Medicina.
RESUMEN
Objetivo: Presentar un caso de transplante de membrana amniótica en un intento de resolver una ampolla filtrante isquémica tardía.
Material y método: Paciente con ojo único, atalamia y seydell espontáneo por ampolla filtrante isquémica. Se practica transplante de membrana amniótica y recubrimiento conjuntival.
Resultado/Conclusión: Hasta los 2 meses existía ampolla plana, y vascularizada. A los 4 meses no hay seydell, presenta buena cámara, pero el aspecto de la ampolla indica isquemia.
SUMMARY
Objetive: To show a case of amniotic membrane graft for late-onset glaucoma filtering leaks.
Material and method: Patient with only one eye, athalamia and spontaneous seydell in leaking glaucoma filtering bleb. We used preserved human amniotic membrane graft and conjunctival recovering.
Result/Conclusion: There was a flat and vascularized bleb at two months after surgery. Four months later the eye presents good chamber, there is not seydell, but the bleb looks like an ischemic one.
INTRODUCCIÓN
La membrana amniótica es un tejido semitransparente y delgado que forma la capa más interna de la membrana fetal. Presenta una gruesa y continua membrana basal con colágeno tipo IV, V, y laminina (1). Las similitudes histológicas con la membrana basal corneal permiten la sustitución de gran parte de sus propiedades (2,3). Presentamos un caso en el que utilizamos este tejido como tratamiento para una bulla isquémica y filtrante tardía postrabeculectomía.
MATERIAL Y MÉTODOS
Paciente de 55 años que acude a nuestro servicio por pérdida de AV y lagrimeo de su OD. A la exploración se objetiva amaurosis en su ojo izquierdo secundario a glaucoma crónico a pesar de dos trabeculectomías realizadas. En el OD presenta AV de «cuenta dedos» y biomicroscópicamente se observa una iridectomía superior secundaria a trabeculectomía superior, e iridectomía temporal secundaria a una segunda intervención (2 años antes), con ampolla filtrante transparente, localizada (fig. 1) y con seydell espontáneo y atalamia. El paciente aporta informe de un año antes de AV por el OD de 0,2. Actualmente la PIO en OD es de 1 mmHg con tonometría de aplanación, y presenta una excavación papilar de 9/10.

Fig. 1. Ampolla isquémica que provoca atalamia. Las flechas delimitan el área
más adelgazada y transparente de la misma.
La cirugía que practicamos consistió en: peritomía de conjuntiva temporal y liberación de la misma hasta conseguir cubrir el área isquémica y 2 mm de córnea clara. Antes de anclarla desbridamos la ampolla isquémica y encontramos una esclera adelgazada pero consistente. Para evitar que el avance de la conjuntiva cicatrizase sobre el lecho escleral e impidiese la futura evacuación controlada y deseada de humor acuoso, colocamos una capa de membrana amniótica sin suturar entre la esclera y la conjuntiva avanzada, sólo en el área escleral isquémica. Además aportábamos así todas las propiedades beneficiosas que la membrana posee. Finalmente suturamos la conjuntiva en córnea clara.
RESULTADOS
Al día siguiente a la cirugía la cámara anterior estaba perfectamente formada, y la PIO era de 8 mmHg. A los 2 meses la membrana había desaparecido y existía una ampolla plana y vascularizada (fig. 2), permitiendo una AV de 0,2. A los 3 meses la conjuntiva estaba retraída, y comenzaba a formarse una ampolla de filtración blanca, pero sin «escape», con PIO de 17 mmHg. A los 4 meses la cámara anterior permanece formada, la PIO es de 15 mmHg y no hay seydell espontáneo, aunque no nos gusta el aspecto isquémico de un área de la ampolla (fig. 3).
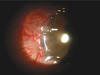
Fig. 2. Al mes de la cirugía. Resto de membrana amniótica (flecha).
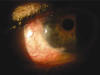
Fig. 3. A los 4 meses de intervención.
DISCUSIÓN
La membrana amniótica presenta una serie de propiedades que la hacen muy útil para problemas de la superficie ocular: permite mantener el fenotipo del epitelio que migra sobre ella (2,3). Regula la inflamación estromal (4): Lo hace modulando la transcripción de quemokinas de los queratocitos en respuesta a los mediadores inflamatorios (5); además crea una barrera física entre los agentes y células inflamatorias que porta la lágrima, debido al fuerte contacto que se crea entre el estroma de la membrana amniótica y el estroma receptor subyacente (5,6). No existe fenómeno de rechazo frente al alotransplante (7-9). Regula la regeneración estromal (2).Facilita la migración de células epiteliales (10), su adhesión y diferenciación (11,12).
Refuerza la adhesión de células basales epiteliales (11,13) y dobla la densidad de células epiteliales basales en la superficie reconstruída sobre la membrana basal amniótica (14). Previene la apoptosis epitelial (15,16). Reduce la respuesta fibrótica (4), y la aparición de pannus corneal (14).Actúa como apósito biológico, aportando una protección constante y manteniendo óptimas condiciones de humedad (6,17). Presenta propiedades antimicrobianas, existiendo menos riesgo de infección que otras mucosas transplantadas (oral, nasal...) (18,19). No manifiesta deficiencia de Stem-cell limbares inducida quirúrgicamente, a diferencia de lo que invariablemente sucede en los flap conjuntivales (20).
Todas estas propiedades eran útiles en nuestro caso. El planteamiento quirúrgico surgió como la fusión de dos técnicas anteriores. Por un lado, las trabeculectomías realizadas con membrana amniótica colocada bajo el flap escleral (21) utilizada en casos de glaucomas incontrolados. Por otro lado, el uso de la membrana para el tratamiento de fugas de ampollas de filtración tras trabeculectomías (22-24). Nosotros, a diferencia de los últimos autores, no la utilizamos como material de recubrimiento que nos «ahorra» conjuntiva, sino que, debido a que disponíamos de suficiente conjuntiva para cubrir el defecto existente —a pesar de las cirugías previas sufridas—, la colocamos entre la conjuntiva adelantada y el lecho escleral adelgazado, en un intento de utilizar todos los factores descritos, como favorecer la regeneración estromal y evitar la cicatrización incontrolada de la conjuntiva sobre el lecho, lo que llevaría al fracaso de la trabeculectomía. Aún así, aunque después de 4 meses el cuadro está controlado y desde el primer momento hubo una respuesta favorable, el aspecto blanquecino de la ampolla nos hace temer un nuevo proceso de «escape» futuro. En este caso actuaríamos igual, pero aportando conjuntiva del ojo adelfo como injerto libre. No tomamos ésta como primera opción para evitar colocar un injerto libre sobre un lecho isquémico, y además disponíamos de suficiente tejido como para cubrir el defecto. Ahora las condiciones han mejorado, el aporte sanguíneo es mayor, y creemos que sería una buena opción en caso de fracaso.
BIBLIOGRAFÍA
Shimazaki J, Hao-Yung Y, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology 1997; 14: 2068-2207
Kim JC,Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in seerely damaged rabbit corneas. Cornea 1995; 14(5): 473-484.
Tseng SCPrabhasawat P, Lee s. Amniotic membranetransplantation for onjunctival surface reconstruction. Am J Ophthalmol 1997; 124: 765-774.
Lee S, Tseng SC., Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am J Ophthalmol 1997; 123: 303-312.
Kruse FE, Rohrsshcneider K Volker HE. Multilayer amniotic membrane transplantation for reconstruction of deep corneal ulcers. Ophthalmology 1999; 16: 1504-1511.
Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patienets with chemical and thermal burns. Ophthalmology 1997; 104: 2068-2076.
Akle CA, Aolfini M, Welsh KI, et al. Inmunogenicity of human amniotic epithelial cells after transplantation into volunteers. Lancet 1981; 22: 1003-1005.
Adolfini M, Akle CA, Mcoll I, et al. Epression of HLA antigens, beta2microglobulin and enzymes by human amniotic epithelial cells. Nature 1982; 295: 325-327.
Houlihan JM, Biro PA, Harper HM, et al. The human amnion is a site of MHC class Ib expression: Evidence for the expression of HLA-E an HLA-G. J Immunol 1995; 154: 5665-5674.
Terranova VP, Lyall RM. Chemotais of human gingival epithelial cells to laminin: A mechanism for epithelial cell apical migration. J Periodontol 1986; 57: 311-317.
Khodadoust AA, Silverstein AM, Kenion AR, et al. Adhesion of regenerating corneal epithelium. The role of basement membrane. Am J Ophthalmol 1986; 65: 339-348.
Stepp MA, Zhu L, Sheppard D, et al. Localized distribution of alpha 9 integrin in the cornea and changes in expression during corneal epithelial cells differentiation. J Histochem Cytochem 1995; 43: 353-362.
Sonnenberg A, Calafat J, Janssen H, et al. Integrin a6/b4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. J Cell Biol 1991; 115: 1383-1395.
Prabhasawat P, Barton K, Tseng CS, et al. Impression cytology study of epithelial phenotype of ocular surfece reconstructed by preserved human amniotic membrane. Arch Ophthalmol 1997; 115: 1360-1367.
Boudreau N, Sympson CJ, Werb Z, et al. Supression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science 1995; 267: 891-893.
Boudreau N, Werb Z, Bissell MJ, et al. Supression of apoptosis by basement membrane requires three-dimensional tissue organitation and withdrawal from the cell cycle. Proc Natl Acad Sci USA 1996; 93: 3500-3513.
Tseng SC. (Discussion) Multilayer Amniotic Membrane transplantation for reconstruction of deep corneal ulcers. Ophthalmology 1999; 106(8): 1511.
Talmi YP, Finckelstein y, Zohar Y. Use of human amniotic membrane as a biologic dressing. Eur J Plast Surg 1990; 13: 160-162.
Zohar Y, Talmi YP, Finckelstein Y, et al. Use of human amniotic membrane in otolaryngologic practice. Laryngoscope 1987; 97: 978-980.
Van der Linden PJQ, Erkers HWH, de Goeij AFPM, et al. Endometrial cell adhesion in an in vitro model using intact amniotic membranes. Fertil Steril 1996; 65:76-80.
Fuhishima H, Shimazaki J, Shinozaki N, et al. Trabeculectomy with the use of amniotic membrana for uncontrollable glaucoma. Ophthalmic Surg Lasers; 1998; 29(5): 428-431.
Bundenz DL, Barton K, Tseng SC. Amniotic membrane transplantation for repair of leaking glaucoma filtering blebs. Am J Ophthalmol 2000; 130: 580-588.
Kee C, Hwang JM. Amniotic membrana graft for late-onset glaucoma filtering leaks. Am J Ophthalmol 2002; 133: 834-835.
Bundenz DL, Barton K, Tseng SC. Repair of leaking glaucoma filtering blebs using preserved human amniotic membrane graft. Invest Ophthalmol Surg Lasers 1998; 29: 428-431.