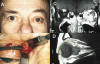
Fig. 1. B: Biopsia orbitaria vía superomedial (Linfoma). C-D: Masa mal definida que se ubica en el espacio intracónico (R.M.).
COMUNICACIÓN SOLICITADA
PÉREZ MOREIRAS J1, COLOMA BOCKOS J2, PRADA SÁNCHEZ C
2(1) Doctor en Medicina. Profesor de
Oftalmología y Cirugía. Facultad de Medicina. Universidad de Santiago de
Compostela. Director Centro Oftalmológico Moreiras. Instituto Internacional de
Órbita y Oculoplástica. Santiago de Compostela. España.
(2) Doctor en Medicina. Cirugía Reconstructiva, Órbita y Oculoplástica. Centro
Oftalmológico Moreiras. Instituto Internacional de Órbita y Oculoplástica.
Santiago de Compostela. España.
INTRODUCCIÓN
La cirugía orbitaria moderna se inicia en 1888 cuando Krönlein describe la orbitotomía lateral. Esta técnica consistía en la extracción de la pared ósea de la cavidad orbitaria para tener acceso a los tumores retrobulbares, los cuales hasta entonces solo podían ser alcanzados retirando el globo ocular, lo que suponía la pérdida irreversible de la visión. Berke y Reese (1) modificaron la incisión original para este abordaje haciéndola en línea recta desde el canto lateral en dirección al conducto auditivo, años más tarde Stallard y Wright popularizaron la orbitotomía lateral modificando la incisión haciéndola en forma de «S» para evitar el daño de las ramas del nervio facial que se dirigen a la frente (2). Desde entonces se han propuesto múltiples vías de abordaje de los tumores orbitarios, como la vía conjuntival y las incisiones cutáneas que siguen las líneas naturales de expresión facial.
Con la llegada de nuevas tecnologías como la Tomografía Computerizada (TC), la Resonancia Magnética (RM) y la Ecografía de alta resolución se ha incrementado nuestro conocimiento de la patología orbitaria y nos ha permitido el conocimiento de la estructura interna de los tumores así como su localización y su relación con otras estructuras orbitarias. Este nuevo conocimiento de la patología de la órbita nos permite obtener un diagnóstico preoperatorio más exacto y planear la cirugía de manera más adecuada. Con este conocimiento más exacto se hace viable la aplicación de pequeñas incisiones, como en la cirugía de la catarata, a la cirugía orbitaria, con el fin no solo de mantener la estética del paciente sino para evitar el daño iatrogénico de estructuras nobles en la órbita. Para la aplicación de este principio es necesario diseñar instrumentos de visualización adecuados y material quirúrgico de microcirugía. Es la razón por la cual desde hace más de 20 años hemos trabajado en el desarrollo de la microcirugía de la órbita incluyendo el uso del microscopio quirúrgico e incorporando instrumento de otras especialidades (O.R.L., Neurocirugía, Odontología, etc.) para obtener mejores resultados en la resección de tumores orbitarios.
PRINCIPIOS DE LA MICROCIRUGÍA
La nueva era quirúrgica y la situación médica actual obliga a los cirujanos a tener estándares quirúrgicos altos que resulten en una satisfactoria recuperación del paciente con una rápida rehabilitación, minimizando la posibilidad de daños iatrogénicos. Muy atrás ha quedado la época en que el cirujano de órbita tenía un puro criterio oncológico donde la función y la cosmética no eran factores importantes y la remoción del tumor justificaba cualquier resultado quirúrgico. Ante lo anterior no hay que olvidar, que si bien se ha entrado en una nueva etapa, el objetivo de la cirugía es ofrecer el mejor beneficio al paciente y si esto conlleva a una pérdida de visión o funcionalidad, debe sacrificarse en beneficio del enfermo; pero jamás debe tenerse como una consecuencia «lógica» de toda cirugía orbitaria, aún más teniendo en cuenta que la mayoría de patología orbitaria es de tipo benigna.
Con los principios quirúrgicos de incisiones pequeñas, rápida rehabilitación, preservación de la funcionalidad y evitando daños iatrogénicos se hace indispensable el tener una visualización adecuada, en especial al existir dentro del pequeño espacio orbitario múltiples estructuras vasculares y nerviosas de vital importancia. El uso de microscopio quirúrgico de campo amplio con lente de 250 mm de distancia focal (como el OPMI 111 de Zeiss o cualquier otro microscopio de ORL o Neurocirugía), es indispensable para este tipo de abordajes utilizando aumentos de 0,4x – 1,0x. Se ha sugerido el uso de endoscopios para la cirugía de órbita, pero la ausencia de binocularidad, estereopsis y la dificultad del uso de sustancias expansivas dentro de la cavidad orbitaria (por colapso del flujo vascular del nervio óptico y del globo ocular) ha limitado su utilización y difusión. El uso de tele lupas (lupas de aumento) es empleado por muchos cirujanos, sin embargo, aquellas que pueden dar magnificaciones razonables son pesadas y nunca dan magnificaciones tan altas como las que ofrece el microscopio, que son indispensables para trabajar en un espacio tan pequeño como la órbita (en especial en el ápex). El empleo de tele lupas requiere el uso de una fronto-luz de fibra óptica que tiene que ser alineada con el eje visual del cirujano lo que obstaculiza al asistente quien generalmente nunca puede visualizar lo que el cirujano está haciendo dentro de la órbita, por lo que dificulta de gran manera una correcta ayuda introperatoria. En resumen, el beneficio de la adecuada magnificación, la iluminación coaxial y la posibilidad de que no solo uno, sino dos ayudantes puedan trabajar simultáneamente con el cirujano durante la intervención (3) hacen que el microscopio sea un instrumento indispensable en nuestra práctica quirúrgica luego de haber tratado a más de 3.384 pacientes en los últimos 25 años y de haber operado al menos 74 tumores intracónicos en los últimos 5 años, en los cuales el empleo de incisiones pequeñas, de instrumental micro quirúrgico y el evitar las osteotomías ha sido la pauta quirúrgica a seguir. El cirujano tiene que viajar a través de la órbita, entre las estructuras orbitarias con mentalidad espacial para transformar los espacios virtuales en reales, para manipular y desbridar tumores como si se encontrase en grandes espacios fáciles de manipular y a su vez tiene que aprender a diagnosticar tumores por la coloración y vascularización de su cápsula o seudo cápsula.
INDICACIONES DE CIRUGÍA ORBITARIA
Las tres indicaciones oncológicas en la patología orbitaria son:
Biopsia.
Exéresis de tumor orbitario.
Exenteración.
Las indicaciones quirúrgicas no oncológicas más frecuente de la órbita son:
Descompresión Orbitaria por Orbitopatía Tiroidea (más común).
Drenaje de abscesos.
Rehabilitación en trauma orbitario.
Alrededor de un 20% de pacientes requieren de biopsia intraoperatoria para lograr un diagnóstico definitivo. Las biopsias pueden ser tomadas bien removiendo la lesión en su totalidad o bien tomando solo un fragmento de ella (para análisis histopatológico e inmunohistoquímico) evitando lesiones a estructuras orbitarias y disminuyendo su tamaño para mejorar la respuesta al tratamiento médico u oncológico. Cuando la biopsia es realizada para confirmar un diagnóstico (brote de una enfermedad conocida) la pieza puede ser llevada al patólogo una vez terminada la cirugía; si la biopsia se requiere para conocer el diagnóstico (biopsia intraoperatoria) entonces debe ser enviada al patólogo durante la intervención, para así, según el resultado decidir la conducta más adecuada a seguir según la naturaleza de la enfermedad. Es importante recalcar que la muestra patológica debe ser tratada y manipulada de manera delicada para evitar artefactos que dificulten la interpretación del patólogo, en especial cuando se sospecha de lesiones de tipo linfoides (fig. 1). Para lo anterior deben usarse instrumentos romos, evitar los cauterios térmicos o eléctricos y utilizar pinzas finas para evitar el aplastamiento en la manipulación del tejido biopsiado.

Fig. 1. B: Biopsia orbitaria vía superomedial
(Linfoma). C-D: Masa mal definida que se ubica en el espacio intracónico (R.M.).
La biopsia con aguja, previa realización de TC o RM, puede ser utilizada en tumores con escaso componente conectivo y más bien de tipo celular como linfomas, metástasis, carcinomas y algunas lesiones inflamatorias. Para la realización de esta técnica es necesario un patólogo especialista en citología en el quirófano (5).
Cuando nos encontramos masas bien definidas, encapsuladas (o pseudo encapsuladas) de lento crecimiento, sin causar defectos en la visión ni diplopía, que moldea la pared ósea, con desplazamiento axial, vertical o lateral del globo como único signo clínico, se puede sospechar una lesión benigna cuyo tratamiento definitivo será su completa remoción quirúrgica. Por el contrario, una masa pobremente definida, con bordes mal delimitados que se extiende en la órbita, causando alteraciones funcionales (visuales o motoras) y que infiltra o erosiona tejido óseo debe hacernos sospechar una lesión maligna cuyo tratamiento requerirá mas que cirugía, por lo que solo será necesario realizar una biopsia.
La exenteración, la mayoría de las veces representa el fallo de la medicina, siendo una cirugía mutilante donde el objetivo es la completa remoción de las estructuras orbitarias para así extraer una lesión maligna que no puede ser controlada o extraída individualmente y cuya extensión al sistema nervioso central (SNC) o a tejidos adyacentes o distantes tiene que ser evitada.
EQUIPO QUIRÚRGICO
Con pocas excepciones, la mayoría de los centros de formación oftalmológica centran su entrenamiento en segmento anterior, glaucoma, estrabismo y retina, no solo porque los oftalmólogos generales tienden a preferir estas sub-especialidades, sino porque los sistemas públicos de salud (donde se realizan los programas de residencias) requieren de más cirujanos de cataratas para satisfacer la creciente demanda de la población, y debido también a la gran presión de intereses comerciales de la industria oftalmológica con menor interés en el desarrollo de la cirugía orbitaria y oculoplástica al ser una sub-especialidad que no requiere de equipos sofisticados, siendo los cirujanos de órbita más artesanos que operadores. Ésta es la razón por la cual otras especialidades como cirugía maxilofacial, otorrinolaringología, neurocirugía y cirugía plástica han empezado a incluir la órbita y los párpados dentro de su campo de acción. Esto ultimo no impide que el oftalmólogo trabaje en colaboración, nunca en competición, con cirujanos de otras especialidades, debido a que la órbita está en estrecha relación con los senos paranasales y el sistema nervioso central, además los párpados juegan un rol muy importante en la apariencia de los pacientes; por ende se debe siempre formar un equipo quirúrgico en donde el coordinador y responsable principal sea el cirujano oftalmólogo de órbita ya que es quien mejor conocimiento tiene de la anatomía orbitaria, su funcionalidad y relación con el globo ocular.
La microcirugía orbitaria requiere ayudantes adecuadamente entrenados en esta cirugía, instrumentos especializados (generalmente de otras especialidades micro quirúrgicas), anestesistas experimentados, y en caso de que el tumor así lo requiera, la colaboración de otras especialidades.
PLANIFICACIÓN DEL ABORDAJE QUIRÚRGICO
El cirujano debe plantear con antelación, basado en el examen clínico previo y las imágenes diagnósticas (eco. TC, RM), un adecuado abordaje micro quirúrgico que garantice el correcto desenvolvimiento de la cirugía. Varios aspectos han de ser tenidos en cuenta para planear la cirugía.
La localización del tumor es uno de los aspectos más importantes en este sentido. Tumores localizados en el tercio anterior de la órbita, por delante del ecuador del globo ocular (generalmente tumores palpebrales que causan más desplazamiento que exoftalmos) pueden ser extraídos bajo anestesia local por la vía más directa. La localización del tumor va a definir el lugar por donde se accederá a la órbita (superior, inferior, lateral o medial). Tumores extraperiósticos no requerirán incisiones de la periórbita, lo que permite mantener virgen la cavidad orbitaria, por lo contrario, los tumores intraperiósticos e intracónicos van a requerir disección roma de los tejidos orbitarios.
El segundo aspecto más importante cuando se evalúa el plan quirúrgico es la relación topográfica entre el tumor y las estructuras adyacentes. En tumores intracónicos, la localización del nervio óptico (NO) determinará la vía de abordaje (tabla 1), el cirujano deberá acceder a la masa por el lado opuesto en el que se localiza el nervio óptico, por ejemplo, si la lesión desplaza el NO hacia abajo y hacia fuera, el cirujano deberá llegar al tumor desde el tercio superointerno; este principio quirúrgico tiene como objetivo usar el tumor como protector del nervio óptico ante un posible daño iatrogénico. Una vez que la masa haya sido localizada y analizada su cápsula y vascularización, el cirujano de manera suave, traccionará el tumor hacia la incisión de abordaje alejándolo del NO para evitar daño potencial del mismo, esto último es cierto siempre que no se traten de tumores del nervio óptico o que no estén firmemente adheridos a éste, por lo que al alejarse el tumor del nervio la grasa que se prolapsa sirve de colchón para evitar dañar el nervio. Es importante también establecer la relación de la masa con los músculos extraoculares para evitar que aparezca diplopía post operatoria por daño muscular.

Los límites del tumor deben quedar bien establecidos previamente a la cirugía, no solo para conocer la extensión de la cirugía sino también el daño potencial que ésta puede acarrear. De la misma manera, los límites de la lesión establecerán, según su definición, si la lesión puede o no ser resecada en su totalidad de manera segura. Lesiones bien delimitadas generalmente pueden ser extraídas en su totalidad y «en bloque», pero tumores de bordes poco definidos y mal delimitados suelen no ser resecados en forma completa sin dañar estructuras funcionales de la órbita, por lo que muchas veces su resección es solo parcial y por lo tanto requieren de tratamiento médico complementario. Las posibles adherencias deben tenerse en cuenta para planificar la cirugía, recordando que por norma general, las lesiones apicales suelen tener adherencias firmes dificultando su extracción y aumentando el riesgo de daños colaterales.
La estructura interna de la lesión determinada por ultrasonografía, RMN y TC, va a reflejar la naturaleza del tumor y es un reflejo de su composición histopatológica. En los casos de grandes masas mal definidas, se aconseja biopsia intraoperatoria, su estructura interna nos ayudará en el diagnóstico pero no será fundamental para planificar la cirugía. Por el contrario cuando se tiene un tumor bien definido (encapsulado, redondeado), se planeará la necesidad o no de biopsia según su composición interna (excepto en Tu. De glándula lagrimal por riesgo de diseminación). Los tumores de composición mixoide como los Schwanomas (con pseudo cápsula) o las lesiones quísticas (cápsulas verdaderas) pueden ser vaciados hasta reducir su tamaño y volumen de tal manera que puedan ser extraídos (la cápsula y el contenido remanente) a través de una incisión pequeña sin osteotomía. En estos casos, una vez ubicado y aislado el tumor, se realiza una abertura en la cápsula y utilizando una cucharilla roma se procede a vaciar el tumor, una vez vaciado se tracciona la cápsula o pseudocápsula, se libera de sus adherencias (que generalmente no son muy firmes) utilizando el aspirador o disectores romos. En este tipo de lesiones el uso de instrumentos de fragmentación ultrasónica como la aspiración por ultrasonido de Cavitron (Valley Labs, Richmond Hill, Ontario, Canada) son de gran utilidad, sin embargo, se necesitan puntas de mayor longitud ya que las que existen en el mercado sólo pueden emplearse en tumores de localización anterior. Los tumores sólidos no pueden ser extraídos de esta manera, igualmente existen lesiones como el Adenoma Pleomórfico que posee un importante potencial de recurrencia y/o malignización si la cápsula se rompe o si el tumor es biopsiado y se esparce en la órbita por lo que deben resecarse sin dañar su cápsula. Otros tumores bien definidos como Hemangiomas o Linfangiomas Cavernosos pueden ser extraídos también de la manera anteriormente descrita, una vez aislados y abierto un ojal en su pseudo cápsula puede aspirarse el contenido sanguíneo reduciendo el tamaño del tumor que entonces puede ser moldeado y extraído por una pequeña incisión. Los Hemangiomas Cavernosos reducen de manera dramática su contenido en personas jóvenes debido a que tienen menor componente celular, por el contrario en pacientes de mayor edad la reducción del volumen, una vez aspirado es significativamente menor. Es importante recalcar que la técnica descrita para extracción de tumores de composición mixta, tumores quísticos, y tumores vasculares no es una resección «a trozos», técnica que nunca debe realizarse. Con la técnica de vaciamiento la gran mayoría de tumores intraorbitarios pueden ser abordados sin necesidad de osteotomías.
Para planificar el abordaje quirúrgico en descompresiones orbitarias, es también muy importante contar con imágenes de TC (sin contraste), en cortes axiales y coronales de 5 mm para valorar la composición ósea de la órbita. Es imprescindible valorar el nivel donde termina la pared medial y se inicia el techo de la órbita para evitar accidentalmente transgredir la dura en casos de descompresión de etmoides. Igualmente se debe valorar el espesor de la pared lateral, ya que muchas veces su fresado nos dará suficiente espacio para lograr una buena descompresión, sin embargo, en ocasiones la pared lateral aporta poco espacio adicional, lo que debe ser valorado pre-operatoriamente antes de planificar la cirugía. Es importante recalcar que si bien un exhaustivo examen clínico e imagenológico debe ser realizado previa descompresión es siempre obligatorio disponer de megatoscopio en el quirófano para visualizar las imágenes de TC durante la cirugía y usarlas de guía tanto en la resección de tumores como en la descompresión orbitaria.
ABORDAJE MICROQUIRÚRGICO DE LA ÓRBITA
Las incisiones quirúrgicas siempre deben ser hechas siguiendo las líneas naturales de expresión facial. El uso del microscopio permite el uso de incisiones pequeñas que quedarán ocultas evitando así cicatrices muchas veces deformantes (fig. 2).

Fig. 2. A: Incisiones actuales en la cirugía de Órbita. 1: Incisión del pliegue
palpebral, medial (2) y externa (3). 4: Incisión subtarsal vía conjuntival
(línea punteada) con tarsectomía (4a) o empleando cantotomía-cantolisis (4b). B
y C: Incisiones del pasado en cirugía orbitaria.
Las incisiones en la conjuntiva bulbar están reservadas para tumores anteriores, siempre por delante del ecuador y generalmente para biopsias pequeñas en tumores como los linfomas. La peritomía se realiza evitando daño de células madre del limbo y se realiza la disección roma hasta alcanzar la masa y realizar su escisión. El abordaje caruncular puede ser utilizado para extraer tumores localizados en la región medial de la órbita, adyacentes a la pared etmoidal, sin embargo es más popular en descompresiones orbitarias.
La orbitotomía superior se utiliza cuando la lesión está localizada en la región superior de la órbita o en aquellos tumores que desplazan el nervio óptico hacia abajo. La incisión es realizada en el pliegue del párpado superior para tumores localizados en el techo de la órbita, en la fosa lagrimal y en las regiones superomedial y superoexterna del espacio intracónico (fig. 3).
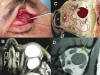
Fig. 3. A: Abordaje superoexterno para tumor intracónico. C: Esquema de
localización intracónica. B y D: R.M. axial y coronal, la flecha verde señala el
abordaje externo, el nervio óptico es desplazado inferior y medial.
En lesiones superoexternas del espacio intracónicos la incisión se realiza a lo largo de todo el pliegue palpebral superior con extensión lateral siguiendo las líneas de expresión facial. La disección se realiza siempre por debajo del orbicular, separándolo del septum hasta alcanzar el reborde orbitario superior (ROS). El periostio es cortado a 2 mm del ROS, despegado del hueso y separado del techo orbitario, en su parte interna el límite lo determina el haz del paquete vásculo-nervioso supraorbitario (en algunos casos excepcionales puede ser también disecado) ya que su manipulación puede producir hipoestesia frontal en el postoperatorio. Una vez se ha separado todo el periostio y el techo orbitario ha sido expuesto en su totalidad se realiza una incisión en la periórbita 2 mm por detrás del ROS para así acceder a la órbita o al espacio intracónico y alcanzar el tumor (8). Cuando se extraen tumores de la glándula lagrimal a través de esta vía, en la gran mayoría de los casos no se realizan osteotomías laterales (figs. 4 y 4a), aunque a veces puede ser necesario sacar pequeños trozos en «sacabocados» del reborde óseo. Cuando nos encontramos con grandes tumores que no pueden ser vaciados y se prevé realizar una osteotomía lateral, se debe exponer todo el proceso Frontozygomático y continuar la disección hacia la fosa temporal entre la fascia muscular y la capa cutánea temporal. El periostio debe ser incidido a lo largo de todo el proceso frontozygomático en su parte lateral externa para poder disecar el músculo temporal; el realizar incisiones relajantes en el músculo temporal pueden ser de gran utilidad para movilizar este músculo (9). La osteotomía es realizada con una sierra oscilante en un nivel acorde a la localización del tumor. En los últimos 5 años no hemos tenido la necesidad de realizar ninguna osteotomía lateral para extraer tumores orbitarios. El abordaje superointerno para tumores intracónicos se realiza a través de una pequeña incisión en el tercio interno del párpado superior de solo 10 ó 15 mm. Para facilita el acceso se separa un poco el orbicular del septum orbitario que luego es incidido para acceder al espacio existente entre el borde medial de la aponeurosis y la pared media desembocando en el paquete graso superointerno. Se realiza entonces una suave disección roma utilizando retractores para separar los paquetes grasos en busca del tumor, al iniciar el acceso, si la grasa anterior estorba para entrar a la órbita se puede coagular con 20 watts de potencia. El oblicuo superior debe ser desplazado hacia arriba con suavidad y protegido por un retractor para evitar su manipulación innecesaria. A través de este paquete graso se puede tener un acceso directo al espacio intracónico (fig. 5).
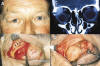
Fig. 4. Tumor de la glándula lagrimal (Adenoma Pleomórfico). C: T.C. muestra una
masa que expande la fosa lagrimal. B: El periostio es incidido a 2 mm del
reborde orbitario (flechas). D: El tumor es resecado "en bloque" sin osteotomía
lateral.
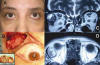
Fig. 4a. Carcinoma mucoepidermoide de la Glándula inferior del globo sin causar
diplopía. C y D: R.M. Coronal y Axial donde se observa masa heterogénea que
capta contraste difusamente y se ubica en la fosa lagrimal. B: Resección
completa del tumor sin osteotomía vía superior y lateral. Recuadro: Tumor
heterogéneo con gran cavidad quística.
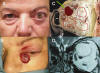
Fig. 5. A: Hemangioma Cavernoso intracónico. C: Esquema de localización
intracónica. La flecha verde señala el abordaje. D: R.M. muestra como la masa
desplaza el nervio hacia abajo. B: Escisión completa del tumor a través del
tercio medio del pliegue palpebral.
Las orbitotomías inferiores son siempre realizadas vía conjuntival, no usamos el abordaje subciliar en ningún caso ya que no ofrece ventaja alguna. La conjuntiva es incidida por debajo del borde inferior del tarso separando en un mismo bloque el complejo conjuntiva-retractores y separando éstos del tarso. Este abordaje se puede realizar con o sin relajación lateral lo cual dependerá de la laxitud del párpado inferior. Cuando se requiere de relajación lateral podemos utilizar bien la cantotomía-cantolisis (abordaje conocido en ingles como «swinging eyelid»), sin embargo en muchos casos preferimos respetar la anatomía del canto lateral y realizar una tarsectomía lateral inferior de manera oblicua para que la pequeña cicatriz cutánea sea casi imperceptible. Una vez liberados los retractores se procede a hacer la disección en el plano septum orbicular separando ambos hasta alcanzar el reborde orbitario inferior. Con el septum ampliamente expuesto se puede acceder al espacio intracónico a través de los paquetes grasos inferolaterales, dentro de los cuales no existe ningún elemento anatómico de importancia, lo que hace de este un abordaje muy seguro (fig. 6). Si la masa se encuentra inferomedial, se puede también acceder al espacio intracónico a través de los paquetes grasos de esa zona, sin embargo este espacio virtual es muy estrecho (es necesario la relajación lateral) y en él transcurre el oblicuo menor, por lo que es un abordaje complicado que debe estar reservado solo para cirujanos experimentados (fig. 7) al acceder al espacio intracónico entre el globo ocular y el músculo oblicuo menor.

Fig. 6. A: Tumor intracónico. C: Esquema de localización intracónica; la flecha
verde indica el abordaje. D: R.M. muestra el desplazamiento superior y medial
del nervio óptico. B: Abordaje conjuntival con tarsectomía. Recuadro: remoción
"en bloque" del tumor.
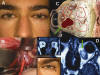
Fig. 7. A: Hemangioma Cavernoso Intracónico. Esquema de localización
intracónica; la flecha verde señala el abordaje. D y recuadro 1: R.M.
Desplazamiento del nervio óptico hacia arriba y afuera. B: Abordaje conjuntival
infero-interno con tarsectomía. Recuadro 2: Séptimo día postoperatorio.
Los tumores apicales deben ser extraídos por abordajes superiores (medio o externo) o incluso, abordajes infero externos (conjuntivales) ya que las orbitotomías laterales no ofrecen ninguna ventaja para acceder a ellos, inclusive al extraer el ala mayor del esfenoides no hay apenas espacio para la manipulación quirúrgica hacia el vértice orbitario que está repleto de estructuras muy delicadas. Durante la exéresis de los tumores apicales no es infrecuente que se produzca una dilatación sectorial iatrogénica de la pupila debido a la manipulación y tracción de las fibras nerviosas pupilares en el ápex de la órbita, incluso los pacientes pueden presentar parálisis temporales de la acomodación en el post operatorio. Los abordajes transfrontales practicados por neurocirugía pueden ser una alternativa en lo tumores del vértice, pero no pensamos que sean necesarios, por el riesgo que conllevan.
Para el abordaje microquirúrgico de los pacientes con orbitopatía tiroidea usamos como rutina la técnica personal descrita por Pérez Moreiras accediendo a la totalidad de la pared medial y a los dos tercios internos del suelo de la órbita (por dentro del canal del infraorbitario) a través de una incisión realizada en el tercio interno del pliegue palpebral superior (6,7). Por esta vía se han realizado más de 567 descompresiones orbitarias en los últimos 9 años.
Una vez realizada la incisión en el pliegue del párpado superior (de unos 10-15 mm), nunca sobrepasando una línea recta vertical trazada desde el punto lagrimal superior, se realiza una breve disección del músculo orbicular buscando el espacio virtual (pero natural) en donde se separa de la pared medial. Al hacer la incisión en el septum medial accedemos al paquete graso supero medial, el cual puede ser traccionado y removido usando 20 watts de coagulación, separando siempre las aletas ligamentosas de los músculos (para evitar restricciones post operatorias). Por dentro de este paquete graso abordamos la pared etmoidal y exponemos el periostio el cual es cortado hacia abajo, paralelo a la pared etmoidal. Es siempre imprescindible abordar la pared etmoidal por arriba del tendón cantal medial, para evitar su ruptura y a la vez mantener controlada la ubicación del saco lagrimal. Una vez expuesto la pared medial, se levanta el periostio y se expone el hueso denudado el cual es quebrado y removido con pinzas de microcirugía, una vez completada toda la extracción de la pared etmoidal se procede a continuar la descompresión hacia el suelo de la órbita que es expuesto por el asistente traccionando con suavidad el periostio, el aplicar mucha presión a la órbita durante la cirugía puede ocasionar daños irreparables a la circulación cilio-retiniana. El suelo es removido hasta alcanzar el canal del nervio infraorbitario (figs. 8 y 9).
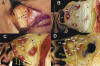
Fig. 8. Esquema de cirugía de descompresión. A: Incisión vía pliegue palpebral
en su tercio medio por dentro del elevador (flechas). B: La flecha señala el
lugar donde se va a acceder a través de la incisión. C y D: Esquemas anatómicos,
las flechas amarillas señalan la dirección del contenido orbitario al romper las
paredes medial e inferior.
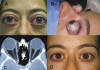
Fig. 9. A y B: Paciente con ORbitopatía Tiroidea con gran exoftalmos que causa
luxación de los globos oculares. C: Imagen axial de TC donde se ve la gran
exoftalmía. D: Post operatorio de descompresión vía pliegue palpebral superior
de pared medial y suelo interno.
Cuando se ha planeado la total descompresión del suelo orbitario la vía de acceso más sencilla es a través de la incisión conjuntival inferior subtarsal, así expondremos todo el suelo y podrá ser removido con facilidad, con este acceso podemos también acceder a la pared medial desde el suelo de la órbita. En casos más infrecuentes cuando la pared lateral va a ser también descomprimida utilizamos la vía superoexterna a través del pliegue palpebral superior para exponer la pared y la celda lagrimal para así proceder al fresado de la parte anterior donde nos detendremos al encontrar la fosa temporal y de la parte posterior (ala mayor) donde nos detendremos al encontrarnos con la dura, evitando siempre romperla.
En resumen, realizando incisiones pequeñas que sigan las líneas de expresión facial, utilizando microscopio quirúrgico y con el apropiado conocimiento topográfico y espacial de la anatomía de la órbita; teniendo un correcto diagnóstico pre operatorio y un equipo asistencial preparado, la gran mayoría de tumores orbitarios pueden ser removidos de manera segura sin la necesidad de realizar osteotomías, lo que ha sido la regla en nuestra unidad desde hace más de 15 años. El sueño de navegar por la órbita es una realidad que años atrás parecía una quimera.
BIBLIOGRAFÍA
Reese A. Tumours of the eye, 3.ª ed. Harper-Row, New York 1976; 459-464.
Wright JE. Orbital surgery. Ophthalmic plastic surgery, 3.ª ed. American Academy of Ophthalmology. 1977.
Nerad Jeffrey, Oculoplastic Surgery. The requisites in ophthalmology. Chapter 14 Surgical Approaches to the Orbit. Sant Louis. Mosby 2001; 387-418.
Alio J, Eiras J, Rabinal F, Valero M, Gómez J, Cantero J. Microcirugía de los tumores orbitarios. Arch Soc Esp Oftalmol 1982; 43-2: 226-237.
Rootman Jack, Diseases Of the Orbit: A Multidisciplinary Approach. 2nd Ed. Philadelphia: Lippincont Williams & Wilkins, 2003; 385-416.
Pérez Moreiras JV, et al. Capitulo 41, Oftalmopatia Distiroidea. En: Pérez Morerias J.V., Prada Sanchez M.C; Patología Orbitaria, Tomo 2. Barcelona: Edika-Med, 2002; 949-1033.
P. Moreiras JV, Coloma J, Prada MC, Adenis JP. Chapter 41 Thyroid Orbitopathy. In: P. Moreiras J.V, Prada M.C., Orbit: Examination, Diagnosis, Microsurgery, Pathology Vol II. Ed Highlights of Ophthalmology, 2004; 949-1036.
Moreiras JV, Coloma J, Prada MC, Salcedo G, Morax S, Blanco E, Blanco J. Chapter 42, Microsurgical approaches for tumors of the orbit. In: P. Moreiras J.V, Prada M.C., Orbit: Examination, Diagnosis, Microsurgery, Pathology. Vol II. Ed Highlights of Ophthalmology, 2004; 1039-1118.
Rootman J, Stewart B, Goldberg RA, Orbital Surgery: A conceptual Approach, Chapter 8. Philadelphia: Lippincot-Raven, 1995; 151-289.