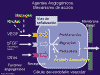
Fig. 1. Mecanismo de acción de los factores antiangiogénicos.
COMUNICACIÓN SOLICITADA
BUENO LOZANO J1, RODRÍGUEZ RAMÍREZ M2, GARCÍA LOZANO I2, ZATO MA3
Instituto de Ciencias Visuales (INCIVI).
(1) Doctor en Medicina. Médico oftalmólogo.
(2) Licenciada en Medicina. Médico oftalmólogo.
(3)
Catedrático en Oftalmología. Director del INCIVI.
La degeneración macular asociada a la edad (DMAE) es la causa de ceguera más frecuente en nuestro medio en la población de más de 50 años. Su elevada prevalencia obliga la realización de numerosos estudios orientados a la prevención y/o tratamiento de esta devastadora enfermedad. Gracias a ello, en el momento actual, estamos siendo testigos de cambios en la actitud terapéutica.
Clásicamente el tratamiento de esta enfermedad consistía en:
— Medidas preventivas: control de factores de riesgo conocidos y aporte de suplementos vitamínicos.
Los factores sobre los que podemos actuar son: eliminar el tabaco, evitar las exposiciones prolongadas a las radiaciones solares y control de la tensión arterial. La dieta debe ser rica en vegetales y aportar cantidades extras de sustancias antioxidantes, complejos vitamínicos y enzimáticos con luteína y zeaxantina (1,2). En el estudio AREDS II se recomienda la ingesta diaria de 500 mg vitamina C, 400 UI de vitamina E, 40 mg de Zinc y 2 mg de cobre. La cantidad óptima de luteína por cápsula al día es de 10 mg. Estas dosis disminuyen un 25% la posibilidad de padecer DMAE húmeda en el ojo contralateral, y reducen un 19% la pérdida de visión moderada o severa del ojo ya afectado. Las diferencias fundamentales con el estudio AREDS I son la eliminación de los betacarotenos por asociar un mayor número de casos con cáncer de pulmón en pacientes fumadores y la reducción a la mitad de la dosis de zinc.
— Medidas terapéuticas: se pretende cerrar la neovascularización coroidea (NVC) mediante fotocoagulación con láser térmico para las lesiones extrafoveolares (3) o terapia fotodinámica (TFD) para las lesiones yuxta o subfoveolares (4,5). Los resultados de este tratamiento difieren en relación al tipo de NVC y al tamaño de la lesión. En el momento actual se recomienda la aplicación de TFD en las lesiones pequeñas de todos los tipos angiográficos y en las grandes predominantemente clásicas u ocultas con progresión reciente y visión menor o igual a 20/50. Por lo tanto existe un subgrupo de membranas que no cubre la terapia con visudyne.
Estos tratamientos van enfocados hacia el estadio final de la NVC, pero no son específicos ni previenen la aparición de nuevos neovasos. Por eso las líneas de investigación de las nuevas terapias se orientan hacia factores concretos que intervienen en la patogénesis de la neovascularización.
Los estudios sobre los factores angiogénicos comenzaron a finales del siglo pasado. En 1997 se aplicó por primera vez la terapia antiangiogénica para tratar pacientes con cáncer y en 1999 para el tratamiento de la DMAE. En 2004 fue aprobado por la FDA para el cáncer colorrectal. En terapia ocular, el primer fármaco inhibidor de la neovascularización ha sido aprobado por la FDA en diciembre de 2004.
Todavía no está completamente comprendida la secuencia patogénica de la NVC, pero sí se conocen varios objetivos hacia los que dirigir los tratamientos. Existe un estímulo inicial (fototoxicidad, estrés oxidativo, disminución del flujo sanguíneo coriocapilar, acúmulo de bioproductos del metabolismo lipídico, activación del complemento, alteraciones en la membrana de Bruch...) que induciría una producción de factor de crecimiento endotelial (VEGF) de forma patológica. Los polimorfonucleares y macrófagos secretan VEGF, poseen receptores para el VEGF, producen citoquinas y proteasas y participan en la ruptura de la barrera hematorretiniana. Dentro de las enzimas, se conocen las metaloproteinasas como degradadoras de la matriz extracelular y favorecedoras de la acción de los factores angiogénicos.
Se ha demostrado la importancia del VEGF como mediador de la neovascularización coroidea y del incremento de la permeabilidad vascular (6). Además tiene propiedades proinflamatoria y neuroprotectora. Se ha comprobado su existencia tanto en el ojo normal (en células endoteliales y en el células del epitelio pigmentario de la retina) como en membranas neovasculares coroideas (extraídas quirúrgicamente o de autopsias). Otros factores estimuladores e inhibidores del crecimiento están también implicados en la neoangiogénesis aunque sus papeles no son tan claros. Al menos existen 6 isoformas humanas de VEGF: 121, 145, 165, 183, 189 y 206. El bloqueo selectivo de la isoforma 165 preferentemente inhibe la neovascularización retiniana patológica sin efectos sobre la vascularización retiniana fisiológica.
La unión de VEGF a su receptor induce una cascada de señales intracelulares que lleva a proliferación de células endoteliales vasculares, migración y aumento de la permeabilidad vascular (fig. 1).

Fig. 1. Mecanismo de acción de los factores
antiangiogénicos.
De forma genérica los tratamientos podrían actuar en varios niveles (7):
1. Degradando el RNA mensajero de VEGF por pequeños RNA que lo interfieran (RNAi).
2. Secuestrando el VEGF, mediante aptámeros anti-VEGF (pegaptanib sódico), anticuerpos monoclonales anti-VEGF (ranibizumab) o con análogos solubles del receptor de VEGF (sFlt-1).
3. Bloqueando los receptores VEGF (sobre todo VEGFR-2) por ejemplo con anticuerpos anti-VEGFR.
4. Inhibiendo la cascada intracelular de la tirosin-quinasa.
5. Actuando sobre los pasos siguientes que originan proliferación, migración y proteolisis. Al ser menos específico bloquearía también vías no mediadas por el VEGF, por lo que supuestamente debería ser más potente; son ejemplos el acetato de anecortave y la triamcinolona.
PEGAPTANIB (MACUGEN)
El Pegaptanib sódico es un aptámero con afinidad hacia la isoforma 165 del VEGF (fig. 2). Bloquea su interacción con los receptores endoteliales y frena el crecimiento endotelial. En el estudio VISION (VEGF Inhibition Study In Ocular Neovascularization) el 70% de los pacientes tratados con inyecciones intravítreas de Macugen 0,3 mg cada 6 semanas perdieron menos de 15 letras del ETDRS comparado con 55% del grupo control (a las 54 semanas). Este efecto no fue dosis dependiente. Menos pacientes con Macugen experimentaron perdida severa de visión (≥ 30 letras) con respecto al placebo (10% frente al 22%). El placebo simula la inyección intravítrea. Se aplicó el tratamiento a cualquier tipo de neovascularización coroidea. No se observaron efectos adversos sistémicos y como efectos locales 1,3% presentaron endoftalmitis (en la mayoría de los casos por Staphyilococcus epidermidis y por errores en la inyección). Posteriormente aplicando un protocolo de inyección intravítrea se ha disminuido considerablemente la incidencia de infección intraocular. La incidencia de desprendimiento de retina y catarata traumática es baja (0,08 y 0,07% por inyección respectivamente). Este estudio concluye que Macugen está indicado en el tratamiento de la neovascularización coroidea de cualquier tipo angiográfico y se considera la dosis óptima de 0,3 mg (8). Actualmente ya se encuentra disponible en España como medicamento extranjero y es el único aprobado, por el momento, por la FDA.

Fig. 2. Fórmula química del Pegaptanib sódico (MACUGEN).
RANIBIZUMAB (LUCENTIS)
El Ranibizumab o rhuFabv2 es una fracción de anticuerpo monoclonal humanizado (fig. 3) diseñado para bloquear todas las isoformas del VEGF e inhibir la permeabilidad, la proliferación de células endoteliales y los neovasos ya formados, de manera dosis dependiente. Su tamaño reducido (48 kDA) le permite atravesar de manera rápida todas las capas retinianas para llegar a la coroides. Su aplicación es intravítrea con intervalos de 4 semanas. El estudio FOCUS ha demostrado mejores resultados al asociarse con TFD; un 90% de pacientes con tratamiento combinado perdieron menos de 15 letras del ETDRS frente al 68% del grupo tratado sólo con TFD. En el estudio MARINA se inyectó 0,3-0,5mg de rhuFabv2 para lesiones mínimamente clásicas y ocultas y los resultados son a 1 año, con un 95% de pérdidas de menos de 15 letras frente al 62% del grupo control; en cuanto a la mejoría de 15 o más letras, encontraron un 25-34% en el grupo con Lucentis frente al 5% con placebo. La incidencia de endoftalmitis es de 0,6% (9). Se inhibe tanto el crecimiento de la lesión como la fuga angiográfica. En la actualidad se desarrolla el estudio ANCHOR para comparar su eficacia en lesiones de predominio clásico.
![]()
Fig. 3. Fracción del inmunocomplejo humanizado rhufabv2 (LUCENTIS).
ACETATO DE ANECORTAVE (RETAANE)
El acetato de Anecortave es un análogo sintético del cortisol (fig. 4) que potencia la actividad angioestática. Su acción se debe a la reducción de la síntesis de enzimas proteolíticas necesarias para la migración celular del endotelio vascular. Tiene un metabolismo sistémico rápido por lo que no se puede emplear por vía oral. Ha demostrado alcanzar concentraciones óptimas para la retina y la coroides aplicado de manera intravítrea y periocular. Por ello y para evitar los efectos adversos de la inyección intraocular se prefiere la aplicación supraescleral con la ayuda de un sistema de contrapresión que evita el reflujo de la sustancia (fig. 5). La aplicación se realiza cada 6 meses. Se han desarrollado numerosos estudios (C-01-99, C-98-03, C-00-07) demostrando la eficacia de la inyección supraescleral de 15 mg de acetato de Anecortave para lesiones subfoveolares de predominio clásico (80% mantienen la visión frente al 42% en el grupo control). Los resultados son mejores asociando TFD (78% frente al 67%). El tratamiento aislado tiene resultados similares a los pacientes tratados sólo con TFD. En general los efectos adversos fueron leves y transitorios. En la actualidad el estudio C-02-60 aplica acetato de Anecortave 15-30 mg en ojos con DMAE seca susceptibles de desarrollar forma húmeda para comprobar su eficacia en la prevención de la neovascularización coroidea (10).
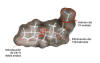
Fig. 4. Estructura del acetato de Anecortave (RETAANE).
![]()
Fig. 5. Método de inyección supraescleral del acetato de Anecortave (RETAANE).
BEVACIZUMAB (AVASTIN)
El Bevacizumab es un anticuerpo monoclonal humanizado completo contra el factor A del VEGF. Fue el primer fármaco antiVEGF utilizado por vía sistémica para el cáncer colorrectal. Por vía sistémica aumenta la tensión arterial y la incidencia de accidentes tromboembólicos (1,9-4,4%). El tratamiento aumenta la supervivencia de los enfermos con cáncer al destruir los vasos tumorales. El estudio SANA demostró resultados similares a las inyecciones intravítreas de Pegaptanib a las 24 semanas, con un coste similar pero evitando los efectos adversos de la inyección. Al haber demostrado su eficacia sistémica se están desarrollando estudios aplicándolo de forma intravítrea. Si demostrara eficacia similar a RHUfabv2 su aplicación mundial sería inmediata por la diferencia de precio (5.50$ por inyección frente a 1000-3300$ por mg de rhufabv2) (11).
TRIAMCINOLONA ACETÓNIDO (TRIGÓN)
La Triamcinolona acetónido es un fármaco corticosteroide con efecto principalmente antiinflamatorio que se está utilizando en varias patologías con edema macular (retinopatía diabética, obstrucción venosa, síndrome de Irvine-Gass,…). Se ha descrito su elevada eficacia antiangiogénica, por lo que se está utilizando intravítreo, sobre todo asociado a TFD. Se ha visto que un 57% mejora o estabiliza la AV en asociación a la TFD. Es controvertida su aplicación puesto que no está diseñado para el uso intraocular. Otras cuestiones aún por resolver son la dosis efectiva del fármaco y el momento de la inyección en relación a la TFD. Al necesitar recambiar el excipiente por BSS para evitar la aparición de endoftalmitis estéril, la concentración y la cantidad real de fármaco que se inyecta es aún dudosa. En la mayoría de los estudios se realiza la aplicación del trigón tras terapia fotodinámica en un tiempo variable (0-7 días). 12 Están en marcha diversos estudios para ver su utilidad (VERITAS, VERTALL, VERTA, VISTA, RETINA, NAPP).
OTROS
VEGF Trap: funciona como receptor soluble de alta afinidad que se une a receptores VEGF. Es capaz de suprimir el crecimiento tumoral y la vascularización in vivo, dando lugar a tumores casi completamente avasculares (13).
siRNA (ARN corto o de interferencia): es una pequeña molécula de doble cadena de ARN que se asocia al complejo proteínico de ARN (RISC) causando la degradación selectiva de un transcriptor de ARNm que contiene una secuencia homóloga a la del siRNA (14).
Inhibidores de protein-quinasa C, inhibidores de la tirosin-quinasa, terapia génica con vectores virales para el factor derivado del epitelio pigmentario (PDEF) que presenta efecto antiangiogénico, lactato de escualamina intravenosa…
En conclusión, vivimos en una década esperanzadora para los pacientes de DMAE con la aparición de potentes fármacos antiangiogénicos.
Sin embargo los estudios clínicos no son a largo plazo por lo que se desconocen los resultados definitivos, así como las posibles complicaciones. Los resultados a más largo plazo se presentan con Macugen, pero su uso no está exento de complicaciones como la endoftalmitis. Los resultados con Lucentis son también prometedores pero su frecuencia de inyección aumenta la posibilidad de complicaciones por la vía de inyección. La triamcinolona presenta la posibilidad del incremento de la presión intraocular que, en ocasiones, precisa de cirugía. No debemos olvidar los buenos resultados con terapia fotodinámica en la neovascularización de predominio clásico con muy escasos resultados adversos y resultados definitivos a largo plazo ya publicados.
La combinación de los fármacos permitirá obtener mejores resultados aunque la limitación de su aplicación internacional se debe a la vía de administración, su frecuencia de aplicación y su elevado precio.
BIBLIOGRAFÍA
The Age-related Eye Diseases Study Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss. AREDS Report No. 8. Arch Ophthalmol 2001; 119: 1417-1436.
The Age-related Eye Diseases Study Group. Associations of mortality with ocular disorder and an intervention of high-dose antioxidants and zinc in the Age-Related Eye Disease Group. AREDS Report Nº 13. Arch Ophthalmol 2004; 122: 716-726.
Macular Photocoagulation Study Group. Laser Photocoagulation of subfoveal neovascular lesions in age-related macular degeneration. Results of randomized clinical trial. Arch Ophthalmol 1991; 109: 1220-1231.
Treatment age-related macular degeneration with photodynamic therapy (TAP) study group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two-year results of 2 randomized clinical trial- TAP reports 2. Arch Ophthalmol 2001; 119: 198-207.
Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration: two-year results of a randomized clinical trial including lesions with occult with no classic choroidal neovascularization-verteporfin in photodynamic therapy report 2. Am J Ophthalmol 2001; 131: 541-560.
Witmer AN, Vrensen GFJM, Van Noorden CJF, Schingemann RO. Vascular endothelial gowth factors and angiogenesis in eye disease. Prog Retin Eye Res 2003; 22: 1-29.
Van Wijngaaden P, Coster DJ, Williams KA. Inhibitors of Ocular Neovascularization. Promises and Problems. JAMA 2005; March 23/30 293(12); 1509-1513.
Gragoudas ES, Adamis AP, Cunningham ET et al. VEGF Inhibition Study In Ocular Neovascularization Clinical Trial Group. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med 2004; 351: 2805-2816.
Puliafito CA, Rosenfeld PJ, Mc Cluskey ER. RhuFab V2 dose escalating trial: safety and tolerability of 3 esclating dosing regimens in subjects with age-related macular degeneration (AMD). Retina Society 2003: Abstract.
The Anecortave Acetate Clinical Study Group. Anecortave acetate as monotherapy for treatment of subfoveal neovascularization in age-related macular degeneration (AMD): 12 month clinical outcomes. Ophthalmology 2003; 110 (12): 90-101.
Michels S, Rosenfeld PJ, Puliafito CA et al. Systemic bevacizumab (Avastin) therapy for neovascular age-related macular degeneration twelve-weeks results of an uncontrolled open-label clinical study. Ophthalmology 2005; 112(6): 1035-1047.
Rechtman E, Danis RP, Pratt LM, Harris A. Intravitreal triamcinolone with photodynamic therapy for subfoveal choroidal neovascularization in age related macular degeneration. B J Ophthalmol 2004; 88: 344-347.
Saishin Y, Takahashi K, Lima e Silva R et al. VEGF-TRAP (R1R2) suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier. J Cell Physiol 2003; 195: 241-248.
Campbell TN, Chory FY. RNA interference: past, present and future. Curr Issues Mol Biol 2005; 7: 1-6.