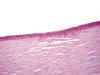
Fig. 1: Roturas de la membrana de Bowman y de la membrana basal epitelial en una córnea explantada por queratocono.
COMUNICACIÓN SOLICITADA
VILLARRUBIA CUADRADO A1, PALACÍN MIRANDA E1, SALAS MOLINA J2, BLANCO A3, HIDALGO TORRES A1
(1) Licenciado en Medicina. Instituto de
Oftalmología La Arruzafa. Córdoba.
(2) Doctor en Medicina. Servicio de Anatomía Patológica del Hospital
Universitario Reina Sofía y del Hospital San Juan de Dios. Córdoba.
(3) Catedrático de Histología. Facultad de Veterinaria. Córdoba.
RESUMEN
El término anglosajón «Ectatic Corneal Disorder» (Desorden Ectásico Corneal) hace referencia a los procesos en los que se produce un adelgazamiento progresivo con aumento de la curvatura corneal: en este grupo se incluye la ectasia corneal que puede ocurrir después de cirugía LASIK debido al debilitamiento de la arquitectura corneal. La causa es desconocida aunque en la mayoría de los casos ocurrirá una mezcla de dos factores: uno puramente mecánico por el debilitamiento corneal; otro, que el paciente presente preoperatoriamente una forma frustra de queratocono. A pesar de que existen factores de riesgo conocidos, ninguno de ellos es un predictor absoluto de que vaya a ocurrir una ectasia después de un LASIK. Ante patrones topográficos mínimamente sospechosos o historia familiar de queratocono, deberíamos indicar tratamiento en superficie. La queratoplastia lamelar anterior profunda es una excelente opción terapéutica en casos en que la ectasia no pueda ser corregida ópticamente o con anillos intracorneales.
El extraordinario auge experimentado por la cirugía refractiva corneal durante los últimos 15 años, no ha estado exento de polémica en cuanto a las complicaciones que podrían aparecer a medio plazo en los ojos operados. Una de las principales características de la cirugía substractiva corneal con láser excímer (PRK, LASEK, EpiLASIK o LASIK) es la de producir un debilitamiento de la arquitectura corneal que puede conducir al desarrollo de una ectasia corneal.
Hoy día ha tomado cuerpo el término anglosajón «Ectatic Corneal Disorder» (Desorden Ectásico Corneal: ECD) para hacer referencia a todos los procesos en los que se produce un adelgazamiento progresivo con aumento de la curvatura corneal (1): en este grupo se incluye el queratocono, la degeneración marginal pelúcida (DMP), el queratoglobo y la ectasia corneal que puede ocurrir después de cirugía LASIK. Los ECD ocupan la segunda causa de indicación de queratoplastia (15% del total) en EEUU.
Las causas que nos han empujado a realizar una revisión de este tema han sido: (a) el lógico aumento en la incidencia de esta patología ya que se han operado miles de ojos en los últimos años; (b) la curiosa aparición de un número cada vez mayor de ectasias corneales en ojos vírgenes (queratocono, DMP) debido a que se revisan muchos más pacientes que antes (al solicitar la cirugía refractiva) y, debido también, a la mejora en la tecnología diagnóstica; (c) los frecuentes trabajos que intentan demostrar una casi segura relación anatomopatológica entre ambos procesos; (d) el desarrollo de las técnicas de trasplante lamelar corneal para solucionar estos trastornos; (e) la aparición de tratamientos que pretenden modificar la estructura corneal (segmentos intracorneales, tratamiento mediante luz ultravioleta).
DEFINICIÓN DE ECTASIA CORNEAL POSTLASIK
Las bandas de colágeno del estroma corneal están organizadas de limbo a limbo entrecruzándose en ángulos de 90 grados (2). Esta especie de puentes de unión entre los extremos corneales son seccionados con la queratotomía producida durante el LASIK al cortar el estroma corneal con el microqueratomo. Si a esto unimos una volatilización del tejido estromal medio para tallar el lentículo corneal refractivo, se comprenderá que la agresión corneal que producimos es de tal magnitud que puede desencadenar una deformidad de la córnea por la propia presión intraocular (PIO). Por tanto, una ectasia corneal yatrógena puede definirse como el incurvamiento progresivo de la parte central o inferior de la córnea con adelgazamiento de la misma, que ocurre meses o años después de la cirugía LASIK y que conduce a un aumento de la refracción miópica, puede asociarse a mayor o menor grado de astigmatismo irregular y lleva a la pérdida de agudeza visual corregida (MAVCC).
El primer caso de ectasia corneal postLASIK de que se tiene constancia fue publicado por Theo Seiler en 1998 (3), pero se desconoce con exactitud el porcentaje de ojos que desarrollan una ectasia corneal tras un LASIK. La incidencia de esta patología sobre el volumen total de LASIK es difícil de determinar ya que no se dispone de datos fiables (ASCRS Member Survey. Post LASIK Ectasia. April 13, 2003. San Francisco. Ca); de hecho, existe abierto un registro europeo para la remisión de casos de ectasia corneal aunque es seguro que existen muchísimos casos sin comunicar. Según las series revisadas, puede existir una incidencia que va desde el 0,008% hasta el 0,66% (4). El momento de inicio tras el LASIK también es variable, pudiendo oscilar desde los 3 meses hasta los 5 años después de la cirugía (5). Además, es frecuente que se desarrolle en el postoperatorio inmediato de un retratamiento (6).
Con técnica PRK solamente existe un caso publicado (7), por lo que, ante un patrón asimétrico en la cara anterior corneal o desplazamientos de la cara posterior que sean congruentes con el punto de menor espesor corneal, recomendamos la realización de cualquier procedimiento de superficie (PRK, LASEK, EpiLASIK) con o sin mitomicina.
HISTOPATOLOGÍA Y PATOGENIA DEL QUERATOCONO
Antes de estudiar los posibles mecanismos patogénicos que llevan a que en un ojo operado se produzca una ectasia, conviene hacer referencia a qué es lo que ocurre en una córnea que presenta una ectasia «de novo», o sea, un queratocono.
El queratocono es una enfermedad degenerativa, no inflamatoria que suele aparecer en la pubertad; es progresiva en aproximadamente el 20% de los casos. La córnea se adelgaza progresivamente produciendo miopía, astigmatismo irregular y pérdida de MAVCC. Basados en estudios epidemiológicos, la incidencia de queratocono se estima en 1 de cada 2.000 personas (8).
La patogenia del queratocono es desconocida. Si bien se han invocado teorías diversas, no se ha encontrado aún un gen que codifique esta patología de una forma directa. Además de una historia familiar de queratocono, factores de riesgo para esta enfermedad son el frotamiento de ojos, síndrome de Down, alergia ocular y enfermedades del tejido conectivo (9). Como ya se ha comentado, la DMP y el queratoglobo son otras alteraciones no inflamatorias corneales que ocurren de forma natural y en las que igualmente se produce adelgazamiento.
Histológicamente se han documentado cambios en la estructura y organización del colágeno y de la matriz extracelular así como apoptosis y necrosis de los queratocitos, lesiones estas que afectan principalmente al estroma anterior central y a la membrana de Bowman (2). Quizás, la lesión histológica más característica sea la alteración de la membrana de Bowman (fig. 1); a ello, puede unirse una hiperplasia epitelial con pérdida de la estructura normal de las fibras de colágeno del estroma así como alteraciones en la membrana de Descemet (MD) en el caso de que esta patología se asocie a enfermedad sistémica (por ejemplo, a dermatitis atópica) (2). Además, con tinción con ferritina puede observarse en algunos casos depósitos de hierro en la capa basal del epitelio: este hallazgo es la traducción histopatológica del anillo de Fleischer que se observa a veces en la lámpara de hendidura (2).

Fig. 1: Roturas de la membrana de Bowman y de la membrana
basal epitelial en una córnea explantada por queratocono.
CARACTERÍSTICAS ANATÓMICAS DE LA CÓRNEA NORMAL QUE PODRÍAN EXPLICAR EL DESARROLLO DE UNA ECTASIA CORNEAL
La ectasia corneal puede ser explicada, teóricamente, mediante factores mecánicos (10). Las 100-120 micras anteriores de la córnea están mucho más «compactadas» que el resto del estroma y pueden ser más resistentes a la deformación mecánica que el estroma posterior (11-14). La hidratación de la córnea también cambia desde la parte anterior a la posterior (15), así como el índice de refracción (16). Además, la tasa de absorción de la radiación ultravioleta es diferente según el nivel de la córnea (17). Existen evidencias de que, debido a la estructura de su colágeno, si la córnea posterior es muy delgada, será incapaz de resistir una PIO normal (14,17-18). El colágeno de la córnea con queratocono no es tan resistente como el de una córnea normal (19). En una córnea determinada, existe probablemente un espesor mínimo que no puede resistir la deformación causada por la PIO de ese ojo: este espesor mínimo variará dependiendo de la resistencia de las fibras de colágeno de cada córnea. Es por ello que habrá córneas que desarrollen ectasia a pesar de ser respetadas unas medidas de seguridad; lo contrario también puede ocurrir: ojos en los que se haya sobrepasado los límites de seguridad universalmente aceptados, pueden permanecer inalterados en su estructura corneal.
El adelgazamiento progresivo en la ectasia comienza posiblemente en el estroma anterior. En estudios con microscopía confocal en flaps delgados (20), se ha encontrado pérdida aparente de queratocitos en el flap: esto es algo similar a la teoría que implica una apoptosis de los queratocitos en el desarrollo del queratocono (21). Una explicación a este fenómeno pudiera ser que, al separar temporalmente (mediante la queratotomía) la lamela anterior de los nervios corneales, se podrían producir alteraciones metabólicas además de los bien conocidos cambios en la película lagrimal (22-24).
SIMILITUDES PATOLÓGICAS ENTRE EL QUERATOCONO Y LA ECTASIA CORNEAL YATRÓGENA
La causa exacta de una ectasia corneal yatrógena es desconocida. Se postulan dos teorías fundamentales (6):
a) Es el resultado puramente mecánico del debilitamiento corneal tras LASIK; en este caso, cualquier ojo en el que realicemos un tratamiento que no respete los estándares de seguridad que luego veremos, está en riesgo de padecer una ectasia corneal.
b) Es un proceso crónico que tan solo afecta a individuos predispuestos, o sea, a pacientes que presentan preoperatoriamente una forma frustra de queratocono (FFK).
Lo más probable es que, en la mayoría de los casos, ocurra una mezcla de ambos factores.
Son muchos los trabajos que indican la posible existencia de una FFK como factor predisponente de la ectasia corneal. Existen trabajos que muestran la histología de una córnea explantada para queratoplastia después de ectasia corneal (3,25-28): en estas muestras se observa la rotura de la membrana de Bowman típica del queratocono; es decir, en estos casos estaríamos hablando de una FFK que ha sido tratada mediante LASIK.
Sin embargo, existen otros casos en los que esto no ocurre, es decir, después de explantar una córnea ectásica, no se observa rotura de la membrana de Bowman (26-29): esto es lo que ocurre en las 2 muestras que nosotros presentamos (fig. 2A y 2B); probablemente, en estos casos lo que ha existido ha sido un corte demasiado grueso y/o algún otro factor predisponente que hoy desconocemos. Lo que sí hemos podido observar mediante microscopía electrónica de transmisión es que la desestructuración de las fibras de colágeno en la ectasia corneal es mucho mayor que en el queratocono (fig. 3A); así mismo, hemos objetivado en la ectasia corneal una hiperplasia de los queratocitos con activación de sus organelas citoplasmáticas mucho mayor que la observada en el queratocono (fig. 3B). Todos estos cambios nos hacen sospechar que en la ectasia corneal se producen unos cambios estructurales en el estroma corneal que pueden catalogarse como «más agudos» que la «desestructuración crónica» que se va produciendo en el queratocono, si bien la activación de los queratocitos orienta a una apoptosis de las células del estroma anterior similar a la que existe en el queratocono.
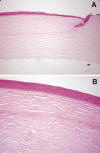
Fig. 2: Integridad absoluta de la membrana de Bowman en dos
córneas explantadas después de ectasia corneal. En una de ellas (A) se aprecia
un flap muy grueso. En la otra (B), el flap no parece excesivamente grueso por
lo que podemos suponer que otros factores desconocidos han influido en el
desarrollo de esta patología. En cualquier caso, ninguna de ellas parece ser una
FFK.
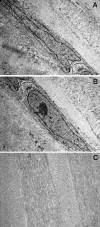
Fig. 3: Desestructuración del entrecruzamiento normal del
colágeno en una córnea ectasiada (A); hiperplasia de los queratocitos con
activación de sus organelas citoplasmáticas (A y B). En (C) se puede observar la
estructura de entrecruzamiento normal de las bandas de colágeno en una córnea
con una patología no ectásica.
FACTORES PREDISPONENTES Y PREVENCIÓN DE LA ECTASIA CORNEAL
Excepto en un caso de PRK (7), todas las ectasias corneales publicadas han sido después de un LASIK miópico.
Si existiera la posibilidad de identificar el/los genes que codifican un estado inicial del queratocono, nos ahorraríamos mucha controversia sobre cuáles son los signos iniciales topográficos de una FFK. Es evidente que debe existir una base genética debido a la alta penetrancia familiar de casos con queratocono (1). Por ello, una historia familiar de queratocono debe hacernos sospechar que la córnea del paciente puede no ser adecuada para una cirugía ablativa corneal.
Los datos topográficos, lógicamente son los más importantes a la hora de descartar un paciente para cirugía refractiva corneal. Ante cualquier anomalía de la cara anterior corneal, debemos preguntar al paciente sobre si tiene costumbre de frotarse los ojos: estos pequeños microtraumatismos crónicos pueden ser la causa de anormalidades corneales subclínicas que, incluso, pueden desaparecer con el abandono de este hábito (1). Asimismo, parece ser que la mayoría de ectasias descritas han ocurrido sobre ojos con astigmatismos oblicuos (H. Gimbel. Comunicación personal. WOC. Brasil, 2006), por lo que esta circunstancia, unida a otros datos clínicos, debe hacernos recelar a la hora de indicar una cirugía LASIK. Son bien conocidos los criterios de Rabinowitz (30) según los cuales, una diferencia dióptrica de 1,4 o más entre los hemimeridianos superior e inferior debe hacernos sospechar un queratocono; así mismo, córneas por encima de 47,2 dioptrías de curvatura corneal máxima y una diferencia dióptrica de 1 dioptría en el centro de la córnea de ambos ojos. Pero hoy día, no solo bastan los datos de la cara anterior corneal extraídos de la topografía con disco de Plácido: se debe tener en cuenta como «gold estándar» los criterios de exclusión recomendados con tecnología Orbscan que son los que se reflejan en la tabla 1. En cualquier caso, existen una serie de «modelos topográficos» en los que debería evitarse una ablación tras una queratotomía (fig. 4).

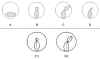
Fig. 4: Patrones topográficos anormales. (A): zona caliente
inferior. (B): pajarita asimétrica. (C): pajarita simétrica con ramas oblicuas
inclinadas más de 30º. (D): pajarita asimétrica con ramas oblicuas inclinadas
más de 30°. (1 y 2): para valorar la inclinación de las ramas de una pajarita,
se traza una línea imaginaria vertical que divida en 2 mitades los lóbulos
superior e inferior de la pajarita: si la línea que divide ambos lóbulos aparece
separada 30º o más del meridiano vertical central, consideraremos este ojo como
de alta sospecha.
En sus trabajos originales, Barraquer (31) recomienda (de una forma empírica) para evitar la ectasia corneal, no operar ojos con espesores corneales de menos de 475 micras así como dejar intacto un lecho corneal mayor de 300 micras. Como se ha demostrado posteriormente, esta regla no debe ser dogmática aunque sí se debe tomar como un principio de mínimos. Aún sin estudios concluyentes que lo demuestren, existe un acuerdo generalizado en no dejar menos de 300 micras como lecho estromal residual, no ablacionar más del 20% del espesor total de la córnea y no obtener una lamela corneal mayor del 25% del espesor total corneal (25,32-36). Insistimos en que estos datos son empíricos y no hay nada demostrado claramente ya que existen casos de ectasia corneal descritos en pacientes en los que todos estos límites de seguridad han sido respetados: probablemente se trate de pacientes con FFK en los que una mínima alteración de la biomecánica corneal ha desencadenado una pérdida de la función estructural de las fibras de colágeno del estroma corneal. Asimismo, son algunos los casos publicados de lechos estromales residuales menores de 250 micras, espesores preoperatorios menores de 500 micras y queratometrías preoperatorias por encima de 48 dioptrías, en los que no se ha desarrollado ectasia corneal (35,37). Es prácticamente seguro que el lecho estromal residual «mínimo» sea una variable específica para cada ojo. En cualquier caso, para validar cualquiera de los datos publicados, se debería realizar paquimetría intraoperatoria para conocer el espesor real del flap ya que la variabilidad en el grosor de corte de los microqueratomos está bien establecida. Existe publicado un caso de ectasia corneal en el que ésta se desarrolló inmediatamente después de la creación de un flap muy grueso sin haber realizado ablación con el láser (38).
Como dato curioso, parece ser que la ectasia corneal es más frecuente en mujeres que en hombres (5), aunque este dato no puede confirmarse fehacientemente debido a que es seguro que muchas de las ectasias corneales que se producen están sin comunicar.
Lógicamente, cuanta más miopía preoperatoria, mayor será la posibilidad de ectasia corneal (6) a igualdad del resto de condiciones. Debemos asimismo evitar retratamientos innecesarios (pensando que lo que está ocurriendo es una regresión miópica por hiperplasia epitelial) ya que podríamos estar actuando sobre un tejido que está comenzando a ectasiarse.
Existen asimismo modelos físicos en los que se demuestra que, cuanto menor sea el diámetro de la ablación, mayor será la posibilidad de ectasia (a igualdad del resto de condiciones) (26).
Hoy día se presta especial atención a las propiedades biomecánicas de la córnea: se han desarrollado dispositivos como el analizador de respuesta ocular que aún no están validados científicamente pero que podrían dar información al clínico sobre la integridad de la biomecánica corneal.
Como resumen de factores predisponentes probados para el desarrollo de ectasia corneal incluiremos: FFK, lecho estromal residual pequeño, poco espesor corneal preoperatorio, alta miopía y edad menor de la media de la población que se interviene con LASIK. En la tabla 2 se reflejan los factores de riesgo para desarrollo de ectasia corneal si bien ninguno de ellos predice de forma segura el desarrollo de una ectasia corneal. Asimismo, como ya hemos comentado, puede desarrollarse ectasia corneal sin ninguno de estos factores de riesgo.

DIAGNÓSTICO DE LA ECTASIA CORNEAL
Es difícil olvidar la imagen topográfica de una ectasia corneal (fig. 5). Sin embargo, no es el primer signo de alerta ante el que nos encontramos. Siempre que veamos una regresión miópica en un ojo operado con LASIK, debemos sospechar una ectasia corneal antes de realizar cualquier retratamiento. Por ello, es fundamental realizar una topografía en la primera semana postoperatoria: si al comparar la topografía en el momento de producirse la supuesta regresión miópica, esta muestra un aumento de curvatura respecto a la realizada postoperatoriamente, debemos sospechar un proceso inicialmente ectásico. Si, por el contrario, se mantiene la curvatura corneal y la refracción ha aumentado, podremos sospechar una hiperplasia epitelial o un aumento del eje axial como causa de la miopización del ojo y por tanto podremos plantear el retratamiento con algo más de confianza.
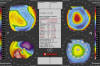
Fig. 5: Imagen típica con tecnología Orbscan de una ectasia
inferior. Zona «caliente» temporal inferior en el mapa axial con gran elevación
de la cara posterior. Curiosamente, no parece estar muy adelgazada en el centro
aunque sí existen grandes diferencias entre la zona más elevada y más deprimida
en el mapa anterior al compararlo con su mejor esfera de referencia.
Además de una miopización con aumento de la curvatura corneal, debemos sospechar una ectasia corneal si la visión comienza a fluctuar. Incluso, está descrito una regresión de la ectasia corneal después del uso de hipotensores tópicos (39); por tanto, nos parece una buena medida realizar un tratamiento limitado en el tiempo con betabloqueantes ante una regresión miópica con aumento de la curvatura anterior de la córnea: si la miopización se corrige (total o parcialmente) con hipotensores tópicos, deberemos sospechar una ectasia corneal y no retratar al paciente. Si además de la miopización nos encontramos en el postoperatorio con un astigmatismo más o menos irregular, la sospecha de proceso ectásico debe ser máxima.
La ectasia corneal puede ser central o inferior (40). En la ectasia central, el astigmatismo irregular puede ser bajo y suelen alcanzarse buenas agudezas visuales con corrección. Existe otro tipo de ectasia, más parecida al queratocono, en la que ocurre un adelgazamiento paracentral inferior con gran componente de astigmatismo irregular y aberración comática; en estos casos, la MAVCC suele ser pobre y son los casos más dramáticos. El diagnóstico diferencial entre ambos tipos de ectasia se realiza mediante la correspondiente exploración topográfica.
TRATAMIENTO DE LA ECTASIA CORNEAL
Desde los tratamientos menos agresivos, como puede ser el intentar adaptar una lente de contacto semirrígida gas-permeable, hasta procedimientos que pueden considerarse definitivos (como la queratoplastia penetrante), encontramos un amplísimo abanico de opciones terapéuticas (41).
La primera medida que debemos tomar una vez diagnosticada la ectasia corneal es realizar una prueba con hipotensores oculares ya que existen casos descritos de regresión completa con este tratamiento (39). Si no conseguimos un resultado óptimo con esta medida, debemos intentar corregirla ópticamente, bien sea con una gafa o bien con lente de contacto semirrígida gas permeable. Lógicamente, la calidad de visión será mejor con este último procedimiento. Si la visión corregida con cualquiera de estos procedimientos no es adecuada, deberemos pasar al tratamiento quirúrgico.
Mediante el uso de anillos intracorneales (INTACS, Ferrara), se han publicado series para corrección de regresión miópica con buenos resultados (42,43), si bien, casos de ectasia corneal diagnosticados claramente solo han sido publicados 14 ojos (42,44-46). Mediante el implante de anillos intraestromales se añade tejido a la periferia de la córnea, aplanándola en el centro: esto reduce la miopía y el astigmatismo y permite una corrección óptica que antes del procedimiento pudiera no ser posible. Parece ser que los nomogramas refractivos para la corrección óptica con estos dispositivos no son correctos después de una ectasia corneal ya que, al tratarse de un tejido muy debilitado, el mismo anillo que en un ojo virgen puede corregir un número determinado de dioptrías, muy probablemente corrija muchas más en un ojo que padece una ectasia corneal. Bajo nuestro punto de vista, una ectasia corneal central será corregida con anillos intracorneales probablemente con un resultado mucho más aceptable que si la ectasia es inferior. En nuestra experiencia, las ectasias inferiores de ojos vírgenes (queratoconos) que no sobrepasan el meridiano horizontal, tienen mejor resultado con el implante de un solo segmento inferior (fig. 6), mientras que si la ectasia es central, el implante de dos segmentos (fig. 7) corregirá el problema de una forma más racional.
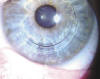
Fig. 6: Implante de un solo segmento inferior en un
queratocono cuya curvatura no sobrepasa la línea media.
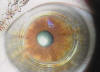
Fig. 7: Implante de dos segmentos en un queratocono central.
Si decidimos que los anillos no serán exitosos o bien fracasan después de su uso, deberemos realizar una queratoplastia, bien sea penetrante o bien sea lamelar anterior profunda. Los resultados con queratoplastia penetrante (QPP) que hemos encontrado en la literatura han sido múltiples (3,25-29). Sin embargo, no conocemos resultados publicados tras queratoplastia lamelar anterior profunda (DALK) después de una ectasia corneal aunque sí tras queratocono (47). Las ventajas de una DALK sobre una QPP en cualquier patología en la que el endotelio esté sano han sido ampliamente descritas en la literatura (48): básicamente, recuperación funcional más temprana debido a poder retirar las suturas precozmente, ausencia de rechazo endotelial, y, en principio, la supervivencia del injerto debe ser mayor en el tiempo. El mayor inconveniente que esgrimen los detractores de esta técnica es la posibilidad de no alcanzar una agudeza visual corregida tan alta como con la QPP, así como una pérdida de calidad de visión debido al «scattering» (difusión de la luz) producido por las irregularidades entre las superficies de contacto. Nosotros estamos de acuerdo con este segundo aserto. Sin embargo, pensamos que el enorme beneficio de una recuperación visual temprana así como el manejo postoperatorio mucho más sencillo, son suficientes argumentos para preferir DALK sobre QPP. Si a esto añadimos que las agudezas visuales corregidas son iguales a las de la QPP (47) si la disección está hecha correctamente (esto es, en plano predescemético) como demuestran los tres casos que aquí publicamos, pensamos que la elección de DALK sobre QPP debería quedar establecida en poco tiempo en cualquier patología con endotelio sano (si bien las series más largas de QPP publicadas hasta ahora nos obligan a reconocer que el «gold estándar» sigue siendo la QPP).
Nosotros realizamos para la DALK la técnica descrita por Gerrit Melles (49). La originalidad de esta técnica consiste en la descripción de una serie de maniobras para visualizar la profundidad de la disección lamelar durante la cirugía (50) basándose en un abordaje posterior para alcanzar de esta forma el plano predescemético; para ello, emplea una serie de signos que se producen después de llenar la cámara anterior (CA) con aire (fig. 8A): «mirror effect» o «signo del espejo», «indentation effect» o «signo de la indentación» y «folding effect» o «signo de los pliegues»; estos signos se pueden usar como indicadores de la cercanía de la punta del cuchillete a la superficie corneal posterior, o sea, a la MD. A partir de aquí, y usando espátulas diseñadas para esta técnica por el propio Melles (2110, DORC Internacional b.v., Zuidland, Holanda), disecamos el espacio predescemético para posteriormente ampliarlo con viscoelástico (fig. 8B). Una vez conseguida esta pseudocámara anterior, trepanamos hasta que aparece viscoelástico para terminar de cortar el botón receptor con tijeras y suturar en su lugar un botón donante sin MD. Todas estas maniobras están muy detalladamente desarrolladas en la Comunicación Solicitada de la SEO de 2005 (51).
![]()
Fig. 8: A): Aire en cámara anterior para poder conseguir una
mejor visualización del plano predescemético y crear el espacio virtual que
también se observa en la figura. B): Viscoelástico en el espacio virtual
existente entre la membrana de Descemet y el estroma profundo; con esta maniobra
conseguimos crear una pseudocámara anterior para poder trepanar hasta la
membrana de Descemet sin perforarla.
Reseñar aquí que en los últimos meses está tomando cuerpo la idea de tratar el queratocono (ectasia corneal en ojo virgen) mediante «cross-linking» del colágeno corneal (52). Es una técnica simple y poco invasiva que consiste en la fotopolimerización de las fibras estromales mediante la acción combinada de rayos ultravioleta de tipo A (UVA) emitidos por una fuente sólida de rayos UVA sobre una sustancia fotosensible (riboflavina o vitamina B2): este tratamiento produciría un aumento de la resistencia en las fibras de colágeno. Parece ser que este proceso, que ocurre de forma natural con la edad en córneas normales, puede, al menos temporalmente, bloquear la progresión del queratocono.
CASOS CLÍNICOS
De los más de 3.000 ojos operados durante 7 años por nuestro grupo con técnica LASIK (en los que se incluyen LASIK hipermetrópicos), no tenemos constancia de que se haya producido ninguna ectasia corneal. Sin embargo, sí nos han remitido casos de varios centros y hemos tenido la oportunidad de tratar 3 casos con la técnica DALK. El resumen de estos casos se encuentra en las tablas 3 y 4. En las figuras 9 y 10 encontramos un resumen iconográfico de los casos A y C.
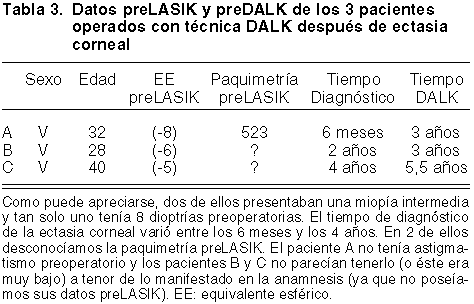

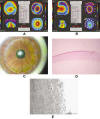
Fig. 9: Paciente A. A): Orbscan preDALK. B): Orbscan postDALK.
C): transparencia corneal a los 12 meses de la DALK. D): histología de la córnea
explantada en la que se aprecia un flap grueso y ausencia de membrana de
Descemet y de endotelio. E): detalle con microscopía electrónica de transmisión
de las fibras estromales profundas deflecadas sin la existencia de membrana de
Descemet ni endotelio.
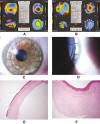
Fig. 10: Paciente C. A): Orbscan preDALK. B): Orbscan
postDALK. C): transparencia corneal a los 3 meses de la DALK. D): detalle de la
sutura en la que se observa el borde del flap de la cirugía LASIK. E y F):
histología de la córnea explantada en la que se aprecia un flap normal,
integridad de la membrana de Bowman y ausencia de membrana de Descemet y de
endotelio; asimismo, se puede observar en detalle la bisagra de la cirugía
LASIK.
CONCLUSIONES
Como se ha podido comprobar, esta inquietante patología se encuentra desgraciadamente «de moda» entre los cirujanos refractivos. Todos hemos tenido la posibilidad de ver en nuestras consultas casos dramáticos, normalmente procedentes de «otros centros». Hoy día somos más restrictivos a la hora de indicar LASIK debido al aumento de esta complicación. Es por ello que, ante patrones topográficos mínimamente sospechosos o historia familiar de queratocono, deberíamos indicar tratamiento en superficie. En cualquier caso, también hay que tener en cuenta que, a pesar de los factores de riesgo mencionados, ninguno de ellos es un predictor absoluto de que vaya a ocurrir una ectasia después de un LASIK; por ello, y debido a que un queratocono puede desarrollarse en ausencia de cirugía refractiva, la existencia de una ectasia postLASIK no necesariamente significa que esta cirugía sea la causante de la patología.
Debemos ser cautos ante patrones topográficos sospechosos tales como incurvamiento corneal inferior asimétrico o pajaritas asimétricas con ramas oblicuas que presenten una angulación de 30º o más (fig. 4): en estos pacientes se puede realizar una PRK siempre que en el consentimiento informado se refleje que existe un riesgo aumentado de progresión a queratocono.
Pensamos que si ópticamente (gafa o lente de contacto) no puede ser corregido el defecto visual y el implante de anillos intracorneales no mejora la visión del paciente o, simplemente, no creemos que vaya a mejorarla por tener un alto componente de astigmatismo irregular, el tratamiento mediante DALK debería ser de elección en estos casos.
BIBLIOGRAFÍA
Binder PS, Lindstrom RL, Stulting D, ey al. Keratoconus and Corneal Ectasia After LASIK. J Refract Surg. 2005; 21: 749-752.
Barraquer RI, De Toledo MC, Torres E. Distrofias y Degeneraciones Corneales. Ed. ESPAXS Publicaciones Médicas. Barcelona, 2004.
Seiler T, Quurke AW. Iatrogenic keratectasia after LASIK in a case of forme fruste keratoconus. J Cataract Refract Surg. 1998; 24: 1007-1009.
Pallikaris IG, Kymionis GD, Astyrakakis NI. Corneal ectasia induced by laser in situ keratomileusis. J Cataract Refract Surg. 2001; 27: 1796-1802.
Randleman JB, Russell B, Ward MA, et al. Risk factors and prognosis for corneal ectasia after LASIK. Ophthalmology. 2003; 110: 267-275.
Binder PS. Ectasia after laser in situ keratomileusis. J Cataract Refract Surg. 2003; 29: 2419-2429.
Holland SP, Srivannaboon S, Reinstein DZ. Avoiding serious corneal complications of laser assisted in situ keratomileusis and photorefractive keratectomy. Ophthalmology. 2000; 107: 640-652.
Kennedy RH, Bourne WM, Dyer JA. A 48-year clinical and epidemiologic study of keratoconus. Am J Ophthalmol. 1986; 101: 267-273.
Rabinowitz YS. Keratoconus. Surv Ophthalmol. 1988; 42: 297-319.
Comaish IF, Lawless MA. Progressive post-LASIK keratectasia; biomechanical instability or chronic disease process?. J Cataract Refract Surg. 2002; 28: 2206-2213.
Bron AJ. The architecture of the corneal stroma. Br J Ophthalmol. 2001; 85: 379-381[editorial].
Berlau J, Becker H-H, Stave J, et al. Depth and age-dependent distribution of keratocytes in healthy human corneas; a study using scanning-slit confocal microscopy in vivo. J Cataract Refract Surg. 2002; 28: 611-616.
Müller LJ, Pels E, Vrensen GFJM. The specific architecture of the anterior stroma accounts for maintenance of corneal curvature. Br J Ophthalmol. 2001; 85: 437-443.
Radner W, Mallinger R. Interlacing of collagen lamellae in the midstroma of the human cornea. Cornea. 2002; 21: 598-601.
Turss R, Friend J, Reim M, Dohlman CH. Glucose concentration and hydration of the corneal stroma. Ophthalmic Res. 1971; 2: 253-260.
Fatt I, Harris MG. Refractive index of the cornea as a function of thickness. Am J Optom Physiol Opt. 1973; 50: 383-386.
Kolozsvári L, Nógrádi A, Hopp B, Bor Z. UV absorbance of the human cornea in the 240- to 400-nm range. Invest Ophthalmol Vis Sci. 2002; 43: 2165-2168.
Roberts C. The cornea is not a piece of plastic. J Refract Surg. 2000; 16: 407-413[editorial].
Andreassen TT, Simonsen AH, Oxlund H. Biomechanical properties of keratoconus and normal corneas. Exp Eye Res. 1980; 31: 435-441.
Vesaluoma M, Pérez-Santonja J, Petroll WM, et al. Corneal stromal changes induced by myopic LASIK. Invest Ophthalmol Vis Sci. 2000; 41: 369-376.
Kenney MC, Brown DJ, Rajeev B. The elusive causes of keratoconus: a working hypothesis. CLAO J. 2000; 26: 10-13.
Slowik C, Somodi S, Richter A, Guthoff R. Assessment of corneal alterations following laser in situ keratomileusis by confocal slit scanning microscopy. Ger J Ophthalmol. 1997; 5: 526-531.
Latvala T, Barraquer-Coll C, Tervo K, Tervo T. Corneal wound healing and nerve morphology after excimer laser in situ keratomileusis in human eyes. J Refract Surg. 1996; 12: 677-683.
Lee JB, Ryu CH, Kim J-H, et al. Comparison of tear secretion and tear film instability after photorefractive keratectomy and laser in situ keratomileusis. J Cataract Refact Surg. 2000; 26: 1326-1331.
Amoils SP, Deist MB, Gous P, Amoils PM. Iatrogenic keratectasia after laser in situ keratomileusis for less than –4.0 to –7.0 diopters of myopia. J Cataract Refract Surg. 2000; 26: 967-977.
Argento C, Cosentino MJ, Tytium A, et al. Corneal ectasia after laser in situ keratomileusis. J Cataract Refract Surg. 2001; 27: 1440-1448.
Rao SN, Epstein RJ. Early onset ectasia following laser in situ keratomileusis: case report and literature review. J Refract Surg. 2002; 18: 177-184.
Spadea L, Palmieri G, Mosca L, et al. Iatrogenic keratectasia following laser in situ keratomileusis. J Refract Surg. 2002; 18: 475-480.
Rumelt S, Cohen I, Skandarani P, et al. Ultrastructure of the lamellar corneal wound after laser in situ keratomileusis in human eye. J Cataract Refract Surg. 2001; 27: 1323-1327.
Rabinowitz YS. Videokeratographic indices to aid in screening for keratoconus. J Refract Surg. 1995; 11: 371-380.
Barraquer JI. Queratomileusis y Queratofaquia. Bogota, Colombia, Instituto Barraquer de América, 1980; 340-342, 405-406.
Kohnen T. Iatrogenic keratectasia: current knowledge, current measurements. J Cataract Refract Surg. 2002; 28: 2065-2066[editorial].
Probst LE, Machat JJ. Mathematics of laser in situ keratomileusis for high myopia. J Cataract Refract Surg. 1998; 24: 190-195.
Gris O, Güell JL, Muller A. Keratomileusis update. J Cataract Refract Surg. 1996; 22: 620-623.
Esquenazi S. Comparison of laser in situ keratomileusis and automated lamellar keratoplasty for the treatment of myopia. J Refract Surg. 1997; 13: 637-643.
Maloney RK. Discussion of paper by Wang Z, Chen J, Yang G. Posterior corneal surface topographic changes after laser in situ keratomileusis are related to residual corneal bed thickness. Ophthalmology. 1999; 106: 409-410.
Iskander NG, Anderson Penno E, Peters NT, et al. Accuracy of Orbscan pachymetry measurements and DHG ultrasound pachymetry in primary laser in situ keratomileusis and LASIK enhancement procedures. J Cataract Refract Surg. 2001; 27: 681-685.
Haw WW, Manche EE. Iatrogenic keratectasia after a deep primary keratotomy during laser in situ keratomileusis. Am J Ophthalmol. 2001; 132: 920-921.
Hiatt JA, Boxer Wachler BS, Grant C. Reversal of laser in situ keratomileusis-induced ectasia with intraocular pressure reduction. J Cataract Refract Surg. 2005; 31: 1652-1655.
Marinho A, Pinto MC, Vaz F. Corneal ectasia after LASIK—how to manage. Semin Ophthalmol. 2000; 15: 148-1500.
Colin J, Velou S. Current surgical options for keratoconus. J Cataract Refract Surg. 2003; 29: 379-386.
Güell JL, Velasco F, Sánchez SI, et al. Intracorneal Ring Segments After Laser in situ Keratomileusis. J Refract Surg. 2004; 20: 349-355.
Barbara A, Shehadeh-Masha’our, Garzozi H. Intacs after laser in situ keratomileusis and photorefractive keratectomy. J Cataract Refract Surg. 2004; 30: 1892-1895.
Pokroy R, Levinger S, Hirsh A. Single Intacs segment for post-laser in situ keratomileusis keratectasia. J Cataract Refract Surg. 2004; 30: 1685-1695.
Siganos ChS, Kymionis GD, Astyrakakis N, Pallikaris IG. Management of Corneal Ectasia After Laser in situ Keratomileusis With INTACS. J Refract Surg. 2002; 18: 43-46.
Alió JL, Salem TF, Artola A, et al. Intracorneal rings to correct corneal ectasia after laser in situ keratomileusis. J Cataract Refract Surg. 2002; 28: 1568-1574.
Watson SL, Ramsay A, Dart JKG, Bunce C, Craig E. Comparision of Deep Lamellar Keratoplasty and Penetrating Keratoplasty in Patients with Keratoconus. Ophthalmology 2004; 111: 1676-1682.
Benson WH, Goosey CB, Prager TC, Goosey JP. Visual improvement as a function of time after lamellar keratoplasty for keratoconus. Am J Ophthalmol 1993; 116: 207-211.
Melles GRJ, Lander F, Rietveld FJR, et al. A new surgical technique for deep stromal, anterior lamellar keratoplasty. Br J Ophthalmol 1999; 83: 327-333.
Melles G, Rietveld F, Beekhuis WH, Binder PS. A Technique to Visualize Corneal Incision and Lamellar Dissection Depth During Surgery. Cornea 1999; 18: 80-86.
Villarrubia A, Mendicute J, Pérez-Santonja JJ, et al. Queratoplastia Lamelar: Técnicas Quirúrgicas. Comunicación Solicitada 81 Congreso de la Sociedad Española de Oftalmología. Ed. Mac Line, S.L. Madrid, 2005.
Caporossi A, Baiocchi S, Mazzotta C, et al. Parasurgical therapy for keratoconus by riboflavin-ultraviolet type A rays induced cross-linking of corneal collagen. J Cataract Refract Surg. 2006; 32: 837-845.