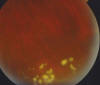
Fig. 1: Biomicroscopía con lente de Goldmann en la que pueden observarse los exudados blanquecinos con apariencia en «banco de nieve» («snowbank»), cubriendo la ora serrata y pars plana inferior.
COMUNICACIÓN SOLICITADA
CANO PARRA J1, DÍAZ LLOPIS M2, SALOM D
31
Doctor en Medicina. Director médico de Clínica ICOA. Instituto de Cirugía Ocular Avanzada en Barcelona.RESUMEN
Las Uveítis Intermedias (UI) constituyen un proceso caracterizado por la inflamación primaria del vítreo, retina periférica y pars plana, siendo la forma común de uveítis en niños y adultos jóvenes. Las UI se denominan «pars planitis» únicamente cuando, sobre la pars plana y ora serrata existen exudados y bandas de colágeno («snowbank») y representa un subtipo de uveítis intermedia con más vitritis y mayor edema macular y peor pronóstico que los pacientes con uveítis intermedia sin este exudado sobre pars plana. Presentamos la epidemiología, manifestaciones clínicas, pronóstico, formas clínicas, posibles complicaciones, el diagnóstico diferencial de las posibles etiologías, los tests diagnósticos útiles, y las opciones de tratamiento en las uveítis intermedias.
INTRODUCCIÓN
Las uveítis intermedias (UI) constituyen un proceso caracterizado por la inflamación primaria del vítreo, retina periférica y pars plana, siendo la forma común de uveítis en niños y adultos jóvenes, además de ser una de las formas de uveítis de mayor duración clínica. Su nombre está basado por la localización anatómica ocular de la inflamación no porque sea una condición clinicopatológica única. Su patogenia incierta ha hecho que a lo largo de la historia haya recibido diferentes denominaciones: pars planitis, vitritis o ciclitis. La primera descripción (1) se atribuye a Fuchs en 1908 con el nombre de «ciclitis crónica»; Schepens en 1950 denominó «uveítis periférica» a la inflamación en la retina periférica con cambios exudativos; Welch en 1960 «pars planitis»; Gass en 1968 «vitritis»; y por último, ya en 1987, el «lnternational Uveitis Study Group» (IUSG) (2) asignó a esta entidad su nombre actual, el de uveítis intermedia, basándose en la principal localización anatómica de asiento de la inflamación intraocular. Esta uveítis intermedia en ocasiones va asociada a sarcoidosis o esclerosis múltiple como entidad causal aunque en otras ocasiones no se logra identificar la etiología (3-6). Sin embargo, el uso de términos como uveítis intermedia y pars planitis continúa confundiéndose, por lo que muchos autores prefieren utilizar pars planitis únicamente cuando, sobre la pars plana y ora serrata existen exudados y bandas de colágeno («snowbank») y representa un subtipo de uveítis intermedia con más vitritis y mayor edema macular y peor pronóstico que los pacientes con uveítis intermedia sin este exudado sobre pars plana.
EPIDEMIOLOGÍA
La incidencia de la UI es de aproximadamente del 10% del total de uveítis (7-15% según autores), pero en los niños la incidencia es superior al 20% de los casos. Comienza de forma típica entre la 2.ª y 4.ª década, siendo muy rara por encima de los 40 años (10%). La gravedad de la inflamación así como la de sus complicaciones es inversamente proporcional a la edad de comienzo, por lo que las formas de inicio en la primera década de vida tendrán peor pronóstico (7-10). En seguimientos a largo plazo se observa bilateralidad en un 80% de casos, pero generalmente de forma asimétrica en la evolución (meses o años de diferencia).
No existe predilección geográfica, por el sexo o raza. Ocasionalmente se han descrito una docena de casos de afectación familiar, como aquel de un varón con una UI típica (vitritis y periflebitis), con leucopenia, bradicardia y áreas focales de desmielinización a nivel cerebral de causa desconocida, encontrándose periflebitis asintomática en tres de sus hermanos (8).
La UI puede encajar en una constelación de procesos clínicos relacionados con el antígeno de histocompatibilidad HLA-DR15 que incluyen la esclerosis múltiple, la neuritis óptica y la narcolepsia. Tanto la pars planitis como la esclerosis múltiple se han asociado con un aumento de la frecuencia del HLA-DR2, particularmente el subalelo DR15 y también el DR51 y DR17, por lo que podría hablarse de una predisposición inmunogenética a padecer ambas enfermedades entre los pacientes que presentasen dichos antígenos, sobre todo en mayores de 25 años (11-16). A excepción de esta última, no existirían diferencias entre la clínica de los pacientes afectos de UI con o sin esclerosis múltiple.
CARACTERÍSTICAS CLÍNICAS
Los pacientes pueden ser asintomáticos, pero lo más frecuente es que presenten visión borrosa y/o de cuerpos flotantes vítreos o «floaters». El comienzo suele ser insidioso, lo cual contrasta con las vitritis agudas observadas en las infecciones, y no suele existir dolor, ojo rojo o fotofobia.
Con respecto a los signos, característicamente el ojo está «blanco y tranquilo» y raras veces se asocia una iridociclitis con escasos precipitados queráticos redondos y pequeños, que pueden estar presentes como consecuencia del reflujo a cámara anterior o «spill-over», excepto en niños, pacientes con esclerosis múltiple, enfermedad de Lyme o sarcoidosis, en los que la inflamación del segmento anterior es más intensa incluso con precipitados queráticos y sinequias. La queratopatía en banda puede ser vista en niños.
El glaucoma en un estudio (17) de 182 ojos con uveítis intermedia se presentó en 15 (8%) aunque 11 de los 15 casos era un glaucoma inducido por corticoides y en sólo 4 casos estaba relacionado con la enfermedad. La catarata es un hallazgo más frecuente, sobretodo la subcapsular posterior y es resultado tanto de la inflamación ocular cono del uso de corticoides.
Los hallazgos más constantes son la vitritis, caracterizada por opacidades pulverulentas en el vítreo (células inflamatorias), que ocasionalmente pueden ser tan densas que llegan a oscurecer toda la retina, y que se observan con la lámpara de hendidura a través de la pupila sin necesidad de dilatación, y las «bolas de nieve» («snowballs»), que se distinguen en la parte inferior del vítreo periférico, junto a la retina pero sin contactar con la misma. Conviene reseñar que estos «snowballs» no son exclusivos de la pars planitis, ya que pueden aparecer en cualquier tipo de inflamación de la periferia del fondo o en uveítis extensas y difusas. Mediante la lente de +20 D e indentación escleral, o con la lente de tres espejos de Goldmann, pueden observarse mejor los exudados blanquecinos en forma de «bolas de nieve», que al hacerse confluentes forman una apariencia típica en «banco de nieve»(«snowbank») o bandas de colágeno cubriendo la ora serrata y/o pars plana (figs. 1 y 2), preferentemente en su zona inferior, aunque también se han encontrado en múltiples localizaciones o revistiendo los 360º de la pars plana. En la zona del banco de nieve se debe examinar cuidadosamente en busca de neovascularización que puede causar hemorragias vítreas. También se puede detectar este banco de nieve mediante biomicroscopía ultrasónica (18).

Fig. 1: Biomicroscopía con lente de Goldmann en la que pueden
observarse los exudados blanquecinos con apariencia en «banco de nieve»
(«snowbank»), cubriendo la ora serrata y pars plana inferior.
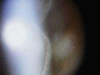
Fig. 2: Imagen biomicroscópica del «tyndall» vítreo en un caso
de uveítis intermedia. La intensa celularidad vítrea coexiste junto a bandas
fibrosas. En ocasiones se produce un reflujo o «spill-over» hacia la cámara
anterior, lo que puede dar lugar a un diagnóstico erróneo de uveítis anterior
recurrente.
El edema macular quístico (EMQ) (fig. 3), es la causa principal de reducción grave de agudeza visual en estos pacientes y se confirma mediante la angiografía fluoresceínica (AFG) o mediante el OCT (19). Aunque responde bastante bien al tratamiento médico, la mejor agudeza visual se consigue después de varios meses. Se han descrito casos de EMQ grave en las uveítis asociadas a infección por Borrelia Burgdorferi, dato a tener en cuenta para el diagnóstico diferencial de las uveítis intermedias en áreas endémicas de la enfermedad de Lyme.
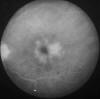
Fig. 3: AFG: EMQ bilateral en forma de pétalos de flor en una
uveítis intermedia.
La agudeza visual se puede afectar precozmente en el rango de visión de 0,5 y puede ser debida tanto a la vitritis como al EMQ.
El nervio óptico suele ser normal aunque a veces existe una leve hiperernia o edema a nivel de la papila. Por otro lado, con cierta frecuencia se observa una vasculitis retiniana periférica (figs. 4 y 5), comprometiendo principalmente a las vénulas; aunque oftalmoscópicamente la vascularización retiniana puede parecer normal, por biomicroscopía se aprecia cómo las venas periféricas presentan envainamientos y exudados perivasculares, llegando incluso a obliterarse. En ocasiones coexisten neovasos periféricos o centrales.

Fig. 4: Angiografía fluoresceínica (AFG) en la que se muestra
una vasculitis retiniana periférica. Pueden apreciarse el rezume de colorante
desde la pared de los vasos inflamados, las dilataciones capilares,
microaneurismas, junto a áreas isquémicas o de no perfusión. Se delimitan
perfectamente líneas de demarcación entre la retina sana y la no perfundida.
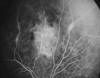
Fig. 5: Vasculitis nasal y exudados por sarcoidosis en una
uveitis intermedia.
Son frecuentes los hallazgos angiográficos no sospechados por oftalmoscopía. Los vasos (venas) envainados tiñen sus paredes y rezuman el colorante, lo que es indicativo de vasculitis focal o difusa (fig. 4). La AFG puede mostrar precozmente edema macular o de papila (fig. 3) y justificar por tanto un tratamiento más agresivo. A veces se puede complicar la uveítis intermedia con una membrana epirretiniana que obliga a su tratamiento quirúrgico (figs. 6-8).
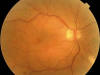
Fig. 6: Membrana epirretiniana y vasculitis nasal secundaria a
sarcoidosis que se manifiesta de debut como uveítis intermedia.
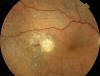
Fig. 7: Retinografía después de extracción de la membrana
epirretiniana.
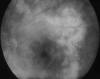
Fig. 8: AFG: EMQ crónico en una uveítis intermedia sarcoidea.
CURSO Y PRONÓSTICO
La UI muestra un curso evolutivo muy variable: desde configurar tan solo un proceso autolimitado y benigno, hasta la cronificación con múltiples períodos de exacerbación y complicaciones como EMQ, glaucoma, membranas epirretinianas e incluso desprendimiento de retina regmatógeno (aunque es una complicación rara en alrededor de solo 3% de las UI). Otra complicación que se puede encontrar es la perdida visual súbita por una hemorragia vítrea y que es la forma en que se presentó la paciente de la figura 6 y que puede ser confundida por ejemplo con una hemorragia vítrea común de un diabético cuando coexiste con diabetes y la vítritis confundirse con la fibrina residual. La ptisis bulbi puede ser el estadío final de una UI incontrolada, con desprendimientos de retina o una membrana ciclítica que causa un desprendimiento del cuerpo ciliar e hipotonía.
Del 70 al 80% de UI se presentan ya de forma bilateral y aproximadamente un tercio de los pacientes que empiezan de forma unilateral con la evolución se termina afectando también el otro ojo.
Aunque no están del todo bien delimitadas, en la práctica podemos encontrar diferentes formas clínicas.
1.ª Uveítis intermedia simple
Más frecuente en niños y jóvenes, se caracteriza por un intenso «tyndall» vítreo (figs. 1 y 2) sin afectación angiográfica de la retina y con poca afectación visual. Algunos de estos casos se presentan como «falsas uveítis anteriores recidivantes» al rezumar la vitritis al segmento anterior. El tratamiento puede hacerse exclusivamente con inyecciones subtenonianas de corticoides depot..
2.ª Uveítis intermedia asociada a vasculitis retiniana y/o edema macular
Idéntica a la anterior, pero con afectación vascular retiniana o macular evidenciables por angiografía fluoresceínica. El edema macular se encuentra entre el 28-50% y el edema del nervio óptico ocurre aproximadamente en el 50% de estos niños.
Los corticoides perioculares suelen ser insuficientes ya que el proceso tiende a cronificarse durante años. En ocasiones, debe valorarse la adicción de inmunomoduladores como la ciclosporina A.
3.ª Pars planitis clásica
Se caracteriza por un «tyndall» vítreo relativamente escaso asociado a «snowballs» y «snowbank» a nivel de la pars plana. Se trata de una forma benigna en la que sólo deben realizarse observaciones periódicas, sin necesidad de tratamiento, a no ser que se deteriore la visión.
4.ª Vitreítis del anciano
De curso frecuentemente crónico, obliga siempre a descartar que en realidad nos encontremos ante un síndrome mascarada, como el que origina el linfoma intraocular (sarcoma de células reticulares). En general, presenta una peor respuesta a los corticoides e inmunosupresores.
Ya que no es infrecuente que la duración del proceso inflamatorio persista por más de 20 años, los estudios que se han realizado sobre estos casos muy avanzados o duraderos han permitido obtener las siguientes conclusiones: 1.ª el pronóstico visual está más relacionado con la gravedad del proceso que con su duración, aunque ambos juegan su papel; 2.ª la alteración macular es el factor pronóstico más importante sobre la visión; 3.ª la presencia de exudados en la pars plana se asocia con peor pronóstico.
COMPLICACIONES
Las principales causas de disminución de la agudeza visual por debajo de 0,5 en la UI (20-22) son la catarata subcapsular posterior (50%) y la degeneración macular subsiguiente al edema macular quístico crónico (30%). Con menos frecuencia aparecen periflebitis (21%), neovasos, hemorragias vítreas ocasionales (8%), papilitis (5%) y bridas vítreas traccionales (fig. 2).
Otras complicaciones descritas en el caso de inflamación incontrolada son la hemorragia vítrea persistente, vitreorretinopatía proliferativa y desprendimiento exudativo o regmatógeno, retinosquisis, desprendimiento coroideo, membranas ciclíticas, queratopatía en banda, glaucoma secundario, heterocromía de iris, hipotonía y ocasionalmente ptisis bulbi.
DIAGNÓSTICO DIFERENCIAL
Las pruebas de laboratorio suelen ser negativas y no ayudan mucho en la identificación etiológica de la inflamación ocular. No obstante, previo al tratamiento se debe realizar una buena anamnesis y una exploración dirigida para excluir todas aquellas entidades que puedan originar una clínica similar.
Coriorretinitis (toxocara, toxoplasma, cándida, CMV): deben realizarse estudios serológicos útiles para excluir el diagnóstico de agentes infecciosos. Ocasionalmente el foco coriorretiniano de la toxoplasmosis puede ser muy periférico y por tanto difícil de observar. La forma retiniana de la toxocariasis usualmente es granulomatosa y no inferior, aunque en niños puede aparecer una alteración vítrea aislada, sin granulomas. Las retinocoroiditis candidiásica y por CMV pueden presentar vitritis, pero tienen unas lesiones características que las diferencian de la UI.
Enfermedad de Lyme: se efectuarán los estudios serológicos correspondientes en pacientes con clínica de la enfermedad y datos epidemiológicos concretos (23) (picadura de garrapata, cazadores que han tenido contacto con venados y otros animales salvajes en determinadas áreas endémicas de Estados Unidos o Europa).
Sífilis: diferenciación en base a la positividad del FTA-Abs, junto a las manifestaciones sistémicas (24).
Tuberculosis: el Mantoux y la radiografía de tórax pueden orientar el diagnóstico.
Uveítis por HTLV-l «Human T cell lymphotropic virus type 1») (25).
Enfermedad de Whipple: la clínica esencialmente digestiva y la biopsia intestinal confirmarán el diagnóstico.
Endoftalmitis endógena: buscaremos focos sépticos sistémicos, fundamentalmente en pacientes inmunocomprometidos (diabéticos con infección urinaria y sepsis, abscesos hepáticos, etc.).
Síndrome de lrvine-Gass: origina EMQ tras extracción de catarata (26), pero en estos casos el ojo muestra signos inflamatorios a nivel del segmento anterior.
lridociclitis heterocrómica de Fuchs: aunque se observa un discreto aumento de la celularidad vítrea y más raramente EMQ, es típicamente unilateral, frecuente la heterocromía y característicos los precipitados queráticos difusos estrellados.
Esclerosis múltiple establecida: se descarta mediante resonancia nuclear magnética cerebral.
Sarcoidosis: deben realizarse radiografía de tórax y el test de la enzima convertidora de angiotensina (ECA).
Síndromes mascarada (reticulosarcoma, melanoma...): la TAC, RMN y vitrectomía pueden ser útiles en el diagnóstico.
Retinocoroidopatía en perdigonada (tipo «birdshot»): a sospechar en pacientes de 40-50 años con vitritis asociada a múltiples áreas de despigmentación retiniana, de forma bilateral y simétrica.
Amiloidosis: origina opacidades vítreas perladas. Pueden ser necesarias la biopsia rectal y pruebas especiales de tinción como el rojo-Congo.
Vasculitis retiniana: (enfermedad de Behçet): diagnóstico en base a criterios internacionales consensuados (aftas orales y genitales, lesiones cutáneas, uveítis, test de patergia).
Cuerpo extraño intraocular: puede comportarse como un síndrome mascarada y ser difícil su visualización oftalmoscópica, por la existencia de opacidades corneales, cristalinianas, vitritis intensa o endoftalmitis asociada. Es importante comprobar el antecedente de trauma ocular perforante y la existencia de cicatrices corneales o esclerales como puerta de entrada, así como la realización de una ecografía o TAC ocular y orbitario.
Vitritis en pacientes ancianos: puede enmascarar un linfoma intraocular u otros procesos malignos. La falta de respuesta a los esteroides y la biopsia vítrea confirmarán el diagnóstico.
Desprendimiento vítreo posterior: a veces origina opacidades que alteran la agudeza visual y un aumento de células inflamatorias en el vítreo, así como un desprendimiento de retina inadvertido, sobre todo de áreas inferiores.
Enfermedades retinianas heredo-degenerativas (retinopatía pigmentaria): la forma típica mostrará espículas de pigmento en media periferia, aspecto moteado-atrófico de la retina, maculopatía, atenuación vascular y atrofia óptica. El campo visual, AFG y pruebas electrofisiológicas ayudarán a establecer el diagnóstico correcto.
TESTS DIAGNÓSTICOS
No existen pruebas de laboratorio específicas que confirmen el diagnóstico de UI, y los que se hagan deberán ir encaminados a determinar la causa de la pérdida visual o para conducir el tratamiento.
La investigación inicial de laboratorio puede incluir un recuento sanguíneo, velocidad de sedimentación globular (VSG), radiografía de tórax, Mantoux, ECA, FfA-Abs y títulos de anticuerpos contra la enfermedad de Lyme. El resto de exploraciones se deben realizar en función de las circunstancias clínicas, por ejemplo si se sospecha toxocara, toxoplasma, esclerosis múltiple o linfoma intraocular.
La ecografía puede ser útil cuando el estudio de la retina es dificultoso, no permitiéndose una adecuada visualización de su estado anatómico o de la extensión y densidad de la participación vítrea. Otros estudios de imagen ocular que pueden resultar de utilidad son la tomografía de coherencia óptica (OCT) y la biomicroscopía ultrasónica (BMU) (18,19).
La angiografía fluoresceínica es el test más útil, tanto para el diagnóstico como para el tratamiento, y confirma el EMQ, la participación del nervio óptico, la vasculitis de la periferia retiniana y la rara complicación de la neovascularización.
Finalmente, otros tests más recientes (27,28) son la medida de la Sicam-l (molécula soluble de adhesión intercelular), junto a la de interleuquina-8 (IL8), que pueden usarse como marcadores de enfermedad ocular activa y de la predisposición a desarrollar una enfermedad sistémica asociada en pacientes con UI.
TRATAMIENTO
Según la mayoría de los autores, al tratarse la UI de una inflamación crónica que además puede tener un curso benigno (80% de los casos), no siempre es necesario el tratamiento y la sola presencia de «floaters» no lo justifica. Sus principales indicaciones son: aparición de EMQ, reducción de la agudeza visual a 0,8 o menor y persistencia de inflamación severa del vítreo. Se han propuesto distintos escalones terapéuticos progresivos según la respuesta del paciente (29,30); sin embargo, dado que los pacientes con UI exhiben un amplio rango de actividad inflamatoria e índice de recurrencias, otros autores abogan por un plan individualizado de tratamiento para el control de la inflamación, siendo flexibles a la hora de elegir la terapia inicial.
Corticoides
Las inyecciones subtenonianas (31,32) de corticoides depot son eficaces y tienen menos efectos adversos, pero sí que ocasionan hipertensión intraocular con más frecuencia de lo que se cree.
La inyección de triamcinolona intravítrea (33) es un tratamiento efectivo a corto plazo para el EMQ resistente en las uveítis pero al igual que los esteroides administrados por otras vías puede ocasionar hipertensión ocular y catarata, por lo que estaría en principio contraindicado en pacientes con glaucoma o fáquicos jóvenes.
Los implantes de acetónido de fluocinolona (34) en la cavidad vítrea a través de pars plana constituyen una prometedora terapia para el tratamiento de la uveítis grave, aunque se precisa un control cuidadoso de la presión intraocular.
En pacientes que no toleran la inyección o en casos bilaterales se emplean corticoides sistémicos (35) como la prednisolona, que debe mantenerse al menos cuatro meses antes de considerar fallo en la respuesta, no siendo raras las recidivas tras su supresión.
Ciclosporina A e inmunosupresores de baja toxicidad
El uso de Ciclosporina A (36) o azatioprina asociados a dosis reducidas de corticoides pueden evitar medidas más agresivas. Se toleran bien por los niños y jóvenes, pero en los ancianos no es infrecuente la hipertensión arterial. Se ha llegado a proponer una «triple asociación a bajas dosis» de corticoides, ciclosporina A y azatioprina en casos refractarios. Algunos estudios han demostrado que su efecto terapéutico puede valorarse mediante la medida de la interleuquina-l (molécula natural de inmunomodulación) que aumenta de forma significativa en sangre tras dicha combinación terapéutica.
También se ha observado una reducción en la actividad de la uveítis durante la terapia con micofenolato mofetilo (37), relacionándose con la disminución en la frecuencia de células CD4 CD69-positivo en sangre periférica; ello es una medida de la actividad de las uveítis y puede guiar la inmunosupresión adecuada.
Vitrectomía
La vitrectomía (38,39) puede realizarse con fines diagnósticos, en el anciano, para buscar células linfomatosas, o con fines terapéuticos, en el niño, para tratar de disminuir la corticodependencia. Resulta eficaz asimismo en la supresión de las opacidades vítreas del eje visual y beneficiosa en casos de EMQ persistente, así como en la extirpación de membranas epirretinianas asociadas a la pars planitis.
Crioterapia de la base del vítreo
Se trata de una técnica controvertida que sólo se recomienda en casos de neovascularización periférica hemorrágica o refractaria al tratamiento (40). Tiene pocas complicaciones y debe considerarse en pacientes con pars planitis que responden poco o con efectos adversos o contraindicaciones de terapia esteroidea.
Inmunosupresores
La ciclofosfamida, clorambucil y el metotrexate, parecen más recomendables en el anciano donde la producción de aplasias medulares o linfomas mas tardíos puede tener menos trascendencia.
Cirugía de catarata
En caso de tener que realizarse cirugía de catarata mediante facoemulsificación o extracción extracapsular, es muy importante el control absoluto previo de la inflamación, y realizar la cirugía de la forma más atraumática posible y con un seguimiento postoperatorio regular (41,42). El implante de lentes intraoculares en casos seleccionados es bien tolerado y proporciona buenos resultados visuales.
BIBLIOGRAFÍA
Aaberg TM. The enigma of pars planitis. Am J Ophthalmol 1987; 103: 828-830.
Bloch-Michel E, Nussenblat RB. International Uveitis Study Group recommendations for the evaluation of intraocular inflammatory disease. Am 1 Ophthalmol 1987; 103: 234-235.
Benezra D, Maftzir G, Barak V. Blood serum interleukin+1 receptor antagonist in pars planitis and ocular Behçet disease. Am 1 Ophthalmol 1997; 123(5): 593-598.
Bhende M, Biswas l, Sharma T, Chorra SK, Gopal L, Shroff CM. Ultrasound biomicroscopy in the diagnosis and management of pars planitis caused by caterpillar hairs. Am J Ophthalmol 2000; 130 (1): 125-126.
Brydak-Godowska l, Drobecka-Brydak E, Ciszewska I, Skorska J, Paczek L. The intermediate uveitis with systemic symptoms: a case report. Klin Oczna 1999; 101 (2):j 131-134.
Chatzistefanou K, Markomichelakis NN, Christen W,J, Soheilian M, Foster CS. Characteristics of uveitis presenting for the first time in the elderly. Ophthalmology 1998; 105(2): 347-352.
Cunningham ET Jr. Uveitis in children. Ocul Immun_1 Inflamm 2000; 8(4): 251-261.
Deane JS, Rosenthal AR. Course and complications of intermediate uveitis. Acta Ophthalmol Scand 1997; 75(1): 82-84.
Demols PE Intermediate uveitis. Bull Soc Beige Ophtalmo1 2001; 279: 41-46.
Guex-Crosier Y. Epidemiology of uveitis. Rev Pral 1999; 49(18): 1989-1994.
Oruc S, Duffy BF, Mohanakumar T, Kaplan HJ. The association of HLA class II with pars planitis. Am J Ophthalmol 2001; 131(5): 657-659.
Pérez Torregrosa VT, Martínez-Costa R. «Uveítis Intermedia - Pars Planitis». Grupo Multicéntrico para el estudio de las Uveitis. Diagnóstico en Uveítis 1995; 411-415.
Pérez Torregrosa VT, Martínez-Costa R. «Vitritis - Uveítis Intermedia». Grupo Multicéntrico para el estudio de las Uveítis. Diagnóstico en Uveítis 1995; 193-197.
Prieto JF, Dios E, Gutierrez JM, Mayo A, Calonge M, Herreras JM. Pars planitis: epidemiology, treatment, and association with multiple sclerosis. Ocul Immunol Inflamm 2001; 9(2): 93-102.
Raja SC, Jabs DA, Dunn JP, Fekrat S, Machan CH, Marsh MJ, Bressler NM. Pars planitis: clinical features and class II HLA associations. Ophthalmology 1999; 106(3): 594-599.
Tang WM, Pulido JS, Eckels DD, Han DP, Mieler WF, Pierce K. The association of HLA-DR 15 and intermediate uveitis. Am J Ophthalmol 1997; 123(1): 70-75.
Smith RE, Godfrey WA, Kimura SJ. Complications of chronic cyclitis. Am J Ophthalmol 1976; 82: 277-282.
Haring G, Nolle B, Wiechens B. Ultrasound biomicroscopie imaging in intermediate uveitis. Br J Ophthalmol 1998; 82(6): 625-629.
Hassenstein A, Bialasiewicz AA, Richard G. Optical coherence tomography in uveitis patients. Am J Ophthalmol 2000; 130(5): 669-670.
Traspas Tejero R, Sarmiento Torres B, Tejada Palacios P, Pérez Blázquez E. Expresividad clínica de la uveítis intermedia. Arch Soc Esp Oftalmol 1998; 73: 131-136.
Vakur Pinar. MD. Intermediate Uveitis. Ocular Immunology and Uveitis Service. Massachusetts Eye and Ear Infirmary. Boston, MA.
Sherman MD, Own KH. Interstitial nephritis and uveitis syndrome presenting with bilateral optic disk edema. Am J Ophthalmol 1999; 127(5): 609-610.
Mikkila H, Seppala I, Leirisalo-Repo M, Immonen I, Karma A. The etiology of uveitis: the role of infections with special reference to Lyme borreliosis. Acta Ophthalmol Scand 1997; 75: 716-719.
Mwanza JC, Kayembe DL. Uveitis in HIV-infected patients. Eur J Ophthalmol 2001; 11(1): 53-56.
Takahashi T, Takase H, Ufano T, Sugita S, Miyata K, Miyata N, Mochizuki M. Clinical features of human T-lymphotropic virus type 1 uveitis: a long-term follow-up. Ocul Immunol lnflamm 2000; 8(4): 235-241.
Ormerod LD, Puklin JE, Giles CL. Chronic Propionibacterium acnes endophthalmitis as a cause of intermediate uveitis. Ocul Immunol Inflamm 1997; 5(1): 67-68.
Klok AM, Luyendijk L, Zaal MJ, Rothova A, Hack CE, Kijlstra A. Elevated serum IL-8 levels are associated with disease activity in idiopathic intermediate uveitis. Br J Ophthalmol 1998; 82(8): 871-874.
Klok AM, Luyendijk L, Zaal MJ, Rothova A, Kijlstra A. Soluble ICAM-l serum levels in patients with intermediate uveitis. Br J Ophthalmol 1999; 83(7): 847-851.
Kaplan HJ. Intermediate uveitis (pars planitis, chronic cyclitis) a four step approach to treatment. In: Saari KM. Uveitis update: Amsterdam: Excerpta Medica; 1984; 169-172.
Rojas B, Zafirakis P, Christen W, Markomichelakis NN, Foster CS. Medical treatment of macular edema in patients with uveitis. Doc Ophthalmol 1999; 97 (3-4): 399-407.
Tanner V, Kanski JJ, Frith PA. Posterior sub-Tenon's triamcinolone injections in the treatment of uveitis. Eye 1999; 13 (Pt 5): 703-704.
Lafranco Dafflon M, Tran VT, Guex-Crosier Y, Herbort CP. Posterior sub-Tenon's steroid injections for the treatment of posterior ocular inflammation: indications, efficacy and side effects. Graefes Arch Clin Exp Ophthalmol 1999; 237(4): 289-295.
Young S, Larkin G, Branley M, Lightlman S. Safety and efficacy of intravitreal triamcinolone for cystoid macular edema in uveitis. Clin Experiment Ophthalmol 2001; 29(1): 2-6.
Jaffe OJ, Ben-Nun J, Guo H, Dunn JP, Ashton P. Fluocinolone acetonide sustained drug delivery device to treat severe uveitis. Ophthalmology 2000; 107(11): 2024-2033.
Wakefield D, Jennings A, McCluskey PJ. Intravenous pulse methylprednisolone in the treatment of uveitis associated with multiple sclerosis. Clin Experiment Ophthalmal 2000; 28(2): 103-106.
Walton RC, Nussenblatt RB, Whitcup SM. Cyclosporine therapy for severe sight-threatening uveitis in children and adolescents. Ophthalmology 1998; 105 (11): 2028-2034.
Kilmartin DJ, Fletcher ZJ, Almeida JA, Liversidge J, Forrester JV, Dick AD. CD69 expression on peripheral C04+ T cells parallels disease activity and is reduced by mycophenolate mofetil therapy in uveitis. Invest Ophthalmal Vis Sci 2001; 42(6): 1285-1292.
Potter MJ, Myckatyn SO, Maberley AL, Lee AS. Vitrectomy for pars planitis complicated by vitreous hemorrhage: visual outcome and long-term follow-up. Am J Ophthalmol 2001; 131(4): 514-515.
Dev S, Mieler WF, Pulido JS, Mittra RA. Visual outcomes after pars plana vitrectomy for epiretinal membranes associated with pars planitis. Ophthalmology 1999; 106(6): 1086-1090.
Pulido JS, Mieler WF, Walton D, Kuhn E, Pastel E, Hartz A, Jampol LM, Weinberg DV, Logani S. Results of peripheral laser photocoagulation in pars planitis. Trans Am Ophthalmol Soc 1998; 96: 127-137; discussion 137-141.
Kaufman AH, Foster CS. Cataract extraction in patients with pars planitis. Ophthalmology 1993; 100: 1210-1217.
Fogla R, Biswas J, Ganesh SK, Ravishankar K. Evaluation of cataract surgery in intermediate uveitis. Ophthalmic Surg Lasers 1999; 30(3): 191-198.