
REVISIÓN ACTUALIZADA
MONTERO MORENO JA
1, RUIZ MORENO JM2, FERNÁNDEZ MUÑOZ M3, DE LA VEGA GALIANA C4, CLARAMONTE MESSEGUER P51
Doctor en Medicina. Unidad de Retina y Vítreo. Instituto Oftalmológico de Alicante. VISSUM. Servicio de Oftalmología. Hospital Pío del Río Hortega. Valladolid.RESUMEN
Presentamos una revisión sobre el empleo de los nuevos fármacos antiangiogénicos en cuadros no relacionados con la DMAE. En los últimos años estos fármacos han causado un gran cambio en el tratamiento de las enfermedades oculares, y se espera que estos cambios continúen a lo largo de esta década gracias a la llegada de nuevos antiangiogénicos y de nuevas indicaciones y vías de administración. En esta revisión se describen los resultados publicados o que se encuentran en vías de investigación referentes al uso de pegaptanib, ranibizumab y bevacizumab.
Palabras clave: Bevacizumab, edema macular, glaucoma neovascular, neovascularización de iris, neovascularización subretiniana, oclusión de vena retiniana, pegaptanib, ranibizumab, retinopatía diabética.
El tratamiento de la patología neovascular vítreo retiniana ha experimentado unos cambios vertiginosos a lo largo de las últimas dos décadas, pasando de los tratamientos mediante fotocoagulación con los láseres de argón y de diodo (mejor conocidos a partir de los resultados de los estudios de fotocoagulación macular (MPS) (1) y sus nuevas aplicaciones mediante la termoterapia transpupilar), la terapia fotodinámica (TFD) (2) y más recientemente al uso de nuevos fármacos que bloquean el factor de crecimiento endotelial vascular (VEGF) como pegaptanib (3) y ranibizumab (4). Sin embargo, y pese a que estos nuevos antiVEGF se diseñaron para ser utilizados en el tratamiento de la neovascularización coroidea submacular (NVC) en el contexto de la degeneración macular asociada a la edad (DMAE), recientemente hemos asistido a su aplicación bajo nuevas indicaciones, algunas de ellas en fase de desarrollo. Igualmente debemos mencionar la incorporación de otros fármacos en este campo, algunos ya conocidos y utilizados previamente pero que se aplican bajo el nuevo punto de vista de la antiangiogénesis como los corticoides; y otros desarrollados bajo otras indicaciones y que se han empezado a utilizar en oftalmología como el bevacizumab.
El VEGF es un mediador de la inflamación que puede actuar en múltiples procesos. En concreto se conoce su implicación en modelos animales de neovascularización de iris y de retina, así como se ha demostrado su presencia en los procesos de neovascularización retiniana y de edema macular (5,6). Actúa mediante un mecanismo pro-inflamatorio, incrementando la permeabilidad vascular y produciendo y manteniendo los nuevos vasos, al tiempo que modula la formación de trombos, el flujo vascular y la vasodilatación, y parece cumplir también una función de neuroprotección.
La inyección de VEGF intravítrea en animales de experimentación es capa de producir un cuadro muy similar a la retinopatía diabética, e inducir la aparición de vasos en el segmento anterior en un modelo de glaucoma neovascular que puede inhibirse mediante la inyección intraocular de fármacos antiVEGF. La posibilidad de bloquear estos mecanismos, así como la similitud de la NVC asociada a la DMAE con otros procesos, ha permitido ampliar las indicaciones de los antiVEGF, en muchos casos dentro de ensayos clínicos o como utilización fuera de indicación (off-label), dentro de un procedimiento de Uso Compasivo. Sin embargo, existe también la posibilidad de que un bloqueo completo y no selectivo del VEGF pueda dar lugar a una exacerbación del daño neurológico por la pérdida de autorregulación vascular o incluso dañar tejidos extraoculares que dependen de la formación y el mantenimiento de los neovasos, como es el caso del miocardio isquémico. Por este motivo será necesario extremar las precauciones conociendo bien el estado general del paciente y ceñirse a estos procedimientos de uso compasivo con consentimiento informado por escrito.
PEGAPTANIB
Pegaptanib es un aptámero formado por 28 bases nitrogenadas unido a dos radicales de polietilénglicol que le proporciona una mayor vida media. Los aptámeros son monocadenas de ácido ribonucleico que adoptan una estructura tridimensional y poseen propiedades de reconocimiento y unión a receptores similares a los de los anticuerpos. Está diseñado para unirse y bloquear de forma específica la isoforma 165 (formada por 165 aminoácidos) del VEGF extracelular (7).
Los resultados iniciales referentes a la eficacia de pegaptanib en DMAE húmeda se publicaron en 2004 (8), y posteriormente se ha probado su eficacia en el tratamiento del edema macular diabético (9), además de haber sido ensayado en otros procesos vitreoretinianos tales como el edema macular (diabético, secundario a la obstrucción de vena central de la retina (OVCR) o a la cirugía de la catarata), angiomatosis de Von Hippel Lindau (10), o neovascularización subretiniana secundaria al síndrome de presunta histoplasmosis (tabla 1). También se ha comunicado su empleo con buenos resultados en casos aislados de enfermedad de Coats (11), neovascularización secundaria a estrías angioides (12), coroidopatía polipoidal (13) y miopía magna (14).

Entre las ventajas de pegaptanib cabe destacar su altísima afinidad por la isoforma VEGF165 que se encuentra en el ojo (miles de veces mayor que por otras isoformas presentes en el resto del organismo) otorgándole un mejor perfil de seguridad sistémico (al no bloquear las isoformas presentes en otros territorios, como el miocardio y respetando los vasos normales) y su característica de ser una molécula pequeña y de origen sintético, lo cual al menos teóricamente, reduciría su antigenicidad [si bien se han descrito dos casos de reacción anafilactoide tras su inyección (15)] y le otorga una mayor estabilidad frente a los anticuerpos. Sin embargo esta misma alta afinidad es la causa de su acción limitada, pues no es capaz de bloquear otras isoformas de cadenas más cortas que se producen en el ojo como resultado de la degradación de la cadena del VEGF.
Pegaptanib viene presentado en jeringas precargadas con 0,3 mg de fármaco en un volumen de 0,08 mL y montadas con una aguja de 27G. Se administra por vía intravítrea cada 6 semanas.
Debido a su formulación con polietilénglicol pasa lentamente a la circulación general y se elimina por vía renal. Ha sido el primer antiangiogénico para uso intraocular aprobado en Estados Unidos (Food and Drug Administration, FDA) y en la Unión Europea, y ha pasado rigurosos controles de seguridad sistémica, inmunogénica y mutagénica.
Pegaptanib en el tratamiento del edema macular diabético
Los resultados del ensayo clínico sobre la eficacia de pegaptanib en inyección intravítrea en el tratamiento del edema macular clínicamente significativo en el curso de la retinopatía diabética se publicaron en 2005 (9). En este ensayo se utilizaron tres concentraciones de pegaptanib (0,3, 1 y 3 mg) o inyección simulada cada 6 semanas durante 30 semanas con la posibilidad de asociar un tratamiento de rescate mediante fotocoagulación con láser de argón a partir de la semana 12. Se reclutaron 172 pacientes con edema macular que afectaba la fóvea y se realizó seguimiento mediante estéreo fotografías en color, angiografía fluoresceínica (AFG), tomografía óptica de coherencia (OCT) y medida e la agudeza visual mejor corregida (MAVC).
Los resultados de este estudio demostraron mejoría de 2 líneas en el 34% de ojos tratados mediante 0,3 mg de pegaptanib frente al 10% de los ojos del grupo control (inyección simulada), con reducción del edema macular medido mediante OCT y reduciendo la necesidad de láser focal (fig. 1).
![]()
Fig. 1: Evolución del edema macular diabético tras la
inyección intravítrea de pegaptanib cada 6 semanas. 1 a: OCT previa al
tratamiento. 1 b: OCT a las 12 semanas de iniciar el tratamiento, con reducción
del edema. 1 c: OCT a las 12 semanas de finalizar el tratamiento, con rebrote
del edema. 1 d: OCT tras la inyección intravítrea de triamcinolona, mostrando
resolución completa del edema.
Si bien en este ensayo estaban excluidos de forma expresa los pacientes con retinopatía diabética proliferante (RDP), el examen retrospectivo de las AFG demostró la presencia de RDP en 16 de los ojos tratados (con pegaptanib o del grupo control) y en 4 ojos contralaterales. De estos ojos se pudo comprobar cómo desaparecía el cuadro neovascular en 8 de los 13 ojos que habían recibido tratamiento con pegaptanib, frente a ninguno de los ojos del grupo control ni de los ojos contralaterales. En tres de estos 8 casos, reapareció la actividad neovascular tras la suspensión del tratamiento. Estos resultados avalan, si bien de forma secundaria, los objetivos del estudio, la actividad anti neovascular de pegaptanib y la ausencia de efectos a nivel del ojo contralateral.
Pegaptanib en el tratamiento del edema macular secundario a la OVCR
Los resultados de este ensayo clínico se hicieron públicos en la reunión de Euretina de 2007 celebrada en Montecarlo. En este estudio se realizó tratamiento mediante inyecciones intravítreas de dos dosis diferentes de pegaptanib (0,3 y 1 mg) o inyección simulada cada 6 semanas durante 24 semanas en 98 pacientes con pérdida reciente de agudeza visual causada por edema macular secundario a OVCR (de menos de 6 meses de evolución) y que no presentaran componente isquémico, si bien se permitía la realización de tratamiento mediante panfotocoagulación con láser de árgon en los casos en los que los pacientes evolucionaran hacia formas isquémicas y proliferantes. Se realizó un seguimiento mediante OCT, AFG y MAVC durante 52 semanas.
Los resultados de este estudio demostraron una mejoría en el promedio de la MAVC de los pacientes de los grupos tratados frente al grupo control que fue evidente desde la primera inyección y se mantuvo durante el periodo de tratamiento (mejoría promedio de 10 letras frente a pérdida promedio de 3 letras, estadísticamente significativa para la dosis de 1 mg, p<0,05). Entre aquellos pacientes que ganaron más de 3 líneas hubo una tendencia favorable al grupo tratado con pegaptanib (no estadísticamente significativa), así como para aquellos que perdieron más de 3 líneas en la semana 30 (estadísticamente significativa, p<0,05). La diferencia también fue estadísticamente significativa a favor de pegaptanib para aquellos pacientes que en la semana 30 alcanzaban una MAVC superior a 0,1 (p<0,05).
El examen mediante OCT mostró una reducción del espesor foveal y del subcampo central desde la primera semana tras la inyección de pegaptanib superior a la alcanzada en el grupo control (151, 186 y 253 µm respectivamente para los ojos del grupo control y los tratados con 1 y 0,3 mg de pegaptanib) (fig. 2).
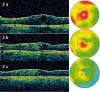
Fig. 2: Reducción del edema macular secundario a OVCR mediante
inyecciones con pegaptanib cada 6 semanas. 2 a: OCT basal. 2 b: OCT a las 12
semanas de iniciado el tratamiento. 2 c: OCT a las 24 semanas de iniciado el
tratamiento, que muestra una resolución casi completa del edema.
Pese a que inicialmente ninguno de los ojos incluidos en este ensayo mostraba forma isquémica, se asistió a la aparición de neovascularización retiniana y/o de iris en 6 casos, 3 tratados con pegaptanib y 3 del grupo control (fig. 3).
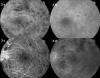
Fig. 3: Aparición de neovascularización en un paciente con
OVCR tratado con pegaptanib. 3 a: AFG basal, muestra una OVCR edematosa sin
isquemia. 3 b: AFG a las 12 semanas de iniciado el tratamiento, con reducción de
las hemorragias y del edema. 3 c: AFG a las 24 semanas muestra un rebrote del
edema asociado a neovascularización de la papila. 3 d: AFG a las 30 semanas, que
muestra progresión del edema y de la neovascularización, pese al tratamiento con
antiangiogénicos.
No se produjeron efectos adversos a nivel sistémico a lo largo del estudio ni hubo efectos adversos oculares graves como endoftalmitis, desprendimiento de retina o cataratas, si bien uno de los pacientes del grupo control decidió abandonar el estudio por pérdida de MAVC.
BEVACIZUMAB
Bevacizumab es un anticuerpo murino monoclonal antiVEGF humanizado; es decir, se origina a partir de ratones inmunizados y sólo la parte que se une al antígeno sigue siendo de origen murino habiéndose sustituido el resto del anticuerpo por proteina humana con fin de reducir su antigenicidad (fig. 4).

Fig. 4: Esquema mostrando la estructura de los anticuerpos
antiVEGF. 4 a: pegaptanib, molécula con afinidad por el VEGF basada solamente en
su estructura tridimensional. 4 b: Anticuerpo murino monoclonal antiVEGF. 4 c:
Anticuerpo monoclonal humanizado (bevacizumab), mantiene sólo la zona de unión
al anígeno; el resto de la molécula se sustituye por proteína humana. 4 d:
Ranibizumab, fracción Fab del anticuerpo humanizado.
Este fármaco se diseñó inicialmente para el tratamiento de pacientes con carcinoma colorectal metastásico (16); sin embargo, posteriormente ha sido utilizado habitualmente bajo uso compasivo en el tratamiento de otras neoplasias (17) y recientemente ha comenzado a utilizarse en oftalmología, especialmente en el tratamiento de la DMAE húmeda (18). Bevacizumab no es un fármaco que haya sido aprobado para su uso oftalmológico en la Unión Europea por lo que su empleo queda supeditado al uso compasivo.
Bevacizumab es capaz de bloquear todas las isoformas del VEGF, por lo que su falta de especificidad puede plantear problemas de seguridad a nivel sistémico, especialmente en pacientes con antecedentes de patología isquémica o tromboembólica, como se ha visto tras su empleo a nivel sistémico.
Su administración para uso oftalmológico se realiza por vía intravítrea, habitualmente 1,25 mg en un volumen de 0,05 mL, aunque inicialmente se describió su uso por vía intravenosa (19). Debido a la falta de estudios de farmacocinética ocular previos, no se conoce cuál pueda ser la pauta más adecuada de inyección, si bien suele considerarse cada 4 a 6 semanas (18,20); o más frecuentemente, puede plantearse la reinyección a demanda tras el empeoramiento de los síntomas o del espesor retiniano medido mediante OCT en controles mensuales.
Las series publicadas no siempre refieren la aparición de recidivas debido a la brevedad de los periodos de seguimiento; sin embargo éstas son frecuentes haciendo poco predecible el resultado final del tratamiento.
Se ha podido comprobar el paso de bevacizumab a la circulación sistémica y su recirculación, alcanzando niveles terapéuticos en el ojo contralateral. Este fármaco se acumula en los gránulos plaquetarios, pasando a los gránulos de nuevas plaquetas a medida que la población plaquetaria se va renovando, lo cual prolonga su vida media.
Pese a ser un fármaco no diseñado para uso oftalmológico, y ser necesaria la obtención de una aprobación para su uso individualizado como uso compasivo, en la actualidad su empleo está multiplicándose en oftalmología. No existen aún resultados de ensayos clínicos publicados sobre sus efectos, pero hay múltiples ensayos en marcha como se muestra en la tabla 2.

No cabe duda de que uno de los factores más atractivos de bevacizumab es su bajo costo, especialmente comparado con otros tratamientos existentes actualmente. Sin embargo no se debe perder de vista que en su manejo estamos, más aun que en el caso de pegaptanib y ranibizumab, moviéndonos en un campo muy indeterminado por estar utilizando (1) un fármaco no aprobado para su uso oftalmológico, dentro del marco del uso compasivo y (2) en indicaciones para las cuales ni siquiera aquellos otros fármacos con los cuales los podríamos comparar (pegaptanib y ranibizumab) han sido aprobados. Por este motivo se hace necesario extremar las precauciones, obteniendo la correspondiente autorización de uso compasivo, explicándolo al paciente y haciéndolo constar en el consentimiento informado y en la historia clínica.
Bevacizumab en el tratamiento de la retinopatía diabética
A lo largo de los últimos dos años se ha publicado una veintena de artículos referentes al uso de bevacizumab en pacientes con diversas formas de retinopatía diabética, especialmente edema macular, neovascularización del ángulo, del iris y de la papila, y como adyuvante de la cirugía.
La mayor parte de estos estudios sin embargo carecen de un seguimiento suficientemente prolongado, lo que dificulta una adecuada valoración de sus resultados.
Los trabajos de Avery y cols (21,22) y más recientemente de Jorge (23) han mostrado los resultados del tratamiento del edema macular diabético y de la retinopatía proliferativa mediante inyecciones únicas de bevacizumab con seguimientos de 11 a 12 semanas. Estos trabajos relatan un efecto beneficioso en todos los ojos tratados a partir de la primera semana tras la inyección, alcanzándose también un efecto más tenue en el ojo contralateral. Pese al compromiso vascular de los pacientes diabéticos, no se observaron efectos colaterales a nivel sistémico.
La duración del efecto parece ser limitada y variable, reapareciendo la fuga de fluoresceína a partir de los neovasos entre la segunda y la 11 semana tras la inyección. Entre el 73 y el 82% de los ojos mostraron desaparición de la fuga de fluoresceína de los neovasos papilares y del iris, y una disminución de la superficie de la retina afectada por los neovasos.
El efecto de bevacizumab sobre el edema macular diabético muestra una reducción de edema determinado mediante AFG y OCT que se asocia en ocasiones a una leve mejoría de AV. Un estudio más ambicioso sobre el efecto de bevacizumab en el edema macular diabético es el multicéntrico que se ha publicado en 2007 (24), describiendo una serie de 110 ojos tratados mediante inyecciones de 1,25 ó 2,5 mg de bevacizumab y repetidas a demanda cada 4 a 28 semanas con un promedio de 11 a 14 semanas, con una mejoría significativa en el espesor macular medido mediante OCT y en la agudeza visual.
Otros estudios (25) han mostrado una acción de reducción de la actividad neovascular proliferativa vitreoretiniana, muy favorable como adyuvante a la vitrectomía, reduciendo el calibre de los neovasos y con ello la posibilidad de sangrado intra y postoperatorio, cuando se realizaba la inyección entre 2 y 11 días antes de la cirugía. Al parecer también es eficaz reduciendo la duración de las hemorragias intravítreas asociadas a la retinopatía diabética. Sin embargo, el empleo aislado de las inyecciones de bevacizumab o su uso tras la cirugía puede incrementar las tracciones a partir de los neovasos y facilitar la aparición de desprendimientos de retina traccionales.
También se han encontrados resultados favorables tras el uso intracamerular de 1 mg (26) o intravítreo de 1,25 mg de bevacizumab (27,28) sobre la neovascularización del segmento anterior. Pese a que se trataba de casos aislados, y la probabilidad de recurrencia es muy alta cuando desparezca el efecto del fármaco, puede ser un procedimiento de utilidad para facilitar otros procedimientos como la capsulotomía Nd-YAG o la cirugía convencional sobre el segmento anterior.
Bevacizumab en el tratamiento de la OCVR
Otra veintena de artículos recientes ilustran sobre el uso de bevacizumab en el tratamiento del edema o la proliferación asociadas a la OVCR. Los resultados mostraban mejorías estadísticamente significativas en cuanto a la agudeza visual, reducción del edema macular y de la extensión de la zona neovascular frente a menos de un 0,21% de efectos adversos.
Si bien los trabajos iniciales eran muy optimistas al respecto, mostrando la rápida regresión de los neovasos (29) o del edema macular (30), incluso en las formas isquémicas (31), estudios más recientes han alertado sobre la aparición de un rebote en el edema macular tras el tratamiento, empeorando respecto a la situación inicial (32).
Bevacizumab en el tratamiento de la NVC asociada a la miopía magna (MM)
En la línea de los buenos resultados obtenidos con la TFD en la MM tras su empleo en la DMAE, se iniciaron los tratamientos con bevacizumab en pacientes con NVC por MM.
En este punto cabe destacar, al menos desde un punto de vista teórico, el potencial riesgo de realizar inyecciones intravítreas repetidas en pacientes con una retina periférica más frágil y la posibilidad de inducir en ellos desgarros y desprendimientos de retina. Otra posibilidad a considerar es el riesgo de teratogenia al tratarse de poblaciones en edad fértil, todo lo cual tendrá que ser convenientemente explicado y aclarado al paciente, haciéndolo constar en el consentimiento informado.
Desde los primeros casos aislados publicados (33-35), hasta series algo más largas recientemente (36-38), se han comunicado resultados favorables consiguiéndose el cierre de las lesiones neovasculares, reducción del edema macular medido mediante OCT y mejoría de la agudeza visual tras una o dos inyecciones de 1 a 1,25 mg, y tras un tiempo de seguimiento limitado, sin aparición de efectos adversos. Este efecto beneficioso se ha observado tanto en pacientes que no habían sido tratados previamente, como tras un tratamiento fracasado con TFD (fig. 5).
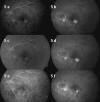
Fig. 5: NVC asociada a la MM, refractaria al tratamiento con
TFD y con buena respuesta a bevacizumab. 5 a y b: tiempos precoces y tardíos de
AFG basal tras dos sesiones con TFD. 5 c y d: tiempos precoces y tardíos de AFG
tras una tercera sesión de TFD, que no muestra cambios. 5 e y f: tiempos
precoces y tardíos de AFG tras la primera inyección de bevacizumab, muestra el
cierre completo de la lesión neovascular.
Otros usos de bevacizumab
Se han publicado casos aislados del uso de este fármaco en el tratamiento de otros cuadros como hemangiomas retinianos (39,40), maculopatía por irradiación (41), edema macular secundario a uveitis (42), retinopatía de la prematuridad (43), neovascularización corneal (44,45), adyuvante en la cirugía filtrante (46), tratamiento de tumores (47,48), NVC polipoidal (13), proliferación angiomatosa retiniana (RAP) (49) y la retinopatía por irradiación (50,51), entre otras. Los resultados, al menos inicialmente son positivos, estando siempre pendientes de seguimientos más largos en series mayores.
RANIBIZUMAB
Ranibizumab deriva del anticuerpo murino humanizado antiVEGF, al cual se le ha eliminado la fracción cristalizable (Fc), manteniéndose tan sólo la fracción que se liga al antígeno (Fab). Esta modificación facilita su penetración a través de la retina, incrementa en unas 140 veces su afinidad por el receptor y reduce su vida media en sangre periférica, mejorando así su perfil de seguridad. Ranibizumab se une y bloquea todas las formas activas de VEGF, reduciendo la actividad neovascular y la permeabilidad vascular (52). Es un fármaco aprobado para su uso intravítreo en Estados Unidos y en la Unión Europea.
Los resultados de los estudios sobre la actividad de ranibizumab sobre la neovascularización asociada a la DMAE en los estudios MARINA, ANCHOR y PRONTO han conseguido por primera vez mejorar la agudeza visual de estos pacientes (53), por lo que en la actualidad se está ensayando sobre otros procesos como se muestra en la tabla 3. Además se han publicado series cortas o casos aislados referidos a su uso en el tratamiento del edema macular diabético (54), NVC asociada a estrías angioides (12) y a neovascularización corneal (55) con resultados favorables.

Ranibizumab en tratamiento de la retinopatía diabética
Tras los buenos resultados mostrados por un estudio piloto (54), se ha puesto en marcha un ensayo clínico sobre el efecto de ranibizumab sobre el edema macular diabético.
Este estudio piloto (54) siguió 10 ojos de 10 pacientes con edema macular diabético con afectación central, tratados mediante inyecciones mensuales durante 2 meses (3 dosis) y observación hasta el mes 24. El tratamiento fue bien tolerado, apreciándose alguna mejoría en la agudeza visual en ocho de estos casos, que fue superior a las 15 letras en cuatro casos, y reduciéndose el edema macular en todos ellos (fig. 6).
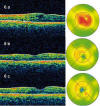
Fig. 6: Reducción del edema macular diabético tras inyecciones
con ranibizumab. 6 a: OCT basal. 6 b: OCT a las 8 semanas, tras 2 inyecciones de
ranibizumab. 6 c: OCT a las 16 semanas, tras 4 inyecciones de ranibizumab.
CONCLUSIÓN
Todos estos tratamientos antiangiogénicos (ranibizumab, bevacizumab y pegaptanib) han demostrado su eficacia en la reducción de la actividad neovascular y del edema retiniano. Sin embargo no debemos perder de vista que en ningún caso se está tratando la enfermedad de fondo, sino tan sólo una de las manifestaciones como es la expresión aumentada del VEGF. Ello hace que en enfermedades de tipo progresivo como son los procesos isquémicos, o las alteraciones derivadas de la retinopatía diabética, tan sólo seamos capaces de bloquear temporalmente estas manifestaciones, y sea de esperar un rebote posterior aún más potente como ya se ha puesto de manifiesto (32). Ello no quita importancia al papel de estos fármacos en procesos que pueden ser autolimitados y en los cuales la aparición y mantenimiento de un edema macular puede producir daños titulares que pueden mantenerse aun cuando el proceso primario se haya resulto, como es el caso de la OVCR edematosa o en la NVC secundaria a la MM. De forma similar, su papel puede ser muy útil como adyuvante en la cirugía vitreorretiniana de la retinopatía diabética o en la cirugía del segmento anterior como es la capsulotomía Nd-YAG en cápsulas vascularizadas o para mejorar el éxito de la cirugía filtrante. Sin embargo cabe esperar que la isquemia tisular se vea exacerbada por el cierre de los neovasos para rebrotar con mayor fuerza cuando el efecto del antiVEGF haya desaparecido, por lo que no debe plantearse como tratamiento de fondo de la RDP, del glaucoma neovascular, o de la OVCR isquémica.
Por otro lado, los tratamientos antiVEGF intravítreos plantean unos riesgos de por sí, asociados al hecho de su situación de «off-label». Es necesario en estos casos tomar una serie de medidas «extra» asociadas a las convencionales sobre la administración de fármacos intravítreos, como se muestra en las tablas 4 y 5.


BIBLIOGRAFÍA
Singerman LJ. Current management of choroidal neovascularization. Ann Ophthalmol 1988; 20: 415-20, 423.
Harding S. Photodynamic therapy in the treatment of subfoveal choroidal neovascularisation. Eye 2001; 15: 407-12.
Gragoudas ES, Adamis AP, Cunningham ET, Jr., Feinsod M, Guyer DR. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med 2004; 351: 2805-16.
Husain D, Kim I, Gauthier D, Lane AM, Tsilimbaris MK, Ezra E, Connolly EJ, Michaud N, Gragoudas ES, O’Neill CA, Beyer JC, Miller JW. Safety and efficacy of intravitreal injection of ranibizumab in combination with verteporfin PDT on experimental choroidal neovascularization in the monkey. Arch Ophthalmol 2005; 123: 509-16.
Tolentino MJ, Miller JW, Gragoudas ES, Chatzistefanou K, Ferrara N, Adamis AP. Vascular endothelial growth factor is sufficient to produce iris neovascularization and neovascular glaucoma in a nonhuman primate. Arch Ophthalmol 1996; 114: 964-70.
Adamis AP, Shima DT, Tolentino MJ, Gragoudas ES, Ferrara N, Folkman J, D’Amore PA, Miller JW. Inhibition of vascular endothelial growth factor prevents retinal ischemia-associated iris neovascularization in a nonhuman primate. Arch Ophthalmol 1996; 114: 66-71.
Vinores SA. Technology evaluation: pegaptanib, Eyetech/Pfizer. Curr Opin Mol Ther 2003; 5: 673-9.
Gragoudas ES, Adamis AP, Cunningham ET, Feinsod M, Guyer ER. Pegaptanib for Neovascular Age-Related Macular Degeneration. for the VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. N Engl J Med 2004; 351: 2805-16.
Cunningham ET, Jr., Adamis AP, Altaweel M, Aiello LP, Bressler NM, D’Amico DJ, Goldbaum M, Guyer DR, Katz B, Patel M, Schwartz SD. A phase II randomized double-masked trial of pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology 2005; 112: 1747-57.
Dahr SS, Cusick M, Rodriguez-Coleman H, Srivastava SK, Thompson DJ, Linehan WM, Ferris FL, 3rd, Chew EY. Intravitreal anti-vascular endothelial growth factor therapy with pegaptanib for advanced von Hippel-Lindau disease of the retina. Retina 2007; 27: 150-8.
Sun Y, Jain A, Moshfeghi DM. Elevated vascular endothelial growth factor levels in Coats disease: rapid response to pegaptanib sodium. Graefes Arch Clin Exp Ophthalmol 2007.
Lommatzsch A, Spital G, Trieschmann M, Pauleikhoff D. [Intraocular application of bevacizumab for the treatment of choroidal neovascularization secondary to angioid streaks.]. Ophthalmologe 2007; 104: 325-8.
Ghajarnia M, Kurup S, Eller A. The therapeutic effects of intravitreal bevacizumab in a patient with recalcitrant idiopathic polypoidal choroidal vasculopathy. Semin Ophthalmol 2007; 22: 127-31.
Bennett MD,Yee W. Pegaptanib for myopic choroidal neovascularization in a young patient. Graefes Arch Clin Exp Ophthalmol 2007; 245: 903-5.
Steffensmeier AC, Azar AE, Fuller JJ, Muller BA, Russell SR. Vitreous injections of pegaptanib sodium triggering allergic reactions. Am J Ophthalmol 2007; 143: 512-3.
Berlin JD. Targeting vascular endothelial growth factor in colorectal cancer. Oncology (Williston Park) 2002; 16: 13-5.
Motl S. Bevacizumab in combination chemotherapy for colorectal and other cancers. Am J Health Syst Pharm 2005; 62: 1021-32.
Lazic R,Gabric N. Intravitreally administered bevacizumab (Avastin) in minimally classic and occult choroidal neovascularization secondary to age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol 2006.
Michels S, Rosenfeld PJ, Puliafito CA, Marcus EN, Venkatraman AS. Systemic bevacizumab (Avastin) therapy for neovascular age-related macular degeneration twelve-week results of an uncontrolled open-label clinical study. Ophthalmology 2005; 112: 1035-47.
Goff MJ, Johnson RN, McDonald HR, Ai E, Jumper JM, Fu A. Intravitreal bevacizumab for previously treated choroidal neovascularization from age-related macular degeneration. Retina 2007; 27: 432-8.
Avery RL, Pearlman J, Pieramici DJ, Rabena MD, Castellarin AA, Nasir MA, Giust MJ, Wendel R, Patel A. Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy. Ophthalmology 2006; 113: 1695 e1-15.
Avery RL. Regression of retinal and iris neovascularization after intravitreal bevacizumab (Avastin) treatment. Retina 2006; 26: 352-4.
Jorge R, Costa RA, Calucci D, Cintra LP, Scott IU. Intravitreal bevacizumab (Avastin) for persistent new vessels in diabetic retinopathy (IBEPE study). Retina 2006; 26: 1006-13.
Arevalo JF, Fromow-Guerra J, Quiroz-Mercado H, Sanchez JG, Wu L, Maia M, Berrocal MH, Solis-Vivanco A, Farah ME. Primary intravitreal bevacizumab (Avastin) for diabetic macular edema: results from the Pan-American Collaborative Retina Study Group at 6-month follow-up. Ophthalmology 2007; 114: 743-50.
Chen E,Park CH. Use of intravitreal bevacizumab as a preoperative adjunct for tractional retinal detachment repair in severe proliferative diabetic retinopathy. Retina 2006; 26: 699-700.
Grisanti S, Biester S, Peters S, Tatar O, Ziemssen F, Bartz-Schmidt KU. Intracameral bevacizumab for iris rubeosis. Am J Ophthalmol 2006; 142: 158-60.
Eren E, Kucukerdonmez C, Yilmaz G, Akova YA. Regression of neovascular posterior capsule vessels by intravitreal bevacizumab. J Cataract Refract Surg 2007; 33: 1113-5.
Silva Paula J, Jorge R, Alves Costa R, Rodrigues Mde L, Scott IU. Short-term results of intravitreal bevacizumab (Avastin) on anterior segment neovascularization in neovascular glaucoma. Acta Ophthalmol Scand 2006; 84: 556-7.
Ahmadieh H, Moradian S, Malihi M. Rapid regression of extensive retinovitreal neovascularization secondary to branch retinal vein occlusion after a single intravitreal injection of bevacizumab. Int Ophthalmol 2005; 26: 191-3.
Rosenfeld PJ, Fung AE, Puliafito CA. Optical coherence tomography findings after an intravitreal injection of bevacizumab (avastin) for macular edema from central retinal vein occlusion. Ophthalmic Surg Lasers Imaging 2005; 36: 336-9.
Costa RA, Jorge R, Calucci D, Melo LA, Jr., Cardillo JA, Scott IU. Intravitreal bevacizumab (avastin) for central and hemicentral retinal vein occlusions: IBeVO study. Retina 2007; 27: 141-9.
Matsumoto Y, Freund KB, Peiretti E, Cooney MJ, Ferrara DC, Yannuzzi LA. Rebound macular edema following bevacizumab (Avastin) therapy for retinal venous occlusive disease. Retina 2007; 27: 426-31.
Sakaguchi H, Ikuno Y, Gomi F, Kamei M, Sawa M, Tsujikawa M, Oshima Y, Kusaka S, Tano Y. Intravitreal injection of bevacizumab for choroidal neovascularization caused by pathological myopia. Br J Ophthalmol 2006.
Laud K, Spaide RF, Freund KB, Slakter J, Klancnik JM, Jr. Treatment of choroidal neovascularization in pathologic myopia with intravitreal bevacizumab. Retina 2006; 26: 960-3.
Nguyen QD, Shah S, Tatlipinar S, Do DV, Anden EV, Campochiaro PA. Bevacizumab suppresses choroidal neovascularisation caused by pathological myopia. Br J Ophthalmol 2005; 89: 1368-70.
Yamamoto I, Rogers AH, Reichel E, Yates PA, Duker JS. Intravitreal bevacizumab (Avastin) as treatment for subfoveal choroidal neovascularisation secondary to pathological myopia. Br J Ophthalmol 2007; 91: 157-60.
Sakaguchi H, Ikuno Y, Gomi F, Kamei M, Sawa M, Tsujikawa M, Oshima Y, Kusaka S, Tano Y. Intravitreal injection of bevacizumab for choroidal neovascularisation associated with pathological myopia. Br J Ophthalmol 2007; 91: 161-5.
Lynch SS,Cheng CM. Bevacizumab for neovascular ocular diseases. Ann Pharmacother 2007; 41: 614-25.
Ziemssen F, Voelker M, Inhoffen W, Bartz-Schmidt KU, Gelisken F. Combined treatment of a juxtapapillary retinal capillary haemangioma with intravitreal bevacizumab and photodynamic therapy. Eye 2007.
von Buelow M, Pape S, Hoerauf H. Systemic bevacizumab treatment of a juxtapapillary retinal haemangioma. Acta Ophthalmol Scand 2007; 85: 114-6.
Ziemssen F, Voelker M, Altpeter E, Bartz-Schmidt KU, Gelisken F. Intravitreal bevacizumab treatment of radiation maculopathy due to brachytherapy in choroidal melanoma. Acta Ophthalmol Scand 2007.
Cordero Coma M, Sobrin L, Onal S, Christen W, Foster CS. Intravitreal Bevacizumab for Treatment of Uveitic Macular Edema. Ophthalmology 2007.
Travassos A, Teixeira S, Ferreira P, Regadas I, Travassos AS, Esperancinha FE, Prieto I, Pires G, van Velze R, Valido A, Machado Mdo C. Intravitreal bevacizumab in aggressive posterior retinopathy of prematurity. Ophthalmic Surg Lasers Imaging 2007; 38: 233-7.
Erdurmus M,Totan Y. Subconjunctival bevacizumab for corneal neovascularization. Graefes Arch Clin Exp Ophthalmol 2007.
Destafeno JJ,Kim T. Topical bevacizumab therapy for corneal neovascularization. Arch Ophthalmol 2007; 125: 834-6.
Jonas JB, Spandau UH, Schlichtenbrede F. Intravitreal bevacizumab for filtering surgery. Ophthalmic Res 2007; 39: 121-2.
Kenawy N, Groenwald C, Damato B. Treatment of a vasoproliferative tumour with intravitreal bevacizumab (Avastin). Eye 2007; 21: 893-4.
Amselem L, Cervera E, Diaz-Llopis M, Montero J, Garcia-Pous M, Udaondo P, Garcia-Delpech S, Salom D. Intravitreal bevacizumab (Avastin) for choroidal metastasis secondary to breast carcinoma: short-term follow-up. Eye 2007; 21: 566-7.
Joeres S, Heussen FM, Treziak T, Bopp S, Joussen AM. Bevacizumab (Avastin) treatment in patients with retinal angiomatous proliferation. Graefes Arch Clin Exp Ophthalmol 2007.
Finger PT,Chin K. Anti-vascular endothelial growth factor bevacizumab (avastin) for radiation retinopathy. Arch Ophthalmol 2007; 125: 751-6.
Finger PT. Anti-VEGF bevacizumab (Avastin) for radiation optic neuropathy. Am J Ophthalmol 2007; 143: 335-8.
Gaudreault J, Fei D, Rusit J, Suboc P, Shiu V. Preclinical pharmacokinetics of Ranibizumab (rhuFabV2) after a single intravitreal administration. Invest Ophthalmol Vis Sci 2005; 46: 726-33.
Rosenfeld PJ, Rich RM, Lalwani GA. Ranibizumab: Phase III clinical trial results. Ophthalmol Clin North Am 2006; 19: 361-72.
Chun DW, Heier JS, Topping TM, Duker JS, Bankert JM. A pilot study of multiple intravitreal injections of ranibizumab in patients with center-involving clinically significant diabetic macular edema. Ophthalmology 2006; 113: 1706-12.
Hosseini H,Nejabat M. A potential therapeutic strategy for inhibition of corneal neovascularization with new anti-VEGF agents. Med Hypotheses 2007; 68: 799-801.