
Fig. 1: La protusión de la córnea sobre la esfera escleral levanta el párpado superior cerrado, y permite determinar los movimientos oculares.
HISTORIA Y HUMANIDADES
MURUBE J
1, CARBONELL JJ2, MUÑOZ NEGRETE F3, REBOLLEDA G4, ARNALICH F5El presente trabajo se ha hecho como parte
del Proyecto FMM-2005/443 de la Fundación Mutua Madrileña.
1
Presidente de la International Society of Dacryology and Dry Eye.
2 Jefe del
Servicio de Neurofisiología Clínica del Sanatorio San Francisco. Madrid.
3 Profesor
Titular de Oftalmología de la Universidad de Alcalá y Jefe del Servicio de
Oftalmología del Hospital Ramón y Cajal. Madrid.
4 Profesora
Asociada de la Universidad de Alcalá y Médico Adjunto de Oftalmología del
Hospital Ramón y Cajal. Madrid.
5 Médico
Oftalmólogo y becario de fellowship en Córnea, en el Moorfields Eye Hospital.
Londres.
El movimiento de los ojos bajo los párpados cerrados es fácil de observar, porque la córnea tiene un radio de curvatura de 8 mm, que protruye sobre la esfera escleral, de radio de curvatura 12 mm, y ambas —esclera y córnea— están cubiertas y levemente presionadas por el párpado superior, de forma que el relieve corneal se evidencie en la superficie palpebral, y cuando el globo ocular se mueve, este relieve se desplaza. Durante milenios las madres han mirado fascinadas a sus hijos durmiendo, los amantes enamorados a sus parejas, las enfermeras cuidadosas a sus pacientes. Sin duda se percataron millones de veces de que bajo los párpados cerrados del durmiente a veces se movían los ojos repetitivamente y después paraban. Sin embargo, falta cualquier referencia de ello (fig. 1).

Fig. 1: La protusión de la córnea sobre la esfera escleral
levanta el párpado superior cerrado, y permite determinar los movimientos
oculares.
Fue hace sólo medio siglo cuando Kleitman y Aserinsky (1) advirtieron, registraron y describieron este hecho.
En español usamos el mismo término «sueño» para expresar el tiempo de estar dormidos, y para expresar las evocaciones que durante ese tiempo pasan al área de lo consciente. En otros idiomas no ocurre así y ambos conceptos se dicen respectivamente sleep/dream en inglés, Schlaf/Traum en alemán, sommeil/rêve en francés, h´y pnos/ónar (upnoV/o´ nat) en griego. Este problema nos viene del latín, donde el sueño de dormir y el de soñar son el primero somnus y el segundo somnium. Para evitar esta confusión, nosotros usaremos los términos sueño/ensueño, ambos aceptados por la Real Academia Española (figs. 2 y 3).

Fig. 2: Salvador Dalí, 1937. «Sueño» (somnus, sleep). Óleo
51x78 mm. La cabeza y cuerpo se caen hacia adelante, los párpados se cierran...
y son sostenidos por tenedores ahorquillados.

Fig. 3: Salvador Dalí, 1944. «Sueño (somnium, dream, ensueño)
desencadenado por el vuelo de una abeja alrededor de una granada un segundo
antes de despertar».
CONSIDERACIONES SOBRE LA FISIOLOGÍA DEL SUEÑO
Hasta hace poco el sueño había sido considerado como un estado pasivo de la actividad cerebral, producido por la fatiga. Ahora sabemos que no es un período de inactividad, sino de actividad distinta a la diurna, gran parte de ella orientada a reordenación de aspectos físicos y psíquicos. Esta reordenación es intensa, y se podría comparar a la de una oficina, en la que durante el día el personal, mobiliario, libros, computadoras y espacios son utilizados para diversos fines, y durante la noche numerosos servicios de limpieza y ordenación organizan la oficina para reiniciar el trabajo al día siguiente.
Fue Piéron en 1913 (43) el primero en considerar el sueño como un estado fisiológico activo, y unos 10 años más tarde, a lo largo de los años 1920 quien profundizó en el ritmo circadiano sueño/vigilia. Durante este decenio, Berger introdujo en 1926 la electroencefalografía (EEG) (aunque no lo publicó hasta 1929) (2). Poco después, Loomis et al (1936) (27) hicieron el primer EEG durante el sueño, y describieron 5 estadíos de sueño, pero no advirtieron que había momentos del sueño en que los ojos se movían rítmicamente bajo los párpados cerrados. Tres lustros después Aserinsky y Kleitman (1) se percataron de estos movimientos, y añadieron al EEG somnil el electro-oculograma (EOG), y en 1953 reportaron que durante el sueño había períodos, unos sin movimientos oculares, y otros con movimientos oculares rápidos (períodos REM o de Rapid Eye Movements), los cuales se alternaban cíclicamente varias veces durante el sueño. El EOG no es un electromiograma (EMG) sino que determina el movimiento ocular porque el polo ocular anterior es electropositivo en relación con el posterior, y por tanto, colocando un electrodo cerca del canthus lateral es posible detectar los movimientos oculares.
Esto despertó el interés por determinar la actividad muscular durante el sueño, y Jouvet (1959) (17) en gatos y Berger (1961) (3) en humanos añadieron el electromiograma (EMG), que en las décadas siguientes incluyó los músculos mentonianos/submentonianos, los intercostales, los tibiales anteriores, etc. Así se descubrió que durante el sueño REM había atonía muscular. La suma de mediciones electrográficas somniles dio lugar a la actual polisomnografía que detecta cambios eléctricos cerebrales, de posición ocular y de músculos esqueléticos, de actividad cardíaca, etc. Cada año, con éstas o con nuevas tecnologías se determinan nuevas actividades electrográficas.
El descubrimiento de Aserinsky y Kleitman de períodos somniles REM había despertado gran interés, y en el lustro siguiente aparecieron algunas publicaciones al respecto (7,8,17). Desde entonces las diferentes actividades electrográficas somniles se ubicaron en dos grupos distintos: las que aparecían durante los períodos REM, y las que lo hacían durante los períodos no REM (NREM).
Los simples movimientos oculares durante el sueño parecen algo trivial, o al menos sin relación con las muchas otras actividades somniles. Sin embargo, esta inexplicada característica de los movimientos oculares somniles es la referencia para la división primaria de la actividad somnil en fases REM y NREM. La oftalmología recibió así una atención venida de fuera, tal vez anecdótica, a la que ha prestado muy poca atención. Todavía, el significado de estos movimientos oculares durante el sueño permanecen desconocidos. Nosotros ofrecemos en esta publicación una hipótesis al respecto, creemos que la primera aparecida hasta el presente (37-41).
¿POR QUÉ DORMIR?
Se desconoce el porqué la mayoría de los animales necesitan dormir. Puede ser que esta facultad se desarrolló para 1) reducir la actividad de los animales cuando son más vulnerables, y así protegerlos de sus predadores. 2) Para ahorrar energía, como también ocurre en otra forma con la hibernación de los osos y otros animales. 3) Para permitir al cerebro concentrarse en determinadas actividades (aprendizaje, memoria) sin ser interferido por la mayor actividad de las horas de vigilia nictemeral. Los fetos tienen un sueño mayoritariamente REM, que es muy distinto al del postnato, pues reúne algunos de los fenómenos incluidos en el período llamado REM, pero le faltan otros muchos: falta la respiración, la termorregulación está ausente, los movimientos oculares REM son excepcionales, etc. Los recién nacidos duermen 17-18 horas diarias. Los niños de 5 años duermen 10-12 horas diarias. Los adultos jóvenes y medios (20-60 años) duermen unas 8 horas diarias.
En animales no humanos también existe el sueño, cuya duración y características varía según la especie. Así, los murciélagos duermen cada día unas 18 horas, las jirafas y elefantes 4-5 horas, y algunos peces sólo unos minutos.
La posición corporal que se adopta durante el sueño también es característica de cada especie. La mayoría de los animales cierra los ojos. En cuanto al tronco y extremidades, el humano suele dormir de lado, con las cuatro extremidades dobladas. La jirafa duerme arrodillada, y con su cabeza alojada en la corva de su rodilla posterior. Y el delfín duerme mientras se mantiene nadando contracorriente.
Algunos fenómenos parecidos al sueño, como son la hibernación, el coma y la narcolepsia son bastante distintos del sueño fisiológico, pero su estudio puede ayudar a entender unos y otros. Así, su estudio clínico y los experimentos en animales han ayudado a determinar las regiones cerebrales implicadas en el sueño, así como las implicadas en el despertar.
ASOCIACIONES NORMALES A LOS PERÍODOS REM/NREM DEL SUEÑO
1. Durante los períodos REM del sueño, el EEG manifiesta la actividad cerebral con un patrón de ondas b, rápidas, cortas y de bajo voltaje, bastante similar a las de los períodos de vigilia. Por ello, el sueño REM se ha equiparado a un sueño superficial o «Desynchronized EEG activity sleep» (D sleep).
Otra asociación polisomnográfica del sueño REM es la de actividad muscular. Los músculos esqueléticos manifiestan una hipotonía en casi todo el cuerpo, que es casi completa en cuello, espalda, brazos y piernas. Los músculos de la respiración y los músculos oculares extrínsecos se afectan menos, de forma que la respiración se mantiene e incluso a veces se hace más activa, y los ojos se pueden mover bajo los párpados cerrados con movimientos saccádicos oculopalpebrales.
Otras características físicas son que las pulsaciones cardíacas se hacen más dinámicas e irregulares, que la temperatura del cuerpo se regula peor, y que el pene de los varones de todas la edades entra en erección (18), el clítoris de las hembras se agranda.
Las principales características psíquicas se refieren a la memoria y al onirismo o ensueños. Los tres principales tipos de memoria son: 1) Memoria episódica verbal (recolección de experiencias), 2) Memoria procesal (aprendizaje de habilidades cognitivas o perceptivo-motoras), y 3) Memoria laboral (o de trabajo). Los tres tipos de memoria necesitan un sueño REM normal para transferirse a las neuronas, desarrollarse y consolidarse, pasando de ser una memoria temporal a ser de largo tiempo (62). Durante el sueño el cerebro humano memoriza, archiva, fija selecciona y relaciona las experiencias y conocimientos, especialmente aquellos recibidos durante la vigilia del día anterior. Solamente una milésima parte de esta actividad se expresa a veces en la conciencia en forma de ensueños.
Los ensueños u onirismos son muy típicos del sueño REM. En 1957 Dement y Kleitman (7) publicaron el sincronismo entre los períodos de sueño REM y los ensueños. Cuando esto fue confirmado por otros investigadores, algunos autores denominaron «oníricos» a los períodos REM, y «no oníricos» a los períodos NREM. Hoy día esto no se ha universalizado (52), porque puede haber ensueños en todas las fases del sueño, pero es evidente que los períodos REM están fuertemente asociados a ensueños, especialmente a aquellos que se manifiestan con imágenes visuales (16), y que las manifestaciones emocionales (ansiedad, miedo, tristeza, amor, eroticismo, alegría) son más frecuentes, intensas, vívidas y escénicas que las de los ensueños desarrollados durante las fases NREM (9,32).
2. Durante las fases NREM del sueño, el EEG muestra la actividad cerebral con un patrón de ondas d, lentas y grandes, que se han equiparado o superpuesto al sueño SWS (Slow-Wave Sleep).
Durante las fases NREM predomina la actividad parasimpática sobre la simpática (miosis, bradicardia, etc). El tono muscular y los reflejos musculares vuelven a la normalidad. La actividad cardiaca y la respiración descienden a los valores habituales. La presión sanguínea y la temperatura corporal disminuyen. Y no suele haber ensueños o estos son poco vívidos. El hablar durante el sueño, el sonambulismo y la enuresis nocturna ocurren durante los períodos NREM.
RITMO Y OTRAS CARACTERÍSTICAS DEL SUEÑO REM
Cuando un adulto normal entra en sueño, su primer ciclo REM/NREM empieza en fase NREM, que dura aproximadamente hora y media (90 min). Después viene un primer período REM, que suele durar aproximadamente 5 ó 10 minutos. Después sigue otro período NREM durante aproximadamente una hora, al que sigue un período REM algo más largo que el del primer ciclo. Los ciclos NREM/REM repiten sucesivamente durante todo el sueño, haciéndose los períodos NREM más cortos y los REM más largos.
También la edad influye en el ritmo REM/NREM. El tiempo de sueño REM es aproximadamente el 50% del tiempo total de sueño en los recién nacidos, el 30% en los niños de 5 años y el 20% en los adultos jóvenes y medios.
La proporción de sueño REM/NREM también es diferente, siendo en el mandril y en el conejillo de Indias de 1/9, y en perros, jirafas y puercoespines, de 1/4. En los mamíferos, cuanto más inmaduro físicamente es el neonato al nacer, como es el humano, más largo es el sueño REM, tanto durante la lactancia, como durante el desarrollo y edad adulta.
Los ciclos de sueño REM/NREM cambian según múltiples circunstancias circadianas, tales como que la actividad laboral sea habitual u ocasionalmente nocturna, el que se trasnoche por vida social y los viajes transoceánicos. También son frecuentes el acortamiento y alteraciones del sueño REM asociados a la depresión mental enfermedad de Alzheimer, distrofia miotónica, narcolepsia (11,51), al glaucoma crónico (23,36,61) y a otras muchas enfermedades. Gastaut et al descubrieron en 1965 (12) la frecuente existencia de crisis de apnea durante el sueño, siendo ésta hoy día la principal causas de anormalidades del sueño y la razón de que sean frecuentes las pruebas de polisomnografía clínica.
¿POR QUÉ HAY FASES DE SUEÑO REM/NREM?
Las distintas actividades de los animales durante el sueño han variado y se han perfeccionado a lo largo de la evolución filogenética, y para no interferir unas con otras probablemente se han ido congregando en dos grupos o períodos distintos, hoy día llamados fases REM y NREM. Estas dos fases asocian y sirven propósitos funcionales distintos, porque cuando una de estas dos fases se suprime, esta fase se hace más larga en el sueño siguiente.
Las fases de sueño REM y NREM existen en los mamíferos y en los pájaros. Aún no se sabe si existen en los reptiles y otros animales. A lo largo de la evolución filogenética parece ser que varias funciones diferentes se han beneficiado de esta alternancia
Hay varias hipótesis para explicar el desarrollo del sueño REM:
1) Jouvet (1959) (17) sugirió que es un estado independiente de «alerta» intercalado en el sueño.
2) Marks en 1995 (30) propuso que la fase REM del sueño es la evolución ontogénica del «sueño activo» del neonato, sueño activo éste que es muy necesario en los niños para desarrollar en el cerebro durante sus desarrollo las conexiones neuronales del animal maduro. Por ello, la deprivación del «sueño activo» en la vida temprana produce una disminución de la masa cerebral (33) y problemas de conducta. Esta hipótesis explicaría por qué la fase de sueño REM disminuye con la edad.
3) Cuanto mayor es la madurez corporal u orgánica de una especie animal al nacer, menor es la duración de su sueño REM. No se sabe por qué es esto. Pero sí se sabe que la inteligencia no parece estar relacionada con esta madurez corporal, pues el tiempo de sueño de los humanos tiene un 20-30% de fase REM, y el de las ballenas y delfines (que tienen un alto nivel de inteligencia con respecto a otros mamíferos) tienen el menor tiempo de fase REM de todos los mamíferos. Así, parece ser que es la madurez corporal u orgánica al nacer, y no la intelectual, la que se relaciona con un sueño REM más corto, o dicho de otra forma, los animales que nacen corporalmente más inmaduros, como el humano, son los que tienen un mayor porcentaje de sueño REM.
4) Se ha sugerido que sirve para consolidar la memoria. Sin embargo, pacientes que han sufrido lesiones cerebrales que le han suprimido el sueño REM tienen una memoria normal.
5) Para reorganizar los neurotransmisores: Los neurotransmisores monoamina (norepinefrina, serotonina e histamina) y los receptores monoamina del cerebro necesitan descansar durante la fase REM para recuperar su total su sensibilidad. Así, durante las fases REM del sueño, las neuronas motoras no son estimuladas y los músculos reposan, salvo los oculomotores y los respiratorios y demás necesarios para el mantenimiento vital.
¿POR QUÉ HAY MOVIMIENTOS OCULARES EN LA FASE REM?
Las teorías anteriores tratan de explicar la agrupación de los fenómenos del sueño en dos fases distintas, REM y NREM, pero no explican por qué los ojos se mueven en la fase REM. La localización de la actividad del sueño durante las fases NREM está en la parte basal del cerebro anterior, delante del hipotálamo, mientras que en las fases NREM se localiza principalmente en el pons Varolii y zona adyacente del cerebro medio.
Veamos algo sobre el sistema nervioso ocular y la motilidad ocular extrínseca. La formación reticular es una parte del cerebro localizada aproximadamente en el pons Varolii (fig. 4). Filogenéticamente es una de las partes más antiguas del cerebro, que está involucrada en acciones estereotípicas autorrítmicas, tales como la respiración, el caminar, la masticación y el comer, los movimientos oculares saccádicos, el orinar, el defecar, la actividad sexual, el ciclo dormir-despertar, los cambios REM/NREM, y otras muchas funciones automáticas o semiautomáticas. El término «formación reticular» es un vestigio etimológico del siglo XIX, cuando se creía que la histología del sistema nervioso central era una red continua de axones y cuerpos celulares. Este concepto desapareció con la «doctrina de la neurona» de Ramón y Cajal que demostró que las neuronas son células independientes que contactan entre sí mediante axones y dendritas, lo que le valió el Premio Nobel 1906 (44).
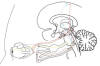
Fig. 4: Esquema de la disposición de los centros del sistema
nervioso central relacionados con el sueño REM y la secreción lacrimal. Las
terminaciones sensoriales del trigémino en la superficie ocular recogen la
sensación de sequedad y tal vez de hipoxia e hiperosmolaridad, e informan al
núcleo sensorial trigeminal del puente de Varolio (en amarillo). Este núcleo
envía eferencias a los núcleos reticulares troncoencefálicos (en azul) y al
tálamo óptico (en celeste). El tálamo óptico envía información al córtex
cerebral y al hipotálamo (en celeste). El córtex cerebral envía eferencias
descendentes a los núcleos lentiforme y caudado del cuerpo estriado (en rojo).
El cuerpo estriado da a su vez eferencias descendentes a los tubérculos
cuadrigéminos anteriores, y a los núcleos del tercer, cuarto y sexto par (en
rojo). Los núcleos oculomotores, a través de sus respectivos nervios (en rojo),
producen los movimientos oculares rápidos (REM), y aumentan el frote de la
superficie ocular anterior con la superficie posterior de los párpados. Esto
aumenta la estimulación sensorial del núcleo trigeminal, que a través de su
conexión con el hipotálamo (en celeste), estimula núcleos hipotalámicos (en
celeste), que a su vez, envían eferencias descendentes al núcleo lacrimatorio
(en violeta). El núcleo lacrimatorio, a través del nervio facial, petroso
superficial mayor, vidiano, ganglio esfenopalatino, orbito-zigomático trigeminal
y nervio lacrimal, aumenta la secreción lacrimal.
Hoy día, cuanto mejor conocemos la histología y fisiología de la impropiamente llamada «formación reticular», mejor conocemos la actividad de sus neuronas y sus conexiones en las funciones automatizadas de los animales.
Cada globo ocular se mueve por la acción de músculos extraoculares —6 en el humano— inervados por tres nervios craneales: el III par para los músculos recto medial, recto superior, recto inferior y oblicuo inferior; el IV par para el oblicuo superior; y el VI par para el recto lateral. Para mover simultánea y conjugadamente ambos ojos, los núcleos de los citados nervios están coordinados por tres centros que asocian y co-relacionan su activación para respectivamente los desplazamientos de la mirada verticales, horizontales y de convergencia. Estos núcleos están distribuidos en los centros pontinos, en los colículos superiores, y en las regiones tectal y pretectal, y están relacionados con los centros vestibulares, los centros motores de párpados, cuello y cuerpo. La formación reticular relacionada con el sueño tiene un sistema de activación descendente conectado al cerebelo y nervios sensitivos, y un sistema de activación ascendente conectado al hipotálamo, tálamo y córtex.
En las fases de sueño REM hay momentos en que se activa rítmicamente el sistema de la musculatura ocular extrínseca, y los ojos se mueven simultáneamente durante un rato con cadencias variables. Estos movimientos REM se generan en los núcleos pontinos superiores intermediarios de la formación reticular y en el córtex y cuerpo geniculado, los cuales se proyectan a los núcleos conjugados oculomotores, al colículo superior, y suelen estar asociados con ondas PGO (pons, corpus geniculatum, cortex occipitalis).
¿COMO ES LA SECRECIÓN LACRIMAL DURANTE EL SUEÑO?
Cantidad de producción lacrimal en vigilia con ojos cerrados
Cuando los mamíferos están despiertos pero mantienen los ojos conniventes (del latín connivere, cerrar los ojos), con los párpados cerrados, producen una cantidad de secreción lacrimal basal que según unos autores es cuantitativamente igual a cuando tienen los ojos abiertos. Así, Mizukawa (1971) (35), usando un test de dilución de isótopos en humanos y en conejos, determinó que la producción lacrimal es aproximadamente la misma cuando los ojos están abiertos que cuando están cerrados. Y Lamberts et al (1980) (24) observaron con el test de Schirmer-Jones (ie, Schirmer I con anestesia tópica) lo mismo en humanos. Pero otros autores encuentran que la secreción lacrimal basal es más baja con los ojos cerrados que con ellos abiertos, y así Maruyama (1974) (31) determinó en conejos que cuando tienen los ojos abiertos producen 42,9 µl/hora de lágrima, y cuando están cerrados la reducen a la cuarta parte (11.7 µl/hora).
Cantidad de producción lacrimal durante el sueño
Cuando los ojos están cerrados durante el sueño, Schirmer (1903) (48) escribió que el ojo normal no produce lágrima, basando su afirmación en el hecho de que los pacientes sin saco lacrimal (la dacriocistectomía era la cirugía más frecuente en aquellos tiempos para tratar la rija) no acumulan lágrima en el lacus lacrimalis cuando duermen. Szmyt (1958) (53) encontró que durante el sueño hay secreción lacrimal , aunque muy reducida. Chodan et al (1975) (5) aplicaron una variedad del test de Schirmer a 30 niños normales, y encontraron que la humectación de la tira de papel absorbente era la misma despiertos que dormidos, y supusieron que como durante el sueño no hay evaporación , la secreción lacrimal es menor, pero existe (Chodan et al. 1975). Murube (1980) (37) encontró con el mismo test de Chodan, ejecutado en niños de 1 a 10 años que la humectación de la tira oscilaba entre 1 y 8 mm, deduciendo que la secreción lacrimal somnil es pobre, y no continua sino intermitente (p. 408), y señaló (pp. 380, 634) que durante el sueño, la secreción lacrimal es muy baja o falta, y que es posible que sólo exista durante las fases REM.
En una reciente publicación (40,41) parece confirmarse esto. En humidimetrías asociadas a polisomnografía encontraron que las fases de REM se asocian a un aumento de la humedad en el espacio entre las gafas y los ojos. Este aumento es variable de unos casos a otros dependiendo de que las gafas estén más o menos ajustadas a la piel periocular y permita un mayor o menor flujo de aire del exterior. Cuando esto ocurre, es fácilmente detectable, pues también baja o sube la temperatura del espacio entre las gafas y los ojos, que suele ser de aproximadamente 33º, y que cuando hay mucho flujo de aire se acerca a la temperatura ambiental que suele ser de 23ºC.
Al despertar, los humanos frecuentemente frotan sus ojos cerrados. Es posible que ello se haga inconscientemente para estimular la secreción lacrimal.
Cualidad de producción lacrimal durante el sueño
Durante el sueño la lágrima es hipoosmolar e hipóxica en relación con la de la vigilia. Lo primero se debe a que disminuye la evaporación, y lo segundo a que disminuye el contacto con la atmósfera.
La hipoosmalidad ha sido comprobada frecuentemente (39). Así, Terry et al 1977 (54) determinaron que durante la vigilia la osmolaridad lacrimal es de 310 mOsm/l, equivalente a una solución acuosa de NaCl 9,7%º, pero que durante el sueño es de 285 mOsm/l, equivalente a una solución cloruradosódica al del 8,9%º. Así, la lágrima somnil ejerce una presión osmótica considerablemente más baja que la vigil (55).
La hipoxia se debe al aislamiento del mar lacrimal. Así, de acuerdo con Terry y Hill (1978) (55), cuando los párpados llevan largo tiempo cerrados la disponibilidad de oxígeno de la superficie ocular es muy baja, y necesita una glicolisis anaeróbica substitutiva.
La secreción lípida de las glándulas de Meibomio y de Zeis, y la mucínica también están disminuidas (37).
Cambios de la córnea durante el sueño
Von Bahr (1956,1962) (58,59) publicó que el espesor corneal no tiene variación entre los períodos de vigilia y de sueño. Otros investigadores no piensan así, pues encuentran que la córnea se engruesa durante el sueño, lo que unos han imputado a la hipoosmolaridad de la lágrima somnil, otros a la falta de oxígeno, y otros a la combinación de ambos factores (28,55).
Mandell et al (1965) (28) observaron en un humano que la córnea al despertar era 3,6% más gruesa que una hora después de tener los ojos abiertos con parpadeo normal. Y esto fue interpretado por Terry y Hill (55) como que la reducida evaporación durante el sueño disminuye la osmolaridad lacrimal y produce un ligero edema corneal.
Mishima et al (1961) (34) publicaron que incluso durante el tiempo vigil, cuando los ojos de los conejos se mantienen largo tiempo cerrados para evitar la evaporación, el espesor corneal aumenta; que cuando se les deja con su parpadeo habitual, el espesor disminuye un 4%; y que cuando de nuevo se les cierran los párpados durante 30 minutos, vuelve a engrosar.
NUESTRA TEORÍA SOBRE LAS FASES REM Y LA PRODUCCIÓN DE LÁGRIMA
En la revisión de la literatura científica no hemos encontrado explicación a los movimientos oculares durante las fases REM del sueño. Nosotros sugerimos en 1980 (37) que los movimientos REM somniles pueden servir para estimular la secreción lacrimal y corregir la hiposecreción lacrimal nocturna.
La humidimetría preocular viene empleándose desde antiguo para determinar la evaporación de la lágrima surfocular (13,45-47,57). La evaporación se produce incluso en connivencia a través de la hendidura interpalpebral y en lacus lacrimalis, facilitado ello por la parcial exposición y las pequeñas contracciones clónicas palpebrales.
Recientemente (40,41) hemos hecho humidimetría preocular en 8 sujetos a los que se practicaba polisomnografía, y a los que durante la prueba se les añadieron gafas semiherméticas, colocándose un sensor de humidimetría entre las gafas y los ojos (fig. 5). Encontramos que la humedad del espacio preocular aumentaba durante las fases de sueño REM y decrecía poco después de dejar los ojos de moverse (fig. 6). La humedad relativa bajo las gafas subió de una media de 68% antes del sueño REM, a una media de 81% unos minutos tras empezar la fase REM. La evidencia de la escasa secreción somnil durante el sueño, y del aumento de la secreción durante las fases REM nos sugiere que los episodios intermitentes de sueño REM tienen por finalidad provocar una actividad y frote ocular con la finalidad de humidificar la superficie ocular.

Fig. 5: Polisomnografía y humidimetría preocular. A.
Humidímetro modelo TestoStor-171-1. B. Detalle del sensor del humidímetro fijado
a la cara posterior de unas gafas semicerradas C. Colocación del humidimetro y
de los electrodos durante una polisomnografía.

Fig. 6: Humidimetría en un paciente dormido entre 11 pm y 6:30
am. Abajo, el tiempo, marcado a las 12 pm y 4 am, señalando los 3 períodos de
sueño REM tomados por polisomnografía. A la izquierda, en rojo temperatura
ambiental y en azul temperatura tras las gafas. A la derecha, en verde, humedad
relativa tras las gafas. La humedad relativa en las fases NREM es de
aproximadamente 38%, pero en las tres fases de sueño REM ocurridas la humedad
relativa subió a 53%, 78% y 52%.
Un complemento a la hipótesis de que los movimientos oculares durante el sueño sirven para producir y extender la lágrima sobre la superficie ocular, es la de que la córnea no tienen sus propias células linfoides del sistema MALT (Mucosal Associated Lymphoyd Tissue) como lo tiene la conjuntiva, (20,22,42), de forma que durante el sueño queda aislada del sistema de detección de antígenos microbianos, citokinas inflamatorias, etc. (22f), y los movimientos oculares pueden servir además para extender la lágrima precorneal a la película preconjuntival.
NUESTRA HIPÓTESIS SOBRE LAS FASES REM Y LOS ENSUEÑOS
Otra asociación de los movimientos REM que ocasionalmente pueden estar en relación con otros fenómenos somniles son los ensueños. La motilidad ocular se ha desarrollado para dirigir los ojos cuando se está despierto hacia los objetos, y fijarlos y seguirlos, e iniciar el complejo proceso de enfocar su imagen en la retina, y de computarizar su transmisión de la retina a los cuerpos geniculados laterales y al área visual del córtex occipital, desde donde esta sensación será asociada a otras áreas, correlacionándola con otras percepciones simultáneas o memorizadas de experiencias anteriores asociadas a relaciones sociales, escritura, lectura, engramas fónicos, interpretándola, estimulando asociaciones con pasadas experiencias, añadiéndole un contenido emocional, e integrándola en un complejo episodio de percepción que ha sido iniciado por un simple movimiento ocular.
Valga la sugerencia de que es posible que cuando los ojos se mueven en las fases REM para humidificar la superficie ocular, indirectamente desencadenan un fenómeno de actividad cerebral asociada a la visión, produciendo ensueños. Incluso puede ser que el impulso que inicia este proceso no sean los movimientos oculares extrínsecos, sino que se inicia cuando los núcleos conjugados pontinos y parapontinos de los músculos oculares empiezan a ser activados por la sequedad ocular, contribuyendo a la imaginería visual del onirismo.
BIBLIOGRAFÍA
Aserinsky E, Kleitman N. Regularly occurring periods of eye motility, and concomitant phenomena, during sleep. Science 1953; 118: 273-274.
Berger H. Ueber das Elektroenkephalogramm des Menshen. Arch f. Psych u. Nervenkrankheiten 1929; 87: 527-570.
Berger RJ. Tonus of extrinsic laryngeal muscles during sleep and dreaming. Science 1961; 134: 840 (Abstract).
Cantero JL, Atienza M, Salas RM, Gómez CM. Alpha power modulation during periods with rapid oculomotor activity in human REM sleep. NeuroReport 1999; 10: 1817-1820.
Chodan BS, Sharma JL, Singh M, Sarwal VKl. Lacrimation during sleep: a clinical study on thirty children. Philip J Ophthalmol 1975; 7: 61-63.
de Andrés I, Garzón M, Vilablanca JR. The disconnected brain stem does not support rapid eye movement sleep rebound following selective deprivation. Sleep 2003; 26: 419-425.
Dement WC, Kleitman N. Cyclic variations in EEG during sleep and their relation to eye movements, body motility, and dreaming. Electroencephalog Clin Neurophysiol 1957; 9: 673-690.
Dement W. The occurrence of low voltage, fast electroencephalogram patterns during behavioural sleep in the cat. Electroencephalog Clin Neurophysiol 1958; 10: 291-296.
Fosse R, Stickgold R, Hobson JA. The mind in REM sleep: reports of emotionasl experience. Sleep 2001; 24: 947-954.
Freud S. Die Traumdeutung (The interpretation of dreams). 1900. Translated by Brill AA. New York: Random House. 1913.
Gagnon JF, Postuma RB, Montplaisir J. Update on the pharmacology of REM sleep behavior disorder. Neurology 2006; 67: 742-747.
Gastaut H, Tassinari CA, Duron B. Etude polygraphique des manifestations épisodiques (hypniques et respiratoires) diurnes et nocturnes du Syndrome de Pickwick. Rev Neurol 1965; 112: 573-579.
Hamano H, Hori M, Mitsunaga S. Application of an evaporimeter to the field of ophthalmology. J Jap Contact Lens Soc 1980; 22: 101-107.
Hong CC, Gillin JC Dow BM, et al. Localized and lateralized cerebral glucose metabolism associated with eye movements during REM sleep and wakefulness: a positron emission tomography (PET) study. Sleep 1995; 18: 570-580.
Hong CC, Jin Y, Potkin SG, et al. Language in dreaming and regional EEG alpha power. Sleep 1996; 19: 232-235.
Hong CC, Potkin SG, Antrobus JS, et al. REM sleep eye movement counts correlate with visual imagery in dreaming: a pilot study. Psychophysiology 1997; 34: 377-381.
Jouvet M, Michel F, Courjon J. Sur un stade d’activité électrique cérébral rapide au cours du somneil physiologique. C R Soc Biol (Paris) 1959; 153: 1024-1028.
Karacan I. The developmental aspect and the effect of certain clinical conditions upon penile erection during sleep. Excerpta Med 1966; 150: 2356-2359.
Kaufman L, Schwartz B, Salustri C, Williamson SJ. Modulation of spontaneoius brain activity during mental imagery. J Cogn Neurosci 1990; 2: 124-132.
Kessing SV. A quantitative normal anatomical study. Acta Ophthalmologica (Copenh) 1968; suppl 95: 1-133.
Kleitman, N. Sleep and Wakefulness. Chicago: University of Chicago Press, 1963.
Knop E, Knop N. Influence of the eye-associated lymphoid tissue (EALT) on inflammatory ocular surface disease. Ocular Surface 2005; 3 (4) Suppl: S-180-186.
Kremmer S, Niederdräing N, Ayertey HD, et al. Obstructive sleep apnea syndrome, normal tension glaucoma, and nCPAP therapy-A short note. Sleep 2003; 26: 161-162.
Lamberts DW, Perry HD, Holly FJ. Schirmer testing with eyes open and closed/Comparaison entre les tests de Schirmer pratiqués paupières ouvertes at paupières fermées. Contactologia (Stuttgart) 1980; 2: 115-117.
LeDoux JE. Emotion circuits in the brain. Annu Rev Neurosci 2000; 23: 155-184.
Leske MC, Podgor MJ. Intraocular pressure, cardiovascular risk variables, and visual field defects. Am J Epidemiol 1983; 118: 280-7287.
Loomis AL, Harvey EN, Hobart GA. Electrical potentials of the human brain. J Exp Psychol 1936; 19: 249-279.
Mandell RB, Fatt I. Thinning of the human cornea on awakening. Nature 1965; 208: 292-293.
Maquet P, Degueldre C, Delfiore G, et al. Functional neuroanatomy of human slow wave sleep. J Neurosci 1997; 17: 2807-2812.
Marks GA, et al. A functional role for REM sleep in brain maturation. Behav Brain Res 1995; 69: 1-11. Maquet P, Franck G. REM sleep and the amygdala. Molecu Psychiaty 1997; 2: 195-196.
Maruyama S. Study on the secretory mechanisms of tear in rabbits. Folia Ophthalmol Japon (Nippon Ganka Kiyo) 1974; 25: 918-921.
Merrit JM, Stickgold R, Pace-Schott E, et al. Emotion profiles in the dreams of men and women. Conciousness and Cogn. 1994; 3: 46-60 (In Japanese).
Mirmiran M, Scholtens J, van de Poll N, Uylings H, et al. Effects of experimental suppression of active (REM) sleep during early development upon adult brain and behavior in the rat. Brain Res 1983; 283: 277-86.
Mishima S, Maurice DM. The oily layer of the tearfilm and evaporation from the corneal surface. Exp Eye Res 1961; 1: 39-45.
Mizukawa T. Physiology of tears. Acta Societatis Ophthalmologicae Japonicae (Nichigan). Tokyo 1971; 75: 1953-1973.
Mojon DS, Mathis J, Zulauf M, et al. Optic neuropathy associated with sleep apnea syndrome. Ophthalmology 1998; 105: 874-877.
Murube del Castillo, J. Dacryología Basica. Madrid: Soc Españ Oftalmol, 1980; pp. 380, 408, 634.
Murube J, Murube E. Near vision accommodation in horizontality with VDT: Why low blinking and dry eye? Advanc Exper Med Biol 2002; 506: 1205-1211.
Murube J. Tear Osmolarity. The Ocular Surface 2006; 4: 11-20.
Murube J, Carbonell J. Sueño REM y oftalmología. In:Muñoz Negrete F, Rebolleda G: V Curso de Actualización en Neuro-Oftalmología. Hospital Ramón y Cajal. Madrid, 23-24 Febrero 2007.
Murube J, Carbonell J. REM sleep and tear secretion. A hypothesis. Abstracts book de la Conferencia Internacional de la Tear Film and Ocular Surface Society. Taormina (Sicilia). 5-8 Septiembre 2007. página 87.
Osterlind G. An investigation into the presence of lymphatic tissue in the human conjunctiva, and its biological and clinical importance. Acta Ophthalmologica (Copenh) 1944; Suppl 23: 1-79.342.
Piéron H. Le problème physiologique du sommeil. Paris: Ed. Masson. 1913
Ramon y Cajal S. El nuevo concepto de la histología de los centros nerviosos. Rev Ciencias Médicas. Barcelona, 1892, 18: 457-476.
Rolando M. Refojo MF. Tear evaporimeter for measuring water evaporation rate from tear film under controlled condition in humans. Exp Eye Res 1983; 36: 25-32.
Rolando M, Refojo MF, Kenyon KR . Increased tear evaporation in eyes with keratoconjunctivitis sicca. Arch Ophthalmol 1983; 101: 557-558.
Rolando M, Refojo MF, Kenyon KR. Tear water evaporation and eye surface diseases Ophthalmologica 1985; 190: 147-149.
Schirmer O. Studien zur Physiologie und Pathologie der Tränenabsonderung und Tränenabfuhr. Graefe’s Archiv Ophthalmol 1903; 54: 197-291.
Schupp HT, Lutzenberger W, Birbaumer N, et al. Neurophysiological differences between perception and imagery. Cogn Brain Res 1994; 2: 77-86.
Shepherd GM. Neurobiology. New York: Oxford University Press. 1983.
Shiromani PJ, Gillin JC, Henriksen SJ. Acetylcholine and the regulation of REM sleep: Basic mechanisms and clinical implications for affective illness and narcolepsy. Ann Rev Pharmacol Toxicol 1987; 27: 137-156.
Solms M. Dreaming and REM sleep are controlled by different brain mechanisms. Behavioral and Brain Sciences 2000; 23: 793-1121.
Szmyt J. Lacrimation tests (en polaco). Klin Oczna 1958; 28: 195-201.
Terry JE, Hill RM. Osmotic adaptation to rigid contact lenses. Arch Ophtalmol (Paris) 1977; 37: 785-788.
Terry JE, Hill RM. Human tear osmotic pressure. Diurnal variations and the closed eye. Arch Ophthalmol (Chicago) 1978; 96: 120-122.
Tielsch JM, Katz J, Sommer A, et al. Hypertension, perfusion pressure and primary open angle glaucoma. Arch Ophthalmol 1995; 113: 216-221.
Tomlinson A, Canal S. Assessment of tear film dynamics: Quantification approasch. The Ocular Surface 2005; 3: 81-95.
von Bahr G. Corneal thickness. Its measurement and changes. Am J Ophthalmol 1956; 42: 251-263.
von Bahr G. The corneal thickness during perfusion of the anterior chamber with solutions of various tonicity. Doc Ophthalmol 1962; 16: 3-10.
Wahlen PJ. Fear, vigilance, and ambiguity: initial neuroimaging studies of the human amygdale. Curr Dirct Psycholog Sci 1998; 7: 177-188.
Walsh JT, Montplaisir J. Familial glaucoma with sleep apnoea: a new syndrome? Thorax 1982; 37: 845-849.
Zhang J. Continual-activation theory of dreaming. Dinamical Psychology. 2005. Rescatado el 13-marzo-2006.