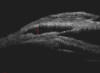
Fig. 1. Imagen de BMU. Lago intraescleral anecoico (altura determinada por la línea roja), membrana trabeculodescemética (grosor delimitado por la línea corta).
REVISIÓN ACTUALIZADA
MUÑOZ-NEGRETE FJ1, REBOLLEDA G2, CASAS-LLERA P3, CABREJAS L4
1 Jefe
Servicio de Oftalmología. Hospital Ramón y Cajal. Profesor Titular Universidad
de Alcalá. Madrid.
2 Doctora
en Medicina. Responsable Unidad Glaucoma y Neuro-Oftalmología. Hospital Ramón y
Cajal. Profesor Asociado Universidad de Alcalá. Madrid.
3
Licenciada en Medicina. Residente de Oftalmología 2.º año. Hospital Ramón y
Cajal. Madrid.
4
Licenciada en Medicina. Residente de Oftalmología 3.er año. Hospital
Ramón y Cajal. Madrid.
INTRODUCCIÓN
Aunque la trabeculectomía continúa siendo la cirugía filtrante del glaucoma más popular, su tasa de complicaciones intra y postoperatorias ha llevado a la búsqueda de cirugías más seguras, como las técnicas de cirugía no perforante. El primer antecedente de la misma fue la sinusotomía de Krasnov, en la que el canal de Schlemm era destechado y la conjuntiva era suturada sobre el canal exteriorizado (1). A partir de ella surgieron diversas modalidades como la viscocanalostomía, en la que se favorece la salida de humor acuoso a través del canal de Schlemm. En la presente revisión vamos a referirnos únicamente a la esclerectomía profunda no perforante (EPNP), en la que la filtración se produce a través de una delicada membrana trabeculodescemética (MTD) (2).
TÉCNICA QUIRÚRGICA
La técnica habitual en la esclerectomía profunda no perforante consiste en la disección de un tapete escleral superficial de 1/3-1/2 de espesor y unas dimensiones de unos 5 x 5 mm (en función del tamaño del implante intraescleral utilizado) que se diseca avanzando 1-1,5 mm en córnea clara. Posteriormente se diseca un segundo tapete profundo de forma y tamaño variable y de 90% de espesor, de modo que podamos visualizar por transparencia la coroides subyacente. Hemos objetivado que cuanto mayor es el volumen y peso del tapete profundo resecado mejor es el resultado tensional (3). Si el plano de disección de este tapete es correcto, nos permitirá la entrada directa al canal de Schlemm, que es así destechado. Una vez dentro del canal, la membrana de Descemet se diseca fácilmente del estroma corneal suprayacente a medida que liberamos la tracción mediante cortes radiales, exponiéndose lo que denominamos membrana trabeculodescemética. Es conveniente obtener una membrana amplia, para lo que es útil realizar cortes radiales en los extremos laterales del tapete escleral profundo. Posteriormente, este tapete profundo es resecado. Para evitar que el tejido escleral remanente oculte parte de la membrana, es útil hacer un surco en la cara posterior del tapete profundo lo más próximo a la MTD antes de resecarlo con tijera de Vannas (2-5).
El siguiente paso es la realización de la trabeculectomía ab externo (resección o pelado del trabeculum yuxtacanalicular), que suele determinar un incremento súbito de la filtración de humor acuoso.
Dado que la tendencia natural es a la cicatrización del tapete escleral con el tejido subyacente, el uso de espaciadores o implantes puede permitir que este espacio permanezca patente más tiempo. Kozlov fue el primero en sugerir su utilización (6). Estudios de biomicroscopía ultrasónica (BMU) sugieren que el humor acuoso filtra a través de la MTD a un área bajo el tapete escleral superficial, que se denomina lago intraescleral, cuyo mantenimiento es fundamental para reducir la presión ocular (PIO) (fig. 1). El uso de implantes puede permitir que este espacio permanezca patente más tiempo, manteniéndose así el efecto hipotensor de la cirugía filtrante y retardando la necesidad de realización de goniopunción en el postoperatorio (fig. 2) (7). En sentido opuesto, se ha sugerido que la reducción progresiva del lago intraescleral podría producir un aumento de PIO, aunque no se ha encontrado una buena correlación entre el volumen del espacio intraescleral, medido con BMU y el nivel de PIO) (2).

Fig. 1. Imagen de BMU. Lago intraescleral anecoico (altura determinada por la
línea roja), membrana trabeculodescemética (grosor delimitado por la línea
corta).
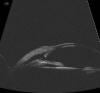
Fig. 2. Imagen de BMU. Rotura de la membrana trabeculodescemética secundaria a
goniopunción.
Sin embargo, también se ha observado la presencia de lago intraescleral hasta 2 años tras EPNP sin implante en un porcentaje elevado de casos (8). Por otro lado, una pequeña serie retrospectiva encontró que la cirugía combinada (EPNP y facoemulsificación) sin implante, en pacientes sin factores de riesgo de fracaso, producía una reducción estadísticamente significativa de la PIO (7,4 mm Hg) y de los fármacos antiglaucomatosos (de 1,93 a 0,13) al año de seguimiento. Sin embargo, la ausencia de grupo control impide conocer su eficacia relativa respecto al uso de antimetabolitos y/o implantes (9).
IMPLANTES EN CIRUGÍA NO PERFORANTE
Existen múltiples materiales tanto reabsorbibles como permanentes que se han postulado como posibles implantes para la cirugía no perforante. Dado el incremento de coste asociado, algunos autores han evaluado alternativas más económicas. Igualmente se ha sugerido el uso de antimetabolitos en sustitución o como complemento al uso de implantes (tabla 1). No existen estudios bien diseñados que nos permitan establecer con seguridad la superioridad de ninguno de los implantes comercializados.

Implantes reabsorbibles
Colágeno porcino (Aquaflow®)
Características generales
El primer implante utilizado con éxito en la EPNP fue diseñado por Kozlov en 1990. Se fabrica a partir de colágeno porcino (Aquaflow®, Staar Surgical AG), que es tratado en varias etapas para garantizar su neutralidad biológica y evitar la producción de reacciones inflamatorias. La esterilidad se consigue con irradiación gamma. Tiene forma de cilindro, que en estado deshidratado mide aproximadamente 0,5 x 4 mm (10). Una vez en contacto con el humor acuoso, se hidrata y aumenta de tamaño 2 veces respecto al estado seco, por lo que también ha recibido la denominación de «esponja de colágeno» (fig. 3).
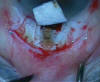
Fig. 3. Implante de colágeno porcino (Aquaflow®).
Se coloca de forma que el extremo anterior apoye sobre la MTD. Se sutura con un punto de nylon 10-0 en el tejido epicoroideo que queda tras resecar el colgajo profundo, 1-2 mm posterior al canal de Schlemm, quedando el extremo posterior haciendo relieve bajo el tapete escleral superficial suprayacente y en ocasiones incluso sobresaliendo por detrás del mismo (fig. 1).
Por acción de las colagenasas y metaloproteinasas del humor acuoso, es digerido progresivamente, disolviéndose entre 6-9 meses tras la cirugía. Este tiempo es suficientemente prolongado para que hayan finalizado los mecanismos habituales de cicatrización, creándose un canal de salida poroso a través del espacio intraescleral y del espacio subconjuntival (10).
Mediante biomicroscopía ultrasónica se observa filtración subconjuntival, con una MTD delgada no perforada y un área hipoecoica supracoroidea posterior a la esclerectomía en el 27% de los casos. Se aprecia como el implante se disuelve lentamente en 6-9 meses dejando un túnel intraescleral (11).
Se está investigando modificar la forma de este implante. Así se ha diseñado su transformación en forma plana cuadrada 4 x 4 mm. En los modelos experimentales iniciales tiene una eficacia comparable al modelo cilíndrico. Presenta una serie de ventajas teóricas sobre la forma cilíndrica, como es el no precisar sutura y reducir el riesgo de perforación de la MTD por el extremo anterior del cilindro, que en algunos casos podría tensar la MTD, romperla y provocar una salida brusca de humor acuoso (10). Debido a su forma podría también ser utilizado para taponar roturas de la MTD. Como inconveniente potencial destaca su reabsorción más rápida (10,12).
Resultados
En todos los estudios practicados se observa que el uso de este implante determina una mayor reducción de PIO y del número de fármacos antiglaucomatosos tanto a corto como a medio y largo plazo. En la tabla 2 se resumen los resultados de los estudios más relevantes.

El estudio más prolongado (seguimiento de 8 años) con EPNP e implante de colágeno encuentra una tasa de éxito completo de 57% y de éxito parcial de 91%. Un 50% de pacientes presentaban una PIO final igual o menor de 15 mm Hg sin medicación. El número medio de fármacos antiglaucomatosos se redujo de 2,3 ± 0,7 a 0,5 ± 0,7. Para ello se precisó utilizar goniopunción con láser Nd:YAG en el 51% de los casos e inyecciones subconjuntivales de 5-FU en el 23% de los pacientes. No se observaron complicaciones significativas (13).
Ácido hialurónico reticulado (SK gel®)
Características generales
Sourdille et al desarrollaron un implante de ácido hialurónico reticulado biosintético que se moldea en forma de triángulo equilatero de 3,5 ó 4,5 mm de lado (SK gel®, Corneal Laboratoires, Paris, Francia) (10,14). Este implante se coloca bajo el tapete escleral sobre el lecho escleral profundo, sin necesidad de ser suturado (fig. 4) (10).

Fig. 4. Implante de ácido hialurónico reticulado (SK-gel®).
El ácido hialurónico es un glicosaminoglicano producido por la matriz extracelular. Al ser de origen natural, no inmunogénico se integra en los ciclos fisiológicos de eliminación. Debido a su estructura entrecruzada («cross-linking»), el hialuronato sódico se degrada muy lentamente, por lo que la reacción inflamatoria inducida es mínima (15). En un estudio histológico realizado en conejos se observa que la cápsula fibrosa que induce es más fina que la que producen otros materiales no reabsorbibles. Aunque teóricamente es reabsorbible, hemos encontrado el implante íntegro envuelto en una cápsula fibrosa en reintervenciones realizadas hasta dos años tras la inserción del implante (15).
En BMU el implante de SK-gel es hipoecoico. Marchini et al en un estudio en 30 pacientes encuentran ampolla filtrante visible con BMU en el 60% de los casos y que la presencia simultánea de hipoecogenicidad supraciliar, hipoecogenicidad escleral y ampolla filtrante se correlacionaba estadísticamente con un mayor éxito quirúrgico (fig. 5) (16).
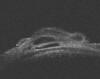
Fig. 5. Imagen BMU (proyección transversal). EPNP con implante SK-gel® 1 mes
tras la cirugía. Hipoecogeneidad escleral, supraciliar y con ampolla de
filtración. Excelente control tensional.
También hemos observado por gonioscopia, la aparición de vasos en el lecho intraescleral, cuya formación no es específica de este implante. La presencia de estos vasos no parece modificar el resultado tensional (17), aunque sí pueden determinar la aparición de microhifemas recurrentes (18).
Resultados
El implante de ácido hialurónico reticulado ha demostrado ser eficaz tanto en cirugía no perforante aislada como combinada con facoemulsificación (4,5). Así, Schwenn et al estudia 22 ojos de 22 pacientes a los que aleatoriamente se les realiza EPNP con implante de SK-gel o trabeculectomía, utilizando en ambos procedimientos MMC. Obtienen una reducción de 11,5 mm Hg (47%) un año después de EPNP asociada a implante de SK-gel® y mitomicina C frente a una reducción de 11 mm Hg (57%) en ojos sometidos a trabeculectomía con aplicación de MMC (19).
Su uso en cirugía combinada de glaucoma y catarata es eficaz, aunque no existen estudios comparativos sin implante (5).
Las complicaciones con el uso de este implante son escasas. Se ha referido migración del implante en cámara anterior en casos con rotura amplia de la MTD. La exposición parcial del mismo en los bordes del tapete escleral superficial es bien tolerada (fig. 6). También se ha descrito una caso de exposición externa a través de una dehiscencia conjuntival que fue repuesto con hemosteta y no planteo problemas tras el sellado progresivo de la conjuntiva en el limbo sin necesidad de sutura (20).
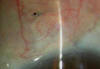
Fig. 6. Exposición parcial de implante de SK-gel® en los bordes laterales del
implante sin reacción inflamatoria asociada.
Esclera autóloga
Se ha sugerido el uso como implante del tapete escleral profundo extirpado durante la EPNP, que es recortado hasta alcanzar unas dimensiones de 4 x 1 mm. Este implante se sutura bajo el tapete superficial con nylon monofilamento 10/0, dejando que el extremo superior del mismo sobresalga del borde posterior horizontal del tapete superficial.
Resultados y complicaciones
Aunque la idea es ingeniosa y económica, este injerto de esclera autóloga induce una fibrosis precoz, como se demuestra por la elevada tasa de goniopunción (45-50%) (21,22). Devlo precisa realizar más goniopunciones en EPNP con implante de esclera autóloga (50%) que sin implante (30%) (22). Además la goniopunción es necesaria más precozmente, hacia el tercer mes de la cirugía (media 14 semanas), en comparación con el implante de colágeno (media 12 meses) (21). En cuanto a los resultados tensionales, son equiparables a la EPNP sin implante (dejando en ambos casos viscoelástico de alta densidad bajo el tapete escleral al final de la cirugía) (22).
Como conclusión, podríamos decir que el implante de esclera autóloga puede favorecer la fibrosis precoz y no ofrece ninguna ventaja respecto a no usar implante.
Membrana amniótica
Ye et al realizan EPNP con implante de membrana amniótica (6 mm x 9 mm) bajo el tapete escleral superficial. Dado que lo combinan con el uso simultáneo de mitomicina C (0,04%), no es posible conocer el papel de la membrana amniótica de forma aislada. En un pequeño estudio no comparativo de 23 ojos de 14 pacientes encuentran una tasa de éxito completa del 100% el primer mes tras la cirugía, que se va reduciendo progresivamente en el tiempo hasta llegar a un 66,7% al año. No encontraron complicaciones significativas (23).
Catgut crómico
Se ha sugerido el uso como implante de un trozo de 2 mm de catgut crómico suturado al lecho escleral profundo. En estado seco tiene unas medidas de 0,5 mm x 0,5 mm x 3 mm. Una vez hidratado se expande. Al estar cromado, su absorción se enlentece (24,25).
Sus ventajas potenciales residen en su bajo coste y en poder ser utilizado en pacientes con objeciones religiosas al uso de productos de origen porcino, como el implante de colágeno porcino.
Resultados y complicaciones
Wevill refiere buen control tensional, sin embargo la metodología del estudio presenta problemas importantes. En primer lugar, el estudio no es comparativo y utiliza 23 ojos de 16 pacientes. Por otro lado, refieren una elevada tasa de perforación de la MTD (30%). Los mismos autores reconocen su inexperiencia en cirugía no perforante y su carencia de instrumental quirúrgico específico. Esto hace que los resultados sólo pudieran extrapolarse a cirujanos en el inicio de la curva de aprendizaje (24).
En un estudio comparativo retrospectivo, aunque con muestra muy pequeña, Shin et al encuentran mejores resultados con implante de colágeno que con el uso de catgut crómico, lo que atribuyen a las diferentes propiedades bioquímicas y la mayor severidad de la reacción inflamatoria inducida por el catgut crómico (25), que puede ser visualizado bajo la conjuntiva hasta 12 meses tras la cirugía.
Esta intensa reacción inflamatoria determina un espacio intraescleral irregular con marcada fibrosis y formación de granulomas (26). Ello obliga al uso prolongado de esteroides tópicos (5,4 meses de media) (24), lo que supone un serio inconveniente y contrarresta una de las ventajas potenciales de la cirugía no perforante, como es la escasa inflamación inducida que permite un postoperatorio más ágil y rápido.
Además de la intensa reacción inflamatoria inducida, han sido descritas otras complicaciones con el uso de este implante, como hifema (10%), dislocación del implante en un caso y oclusión de vena central de la retina en otro caso (24).
Sutura PDS
El PDS o polímero de dioxanona es una sutura monofilamento sintética reabsorbible en aproximadamente 180 días que puede encontrarse corrientemente en cualquier quirófano. Al ser sintética, provoca una mínima reacción inflamatoria tisular, a diferencia de otras suturas naturales como el catgut, tal como se acaba de referir. Folch-Ramos y Castanera han sugerido el uso de varios fragmentos de PDS 3/0 en el espacio intraescleral asociado al uso de MMC (0,02 mg/ml durante 2 minutos). En una muestra de 8 pacientes, y tras un seguimiento entre 9-16 meses, obtienen una reducción porcentual de PIO de 36,5% y una disminución significativa del uso de fármacos antiglaucomatosos (preoperatorio: 2,5; postoperatorio final: 0,12). Los autores no han observado que las reacciones inflamatorias postoperatorias sean más intensas que en la EPNP convencional.
En un caso se produjo extrusión de uno de los fragmentos al espacio subconjuntival, que tuvo que ser extraido. En BMU el PDS es hiperecogénico y produce una sombra acústica posterior, lo que puede facilitar su identificación.
Los autores propugnan su uso en base también a su bajo coste, dado que la sutura mide 45 cm de largo, lo que permitiría recortarla y usarla en numerosos pacientes (27).
Dado que lo utilizan en combinación con MMC no podemos conocer en qué medida la eficacia hipotensora depende del implante y/o del antimetabolito. Se precisarían mayores muestras con estudios comparativos antes de recomendar su utilización.
Implantes no reabsorbibles
T Flux
Características generales
El implante T Flux® (IOLtech Laboratoires, La Rochelle, Francia) es de material acrílico muy hidrofílico (Poly-Megma). Sus dimensiones son 4 mm de longitud de los brazos anteriores, altura del tronco 3,4 mm, espesor 0,15-0,35 mm. Presenta 2 orificios, uno en el cuerpo del implante para fijarlo a esclera con una sutura y otro anterior, a través del cual puede realizarse la goniopunción
Como mecanismo de acción se postula que crea un espacio interescleral permanente y estimula la formación de nuevas venas acuosas. Tensa la MTD por su gran superficie de contacto, facilitando la goniopunción con láser Nd:YAG, previniendo las hernias de iris (28). Sin embargo, dado que parte del implante yace sobre la MTD, algunos autores sugieren que podría bloquear el paso de humor acuoso a través de la MTD, lo que podría justificar la elevada tasa de goniopunción que se precisa cuando se utiliza este implante (63,6% versus 34% en pacientes en los que se usa healon GV) (28). Parece que cuando la goniopunción se practica sobre el implante es menos efectiva que si se realiza anterior o posterior al mismo.
A diferencia de los implantes reabsorbibles este implante es hiperecogénico en BMU (29).
Existe una técnica de inserción sin sutura ideada por G Muñoz, que realiza un surco detrás del espolón escleral que llega a espacio supracoroideo. La cabeza del implante la sitúa en el espacio supracoroideo a través de este surco. Teóricamente podría favorecer el mecanismo de filtración supracoroideo.
Resultados
No existen estudios bien diseñados. Ates estudia de forma prospectiva 25 ojos de 25 pacientes a los que se le practica EPNP con implante de T-Flux®. Partiendo de una PIO media de 26,26 mm Hg, la PIO final fue de 17,6 mm Hg. Un año tras la cirugía la tasa de éxito completo fue de 56% y de éxito relativo 82,6% (tabla 2). No observaron complicaciones significativas. No hubo diferencias respecto a eficacia ni complicaciones respecto a un grupo similar de pacientes a los que se les intervino de viscocanalostomía (30). Ravinet et al obtuvieron un descenso tensional de 53% en el grupo con implante de T-Flux frente al 48% en los que se utilizó Healon GV, siendo la tasa de goniopunción de 66,6% en el primer grupo y de 36,4% en el segundo, lo que puede explicar parte de las diferencias. Encuentra áreas hipoecoicas en el 59% de los ojos a los 2 años, que no se correlacionan con el resultado tensional (28). Dahan en un estudio no randomizado encuentra que la reducción a medio plazo es similar respecto a no utilizar implante, pero que a largo plazo (30 meses) los pacientes con implante de T-Flux presentan PIO más bajas (31).
Wiermann et al realizó un estudio retrospectivo de 72 pacientes comparando T-flux con SK-Gel con un seguimiento a 12 meses. Concluyen que, tanto en EPNP aislada como en facoesclerectomía, ambos implantes son igual de efectivos obteniendo una reducción media de PIO de 18,4 a 13,1 mm Hg con una reducción de necesidad de medicación de 2,3 a 0,2 fármacos (32).
Implante de HEMA
Julio de la Cámara ha diseñado un implante pentagonal compuesto de un co-polímero de peso molecular ultra alto de 2-Hidroxietilmetacrilato (HEMA) (Esnoper®, AJL Ophthalmics, Alava, España). Al ser un polímero no iónico, muestra escasa tendencia a presentar depósitos de proteínas. Tiene forma pentagonal y presenta un orificio central para ser suturado al lecho escleral dejando el lado más ancho dirigido hacia la MTD sin ocluirla (fig. 7). En BMU se muestra hiperecogénico (fig. 8), a diferencia de los implantes reabsorbibles. Los resultados iniciales parecen prometedores, aunque en el momento presente no disponemos de estudios comparativos (33).
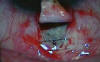
Fig. 7. Implante de HEMA (Esnoper®) suturado a esclera.
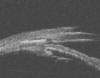
Fig. 8. Imagen BMU. Implante Esnoper®
hiperreflectivo en el lago intraescleral.
Polimetilmetacrilato
Características generales
Recientemente se ha descrito un implante de polimetilmetracrilato (PMMA) en forma de aspa (HOMDEC, SA, Belmont, Suiza) (34) no comercializado en el momento presente. El dispositivo mide 4 x 4 mm y tiene una longitud total de los brazos de 5,4 mm y un espesor de 0,5 mm. Este diseño supuestamente permitiría una máxima patencia del espacio intraescleral impidiendo la obliteración del mismo por la fibrosis del proceso natural de cicatrización. Al mismo tiempo el espacio que queda entre las áreas libres de los brazos actuaría como reservorio de humor acuoso.
Resultados y complicaciones
En un estudio comparativo randomizado comparándolo con el implante de colágeno no observaron diferencias entre ambos implantes en cuanto a tasa de éxito o complicaciones ni en la tasa de goniopunción y/o inyección postoperatoria de MMC. Partiendo de una PIO preoperatoria similar obtuvieron un descenso absoluto al año de seguimiento de 6,6 mm Hg en el grupo del implante de PMMA y de 6,4 mm Hg en el grupo del implante de colágeno. En este estudio piloto, los autores no han encontrado casos con erosión escleral o conjuntival tardía, aunque advierten que dada la consistencia rígida del implante no descartan que se puedan producir a largo plazo.
Los autores refieren que su coste va ser considerablemente inferior a los implantes habitualmente utilizados lo que podría suponer una gran ventaja para la extensión de la cirugía no perforante (34).
Otros
Fragmentos de lentes de contacto
En un intento por abaratar los costes del implante, Kaluzny et al han realizado un estudio experimental en conejos implantando fragmentos de lentes de contacto de hidrogel metacrílico y de silicona, que son recortadas en varios fragmentos de forma triangular para adquirir una forma similar al implante de SK-gel®. En este modelo experimental se comparó la reacción inducida por estos implantes respecto al SK-gel®. Ambos implantes indujeron una reacción inflamatoria mayor que el SK-gel®. Se produjo una cápsula fibrosa alrededor de los 3 implantes, siendo más gruesa la producida por el implante de silicona, mientras que la cápsula producida por el implante de hidrogel y de SK-gel® fue delgada y muy similar a los 30 días, pero a los 360 días, la cápsula del SK-gel® continuaba siendo la más delgada y la de hidrogel tenía un grosor intermedio. Las paredes de la cápsula fueron más gruesas en el lado conjuntival del implante (15).
Antimetabolitos
Dada su capacidad de inhibir la cicatrización, se ha propugnado el uso de antimetabolitos como 5-FU y MMC para mantener el lago intraescleral y favorecer la filtración subconjuntival en EPNP, bien como sustituto de los implantes y también en combinación con ellos.
Mitomicina C
No existe consenso respecto al modo de uso. Los autores utilizan una esponjeta empapada en MMC a concentración de MMC de 0,2 mg/ml 1-2 minutos bajo el tapete escleral superficial, antes de disecar el tapete profundo y 2-3 esponjetas subconjuntivales, siguiendo las precauciones habitualmente recomendadas con el uso de este antimetabolito de evitar el contacto con el borde de la conjuntiva y realizar un lavado profuso del mismo al retirar las esponjetas. Con esta técnica no hemos observado hipotonías persistentes ni fugas tardías en la ampolla de filtración.
La MMC puede utilizarse en sustitución del implante o en combinación con el mismo.
Uso sustitutivo de implante
Respecto a su uso sin implante, en un estudio prospectivo randomizado de 90 ojos de 90 pacientes, Kozobolis et al compararon la eficacia de la EPNP suplementada con MMC (0,2 mg/ml 2,5 minutos antes de la disección del tapete escleral superficial) y sin ella. No utilizaron implante, aunque dejaban viscoelástico (healon GV®) bajo el tapete escleral superficial. Después de 3 años de seguimiento, se produjo un mayor descenso de PIO en el grupo en el que se utilizó MMC (11,7 mm Hg versus 7,1 mm Hg en valor absoluto y 42,3% versus 27,6% en valor porcentual) sin observarse diferencias en la tasa de complicaciones (35).
Por otro lado, Cilino et al realizaron un estudio prospectivo randomizado comparando trabeculectomía y EPNP utilizando en ambos casos MMC a bajas dosis, no observando diferencias significativas respecto a la tasa de éxito final. Sin embargo, los pacientes sometidos a trabeculectomía presentaron una mayor tasa de atalamia e hipotonía (36).
La MMC ha sido propugnada en glaucomas con factores de riesgo de fracaso. Así, Anand indica el uso de MMC (0,2 mg/ml 2 minutos en el espacio subtenoniano) en EPNP sin implante en presencia de factores de riesgo de cicatrización subconjuntival o en casos que se precise una PIO objetivo más baja. La PIO postoperatoria en pacientes con indicación de uso de MMC fue más baja que en aquellos en los que no se indicó (la probabilidad de obtener al año de seguimiento una PIO postoperatoria menor o igual de 18 mm Hg fue 67% en el grupo sin MMC y 86% en el grupo con MMC; y la probabilidad de obtener una PIO menor o igual de 14 mm Hg fue 35% y 74% respectivamente). Además, el grupo sin antimetabolitos precisó más goniopunciones (81% versus 45% de los casos en los que se utilizó MMC). Como contrapartida, el grupo con MMC tuvo más frecuentemente ampollas avasculares con filtración transconjuntival (37). Los mismos autores obtuvieron resultados similares en cirugía combinada de EPNP y facoemulsificación asociada a MMC (38).
Estos datos no fueron confirmados en otro estudio prospectivo realizado en población de raza negra en Nigeria, por lo que Mielke et al concluyen que la EPNP con MMC (0,25 mg/ml 2 min al final de la cirugía, 3-4 esponjas suconjuntivales posteriores al tapete) no sería útil en este grupo de población donde la goniopunción postoperatoria no está disponible (39).
Uso combinado de MMC e implantes
La MMC también puede utilizarse en adición a alguno de los implantes disponibles. Así Neudofer et al en un pequeño estudio comparativo randomizado incluyendo 13 ojos sometidos a EPNP con implante de colágeno sin MMC y 13 ojos con MMC (0,3 mmg/ml 3 minutos subconjuntival sobre esclera marcada) encuentran un mayor porcentaje de reducción de PIO final (48% versus 35%) en el grupo en el que se utilizó la MMC, lo que sugiere un efecto adicional de la misma. Sin embargo, se trataba de grupos no homogéneos, con mayor PIO preoperatoria en el grupo en el que se utilizó el antimetabolito, lo que podría haber favorecido la obtención de este mayor porcentaje de reducción (40).
En el mismo sentido, la EPNP asociada a uso combinado de implante de SK-gel® y MMC ha mostrado resultados satisfactorios en una pequeña muestra de pacientes con glaucoma inflamatorio (41) y en reintervenciones de pacientes con trabeculectomía previa fracasada (42).
Podemos concluir de lo anterior que la aplicación intraoperatoria de MMC, tanto de forma aislada, como asociada a implantes, puede incrementar la tasa de éxito de la EPNP aislada y combinada con facoemulsificación, sin incrementar la tasa de complicaciones. Resulta especialmente útil en pacientes con factores de riesgo de fracaso y reintervenciones. Por otro lado, produce con más frecuencia ampollas avasculares, que requieren un seguimiento más meticuloso.
5-Fluoruracilo
Detry-Morel et al realizaron un estudio comparativo de pacientes a los que se les realizaba EPNP con implante de SK-gel, con implante y aplicación tópica intraoperatoria de 5-FU y sólo con 5-FU. Observaron que el grupo con mejor resultado fue el que utilizaron únicamente implante, por lo que el 5-FU no fue de utilidad (43). Otros autores han encontrado evoluciones marginalmente mejores al añadir 5-FU al implante de colágeno en la EPNP (2).
Conclusiones
Uno de los mecanismos de acción de la cirugía filtrante es mantener un lago intraescleral patente que sirva de reservorio de humor acuoso. Este espacio se mantiene de forma más prolongada si se usan implantes y/o antimetabolitos. No existen estudios comparativos bien diseñados que nos indiquen qué implante es más útil. Dado que los implantes suponen un mayor coste se están buscando alternativas más económicas, aunque ninguna de ellas ha mostrado ventajas significativas sobre los implantes comercializados.
El uso de mitomicina C podría ser una alternativa cuando no se dispone de implante, pero debería ser utilizado por cirujanos que hayan finalizado su curva de aprendizaje en la técnica quirúrgica para evitar las complicaciones que el uso de los mismos podrían determinar en una cirugía no perforante reconvertida. La utilización combinada de antimetabolitos y algunos implantes podría proporcionar un efecto hipotensor ocular añadido.
BIBLIOGRAFÍA
Krasnov MM. Externalization of Schlemm´s canal (sinusotomy) in glaucoma. Br J Ophthalmol 1968; 52: 157-161.
Sarodia U, Shaarawy T, Barton K. Nonpenatrating glaucoma surgery: a critical evaluation. Curr Opin Ophthalmol 2007; 18: 152-158.
Torres-Suarez E, Rebolleda G, Muñoz Negrete FJ, et al. Influence of deep scleral flap size on intraocular pressure after deep sclerectomy. Eur J Ophthalmol 2007; 17: 350-356.
Corcostegui J, Rebolleda G, Muñoz-Negrete FJ. Refractive changes after phacoemulsification combined with deep sclerectomy assisted by corneal topography. J Cataract Refract Surg 2004; 30: 2391-2396.
Muñoz Negrete FJ, Rebolleda G, Noval S. [Non-penetrating deep sclerectomy combined with phacoemulsification. Results and complications]. Arch Soc Esp Oftalmol 2003; 78: 499-506.
Kozlov VI, Bagrov SN, Ford VJ. Nonpenetrating deep sclerectomy with collagen. Ophthalmic Surg 1984; 15: 734-740.
Shaarawy T, Nguyen C, Schnyder C, Mermoud A. Comparative study between deep sclerectomy with and without collagen implant: long term follow up. Br J Ophthalmol 2004; 88: 95-98.
Khairy HA, Atta HR, Green FD, et al. Ultrasound biomicroscopy in deep sclerectomy. Eye 2005; 19: 555-560.
Moreno-Lopez M, Perez-Alvarez MJ. [Short- and medium-term intraocular pressure lowering effects of combined phacoemulsification and non-penetrating deep sclerectomy without scleral implant or antifibrotics]. Arch Soc Esp Oftalmol 2006; 81: 93-100.
Roy S, Mermoud A. [Adjuvants to nonpenetrating surgery:drains and implants]. J Fr Ophtalmol 2007; 29: 1175-1179.
Chiou AG, Mermoud A, Underdahl JP, Schnyder CC. An ultrasound biomicroscopic study of eyes after deep sclerectomy with collagen implant. Ophthalmology 1998; 105: 746-750.
Nguyen C, Boldea RC, Roy S, et al. Outflow mechanisms after deep sclerectomy with two different designs of collagen implant in an animal model. Graefes Arch Clin Exp Ophthalmol 2006.
Shaarawy T, Mansouri K, Schnyder C, et al. Long-term results of deep sclerectomy with collagen implant. J Cataract Refract Surg 2004; 30: 1225-1231.
Sourdille P, Santiago PY, Villain F, et al. Reticulated Hyaluronic acid implant in nonperforating trabecular surgery. J Cataract Refract Surg 1999; 25: 332-339.
Kaluzny JJ, Jozwicki W, Wisniewska H. Histological biocompatibility of new, non-absorbable glaucoma deep sclerectomy implant. J Biomed Mater Res B Appl Biomater 2007; 81: 403-409.
Marchini G, Marraffa M, Brunelli C, et al. Ultrasound biomicroscopy and intraocular-pressure-lowering mechanisms of deep sclerectomy with reticulated hyaluronic acid implant. J Cataract Refract Surg 2001; 27: 507-517.
Moreno-Montañes J, Rebolleda G, Muñoz Negrete FJ. Prognostic value of gonioscopy after deep sclerectomy. Eur J Ophthalmol 2007; 17: 702-708.
Moreno-Montañes J, Rodriguez-Conde R. Bleeding during gonioscopy after deep sclerectomy. J Glaucoma 2003; 12: 427-429.
Schwenn O, Springer C, Troost A, et al. [Deep sclerectomy using a hyaluronate implant versus trabeculectomy. A comparison of two glaucoma operations using mitomycin C]. Ophthalmologe 2004; 101: 696-704.
Luke C, Dietlein TS, Roters S, et al. [Implant exposure after viscocanalostomy with reticulated hyaluronic acid (SK-GEL(R)]. Ophthalmologe 2004; 101: 1220-1223.
Mousa AS. Preliminary evaluation of nonpenetrating deep sclerectomy with autologous scleral implant in open-angle glaucoma. Eye 2007; 21: 1234-1238.
Devloo S, Deghislage C, Van ML, et al. Non-penetrating deep sclerectomy without or with autologous scleral implant in open-angle glaucoma: medium-term results. Graefes Arch Clin Exp Ophthalmol 2005; 243: 1206-1212.
Ye W, Sun J, Zhong Y. [Implication of non-perforating deep sclerectomy with amniotic membrane implantation for primary open-angle glaucoma]. Yan Ke Xue Bao 2002; 18: 76-79.
Wevill MT, Meyer D, Van AE. A pilot study of deep sclerectomy with implantation of chromic suture material as a collagen implant: medium-term results. Eye 2005; 19: 549-554.
Shin IH, Nah YS, Hong YJ, Kim CY. Comparison of surgical outcomes between small collagen and chromic catgut implants in deep sclerectomy. Korean J Ophthalmol 2002; 16: 75-81.
Erkilic K, Ozkiris A, Evereklioglu C, et al. Deep sclerectomy with various implants: an experimental and histopathologic study in a rabbit model. Ophthalmologica 2004; 218: 264-269.
Folch Ramos J, Castanera de Molina F. EPNP con implante de PDS. Annals d´Oftalmología 2006; 14: 30-34.
Ravinet E, Bovey E, Mermoud A. T-Flux implant versus Healon GV in deep sclerectomy. J Glaucoma 2004; 13: 46-50.
Hamard P, Tuil E. [Nonpenetrating deep sclerectomy (NPDS) in ultrasound biomicroscopy (UBM)]. J Fr Ophtalmol 2003; 26: 104-105.
Ates H, Uretmen O, Andac K, Azarsiz SS. Deep sclerectomy with a nonabsorbable implant (T-Flux): preliminary results. Can J Ophthalmol 2003; 38: 482-488.
Dahan E, Ravinet E, Ben-Simon JG, Mermoud A. Comparison of the efficacy and longevity of nonpenetrating glaucoma surgery with and without a new, nonabsorbable hydrophilic implant. Ophthalmic Surg Lasers Imaging 2003; 34: 457-463.
Wiermann A, Zeitz O, Jochim E, et al. [A comparison between absorbable and non-resorbable scleral implants in deep sclerectomy (T-Flux and SK-Gel)]. Ophthalmologe 2007; 104: 409-414.
Contreras I, Noval S, Munoz-Negrete FJ, et al. [Ultrasound biomicroscopy in deep sclerectomy with a new acrylic implant]. Arch Soc Esp Oftalmol 2006; 81: 445-450.
Mansouri K, Shaarawy T, Wedrich A, Mermoud A. Comparing polymethylmethacrylate implant with collagen implant in deep sclerectomy: a randomized controlled trial. J Glaucoma 2006; 15: 264-270.
Kozobolis VP, Christodoulakis EV, Tzanakis N, et al. Primary deep sclerectomy versus primary deep sclerectomy with the use of mitomycin C in primary open-angle glaucoma. J Glaucoma 2002; 11: 287-293.
Cillino S, Di PF, Casuccio A, Lodato G. Deep sclerectomy versus punch trabeculectomy: effect of low-dosage mitomycin C. Ophthalmologica 2005; 219: 281-286.
Anand N, Atherley C. Deep sclerectomy augmented with mitomycin C. Eye 2005; 19: 442-450.
Anand S, Anand N. Combined phacoemulsification and deep sclerectomy (PDS) with intraoperative mitomycin C (MMC) augmentation. Eye 2007; Apr 20; [Epub ahead of print].
Mielke C, Dawda VK, Anand N. Deep sclerectomy and low dose mitomycin C: a randomised prospective trial in west Africa. Br J Ophthalmol 2006; 90: 310-313.
Neudorfer M, Sadetzki S, Anisimova S, Geyer O. Nonpenetrating deep sclerectomy with the use of adjunctive mitomycin C. Ophthalmic Surg Lasers Imaging 2004; 35: 6-12.
Arruabarrena C, Muñoz-Negrete FJ, Marquez C, Rebolleda G. [Results of nonpenetrating deep sclerectomy in inflammatory glaucoma: one year follow up]. Arch Soc Esp Oftalmol 2007; 82: 483-487.
Rebolleda G, Muñoz-Negrete FJ. Deep sclerectomy with mitomycin C in failed trabeculectomy. Eye 2007; 21: 23-28.
Detry-Morel M, De Temmerman S. [Assessment of nonpenetrating deep sclerectomy with reticulated hyaluronic acid implant SKGEL and/or preoperative application of 5-luorouracil: results of 2 and a half years]. Bull Soc Belge Ophtalmol 2003; 287: 53-62.