Fig. 1A
COMUNICACIÓN SOLICITADA
ALEJANDRE-ALBA N1, ARIÑO GUTIÉRREZ M1, ARRIOLA-VILLALOBOS P2
, GARCÍA SANDOVAL B3, JIMÉNEZ-ALFARO MOROTE I31
Licenciado en Medicina y Cirugía. Servicio de Oftalmología. Fundación Jiménez Díaz. Madrid.RESUMEN
La queratitis por herpes simplex
es producida por herpes virus humanos tipo 1 y 2. La infección primaria puede ser ocular o no, produciéndose después de ella un periodo de latencia en el que el ADN del virus puede encontrarse tanto en las neuronas del ganglio trigémino como en la córnea. Cuando se reactiva el virus viaja por las terminaciones nerviosas hasta el lugar donde produce la infección. Estas reactivaciones producen una gran morbilidad en nuestros pacientes, dejando muchas veces secuelas que conducen a una queratoplastia. La patogénesis de las lesiones se debe sobre todo a la interacción del genoma vírico con el sistema inmune, en algunas como la queratitis estromal es éste el que juega el papel principal, promoviendo la cicatrización y la vascularización a través de numerosas citoquinas. El hecho de que sea una infección en la que tengamos que controlar a la vez la respuesta inmune hace que el tratamiento sea en ocasiones muy complicado. El avance en el conocimiento de la respuesta inmune contra el virus sin duda implicará grandes mejoras en el tratamiento de la queratitis herpética.Palabras claves: Virus herpes simple, queratitis herpética.
Tanto el virus herpes simplex (VHS) tipo 1 como el tipo 2 son morfológicamente similares al resto de virus de la familia herpesviridae con una cápsula icosaédrica que protege una doble cadena de ADN asociada a fosfoproteinas. Ambos se diferencian en algunas glicoproteínas y tienen distintos puntos de corte cuando sometemos su ADN a la acción de endonucleasas (lo que hace muy fácil distinguirlos mediante PCR).
Hasta el 90% de la población presenta anticuerpos positivos frente al VHS.
Aunque VHS-1 normalmente afecta la región orofaríngea y VHS-2 el área genital, ambos pueden observarse en cualquier localización. Típicamente, la afectación ocular en el adulto está causada por VHS-1, mientras que la mayoría de las conjuntivitis y queratitis neonatales se debe al VHS-2 por su paso a través del canal del parto. La infección primaria puede ser o no sintomática y es seguida por un estado latente de no replicación viral. Se requiere un contacto próximo personal para la transmisión de la infección viral, siendo las principales puertas de entrada las membranas mucosas y la piel. Además la epidemiología de la infección herpética se encuentra en un proceso de cambio, en los últimos 30 años la prevalencia de anticuerpos contra el VHS-2 ha aumentado un 30% y el cambio en los hábitos sexuales ha hecho aumentar la incidencia de infección genital por VHS-1 (1).
La afectación ocular por HSV constituye un problema de salud de primer orden. En Estados Unidos se estima que existen más de 20.000 nuevos casos anuales y un número total de episodios anual superior a los 48.000 (2). En Francia (población más parecida a la nuestra) la incidencia es de 31,5 por 100,000 personas-años (intervalo de confianza con un 95%, 25,5-37,5), de los cuales 13,2 por 100,000 personas-años son casos nuevos (95% IC, 10,4-15,9) y 18,3 por 100.000 personas-años son recurrencias (95% CI, 14,6-22,1). Los cuadros clínicos se distribuyeron de la siguiente manera: queratitis dendrítica (56,3%), queratitis estromal (29,5%), queratitis geográfica (9,8%). El cuadro de queratitis fue acompañado de conjuntivitis en el 18.8%, y de uveítis en el 11,8%, con afectación de los párpados en el 8.6% (3). Estas cifras de incidencia aumentan en patologías como la atopia y la diabetes (4).
La tasa de recurrencia es del 9,6% durante el primer año, 22,9% a los dos años y llegando al 63,2% si seguimos a los pacientes durante 20 años. La probabilidad de recidiva en el siguiente año aumenta con el número de episodios padecidos por el paciente. La infección bilateral es rara, aunque algunos estudios la sitúan entre el 1 y el 10%, siendo con mucho más frecuente en pacientes con atopia (5).
HERPES OCULAR PRIMARIO
La infección sistémica por VHS suele ocurrir en los primeros años de la vida a través del contacto con las lesiones orales y las secreciones contaminadas. Aunque en los últimos años el contagio en los países desarrollados es cada vez más tardío, mientras que en los países en vías de desarrollo sí que se produce en los primeros años de vida (4). Los estudios clásicos muestran como los anticuerpos frente VHS son positivos en los primeros meses de vida por el paso de los mismo a través de la placenta, desapareciendo a continuación; entre los 15 y los 25 años aparece un nuevo pico (6). Suele ser subclínica en el 85-99% de los casos y es más frecuente que afecte la región perioral. La afectación ocular en la infección primaria por VHS es variada e incluye conjuntivitis folicular aguda, queratoconjuntivitis y blefaritis herpética. También se ha descrito un caso de una úlcera conjuntival geográfica en una primoinfección (7). Aunque la blefaroconjuntivitis primaria se resuelve sin tratamiento, se aconseja el uso de agentes antivíricos tópicos y sistémicos 2-4 veces/día hasta la resolución del cuadro, puesto que la medicación parece acortar el curso y disminuir el riesgo de complicaciones corneales, si bien no hay ensayos clínicos que avalen esta actitud.
HERPES OCULAR RECIDIVANTE
Tras la primoinfección primaria el virus viaja por las terminaciones nerviosas para alojarse en distintos ganglios sensitivos, simpáticos e incluso en el sistema nervioso central (8), pero además quedan copias latentes con capacidad infecciosa en los órganos periféricos como la córnea (9). Los microorganismos alojados en las neuronas no son virus completos, sino partes del genoma del virus que al transcribirse llevan a la infección. El sistema inmune es el encargado de evitar la extensión de la infección en las reactivaciones, pero (especialmente en el ojo) también forma parte de las lesiones que aparecen y es el causante de muchas de las secuelas. Las variaciones individuales en el sistema inmune juegan un papel importante en cómo y con qué frecuencia se dan las reactivaciones: así existen polimorfismos en la lactoferrina lagrimal que facilitan la aparición de queratitis herpética (10). Cuando existe una infección corneal por VHS se produce una compleja reacción local en la que la expresión de citoquinas es dinámica de forma que existen diversas etapas. Empiezan por la secreción de factores quimiotácticos para neutrófilos y más tarde de linfocitos (11), siendo muy característica la secreción desde etapas muy tempranas de VEGF (12).
El estudio HEDS (Herpetic Eye Disease Study) halló una tasa de recidivas del 18% en un grupo de 346 pacientes, seguidos 18 meses, que el año anterior habían presentado un brote herpético ocular (6). Las manifestaciones corneales de la enfermedad herpética ocular incluyen queratitis epitelial infecciosa, queratopatía neurotrófica, queratitis intersticial estromal inmune, queratitis estromal necrotizante y endotelitis y algunas formas clínicas menos frecuentes. La queratitis recidivante por HSV es típicamente unilateral.
Se han descrito diversos desencadenantes de la recidiva herpética como los rayos ultravioleta, los cambios hormonales asociados a la menstruación, la utilización de prostaglandinas tópicas (13), cirugías oculares como la de catarata (14), la cirugía refractiva corneal (aunque el riesgo utilizando profilaxis oral y tras un año de inactividad parece bajo) (15) e incluso se ha descrito un caso tras recibir un tratamiento de «cross-linking» (16).
La utilización de antivíricos orales reduce el número anual de recurrencias, no habiéndose encontrado diferencias entre los distintos fármacos (17).
Queratitis infecciosa
Se caracteriza por la presencia de virus vivos en fase de replicación en las lesiones. Estas se producen al reactivarse los virus latentes en el sistema nervioso, en el tejido corneal o en otras zonas del ojo (aunque como hemos dicho no es necesario que existan virus enteros, muchas veces se trata de virus que han insertado su genoma en el de células como las neuronas). Las manifestaciones más frecuentes son las queratitis dendríticas y las geográficas. El cuadro se inicia con la aparición de finas vesículas en el epitelio, que en un plazo de 24 horas coalescen para formar la típica lesión dendrítica.
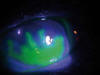
Ésta es la afectación más característica y consiste en una lesión lineal ramificada con bulbos terminales, rodeada por bordes de epitelio edematoso que contienen virus vivos. Estas úlceras presentan unas propiedades en cuanto a su tinción que ayudan al diagnóstico: la úlcera tiñe positivamente con fluoresceína, mientras que los bordes epiteliales sobreelevados lo hacen negativamente. La tinción con rosa de bengala, por su parte, es captada por las células epiteliales edematosas desvitalizadas del borde de la úlcera. Durante el proceso de curación, el epitelio corneal aparece opaco, pero su aspecto es plano y no tiñe con fluoresceína. Esta epiteliopatía dendritiforme no supone infección activa y no debe tratarse con antivíricos tópicos, que suelen ser epiteliotóxicos. Cuando la úlcera dendrítica se agranda y pierde su aspecto lineal, se conoce como úlcera geográfica. En estos casos, existe un defecto amplio que tiñe con fluoresceína (fig. 1A y 1B) y se extiende hasta la membrana basal del epitelio, sus bordes están edematosos y contienen virus vivos, igual que las formas dendríticas, siendo su morfología festoneada y con bulbos terminales, lo que ayuda a diferenciarla de abrasiones epiteliales en fase de curación o formas de queratopatía neurotrófica cuyos bordes son lisos, enrollados y sobreelevados. Estas úlceras geográficas se asocian al uso previo e inadecuado de esteroides que favorecen la replicación viral.
Mucho menos frecuente es la úlcera marginal. Se debe también a la replicación viral, pero la proximidad del limbo hace que se produzca una gran quimiotaxis, atrayendo numerosos leucocitos que forman un infiltrado blanquecino bajo la úlcera, acompañado de una gran hiperemia limbar sectorial. La intensidad de la inflamación hace que los pacientes presenten mucha más sintomatología.
Recientemente se ha descrito una forma menos común de queratitis infecciosa llamada «Queratitis en Archipiélago», estas lesiones podrían deberse a la extensión centrípeta de una úlcera marginal, o más probablemente a una reactivación multifocal a lo largo del trayecto de diferentes puntos, formando una lesión con aspecto de varios islotes. Con frecuencia las lesiones en archipiélago acompañan a una úlcera marginal. En diversos pacientes se ha demostrado la presencia viral mediante PCR, pero el componente inmunológico de la lesión también es importante, infiltrando las lesiones y produciendo fibrosis subepitelial (18).
El tratamiento de la queratitis epitelial infecciosa consiste en la aplicación tópica de antivíricos. Actualmente en nuestro país podemos elegir entre dos fármacos: pomada de aciclovir, o gel de ganciclovir. Ambos deben instilarse 5 veces al día. Solemos mantener el tratamiento durante 7-14 días siendo el criterio más importante para suspenderlo la curación de la lesión herpética, se aconseja mantener el fármaco hasta una semana después de la resolución, sin superar los 21 días de tratamiento, si bien podemos reducir la dosis a tres aplicaciones diarias o retirarlo antes en función de la toxicidad corneal. Hasta el momento sólo existe un ensayo clínico publicado en una revista «paired review» que compare ambos tratamientos (19), en el cual no se observaron diferencias estadísticamente significativas en cuánto a curaciones, ni en cuánto a toxicidad corneal si consideramos ésta como queratitis punteada. Si que hubo diferencias a favor del gel de ganciclovir en cuánto a molestias en el momento de la aplicación del fármaco. El uso de aciclovir oral es apoyado por diversos expertos, sugiriendo que presenta un mayor cumplimiento terapéutico, menos efectos adversos locales y una mejor cicatrización (20), además existen algunos artículos en los que parece haber beneficio en el uso de antivirales orales, especialmente si su uso tópico es mal tolerado (21,22).
En ocasiones es útil desbridar la lesión para disminuir la carga viral. También la asociación de Interferón tópico ha demostrado su eficacia en revisiones sistemáticas (23,24).
Es interesante el uso de un antibiótico tópico de amplio espectro y no epiteliotóxico en úlceras extensas para evitar la sobrinfección de las lesiones. Podemos asociar a esto un colirio ciclopéjico para disminuir el dolor.
La queratitis estromal necrotizante (fig. 2) es una manifestación infrecuente en la que existe una lesión epitelial asociada a necrosis, ulceración e infiltración estromal. En ella se asocian la infección activa con una intensa respuesta inmune que conduce a la destrucción del estroma. Es un cuadro de difícil manejo ya que además de controlar la infección con antivíricos (dada la gravedad del cuadro se suelen asociar antivíricos orales), hay que frenar la degradación del estroma. Los fármacos más potentes para hacerlo son los corticoides, preferiblemente sin conservantes, pero tienen la desventaja de facilitar la infección e inhibir la cicatrización por lo que el equilibrio que se debe guardar es complicado. Hay que utilizar además armas para frenar las colagenasas como la vitamina C y las tetraciclinas, a pesar de que la eficacia de ambas es limitada. En lesiones que no responden al tratamiento en las que el «melting» corneal amenaza con perforar la córnea, el empleo de membrana amniótica parece resultar útil (25,26).
En úlceras que persisten más de 14 días, debe distinguirse entre una verdadera queratitis infecciosa, una epiteliopatía dendritiforme y una queratopatía neurotrófica, cuyos bordes son lisos, sobreelevados y aparecen enrollados sobre la úlcera. Los esteroides tópicos deben evitarse en este tipo de afectación, así como los antivíricos tópicos.
Queratopatía neurotrófica
Las queratitis epiteliales infecciosas predisponen a la aparición de una lesión neurotrófica. Su origen es multifactorial, por un lado las terminaciones nerviosas corneales quedan dañadas, disminuyendo la secreción de factores neurotróficos, además aparece una hipoestesia corneal que disminuye el parpadeo, de forma que el epitelio está más expuesto a agresiones. Las terminaciones nerviosas forman parte del reflejo del lagrimeo, por lo que su alteración disminuye la cantidad de lágrima. Si no identificamos correctamente el problema y tratamos al paciente con antivíricos y/o esteroides tópicos agravaremos el cuadro. Éste suele empezar por una queratitis punctata, frecuentemente inferior que confluye hasta formar una úlcera de bordes bien delimitados, redondeada y que con frecuencia tiene un lecho grisáceo cuando progresa hacia el estroma (fig. 3). La activación de fenómenos colagenolíticos puede llevar incluso a la perforación ocular.
Como se deduce de la patogenia, el tratamiento consiste en minimizar la acción de los agentes tóxicos y facilitar la lubricación corneal. Por ello el tratamiento es retirar todos los colirios tóxicos ya sea por su principio activo o por sus conservantes y utilizar lágrimas artificiales sin éstos. Solamente utilizaremos antibióticos si por el tamaño de la lesión tememos una sobreinfección y estos serán lo menos epiteliotóxicos posible.
En los casos con mala respuesta existen diversas maniobras de utilidad. Se puede desbridar la lesión para que al retirar el epitelio dañado de los bordes, el sano crezca más rápidamente cubriendo la lesión. El uso de lentes de contacto terapéuticas para evitar el traumatismo palpebral y las agresiones externas es útil en muchos casos, siempre con cobertura antibiótica. En este sentido actuaría la tarsorrafia lateral o total, ya sea con sutura, cianoacrilato, o mediante una ptosis inducida con toxina botulínica. Para muchos autores es una de las opciones más eficaces y permite resolver defectos que presentaban muy mala respuesta a otros métodos.
Es muy útil la aportación de factores regenerativos como el factor de crecimiento epidérmico (EGF), sustancia P, anticolagenasas, o fibronectina que se consigue al administrar de forma tópica un colirio de suero antólogo al 20%, parece que la obtención de un colirio a partir de un concentrado de plaquetas sería incluso más eficaz. Podemos además utilizar otros tratamientos anticolagenolíticos como las tetraciclinas o la vitamina C por vía sistémica.
En úlceras refractarias es tremendamente eficaz la realización de un injerto de membrana amniótica, que aporta membrana basal para que pueda crecer un nuevo epitelio además de contener factores antiinflamatorios y antiangiogénicos, estas dos últimas funciones se pueden potenciar utilizando además una membrana amniótica como «parche», es decir, con el epitelio hacia abajo, y cuya extensión supere los límites del defecto epitelial (fig. 4).
Queratitis estromales
La afectación estromal supone un 2% de los episodios iniciales y un 20 al 48% de la afectación herpética recurrente (27).
Su afectación puede ser primaria o secundaria a úlceras dendríticas, queratopatías neurotróficas y endotelitis. Existen dos formas de afectación estromal primaria con fisiopatologías diferentes:
a) Queratitis estromal Inmune (intersticial) (28): el mecanismo inflamatorio se debe a la presencia de una gran carga de partículas virales antigénicas en el estroma que induce una cascada de reacciones antígeno-anticuerpo-complemento y cursa con una inflamación estromal con integridad epitelial en la mayoría de los casos (fig. 5). Existen 3 patrones de afectación estromal: focal, multifocal y difuso. Suelen acompañarse de inflamación en la cámara anterior y de neovascularización que puede ocurrir a cualquier nivel. Si el tratamiento antiinflamatorio es precoz e intensivo los vasos regresan dando lugar a los llamados «vasos fantasma» pero si permanecen pueden dar lugar a una queratopatía lipídica que aumenta el riesgo de rechazo en una queratoplastia penetrante posterior.
Una forma específica de queratitis estromal inmune es el anillo inmunológico secundario al depósito de inmunocomplejos antígeno-anticuerpo en el estroma medio, central o paracentral.
b) Endotelitis: entidad clínica distinta que cursa con inflamación endotelial (precipitados retroqueráticos —PRKs—), edema estromal secundario (sin inflamación a ese nivel) y epitelial. Puede asociarse a cierto grado de iritis e hipertensión ocular (secundaria a la trabeculitis). Se clasifican en disciforme, difusa o lineal en función del patrón de afectación.
b.1) Endotelitis disciforme: es la forma más común. Los PRKs inducen una descompensación endotelial dando lugar a un edema estromal con forma de disco que no sobrepasa la zona de PRKs y al edema epitelial microquístico cuando aparece.
b.2) Endotelitis difusa: es una forma rara en la que los PRKs aparecen en toda la superficie corneal.
b.3) Endotelitis lineal: se caracteriza por una línea de PRKs de extensión centrípeta desde el limbo y una zona de edema estromal y epitelial bien delimitada entre los precipitados y el limbo. Es la entidad más resistente por lo que se recomienda utilizar antivíricos orales en el tratamiento.
TRATAMIENTO DE LA ENFERMEDAD INMUNOLÓGICA
Los corticoides son el tratamiento de elección. Quedó demostrada su eficacia (en el control de la inflamación y reducción de la duración del proceso) asociada a antivíricos tópicos en el estudio HEDS (Herpetic Eye Disease Study). Siempre debemos asociar antivíricos para disminuir la posibilidad de recidiva infecciosa, los tópicos han demostrado su utilidad, y en algunos estudios el empleo de valaciclovir oral también lo ha hecho. Los antivíricos orales de forma aislada no demostraron su eficacia durante la fase activa de la enfermedad pero si en la reducción de la frecuencia de reactivación con una pauta profiláctica de aciclovir a dosis de 400 mg/12 h/1 año. Se ha planteado la posibilidad de que sea más seguro empezar el tratamiento con antivíricos e introducir después los corticoides, ya que en muchos pacientes existe un nivel de replicación viral, aunque sea escaso.
La frecuencia de instilación inicial del tratamiento esteroideo y la reducción paulatina del mismo varía de unos pacientes a otros en función del grado de afectación y de la respuesta al tratamiento por lo que la pauta debe individualizarse. Se debe mantener al menos 10 semanas, de lo contrario puede aumentar el número de recurrencias. Si a pesar de una lenta reducción éstas aparecen se debe introducir antivíricos orales como tratamiento profiláctico durante 1 año (29,30).
Existe una serie de 12 casos de queratitis estromal no necrotizante sin respuesta al tratamiento con corticoides tópicos, en la que 10 respondieron al tratamiento con ciclosporina al 0,05% dos veces al día (31).
Dada la complejidad de la respuesta inmune al herpes y su importancia en las secuelas producidas por la queratitis herpética existen varias dianas terapéuticas interesantes para combatirlas. La activación de la cox-2 ocupa un lugar clave en la cadena, y ha demostrado en el laboratorio que su neutralización reduce la aparición de secuelas (32). Aunque todavía no ha sido bien delimitado su papel en la queratitis herpética, dada la importancia que juega la neovascularización en las lesiones, el uso de anti-VEGF jugará seguramente algún rol en el tratamiento (33).
Iridociclitis
Puede ser granulomatosa o no-granulomatosa, aparecer aislada (raro) o asociada a un cuadro de queratitis estromal (necrotizante o inmune) o de endotelitis. La etiopatogenia no es clara pero parece estar implicado el virus activo. Se acompaña de PRKs, grado variable de celularidad en la cámara anterior, atrofia iridiana sectorial (secundaria a necrosis isquémica), hipertensión ocular (secundaria a la trabeculitis y/o al bloqueo trabecular por células inflamatorias).
Debemos pensar en ella ante un cuadro de uveítis anterior unilateral asociada a hipertensión ocular con leucomas corneales y refractaria al tratamiento con corticoides tópicos.
Tratamiento de la iridociclitis
Aciclovir oral 400 mg 5 veces al día durante 10 semanas asociado a corticoide tópico, midriáticos e hipotensores oculares (34) en caso de que la presión intraocular lo precise.
BIBLIOGRAFÍA
Pepose JS, Keadle TL, Morrison LA. Ocular herpes simplex: changing epidemiology, emerging disease patterns, and the potential of vaccine prevention and therapy. Am J Ophthalmol 2006; 141: 547-557.
Liesegang TJ, Melton J III, Daly PJ et al. Epidemiology of ocular Herpes simplex. Arch Ophthalmol 1989; 107: 1155-9.
Labetoulle M, Auquier P, Conrad H, Crochard A, Daniloski M, Bouée S, El Hasnaoui A, Colin J. Incidence of herpes simplex virus keratitis in France. Ophthalmology 2005; 112: 888-95.
Kaiserman I, Kaiserman N, Nakar S, Vinker S. Herpetic eye disease in diabetic patients. Ophthalmology 2005; 112: 2184-8.
Herpetic Eye Disease Study Group. Predictors of recurrent herpes simplex virus keratitis. Cornea 2001; 20: 123-8.
Scott T. Epidemiology of herpetic infection . Am J Opthalmol 1957; 43: 134.
Jain AK, Sukhija J, Chopra I, Sachdev N. Primary conjunctival herpetic geographic ulcer in an immunocompetent patient. Ann Ophthalmol 2007; 39: 67-9.
Stevens JG, Nesburn AB, Cook ML. Latent Herpex simplex virus from trigeminal ganglia of rabbits with recurrent eye infection. Nature 1972; 235: 216.
Shimomura Y, Deai T, Fukuda M, Higaki S, Hooper LC, Hayashi K. Corneal buttons obtained from patients with HSK harbor high copy numbers of the HSV genome. Cornea 2007; 26: 190-3.
Keijser S, Jager MJ, Dogterom-Ballering HC, Schoonderwoerd DT, de Keizer RJ, Krose CJ, Houwing-Duistermaat JJ, van der Plas MJ, van Dissel JT, Nibbering PH. Lactoferrin Glu561Asp polymorphism is associated with susceptibility to herpes simplex keratitis. Exp Eye Res 2008; 86: 105-9.
Araki-Sasaki K, Tanaka T, Ebisuno Y, Kanda H, Umemoto E, Hayashi K, Miyasaka M. Dynamic expression of chemokines and the infiltration of inflammatory cells in the HSV-infected cornea and its associated tissues. Ocul Immunol Inflamm 2006; 14: 257-66.
Zheng M et al. Contribution of vascular endotelial growth factoring the neovascularization process during the pathogenesis of stromal keratitis J Virol 2001; 75: 9828-9835.
Kothari MT, Mehta BK, Asher NS, Kothari KJ. Recurrence of bilateral herpes simplex virus keratitis following bimatoprost use. Indian J Ophthalmol 2006; 54: 47-8.
Barequet IS, Wasserzug Y. Herpes simplex keratitis after cataract surgery. Cornea 2007; 26: 615-7.
de Rojas Silva V, Rodríguez-Conde R, Cobo-Soriano R, Beltrán J, Llovet F, Baviera J. Laser in situ keratomileusis in patients with a history of ocular herpes. J Cataract Refract Surg 2007; 33: 1855-9.
Kymionis GD, Portaliou DM, Bouzoukis DI, Suh LH, Pallikaris AI, Markomanolakis M, Yoo SH. Herpetic keratitis with iritis after corneal crosslinking with riboflavin and ultraviolet A for keratoconus. J Cataract Refract Surg 2007; 33: 1982-4.
Miserocchi E, Modorati G, Galli L, Rama P. Efficacy of Valacyclovir vs Acyclovir for the Prevention of Recurrent Herpes Simplex Virus Eye Disease: A Pilot Study. Am J Ophthalmol 2007; 144: 547-551.
Gabison,E, Nicolas Alfonsi N, Serge Doa S,Racine L, Sultan G, Baudouin C, Hoang-Xuan T. Archipelago Keratitis A Clinical Variant of Recurrent Herpetic Keratitis? Ophthalmology 2007; 114: 2000-2005
Hoh HB, Hurley C, Claoué C, Viswalingham M, Easty DL, Goldschmidt P, Collum LMT. Randomised trial of ganciclovir and acyclovir in the treatment of herpes simplex dendritic keratitis: a multicentre study. Br J Ophthalmol 1996; 80: 140-3.
Holland EJ, Brilakis HS, Schwartz GS. Herpes simplex keratitis. En: Krachmer JH, Mannis M, Holland EJ, eds. Cornea 2nd edition. Philadelphia: Elsevier Mosby. 2005; 1043-74.
Higaki S, Itahashi M, Deai T, Fukuda M, Shimomura Y. Effect of oral valaciclovir on herpetic keratitis. Cornea 2006; 25: S64-7.
Sozen E, Avunduk AM, Akyol N. Comparison of efficacy of oral valacyclovir and topical acyclovir in the treatment of herpes simplex keratitis: a randomized clinical trial. Chemotherapy 2006; 52: 29-31.
Wilhelmus KR. Therapeutic interventions for herpes simplex virus epithelial keratitis. Cochrane Database Syst Rev 2007; 24: CD002898.
Guess S, Stone DU, Chodosh J. Evidence-based treatment of herpes simplex virus keratitis: a systematic review. Ocul Surf 2007; 5: 240-50.
Shi W,Chen M,Lixin Xie L. Amniotic Membrane Transplantation Combined with Antiviral and Steroid Therapy for Herpes Necrotizing Stromal Keratitis. Ophthalmology 2007; 114: 1476-1481.
Spelsberg H, Reichelt JA. Amniotic membrane transplantation in proven ulcerative herpetic keratitis: successful anti-inflammatory treatment in time. Klin Monatsbl Augenheilkd 2008; 225: 75-9.
Liesegeng TJ. Epidemiology of ocular herpes simples virases. Arch Ophthalmol 1989; 107: 1160-5.
Holland EJ et al. Herpes simples keratitis. En: Krachmer JH, Mannis MJ, Holland EJ, eds, Cornea. Elservier. Philadelphia. 2005; 1054-1062.
Acyclovir for the prevention of recurrent herpes simples eye disease. Herpetic Ee Disease Study Group. N Engl J Med 1998; 339: 300-306.
Barron BA, Gee L, Hauck WW, et al. Herpetic Ee Disease Study. A controlled trial of oral acyclovir for herpes simplex stromal keratitis. Ophthalmology1994; 101: 1871-1882.
Rao SN. Treatment of herpes simplex virus stromal keratitis unresponsive to topical prednisolone 1% with topical cyclosporine 0.05%. Am J Ophthalmol 2006; 141: 771-772.
Biswas PS, Banerjee K, Kim B, Kinchington PR, Rouse BT. Role of inflammatory cytokine-induced cyclooxygenase 2 in the ocular immunopathologic disease herpetic stromal keratitis. J Virol 2005; 79: 10589-600.
Hosseini H, Khalili MR. Therapeutic potential of bevacizumab (Avastin) in herpetic stromal keratitis (HSK). Med Hypotheses 2007; 69: 568-70.
A controlled trial of oral acyclovir for iridocyclitis caused by herpes simples virus. Herpetic Eye Disease Study.