HISTORIA Y HUMANIDADES
Historia del tratamiento del pterygion.
Desde Susruta hasta la betaterapia surfocular (parte II): Adición de
radioterapia al tratamiento del pterygion
MURUBE E, GARCÍA PÉREZ M, DE ANTONIO ME,
ELBAKARY M, MURUBE J
1
Este trabajo se ha desarrollado como parte de la beca de la Fundación Mutua
Médica Madrileña 2005/443.
El tratamiento del pterygion mediante radioterapia, aislada o
aditiva a técnicas quirúrgicas, es un proceder que se inició hace medio siglo,
que pese a sus buenos resultados tuvo poco desarrollo en nuestro país, y que
recientemente está expandiéndose. Veamos la evolución histórica de sus aspectos
terapéuticos.
Un átomo es radiactivo cuando tiene un exceso de energía y por
tanto es inestable y se desintegra con mayor o menor rapidez. Hace poco más de
un siglo, Ernest Rutherford, neozelandés premio Nobel de Química 1908 (15),
basándose principalmente en la penetrancia de las radiaciones electromagnéticas
en los tejidos y materia en general, las dividió en alpha, beta y gamma, según
fuesen apenas, algo o bastante penetrantes. Más tarde se añadieron los rayos X.
Hoy sabemos que los rayos a son la emisión de
núcleos de helio; los b son la emisión de
electrones nucleares; los g son la emisión de
fotones de alta energía; y los X son la emisión de electrones procedentes no del
núcleo, sino de la corteza atómica.
La principal característica de los rayos beta (electrones de
alta velocidad) es que limitan su radiación ionizante a los tejidos
superficiales, donde acaban siendo absorbidos, evitando daños a estructuras más
profundas. Los rayos gamma y los rayos X por el contrario penetran más
profundamente en los tejidos.
Acción de las radiaciones sobre los tejidos: La irradiación
de los tejidos vivos causa la ionización del núcleo y citoplasma de sus células,
siendo más sensibles a los rayos beta los tejidos en crecimiento (epitelio
regenerante, fibrobastos, neovasos) que los estabilizados. La inhibición de la
proliferación fibrobástica y vascular es inmediata y permanente. En los
neovasos, detiene su crecimiento y causa la obliteración de los ya existentes
por endarteritis obliterante. Los capilares superficiales del pterygion se
obliteran con 2000 rep (9). Capilares más profundos pueden necesitar hasta 7000
rep. Ya en 1940 Burnam et al (10) señalaron que dosis surfoculares sobre 7000
rep causan necrosis local, neovascularización paradójica y daño al cristalino.
En los tejidos ya maduros el efecto de la beta-irradiación es menor (34).
Elementos radiactivos: Las fuentes de rayos beta
fueron hasta hace poco menos de un siglo los elementos radiactivos disponibles
naturalmente que emiten abundantes rayos beta. En 1939 el físico Lawrence,
Premio Nobel 1939, inventó el cyclotron, el primer acelerador de partículas que
consiguió altas energías. Más recientemente se crearon los reactores nucleares.
Los recientes elementos artificialmente radiactivos han sido útiles para usarlos
en aplicadores de rayos beta.
Entre los muchos elementos radiactivos, los hay que emiten
abundante radiación beta sin emisión gamma; pero para el uso práctico en
medicina surfocular interesa que no se degraden rápidamente, y por tanto tengan
una larga vida media de actividad (se define como vida media el tiempo en que la
emisión se reduce a la mitad). Así, la vida media del rodio-106 (Rh106)
es de 30 segundos, la del fósforo-32 (P32) es de 14,3 días, la del
estroncio-89 (Sr89) de 55 días, la del rutenio-106 (Ru106)
de 1 año, y la del estroncio-90 (Sr90) de 29,1 años (medidas antiguas
le habían calculado una vida media de 25 años (9) o de 28 años (40). De todos
ellos, el Sr90 se ha mostrado el mejor para ser utilizado en los aplicadores de
energía radiactiva en enfermedades superficiales porque sólo emite rayos beta, y
porque tiene una larga vida media, y por tanto no precisa una renovación
frecuente. Paulatinamente el estroncio-90 se descompone a itrio-90 (Y90),
que sí emite rayos gamma.
Entre los elementos químicos radiactivos destaca el radio
(Ra), un millón de veces más radiactivo que el uranio. Su isótopo más estable,
el Ra-226, tiene una vida medio o periodo de semidesintegración de 1.602 años.
Al irse desintegrando, se va transmutando a radón (Rn), que es otro
elemento químico radioactivo. El radio y el radón tienen la desventaja de que
emiten rayos gamma, lo que tiene más riesgos para el paciente por su
penetrabilidad en los tejidos. Los aplicadores de radón (10) fueron pronto
substuidos por los de radio (16).
Unidades radiactivas. El oftalmólogo que aborda el tema de
la betaterapia surfocular, encuentra en la literatura citas de unidades de
medición distintas, que debe interpretar:
El roentgen es la unidad de dosis de exposición a rayos
X, rayos gamma y otras radiaciones ionizantes. No es aplicable a la radiación
corpuscular. Un roentgen es igual a la cantidad de radiación producida por una
carga eléctrica de 0,000258 culombios por kilogramo de aire seco.
Cuando se estudia el efecto de las radiaciones ionizantes, es
importante conocer la energía absorbida por el material en estudio. Por esto se
introdujeron otras unidades: el rep y el rad. El rep
(roentgen equivalent physical) es la cantidad de radiación ionizante de
cualquier tipo que se absorbe en un determinado punto de un cuerpo o tejido en
cantidad de 93 ergs/g. Es aproximadamente igual a 1 roentgen de 250 kVp de
radiación en el tejido, o 0,93 rads, o 9,3 miligrays. El rad (radiation absorbed
dosis) es la unidad de energía de radiación ionizante absorbida por el material
irradiado. Un rad es igual a 100 ergs por gramo.
El reb (Röntgen-equivalent-beta) equivale a 0’00982 Gy,
es decir, aproximadamente 1 centiGy (24). El reb es hoy una medida prácticamente
obsoleta. El gray (símbolo Gy) es una unidad establecida en 1975 por el
Sistema Internacional de Unidades para expresar la dosis de radiación ionizante
absorbida por una determinada unidad de materia o tejido. Un gray es equivalente
a la absorción de un julio de energía ionizante por un kilogramo de material
irradiado (1 julio/kg.). Esta dosis varía de un punto a otro dentro de material
irradiado. El gray suele usarse hoy más que el rad.
El rem (roentgen equivalent man) fue introducido porque
algunas radiaciones al ser absorbidas son más efectivas que otras en producir
cambios biológicos. El rem es una unidad que relaciona la dosis de cualquier
radiación con el efecto biológico de esa dosis.
BRAQUITERAPIA. EVOLUCIÓN DE LOS
APLICADORES
La braquiterapia o plesioterapia (del griego
bracuV = corto y plhsioV
= próximo) es el tratamiento que se hace colocando el material radiactivo
directamente o cerca del área a tratar. Su primera aplicación a enfermedades de
superficie ocular la hizo en 1927 Burnam con un aplicador radiactivo de contacto
que contenía radón (10), y que emitía rayos beta y, en escasa medida,
rayos gamma. En años sucesivos, lo fue aplicando a distintas lesiones
superficiales de piel y ojo, entre ellas pterygia recurrentes, sin que
apareciesen tras la irradiación trastornos de la córnea, cristalino u otras
partes del ojo. Illif (38) lo aplicó a 18 casos de pterygion.
El radio emite radiaciones alpha, beta y gamma en una
proporción del 90, 4 y 6% respectivamente (44). Arruga (3) publicó en 1946 que
en casos de pterygion de tendencia recidivante se pueden usar los rayos X
inmediatamente después de la operación, aplicando 100 r y repitiendo cada 3 días
hasta un total de 1000 r en 10 sesiones. El mayor peligro de los rayos X es su
gran penetrablidad, y por consiguiente el alcanzar tejidos corporales profundos
no deseados. Por ello, en el ojo, donde se teme la catarata, los rayos beta son
preferidos a los rayos X.
Más tarde, en 1948, Swanberg (68) usó la betaterapia, utilizando
radio D, para tratar lesiones de párpados y surfoculus, aunque en su publicación
no cita específicamente las enfermedades en que lo usó. El aplicador de Swanberg
(fig. 1) contenía 10 mc de radio D (que tiene una vida media de 22 años); y
produce rayos beta, pero no gamma . Pocos años después se aplica al pterygion:
Okrainetz (54) en 3 casos y Paufique et al (59) en un caso.

Fig. 1: Aplicador de Swanberg (1948). El radio D está en el pequeño cilindro
terminal, de 9 mm de diámetro. La superficie radiactiva del cilindro es un
círcula central de 5,6 mm de diámetro, cubierta por un fino filtro de aluminio
de 50 micras. El cilindro terminal de aplicación está unido a una varilla y
ésta, a un mango.
Krohmer (42) defendía utilizar aplicadores de radium D porque el
90% de la energía que emite se absorbe en el primer milímetro de tejido,
mientras que con el aplicador de Sr90 sólo se absorbe en el primer
milímetro un 59%, por lo que el 41% de su emisión llega a tejidos más profundos
que no se pretendía irradiar.
El primer aplicador ocular de S90 lo hicieron
Friedell et al en 1950 (34), y lo utilizaron en pacientes con pterygia,
conjuntivitis vernales, vascularizaciones corneales, y otros padecimiemntos
surfoculares (fig. 2).
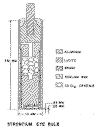
Fig. 2: Terminal del aplicador de Friedell. Es una cápsula de lucita, a su vez
introducida en una cápsula de aluminio, que ambos dos impiden la salida de rayos
beta, excepto en su parte distal que se aplicará al ojo, y en la que estas capas
tiene un escaso espesor de 0,25 mm.
El más usado en el último tercio del siglo pasado probablemente
fue el modelo difundido por Bernstein (9), que tiene un diámetro total de 12,7
mm y un diámetro activo de 7,8 mm. En la superficie de aplicación emite una
dosis de 50 r beta por segundo.
Castroviejo (16,17,19), para limitar el área de irradiación,
creó unas máscaras o filtros que reducen la superficie de salida de la radiación
a la forma y extensión necesaria, de forma que si así se desea, se puede
irradiar sólo un arco del limbo esclerocorneal o un área circular muy reducida
(fig. 3).

Fig. 3: Aplicador de Sr90, con filtros limitadores de Castroviejo
(16-18).
Posteriormente han aparecido numerosos modelos de
beta-aplicadores de estroncio-90 que se emplean principalmente para el
tratamiento del pterygion. Los más usados en los últimos decenios contienen
entre 50 y 125 mc de Sr90, que emite casi exclusivamente radiaciones
beta. Su radiación inicial es de 3.000 rads/minuto, y en 29 años se reduce a la
mitad. Así un aplicador con 29 años de antigüedad emite solo 1.500 rads/minuto,
y en 58 sólo emitirá 750 rads/minuto. La mayoría de los beta-aplicadores de Sr90
emiten por su superficie activa aproximadamente 3000 rep por minuto, como el
manufacturado por Tracer Lab (Irvine, CA. modelo RA-1 Sr) (26), o el de Amarsham
International PLC (Little Chalfont, Backinghamshire, UK) (39).
APLICACIÓN CLÍNICA DE LA BETATERAPIA
La técnica de braquiterapia consiste en colocar la superficie
activa del aplicador en contacto con el área a irradiar, y en mantener el
contacto durante el tiempo en que se ha calculado que emite la dosis de
radiación deseada. Frecuentemente se usa inmediatamente tras la extirpación
simple del pterygion, pero hay infinidad de otras variantes, pasando por la
aplicación sin extirpación del pterygion, o la dosificación de la irradiación en
fracciones
Aplicación directa sin cirugía previa. La betaterapia,
utilizada aisladamente, sin previa extirpación quirúrgica, produce una reducción
significativa del tamaño del pterygion (119,57,58), pero suele ser insuficiente
para la curación, tal vez por actuar sobre tejidos relativamente maduros y menos
influibles por la irradiación.
Pajic (58), en pterygia primarios sin cirugía previa, con
invasión corneal ligera o media, da dosis totales de 50 Gy dividida en 4
fracciones. En 54 pterygia primarios redujo la longitud radial corneal de
invasión de una media de 1,6 mm a una de 0,9 mm, haciéndolos avasculares, con
aspecto de pannus, y no teniendo ninguno reactivación. Sin embargo, otros
cirujanos encuentran que el tratamiento del pterygion sólo con betaterapia da
peores resultados que tras excisión previa, tal vez por ser tejidos
relativamente maduros, y por tanto menos alterables por la irradiación.
Aplicación tras cirugía. Ya desde 1954 Friedell et al (35)
observaron mejores resultados cuando se hacía la extirpación del pterygion y su
posterior radiación, que cuando sólo se aplicaba radiación sin extirpación
previa. Su uso para prevenir las recidivas del pterigion data de los años ’40
(16,17,44).
Dosis de irradiación y su penetración. La dosis de
betaterapia más frecuentemente aplicada es la de 1500 rads (43,61,67). Los rayos
beta son fácilmente absorbidos por los tejidos, y por ello reducen grandemente
su intensidad cuanto más profundizan. Un aplicador de Sr90 suministra
el 100% de la dosis de rayos beta calculada por el fabricante en la superficie
de aplicación, pero a 1 mm de profundidad sólo llega el 59% de la dosis recibida
en la superficie, (42); a 2 mm, el 19%; a 3 mm, el 10%; y a 10 mm, el 1%. Por
ello, no suele producir daño en los tejidos subyacentes al pterygion. Si por
error se dan dosis de 3.000 ó 4.000 rads por mantener la aplicación más tiempo
del calculado, o por hacer dos aplicaciones en sitios distintos que se
sobrelapan en un huso de la superficie ocular (que por tanto duplica la
radiación recibida en este huso), se corre el peligro de que haya una moderada
degeneración escleral local, perceptible porque en unos meses puede
transparentar una coloración azulada.
El ecuador cristaliniano queda a unos 3 mm de profundidad de la
superficie ocular, y recibe aproximadamente el 10% de la radiación aplicada al
área del pterygion, sin capacidad ya para dañar las células epiteliales
subcapsulares del ecuador de la lente que devendrán en fibras cristalinianas, y
que incluso en casos de sobredosificación sólo produciría a lo largo de los años
opacificaciones periféricas sectoriales (26,39,47, 51,52,58).
El estroncio-90 sólo produce rayos beta, pero paulatinamente se
va descomponiendo en ítrio-90, y éste sí produce rayos gamma, que son más
penetrantes que los beta, al igual que los rayos X.
Bernstein (9) aplicaba dosis de 3.000 rep, pero aumentaba a
4.000 rep en casos de pterygia crassa y rapidamente invasivos, y bajaba a sólo
2.000 rep en casos de córneas adelgazadas por cirugías previas. Pinkerton (61),
tras más de 30 años de experiencia, aconseja aplicar 1500 rep por área, o a lo
más, 3000 rep por área. Isohashi et al (39) dan dosis postop totales de 30-35
Gy, y Monteiro-Grillo et al (47) de entre 20 y 60 Gy.
Momento de aplicación de la irradiación: La mayoría de los
cirujanos surfoftalmólogos encuentran que no se debe demorar la betaterapia más
de 1 a 4 días tras la extirpación quirúrgica del pterygion, y los más prefieren
hacerla en el mismo acto quirúrgico tras extirpar el pterygion
(9,35,39,61,74,75).
La betaterapia surfocular para tratar el pterygion se extendió
menos de lo que sus excelentes resultados harían suponer, porque el paciente,
una vez operado del pterygion, suele ser remitido a un servicio hospitalario de
radioterapia, que necesita atenderlo en las primeras horas o días, interpretar
la importancia o no de las molestias postop del paciente, conocer la técnica de
uso del blefarostato, anestesia tópica, uso del aplicador de contacto sin dañar
la córnea, etc, lo que, aunque sencillo para un oculista, lo es menos para un
radiólogo. Para evitar esto, y solucionar el acto de la beta-terapia por el
mismo cirujano tras el acto operatorio, es necesario que éste cumpla las medidas
legales y sanitarias de seguridad de utilización de energías radiantes.
Fraccionamiento de la irradiación: Hace medio siglo, al
principio de la betaterapia surfocular, se tendía a fragmentar las dosis total
en 3 o más fracciones separadas por unos días o una semana. El criterio de la
necesidad de nuevas dosis se hacía por la observación al fentobiomicroscopio de
los vasos corneales y su profundidad (9,35). El fraccionamiento de la dosis se
mostró pronto poco práctico y se pasó a la dosis única, que es la más extendida
actualmente (16,43,61,67).
RESULTADOS DE LA BETATERAPIA: EXITOS Y
COMPLICACIONES
Se entiende por éxito la desaparición invasiva y estética del
pterygion, falta de daños añadidos y la ausencia de recurrencia tras la
aplicación de radioterapia (fig. 4). Se entiende por complicaciones la aparición
de nuevos problemas como consecuencia de la actuación médica.
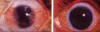
Fig. 4: Pterygion doble nasal y temporal tratado con queratectomías lamelares
parciales, autoplastia conjuntival y aplicación de 1.500 r de braqui-betaterapia
en el limbo afectado por la disección (Castroviejo) (19).
El seguimiento postoperatorio de paciente debe prolongarse hasta
la normalización del cuadro surfocular. Se han descrito complicaciones
irradiativas aparecidas incluso 2 años tras la operación (45,52). Cuando la
betaterapia surfocular se iniciaba, se aconsejaba seguir el postop durante un
mínimo de 4 años (9). En revisiones hechas 11 años después de la aplicación no
se han encontrado efectos nuevos (46) de la radioterapia:
La tasa de éxitos depende no sólo de la betaterapia aplicada y
de su forma de aplicación, sino también de las características del pterygion y
de la técnica de excisión aplicada. Para muchos cirujanos con amplia experiencia
personal, la aplicación postop de Sr90 es la forma más eficaz de
complementar la extirpación (23,35).
Las complicaciones atribuidas a la betaterapia generalmente no
se deben a causas desconocidas o imprevistas, sino a haber calculado mal las
dosis de betaterapia aplicada (5,37,69-72). Observaciones hechas a finales del
siglo pasado informan de que frecuentemente los aplicadores de Sr90
están mal calibrados, y esto puede explicar algunas infra o sobredosis (26).
En un reciente estudio, Isohashi et al 2006 (39), tras cirugía
más irradiación, encuentran como intrascendentes manifestaciones postoperatorias
pasajeras la conjuntivitis moderada, picor, dolor local, molestias visuales,
fotofobia y aumento del flujo lacrimal, que desaparen en el primer trimestre.
Algunas de estas manifestaciones probablemente son dependientes más de la lesión
de la extirpación quirúrgica que de la betaterapia. No vieron complicaciones
graves como escleromalacia, necrosis escleral y úlceras esclerales.
Complicaciones atribuidas a la betaterapia son quistes
epiteliales (9), áreas de simblefaron: (26), astigmatismo: (32), adelgazamiento
corneal: y ulceraciones corneales (26,54), atrofia escleral (14,47), iritis y
endoftalmitis (43,46,70). Especial mención merecen la catarata, el daño de la
musculatura ocular extrínseca y las recurrencias.
La catarata puede presentarse cuando la radiación inicial daña
las células del epitelio cristaliniano ecuatorial, lo que altera las nuevas
fibras que van siendo creadas en la corteza de ese sector cristaliniano, que
pueden opacificarse y dar Reitern (que en alemán significa «jinetes», por ser
opacidades que pueden simular las piernas de un jinete, una de ellas en la
corteza por delante del ecuador y otra, aunque generalmente de longitud y
dirección distinta, por detrás del ecuador), casi siempre sin afectar la visión,
aunque esto podría ocurrir si alcanza el sector subcapsular posterior
(46,70-73). Para que se afecte el área pupilar haría falta haber aplicado
8.000-10.000 rep (73) La catarata fue muy temida cuando su extracción era
intracapsular y la cirugía de tercio medio del siglo pasado daba complicaciones
abundantes (37). Por ello Bernstein (9) recomendaba no dar más de 4000 rep. Hoy,
las operaciones de extracción de cristalino tienen un amplio margen de
seguridad, hasta el extremo de que se extraen cristalinos no por catarata, sino
para quitar el uso de gafas de presbicia introduciendo lentes intraoculares
multifocales.
Hilger (37) encontró en revisiones hecha 5 años después que
ningún caso tenía catarata ecuatorial, si habían recibido 3000 rep, y que un 6%
de casos tenían ligeras opacidades cristalinianas si habían alcanzado de 3000 a
5000 rep.
Otra complicación rara es el daño de la musculatura ocular
extrínseca, que sólo suele producirse en los pterygia infiltrantes de las áreas
subconjuntivales retrógradas que alcanzan la musculatura ocular extrínseca, y
que pueden manifestarse en heteroforias, heterotropías y diplopía. Son más
frecuentes en las recidivas (2,41). Unas veces se deben a que el tejido
subconjuntival y episcleral penetra hacia atrás hasta la inserción muscular del
recto medial o la sobrepasa. Y otras a que se produce unas inextensibilidad o
retracción del trígono conjuntival nasal. La extirpación del tejido
subconjuntival que rodea el área expuesta del pterygion y la betairradiación de
esta área disminuye esta rara complicación.
Las recurrencias de un pterygion extirpado e irradiado suelen
producirse en las primeras semanas o meses después del tratamiento (47). El
mayor número de recurrencias ocurre en los casos en que la cirugía fue de
extirpación más transplante (9). Según algunos autores, la edad, y el género no
influyen en la frecuencia de recurrencias (26), pero según otros los pterygia de
varones de menos de 40 años son más recurrentes (39).
Las recurrencias tras cirugía más irradiación con Sr90
no son frecuentes (37). Castroviejo (16) encontró que con una correcta
aplicación se prevenía la recidiva en todos los casos. Tras extirpación e
irradiación hay publicadas recurrencias en el 7,7% de los casos (39), en el 8,6%
(36), y en el 5,4% en los pterygia tratados por primera vez, y en el 19% de los
reoperados (70). En general, las recurrencias oscilan alrededor de 2/3 de los
operados cuando no se aplica betaterapia, y del 0,5% a un tercio de los operados
cuando se aplicó betaterapia (1,4,5,13,23,24,26, 48,55,61,62,75).
En nuestra experiencia, hemos revisado 153 pterygia extirpados y
radiados con las misma técnica, con más de 4 años de supervisión. La técnica
empeada fue la misma en todos ellos: Queratectomía muy superficial que se inicia
en la cabeza progresante del pterygion y se sigue en dirección al limbo hasta
sobrepasarlo. Se continúa separando el pterygion de la esclera hasta la plica
semilunar (en el caso más frecuente, de un pterygion nasal), y se extirpa todo
el pterygion en un bloque. Se limpia la esclera expuesta de los restos de tejido
subconjuntivall y episcleral. A continuación, traccionando con una pinza del
tejido subconjuntival y episcleral situado bajo la franja conjuntival que rodea
el pterygion extirpado, se le expone al exterior y se corta con tijera. Así se
evita que queden en las áreas limítrofes a la esclera denudada un tejido
subconjuntival con posible inflamación. Una vez denudada la esclera, colocamos
sobre la córnea, limbo, esclera denudada y conjuntiva limítrofe la superfice
circular activa del aplicador de Sr90-Y90 (Nuclear
Associates, Inc, NY, Model 67850, que emite 50 rad por segundo), llegando en el
ecuador surfocular desde el vértice del lecho corneal denudado hasta donde
alcance cerca de la plica semilunar. A menudo desplazamos el aplicador un poco
hacia abajo con respecto al diámetro corneal horizontal (fig. 5), pues en la
mayoría de los pterygia, por causas aún no aclaradas, el pterygion se extiende
algo más por la zona conjuntival cubierta por el párpado inferior que por la
cubierta por el párpado superior. Si quedan áreas pterygianas sin irradiar en el
trígono conjuntival expuesto, se pone en el aplicador una máscara filtrante de
Castroviejo y se hacen dos aplicaciones más en el área yuxtacaruncular: una
desde la horizontal media hacia arriba y otra desde esta horizontal hacia abajo.
Se instila un colirio antibiótico-corticosteroide que se repetirá quater in die,
y se ocluye el ojo durante 6 días.
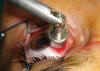
Fig. 5: Betaterapia mediante un aplicador de Sr90 del área desnuda de
un pterygion recién extirpado.
De los 153 pterygia citados, 51 eran primarios y 102
recidivados. Se clasificaron en grado 1: neovasos ligeros e invasión limbal
incipiente. Grado 2: neovasos abundantes, invasión corneal inferior a 2 mm (del
diámetro corneal horizontal). Grado 3: neovasos abundantes, e invasión corneal
de 2 a 5 mm. Grado 4: neovasos abundantes e invasión corneal superior a 5 mm.
La reoperación de las recurrencias deben ser bien evaluadas,
porque la evolución de los pterygia recurrentes suele ser peor que la de los
primarios. Según los autores mas conservadores, sólo deben reoperarse si afectan
al área corneal óptica, si hay un defecto estético evidente o si hay simbléfaron
(76,77). Pero la eficacia de la betaterapia permite abordar tanto el pterygion
primario como el recurrente con amplias expectativas de éxito.
BIBLIOGRAFÍA
-
Alaniz-Camino F. The use of of postoperative beta radiation in
the treatment of pterygia. Ophthalm Surg 1982; 13: 1022-1025.
-
Álvarez de Toledo Elizalde JP, de la Paz Dalisay M. Pterigión:
Caso clínico y revisión. Arch Soc Canar Oftalmol 2003; 14: 53-63.
-
Arruga H. Cirugía Ocular. Barcelona: Salvat Editores. 1946,
1950. pp 317-330 .
-
Aswad MI, Baum J. Optimal time for postoperative irradiation
of pterygia. Ophthalmology 1987; 94: 1450-1451.
-
Bahrassa F, Datta R. Postoperative beta radiation treatment of
pterygium. Int J Radiat Oncol Biol Phys. 1983; 9: 679-684.
-
Barraquer Moner JI. Etiología y patogenia del pterigion y de
las excavaciones de la córnea de Fuchs. Arch Soc Amer Oftalmol Optom 1964; 5:
49-60.
-
Barraquer Moner JI. Tratamiento del pterigion. Arch Soc Amer
Oftalmol Optom (Colombia) 1965; 5: 99-111.
-
Barraquer JI. Etiology, pathogenesis, and treatment of
pterygion. In: 1st Symposium on Medical and Surgical Diseases of the Cornea.
1980. Trans N. Orleans Acad Ophthalmol. St Louis, CV Mosby. pp 167-178.
-
Bernstein M, Unger SM. Experiences with surgery and strontium
90 in the treatment of pterygium. Am J Ophthalmol 1960; 49: 1024-1029.
-
Burnam CF, Neill, W Jr. Use of beta ray of radium applicator:
Description of method and result obtained in superficial lesions of the eye.
Southern Med J 1940; 33: 279-284.
-
Busin M, Hlladay BL, Arffa RC, et al. Precarved lyophilized
tissue for lamellar keratoplasty in recurrent pterygium. Am J Ophthalmol 1986;
102: 222-227.
-
Butrus SI, Ashraf MF, Laby DM, et al. Increased numbers of
mast cells in pterygia. Am J Ophthalmol 1995; 119: 236-237.
-
Cameron M. Beta-irradiation of pterygia: comparison of
different areas treated. Brit J Ophthalm 1968; 52: 562-563.
-
Cameron M. Preventable complications of pterygium excision
with beta-irradiation. Brit J Ophthalm 1972; 56: 52-56.
-
Campbell J. Ernest Rutherford. The Dictionary of New Zealand
Biography, Vol. 3, 1901-1920. Auckland, New Zealand: Auckland University
Press, 1996.
-
Castroviejo R. La betatherapie dans la vascularisation
cornéenne. L’Ann Thérap Ophtalm 1953; 4: 289.
-
Castroviejo R. New masks to limit the active surface of
radiation on beta ray applicators. Trans Am Acad Ophthalmol Otolaryngol 1956;
60: 486.
-
Castroviejo R. Betatherapie en Ophtalmologie. In: Sedan J.
Thérapeutique Médicale Oculaire. Paris: Masson. 1957; 524.
-
Castroviejo R. Atlas de queratectomías y queratoplastias.
Barcelona: Salvat Edit. 1.ª edición 1964. Betaterapia: pp. 85-88, 166-183,
188-193, 218-223, 395-399, 403-405, 418, 424.
-
Castroviejo R. Atlas of keratectomy and keratoplasty.
Phildelphia: W.P. Saunders Co., 1966.
-
Castroviejo R. Keratectomie und Keratoplastik (Traducido y
editado por F. Holwich). Stuttgart: G. Thieme Verlag. 1968.
-
ChenZhuo L, Ocaña M, Murube E. Transplante de limbo alógeno.
Su supervivencia determinada por la clínica y la citología de impresión. Arch
Soc Canar Oftalmol 2003; 14: 11-14.
-
Cooper JS, Lerch IA. Post-operative irradiation of pterygia:
ten more years of experience. Radiology 1978; 128: 753-756.
-
Cooper JS, Lerch IA. Postoperative irradiation of pterygia: an
unexpected effect of the time/dose relationship. Radiology 1980; 135: 743-745.
-
Domínguez González JJ, León Hernández FA. Epidemiologia del
pterigión quirúrgico en la isla de La Palma. Arch Soc Canar 27. Oftalmol 2002;
13: 47-54.
-
Dusenbery KE, Alul IH, Holland EJ, et al. Irradiation of
recurrent ptergia: results and complications. Int J Radiat Oncol Phys 1992;
24: 315-320.
-
Dushku N, Hatcher SL, Albert DW, Reid TW. P53 expression and
relation to human papillomavirus infection in pingueculae, pterygia and limbal
tumors. Arch Ophthalmol 1992; 117: 1593-1599.
-
Dushku N, Tyler N, Reid TW. Immunohistochemical evidence that
pterygia arise from altered limbal epithelial basal stem cells (abstract).
IOVS 1993; 34: S1013.
-
Dushku N, Reid TW. Immunohistochemical evidence that human
pterygia originate from an invasion of vimentin-expressing altered limbal
epithelial basal cells. Curr Eye Res 1994; 13: 473-481.
-
Dushku N, Reid TW. P53 expression in altered limbal basal
cells of pingueculae, pterygia, and limbal tumors. Curr Eye Res 1997; 16:
1179-1192.
-
Ergin A, Bozdogan O. Study of tear function abnormality in
pterygium. Ophthalmologica 2001; 215: 204-209.
-
Errais K, Bouden J, Mili-Boussen I, et al. Effect of pterygium
surgery on corneal topography. Eur J Ophthalmol 2008; 18: 177-181.
-
Fernández-Vega Sanz L, Baamonde Arbaiza MB, Fernández-Vega
Sanz, J. Tratamiento del pterigium recidivante con injerto de membrane
amniótica. A propósito de un caso. Arch Soc Canar Oftalmol 2003; 14: 81-86.
-
Friedell HL, Thomas CI, Krohmer JS. Beta-ray application to
the eye. With the description of an applicator utilizing Sr90 and
its clinical use. Am J Ophthalm 1950; 33: 525-535.
-
Friedell HL, Thomas CI, Krohmer JS. An evaluation of the
clinical use of a Strontium 90 beta-ray application with a review of the
underlying principles. Radiology 1954; 71: 25-39.
-
Fukushima S, Inoue T, Inoue T, et al. Postoperative
irradiation of pterygium with 90Sr eye applicator. Int J Radiat Oncol Biol
Phys 1999; 43: 597-600.
-
Hilgers JH. Strontium 90 b-irradiation,
cataractogenicity, and pterygium recurrence. Arch Ophthalm 1966; 76: 329-333.
-
Illif CE. Beta irradiation in Ophthalmology. Arch Ophthalmol
1947; 38: 415-441.
-
Isohashi F, Inoue T, Xing S, et al. Postoperative irradiation
for pterygium: retrospective analysis in 1253 patients from the Osaka
University Hospital. Strahlenther Onkol 2006; 182: 437-442.
-
Jaros PA, DeLuise VP. Pingueculae and pterygia. Surv
Ophthalmol 1988; 32: 41-49.
-
Kenyon KR, Wagoner MD, Hettinger ME. Conjunctival autograft
transplantation for advanced and recurrent pterygium. Ophthalmology 1985; 92:
1461-1470.
-
Krohmer JS. Physical measurements on various beta-ray
applicators. Am J Roentgenol Radium Ther Nucl Med; 1951; 66: 791-796.
-
Lentino W, Zaret MM, Rossignol B, Rubenfeld S. Treatment of
pterygium by surgery followed by beta radiation. Am J Roentgenol 1959; 81:
93-98.
-
Lenz M. Radiotherapy for the prevention and obliteration of
corneal vascularization. Am J Ophthalmol 1950; 30: 46-51.
-
MacKenzie FD, Hirst LW, Kynaston B, Bain C: Recurrence rate
and complications after beta irradiation for pterygia. Ophthalmology 1991; 98:
1776-1781.
-
Merriam GR. The effects of beta radiation on the eye.
Radiology 1956; 66: 240-245.
-
Monteiro-Grillo I, Gaspar L, Monteiro-Grillo M, et al.
Postoperative irradiation of primary or recurrent pterygium: results and
sequelae. Int J Radiation Oncology Biol Phys 2000; 48: 865-869.
-
Monselise M, Schwartz M, Politi F, Barishak YR. Pterygium and
beta irradiation. Acta Ophthalmologica (Copenh.) 1984; 62: 315-319.
-
Murube J, Esteban de Antonio M, Murube E, Rivas L. Historia
del tratamiento del pterygion. Desde Susruta hasta la betaterapia surfocular
(parte I). Stud Ophthalmol 2008; 26: 55-66.
-
Murube J. Pterygium: Descriptive nomenclatura of the past.
Ocular Surface 2008; 6: 104-107.
-
Murube J. Pernal, carnabón o pterygion. La enfermedad
surfocular más frecuente de Canarias. Arch Soc Canar Oftalmol. 2008; 19: 1-9.
-
Nishimura Y, Nakai A, Yoshimasu T, et al. Long-term results of
fractioned strontium-90 therapy for pterygia. Int J. Radiat Oncol Biol Phys
2000; 46: 137-141.
-
Ojeda Guerra A, Martín Hernández R. Remedios oftalmológicos
populares de la tradición oral de Tenerife y La Palma. Arch Soc Canar Oftalmol
1976; 1: 89-94.
-
Okrainetz CL. Beta irradiation of the eye using the radium-D
applicator. Am J Ophthalmol 1950; 30: 52-62.
-
Ozarda AT. Evaluation of postexcisional strontium 90 beta ray
therapy for pterygium. South Med J. 1977; 70: 1304.
-
Pajic B, Pugnale-Verillotte N, Greiner RH, Pajic D, Eggspühler
A. Résultat de la thérapie au strontium-yttrium-90 des ptérygions J Fr.
Ophtalmol 2002; 25: 473-479.
-
Pajic B, Pallas A, Aebersold D, et al. Prospective study on
exclusive, nonsurgical strontium-/yttrium-90 irradiation of pterygia.
Strahlender Onkol 2004; 180: 510-516.
-
Pajic B, Greiner RH. Long term results of non-surgical,
exclusive strontium-/yttrium-90 beta-irradiation of pterygia. Radiotherapy and
Oncology 2005; 74: 25-29.
-
Paufique L, Rougier J. La bêtathérapie en pathologie oculaire.
Annales d’Oculistique 1951; 184: 577-585.
-
Pérez Silguero MA, Ayala Barroso E, Herrera Piñero R, Callejón
G, Martín Conde JA, Álvarez Rubio L, Abreu Reyes P. ¿Es eficaz la Mitomicina C
en el tratamiento del pterigion primario? Arch Soc Canar Oftalmol 1986-1998;
9: 9-14.
-
Pinkerton OD. Post-op Strontium 90 treatment lowers pterygium
recurrence. Ophthalmol Times , 15 mayo. 1986, p 54.
-
Rahman SE, Chung CK, Constable MB. Postoperative beta
irradiation in the treatment of pterygium. South Med J. 1979; 72: 823-826.
-
Rodríguez Martín J, de Bonis Redondo E, Rodríguez Santana A,
González de la Rosa MA. Transplante de membrana amniótica en patología de la
superficie ocular. Arch Soc Canar Oftalmol 2001; 12: 101-107.
-
Rodríguez Martín J, Martín Barrera F, Arteaga Hernández V,
Abreu Reyes J, Aguilar Estévez J, González de la Rosa M. Transplante de limbo
en las patología ocular. Arch Soc Canar Oftalmol 2003; 14: 71-76.
-
Rodríguez Gómez C, Cabrera F. Incidencia en pterigio.
Conferencia en V Jornadas Enfermería Oftalmológica en Canarias y XXXVI congr
Soc Canar Oftalmol. Lanzarote 5 junio 2008.
-
Rojas Álvarez E. Cirugía del pterigion: Una historia que aún
no termina. Arch Soc Españ Oftalmol 2008; 83: 333-334.
-
Rowen GE. Pterygium - surgical excision followed by beta
irradiation. Rocky Mountain Med J. 1968; 65: 47-49.
-
Swanberg H. A new ophthalmological applicator for pure beta
irradiation utilizing radium "D" (A preliminary report). Mississippi Valley
Med J & Radiol Rev. 1948; 70: 71-72.
-
Talbot AN. Complications of beta ray treatment of pterygia.
Trans Ophthalm Soc N.Z. 1979; 31: 62-63.
-
Tarr KH, Constable IJ. Late complications of pterygium
treatment. Brit J Ophhalmol 1980; 64: 496-505.
-
Tarr KH, Constable IJ. Radiation damage after pterygium
treatment: Austral J Ophthalmol 1981; 9: 97-101.
-
Tarr KH, Constable IJ. Radiation damage after pterygium
treatment: Trans Ophthalm Soc N. Z. 1981; 33: 139-142.
-
Thomas CI, Storaasli JP, Friedell HL. Lenticular changes
associated with beta radiation of the eye and their significance. Radiology
1962; 79: 588-597J.
-
Thommy CP, Abiose A. Beta irradiation in the management of
pterygium. J Ocular Therapy Surg 1983; 60: 236-241.
-
van den Brenk HAS. Results of prophylactic postoperative
irradiation in 1,300 cases of pterygium. Am J Roentgenol 1968; 103: 723-733.
-
Youngson RM. Recurrence of pterygium after excision. Brit J
Ophthalmol 1972; 56: 120-125.
-
Zauberman H. Pterygium and its recurrence. Amer J Ophthalmol
1967; 63: 1780-1786.




