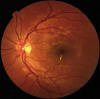
Fig. 1: Edema macular focal.
COMUNICACIÓN SOLICITADA
PERDOMO TRUJILLO Y1, LÓPEZ GÁLVEZ MI2
1 Doctora
en Medicina. Instituto de Oftalmobiología Aplicada (IOBA). Universidad de
Valladolid. España.
2 Doctora
en Medicina. Instituto de Oftalmobiología Aplicada (IOBA). Universidad de
Valladolid. Hospital Clínico Universitario de Valladolid. España.
INTRODUCCIÓN
La Diabetes Mellitus está considerada como la causa más frecuente de ceguera en la población activa en los países industrializados, siendo la retinopatía diabética proliferante la responsable de la mayoría de los casos de pérdida severa de visión y el edema macular diabético de los de disminución moderada, proceso que acontece sobretodo en diabéticos tipo 2. El láser ha sido y continúa siendo el «gold Standard» del tratamiento de las complicaciones oculares de la diabetes. La panretinofotocoagulación consigue evitar la progresión hacia la ceguera en un porcentaje significativo de pacientes. Sin embargo, los resultados del láser son mucho más decepcionantes en el control del edema macular donde sólo se detiene la progresión en un 50% de los pacientes. La búsqueda de nuevas alternativas se ha constituido en un objetivo prioritario y aunque los mecanismos patogénicos implicados en el desarrollo de este proceso aún no son bien conocidos, la implicación del factor de crecimiento vascular endotelial (VEGF) en el mismo ha abierto una nueva vía de investigación. Son numerosas las publicaciones que hablan de la utilidad de los antiangiogénicos en el control del edema macular y actualmente hay varios ensayos clínicos en marcha en Europa y EEUU que tratan de evaluar su seguridad y eficacia.
El edema macular diabético (EMD) constituye la primera causa de pérdida de agudeza visual en la población diabética, sobre todo en pacientes con edades comprendidas entre los 20 y los 60 años de edad y con retinopatías diabéticas no proliferantes. Aunque la prevalencia es variable dependiendo de las distintas series consultadas, actualmente se acepta que afecta a 1 de cada 10 pacientes diabéticos, un 40% de los cuales sufre una importante repercusión sobre su función visual.
Se trata de un proceso complejo que responde a una etiopatogenia multifactorial. El edema macular diabético aparece como consecuencia de la ruptura de la barrera hemato-retiniana interna y externa y el acúmulo de fluido a nivel de la retina central. La hipoxia retiniana y la síntesis y liberación de factores vasoproliferativos juegan también un papel fundamental. El exceso de fluido en el área macular está asociado a una alteración del flujo de iones y se manifiesta clínicamente por un aumento en el grosor de la retina. Este aumento del espesor macular provoca el estrechamiento y la distorsión de las neuronas que con el tiempo da paso a muerte neuronal por lo que inicialmente se produce una disminución reversible de la agudeza visual que con el tiempo se transforma en permanente (1).
El rezume de plasma desde los capilares de la retina central puede ser visualizado en la angiografía y puede ser focal (fig. 1), cuando procede de grupos concretos de microaneurismas asociándose a la alteración de la barrera hemato-retiniana, o difuso (fig. 2), cuando no se asocia a alteraciones estructurales visibles y en cambio están presentes ciertas alteraciones microscópicas en los vasos retinianos. Ha sido descrita la alteración de las proteínas que forman las «tight junctions» entre células endoteliales. Dichas alteraciones no son detectadas en la angiografía y se asocian a una concentración intraocular elevada de factores estimuladores de la permeabilidad vascular (1-3).
![]()
Fig. 2: Edema macular difuso y quístico (tomografía de coherencia óptica, OCT).
Los protocolos que rigen en la actualidad el tratamiento del edema macular diabético son los que se establecieron en base a los resultados del Estudio para el tratamiento precoz de la retinopatía diabética (ETDRS). De acuerdo con estos protocolos el «gold Standard» del tratamiento es el láser y se debe aplicar siempre que exista un edema macular clínicamente significativo independientemente de la agudeza visual del paciente. La técnica varía dependiendo del tipo de edema: fotocoagulación focal para los edemas maculares focales y en rejilla o rejilla modificada para los edemas maculares difusos.
Los resultados del tratamiento láser son bastante alentadores en los edemas maculares focales pero decepcionantes en los edemas maculares difusos probablemente por su complejidad etiopatogénica lo que justifica que desde hace ya varios años se estén buscando nuevas alternativas terapéuticas para este tipo de edemas.
FACTORES DE CRECIMIENTO Y EDEMA MACULAR
La hipoxia retiniana es un condicionante decisivo en la patogénesis del EMD al incrementar la expresión del factor de crecimiento vascular endotelial (VEGF), originalmente descrito como factor tumoral de permeabilidad vascular y también conocido como VEGF-A, que está considerado un potente inductor de la permeabilidad vascular y la angiogénesis (4-6).
Los niveles intraoculares de VEGF-A se encuentran elevados en pacientes con EMD y son significativamente más altos en pacientes con rezume importante en el área macular que en pacientes con rezume mínimo (7). En modelos animales de diabetes se ha visto que esta elevación coincide con la ruptura de la barrera hemato-retiniana. Además la inyección de VEGF-165 en ojos de animales sanos es capaz de inducir alteraciones vasculares similares a las observadas en la retinopatía diabética (8).
El gen VEGF-A esta conformado por 8 exones y un exón alternativo del cual derivan las 9 isoformas del VEGF-A descritas en humanos: VEGF121, VEGF145, VEGF148, VEGF162, VEGF165, VEGF165b, VEGF183, VEGF189, VEGF206 (9) Todas las isoformas excepto VEGF121, poseen un sitio de unión potencial a la plasmina (fibrinolisina) que en caso de unión a esta proteína genera una isoforma menor VEGF110 (9,10).
El VEGF-A regula la homeostasis y el desarrollo de los vasos sanguíneos y linfáticos, además tiene importantes efectos sobre las células neurales. En la RD el VEGF es producido por las células del epitelio pigmentario, los pericitos y las células endoteliales de la retina en respuesta a la hipoxia causada por la alteración estructural de los capilares y es estimulado por otros factores de crecimiento como el «transforming growth factor», las interleukinas o el «platelet-derived growth factor». El VEGF-A se une a tres variantes del receptor III de la tirosin kinasa, se denominan receptores 1, 2 y 3 del VEGF-A. Cada isoforma del VEGF-A se une a un subtipo especifico de receptor generando señales metabólicas diversas, la especificidad de la señal originada por los distintos receptores VEGF-A está estrechamente modulada por el reclutamiento de correceptores como las neurolipinas, heparan sulfato, integrinas o caderinas (11).
Estas observaciones han convertido al VEGF-A en una importante diana terapéutica en el tratamiento de las enfermedades caracterizadas por un exceso de vascularización y permeabilidad vascular como sucede en el desarrollo del daño retiniano microvascular diabético.
ANTIANGIOGÉNICOS Y EDEMA MACULAR
Existe un gran número de publicaciones científicas referidas al papel de las terapias antiangiogénicas en el tratamiento del EMD. Publicaciones, que ponen de manifiesto su capacidad para reducir el espesor retiniano e inducir la regresión de la neovascularización mejorando la función visual aunque la respuesta es variable y los beneficios suelen ser transitorios requiriéndose inyecciones repetidas. Pese a ello, la mejoría de la agudeza visual ha despertado un gran interés por su utilización en la práctica clínica y se han puesto en marcha varios ensayos clínicos cuya finalidad es determinar su seguridad y eficacia para esta indicación. La limitación de estos fármacos para producir un efecto mantenido en los pacientes con EMD es reflejo de la complejidad que caracteriza la patogénesis de esta entidad.
Existen en la actualidad 10 fármacos antiangiogénicos reconocidos y aprobados por la «Food and Drug Administration» (FDA) en los Estados Unidos, sus indicaciones son diversas y sólo 3 son utilizados en oftalmología (12). En general los fármacos antiangiogénicos actúan bloqueando la producción de VEGF-A, bloqueando directamente al VEGF-A, o bloqueando la unión al receptor o la señalización generada por el mismo. Los tres fármacos utilizados en oftalmología actúan neutralizando de manera específica al VEGF-A.
Pegaptanib sódico (Macugen, Eyetech Pharmaceuticals, Inc., New York, NY)
Este medicamento fue aprobado en el año 2004 por la FDA en los Estados Unidos para el tratamiento de la forma húmeda de Degeneración Macular Asociada a la Edad (DMAE). Pegabtanib es un aptámero formado por una única cadena de ácido ribonucleico. Posee alta especificidad, se une a la isoforma VEGF165, neutraliza la isoforma VEGF164 y no es inmunogénico. Se administra mediante inyección intravítrea y ha demostrado un buen perfil de seguridad en los ensayos clínicos llevados a cabo para el tratamiento de la DMAE húmeda.
En el año 2005 concluyó el primer estudio de fase II (13), randomizado, controlado, doble ciego, multicéntrico y comparativo con pegabtanib en pacientes con EMD clínicamente significativo, el estudio se realizó en 172 pacientes y tuvo como objetivo determinar la seguridad y eficacia de este fármaco en el EMD. La pauta utilizada en el estudio es similar a la que se utiliza en pacientes con degeneración macular asociada a la edad: se inyectan tres dosis (0,3 mg, 1 mg, 3 mg) intravítreas de fármaco o placebo cada 6 semanas durante un mínimo de 12 semanas. En la semana 36 la agudeza visual media de todos los grupos tratados con pegaptanib fue mejor que la del grupo control, siendo esta diferencia estadísticamente significativa para la dosis de 0,3 mg, por lo que ha sido la dosis seleccionada para posteriores estudios. Los pacientes mostraron también una disminución importante del espesor retiniano central y una menor necesidad de tratamiento adicional con láser durante su seguimiento. Con respecto a la seguridad, entre las 652 inyecciones realizadas sólo se registró un caso de endoftalmitis (0,15%) que no se asoció a severa pérdida visual. Actualmente se encuentran en fase de reclutamiento otros dos estudios de fase II/III, multicéntricos, que abarcarán 300 pacientes respectivamente (www.clinical trials.gov). Sus conclusiones están previstas para el año 2010 y permitirán conocer la utilidad real de este fármaco en el control de las complicaciones oculares de la diabetes.
Ranibizumab (Lucentis, Genetech, Inc. South San Francisco, CA)
Es un anticuerpo monoclonal recombinante, totalmente humanizado, que actúa sobre el fragmento Fab (antigen-binding fragment) y neutraliza todas las isoformas biológicamente activas del VEGF-A. Ha sido desarrollado exclusivamente para uso oftalmológico. Estudios preclínicos han demostrado que el ranibizumab inhibe la permeabilidad vascular y la angiogénesis. (Lowe J et al, unpublished data). También se han publicado algunos estudios pilotos de pequeñas series de casos que han demostrado la eficacia de ranibizumab en el EMD utilizando dosis de 0,3 mg o 0,5 mg, a la hora de reducir el espesor retiniano central en pacientes con edema macular clínicamente significativo (14).
Además parece tener un buen perfil de seguridad. Los datos iniciales obtenidos a partir de un estudio multicéntrico en fase I/II en 64 pacientes con degeneracion macular asociada a la edad indican la viabilidad de la administración intravítrea repetida del fármaco siendo los efectos adversos más frecuentes la aparición de una inflamación leve transitoria y de pequeñas hemorragias locales en el punto de inyección. No se detectó ningún evento adverso de tipo sistémico.
En la actualidad existen cinco estudios multicéntricos, randomizados, de fase II/III en etapa de reclutamiento (Novartis, Allergan y Genetech). El primero de ellos abarca una serie aproximada de 700 pacientes, y su objetivo es determinar la mejor opción terapéutica en los pacientes con EMD ya sea: láser exclusivo, láser combinado con inyección intravítrea de triamcinolona, láser combinado con inyección intravítrea de ranibizumab o inyección intravítrea de ranibizumab aislada. Hasta el momento no se conoce si los esteroides intravítreos o las inyecciones de anti VEGF-A, asociadas o no a tratamiento con láser, son más efectivos que el tratamiento láser convencional. Entre las hipótesis existentes se plantea la posibilidad de que uno o ambos tipos de inyección intravítrea, con o sin tratamiento láser puedan favorecer un mejor resultado funcional que el tratamiento láser convencional. Otro de los objetivos del estudio es determinar si los efectos secundarios justifican los beneficios del tratamiento anti VEGF-A. El resto de los ensayos se orientan hacia la determinación de la tolerancia y la eficacia de este fármaco. Sus características pueden ser observadas en la página web www.clinicaltrials.gov
Bevacizumab (Avastin, Genetech)
Es un anticuerpo IgG monoclonal, recombinante, que se une e inhibe todas las isoformas del VEGF-A. Se trata de un fármaco aprobado por la FDA para el tratamiento del cáncer metastásico de colon, no autorizado para uso oftalmológico y que se utiliza fuera de indicación, como uso compasivo, en el tratamiento de la neovascularización coroidea asociada a la DMAE, a la miopía magna y otras patologías así como en el control del edema de mácula secundario a oclusiones venosas o a la diabetes mellitus, siendo numerosas las publicaciones científicas que avalan su eficacia (15,16). Existen en la actualidad dos estudios con Bevacizumab en pacientes con EMD, uno de ellos, estudio de fase II, auspiciado por la «Diabetic Retinopathy Clinical Research Network», encaminado a determinar la dosis y los efectos relacionados con los intervalos entre dosis de bevacizumab, ha terminado su fase de reclutamiento y se encuentra pendiente la publicación de sus resultados (www.clinicaltrials.gov).
El segundo es un estudio fase I que compara la eficacia entre inyección intravítrea de triamcinolona e inyección de bevacizumab en pacientes con EMD. Los hallazgos preliminares de esta serie de 28 pacientes fueron publicados recientemente, concluyendo que una única inyección de triamcinolona ofrecía ciertas ventajas sobre la inyección de bevacizumab en el manejo a corto plazo del edema macular diabético refractario, específicamente referido a los cambios en el espesor retiniano central (17).
VEGF-trapR1R2 (Aflibercept, Regeneron Pharmaceuticals, Tarrytown, NY)
Es una proteína de fusión recombinante, análogo soluble del receptor VEGF-A, que contiene los dominios Ig 2 del VEGF-R1 e Ig 3 del VEGF-R2, que se fusionan a la porción Fc de la IgG 1 humana. El VEGF-TRAPR1R2 se une al VEGF-A con una altísima afinidad y la administración de una inyección subcutánea de 25 mg/kg de VEGF-TRAPR1R2 ha demostrado neutralizar eficazmente al VEGF-A en ratas con tumores secretores de VEGF (18,19).
Este compuesto es un antagonista selectivo pero no especifico del VEGF-A ya que resulta difícil inhibir este receptor sin inhibir otros receptores como el platelet-derived growth factor (PDGF) y los receptores del stem cell factor (20-23). Los efectos de esta actividad adicional del fármaco son desconocidos lo cual hace prudente orientar las investigaciones hacia la búsqueda de inhibidores más selectivos (24).
Un ensayo clínico de fase I, que reúne una pequeña serie de 5 pacientes sometidos a inyección intravítrea de VEGF-trap ha sido diseñado para el estudio de la eficacia de este medicamento en pacientes con EMD, sus resultados aun no han sido publicados (www.clinicaltrials.gov).
Bevasiranib sodium (Opko Health, Inc.)
Es un inhibidor de la transcripción intracelular del VEGF-A. Se encuentran en curso ensayos clínicos de este medicamento para la DMAE, pero no se han publicado aún estudios en pacientes con edema macular diabético (www.clinicaltrials.gov).
Es un inhibidor no selectivo, que actúa interfiriendo al RNA e inhibiendo la expresión de un gen específico. Sin embargo muy recientemente se ha publicado un trabajo en un modelo experimental de neovascularización coroidea en ratones en el que se apunta un mecanismo de acción diferente (25) al describir los autores que SiRNAs no dirigidos son capaces de inhibir la neovascularizción coroidea de manera semejante a como lo hacen los SiRNA dirigidos específicamente contra el VEGF-A. La razón radica en la activación de un receptor celular de superficie de múltiples células endoteliales, el TLR3, incluyendo las de la aorta, la dermis, el pulmón y otros tejidos lo que los transforma en fármacos con potenciales efectos secundarios que tienen que ser estudiados.
SEGURIDAD DE LOS ANTIANGIOGÉNICOS
Aunque todos estos fármacos se administran localmente por vía intravítrea y por lo tanto parecen bastante seguros, parte de las dosis administradas de anti VEGF-A en la cavidad vítrea pueden pasar a la circulación sistémica produciendo efectos secundarios sistémicos que resultan particularmente importantes en los pacientes diabéticos. Por esta razón es necesario no sólo conocer las ventajas potenciales de estos nuevos fármacos sino también los efectos adversos que pueden desencadenar. Teniendo en cuenta, además, que el tratamiento con inhibidores del VEGF-A en el caso del edema macular diabético será necesario aplicarlo, al menos teóricamente durante años, es necesario considerar que la inhibición crónica del VEGF-A puede causar efectos adversos que, por otro lado, pudieran no aparecer de manera inmediata.
Los efectos adversos descritos como consecuencia del bloqueo del VEGF-A incluyen: la hipertensión arterial, proteinuria, defectos de cicatrización, deficiente desarrollo de circulación colateral, inhibición de la médula ósea, infertilidad, inhibición de la regeneración del músculo esquelético y de la remodelación cardíaca (26).
Hoy en día, se sabe, que el VEGF-A está implicado en el control del tono vascular y en el funcionamiento de los capilares glomerulares. La hipertensión es provocada por un predominio de la vasoconstricción y la proteinuria es secundaria a la alteración de las células endoteliales glomerulares y al colapso de las asas capilares del glomérulo. De hecho, tanto la hipertensión como la proteinuria se considera que son buenos marcadores de la inhibición sistémica de VEGF-A y destacan invariablemente entre los efectos adversos de la administración sistémica de bevacizumab descritos en los ensayos clínicos de este medicamento en procesos oncológicos (26,27).
El deficiente desarrollo de circulación colateral para algunos autores pudiera guardar relación con los eventos isquémicos cardiovasculares reportados en ensayos clínicos con inhibidores de VEGF-A. Algunos estudios han mostrado la presencia de concentraciones bajas de VEGF-A y sus receptores en el miocardio de pacientes diabéticos, resultando en una inadecuada formación de colaterales. Estos hallazgos sugieren que los pacientes diabéticos pudieran ser más propensos al desarrollo de isquemia del miocardio cuando se bloquea al VEGF-A circulante (27).
A nivel ocular se han descrito endoftalmitis, cataratas y desprendimientos de retina aunque son poco frecuentes (<1,5%) siendo mas comunes las hemorragias subconjuntivales o las abrasiones corneales (26). De particular interés es en la inhibición crónica la repercusión sobre el epitelio pigmentario y la coriocapilar. Es bien conocido el hecho de que la secreción del VEGF-A ejerce un efecto neuroprotector sobre la retina isquémica y ayuda al mantenimiento de la coriocapilar. La inhibición crónica de este factor podría acompañarse de una pérdida de células ganglionares y de importantes secuelas.
CONCLUSIONES
No cabe duda de que los antiangiogénicos se muestran como una alternativa prometedora para el control de las complicaciones oculares de la diabetes y más concretamente para el edema macular diabético pero es necesario definir las dosis, la pauta y el perfil de seguridad antes de que puedan ser incluidos en los protocolos de tratamiento y para ello es necesario que concluyan los ensayos clínicos que están en marcha. Además es preciso determinar si pueden ser utilizados como única terapia o es necesario usarlos en combinación con otros tratamientos para prolongar su efecto y evitar reacciones adversas. Estos fármacos representan una nueva era en el control del edema macular diabético con un mayor énfasis en los tratamientos médicos conservadores y menor en los tratamientos quirúrgicos más destructivos.
BIBLIOGRAFÍA
Nguyen QD, Tatlipinar S, Shah SM, Haller JA, Quinlan E, MD, Sung J, Zimmer-Galler I, Do DV, Campochiaro PA. Vascular Endothelial Growth Factor is a critical stimulus for Diabetic Macular Edema. Am J Ophthalmol 2006; 142: 961-969.
Moore J, Bagley S, Ireland G. Three dimensional analysis of microaneurysms in the human diabetic retina. J Anat 1999; 194: 89-100.
Antcliff RJ, Marshall J. The pathogenesis of edema in diabetic maculopathy. Semin Ophthalmol 1999; 14: 223-232.
Ozaki H, Hayashi H, Vinores SA. Intravitreal sustained release of VEGF causes retinal neovascularization in rabbits and breakdown of the blood-retinal barrier in rabbits and primates. Exp Eye Res 1997; 64: 505-517.
Derevjanik NL, Vinores SA, Xiao W-H. Quantitative assessment of the integrity of the blood-retinal barrier in mice. Invest Ophthalmol Vis Sci 2002; 43: 2462-2467.
Chun DW, Heier JS, Topping TM, Duker JS, Bankert JM. A Pilot Study of Multiple Intravitreal Injections of Ranibizumab in Patients with Center-Involving Clinically Significant Diabetic Macular Edema. Ophthalmology 2006; 113: 1706-1712.
Funatsu H, Yamashita H, Ikeda T. Vitreous levels of interleukin-6 and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2003; 110: 1690-1696.
Starita C, Patel M, Katz B, Adamis AP Vascular endothelial growth factor and the potential therapeutic use of pegaptanib (macugen) in diabetic retinopathy. Dev Ophthalmol. 2007; 39: 122-148.
Takahashi H, Shibuya M. The vascular endothelial growth factor (VEGF)/VEGF receptor system and its role under physiological and pathological conditions. Clin Sci 2005; 109: 227-241.
Robinson CJ, Stringer SE. The splice variants of vascular endothelial growth factor (VEGF) and their receptors. J Cell Sci 2001; 114: 853-865.
Cébe-Suarez S, Zehnder-Fjällman A, Ballmer-Hofer K. The role of VEGF receptors in angiogenesis; complex partnerships. Cell. Mol. Life Sci 2006; 63: 601-615.
Aiello LP. Beyond VEGF: VEGF-independent molecular and genetic pathways and their implications for the treatment of diabetic eye disease. Program and abstracts of the 40th Annual Scientific Meeting of the Retina Society; September 27-30, 2007; Boston, Massachusetts.
Cunningham ET, Adamis AP, Altaweel M. A phase II randomized double-masked trial of pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology 2005; 112: 1747-1757.
Chun J, Heier T, Topping J, Duker J, Bankert J. A Pilot Study of Multiple Intravitreal Injections of Ranibizumab in Patients with Center-Involving Clinically Significant Diabetic Macular Edema. Ophthalmology 113;10; 1706-1712.
Fung AE, P J Rosenfeld PJ, Reichel E. The International Intravitreal Bevacizumab Safety Survey: using the internet to assess drug safety worldwide. Br J Ophthalmol 2006; 90: 1344-1349.
Diabetic Retinopathy Clinical Research Network. A Phase II Randomized Clinical Trial of Intravitreal Bevacizumab for Diabetic Macular Edema. Ophthalmology 2007; 114: 1860-1867.
Paccola L, Costa RA, Folgosa MS, Barbosa JC, Scott IU, Jorge R. Intravitreal triamcinolone versus bevacizumab for treatment of refractory diabetic macular oedema (IBEME study).Br J Ophthalmol 2008; 92: 76-80.
Wulff C, Wilson H, Wiegand SJ, Rudge JS, Fraser HM. Prevention of thecal angiogenesis, antral follicular growth and ovulation in the primate with vascular endothelial growth factor trapR1R2. Endocrinology 2002; 143: 2797-2807.
Wong AK, Alfert M, Castrillon DH, Shen Q, Holash J, Yancopoulos GD, Chin L. Excessive tumor-elaborated VEGF and its neutralization define a lethal paraneoplastic syndrome. Proc Natl Acad Sci 2001; 98: 7481-7486.
Fabbro D, Buchdunger E, Wood J, Mestan J, Hofmann F, Ferrari S, Mett H, O’Reilly T, Meyer T. CGP 41251 a protein kinase inhibitor with potential as an anti-cancer agent. Pharmacol Ther 1999; 82: 293-298.
Bold G, Altmann K-H, Bruggen J, Frei J, Lang M, Manley PW, Traxler P, Wietfeld B, Buchdunger E, Cozens R, Ferrari S, Furet P, Hofmann F, Martiny-Baron G, Mestan J, Rosel J, Sills M, Stover D, Acemonglu F, Boss E, Emmengger R, Lasser L, Masso E, Roth R, Schlachter C, Vetterli W, Wyss D, Wood JM. New anilino-phthalazines as potent and orally well absorbed inhibitors of the VEGF receptor tyrosine kinases useful as antagonists of tumor driven angiogenesis. J Med Chem 2000; 43: 2310-2323.
Drevs J, Hofmann I, Hugenschmidt H, Wittig C, Madjar H, Muller M, Wood J, Martiny-Baron G, Unger C, Marme D. Effects of PTK787/ZK 222584, a specific inhibitor of vascular endothelial growth factor receptor tyrosine kinases, on primary tumor, metastasis, vessel density, and blood flow in a murine renal cell carcinoma model. Cancer Res 2000; 60: 4819-4824.
Wood JM, Bold G, Stover D, Hofmann F, Buchduneger E, Mestan J, Towbin H, Schnell C, Mett H, O’Reilly T, Cozens R, Rosel J, Siemeister G, Menrad A, Schirner M, Thierauch K-H, Schneider MR, Martiny-Baron G, Drevs J, Marme D. PTK787/ZK 222584, a novel and potent inhibitor of vascular endothelial growth factor receptor tyrosine kinases, impairs vascular endothelial growth factor-induced responses and tumor growth after oral administration. Cancer Res 2000; 60: 2178-2189.
Yoshitsugu Saishin , Yumiko Saishin , Kyoichi Takahashi, Raquel Lima e Silva, Donna Hylton, John S. Rudge, Stanley J. Wiegand , Peter A. Campochiaro, VEGF-TRAPR1R2 suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier. J. Cell. Ph 2003;195: 241-248.
Kleinman ME, Yamada K, Takeda A, Chandrasekaran V, Nozaki M, Baffi JZ, Albuquerque RJ, Yamasaki S, Itaya M, Pan Y, Appukuttan B, Gibbs D, Yang Z, Karikó K, Ambati BK, Wilgus TA, DiPietro LA, Sakurai E, Zhang K, Smith JR, Taylor EW, Ambati J. Sequence and target-independent angiogenesis suppression by siRNA via TLR3. Nature 2008; 452: 591-597.
Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E, P, Ferrara N, Fyfe G, Rogers B, Ross R, Kabbinavar F. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. Engl J Med 2004; 350: 2335-2342.
Simó R, Hernández C. Intravitreous anti-VEGF for diabetic retinopathy: hopes and fears for a new therapeutic strategy. Diabetologia. 2008; 11 [Epub ahead of print].