
REVISIÓN ACTUALIZADA
GONZÁLEZ MARTÍN-MORO J1, PILO DE LA FUENTE B2, PENA FERNÁNDEZ I3
1
Licenciado en Medicina. Servicio de Oftalmología. Hospital del Henares. Coslada.
Madrid.
2
Licenciado en Medicina. Servicio de Neurología. Hospital de Arganda. Arganda del
Rey. Madrid.
3
Licenciado en Medicina. Servicio de Radiología. Hospital de la Princesa. Madrid.
RESUMEN
En los últimos años las técnicas de neuroimagen han experimentado un desarrollo espectacular. La resonancia magnética (RM) constituye la técnica indicada en la mayor parte de las situaciones. Las indicaciones de la tomografía computerizada (TC) quedan relegadas de forma genérica a la visualización de hueso, sangre, o cuerpos extraños. En algunas situaciones concretas como la oftalmopatía distiroidea, la TC resulta también superior a la RM. En el campo de la neuroftalmología para la detección de patología desmielinizante hay dos secuencias que resultan fundamentales: RM potenciada en T1 con gadolinio y supresión grasa en el diagnóstico de la neuritis retrobulbar y FLAIR para la detección de las lesiones desmielinizantes. La angiografía de sustracción digital (angiografía convencional) se mantiene como gold standard, en lo que al diagnóstico de la patología aneurismática se refiere, pero la angioRM y el angioTC son herramientas muy potentes que han ido ganando resolución e indicaciones en los últimos años.
INTRODUCCIÓN
En el año 1952 Felix Bloch y Edward Mills Purcell, recibieron un merecido premio Nobel por sus aportaciones al desarrollo de la resonancia magnética. En poco más de 50 años, esta técnica de imagen se ha convertido en una de las herramientas diagnósticas más potentes de las que disponemos, y la radiología ha sufrido una revolución que hace que los médicos de otras especialidades nos sintamos perdidos, enfrentándonos a un sinfín de acrónimos nuevos. Como oftalmólogos generales, y especialmente si nos dedicamos a determinados campos como la neuroftalmología o la cirugía orbitaria es preciso que dominemos al menos una serie de conceptos básicos, para que de este modo seamos capaces de seleccionar la prueba más adecuada y trasmitamos al radiólogo la información clínica más relevante, incluyendo en la petición de la prueba el diagnóstico diferencial. El presente artículo no pretende hacer una descripción minuciosa de las distintas técnicas, sino orientar al oftalmólogo general sobre que prueba debe solicitar en cada situación (tabla 1). Para una información más detallada, remitimos al lector al excelente artículo publicado por Lee en el año 2004 (1).

De forma genérica, para la visualización de las vías ópticas, resulta superior la resonancia magnética (RM) en casi todas las indicaciones, esto es así porque los tejidos blandos contienen más agua que el hueso, y por lo tanto más hidrógeno y la RM funciona precisamente estimulando los átomos de hidrógeno. Por el contrario, en el caso de los traumatismos, la tomografía computerizada (TC), será de mayor utilidad para visualizar las fracturas óseas y la presencia de sangre.
TOMOGRAFÍA COMPUTERIZADA (TC)
Las indicaciones de la TC se reducen a una serie de situaciones concretas como la visualización de hueso o sangre, la sospecha de cuerpo extraño intraocular y aquellas circunstancias en las que por la urgencia de la situación la RM no esté disponible (1).
El contraste aumenta la sensibilidad y especificidad de la TC, y debe ser solicitado en muchas de las ocasiones. La alta densidad radiológica del hueso y la sangre hacen que la visualización de la hemorragia durante la fase aguda, la neuropatía óptica traumática o la fractura orbitaria sean algunas de las situaciones en las que no se precisa el uso de contraste (fig. 1).
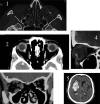
Fig. 1: La presencia de cuerpo extraño intraocular (1), las drusas papilares
(2), la oftalmopatía distiroidea (3), el traumatismo orbitario con sospecha de
fractura orbitaria (4), y el sangrado reciente (5) son algunas de las escasas
situaciones en las que la TC puedc ser superior a la RM. En ninguna de estas
situaciones se precisa el uso de contraste.
Asimismo la oftalmopatía distiroidea tampoco precisa habitualmente del uso de contraste, porque la grasa orbitaria, muy poco radiopaca permite una buena visualización de la musculatura extraocular. En ese caso, se recomienda la realización de una TC orbitaria en lugar de una TC craneal (los cortes son más finos 3 mm frente a 5 mm y la angulación es diferente).
Además del importante coste económico que tiene solicitar cualquiera de estas pruebas diagnósticas, en el caso de la TC existe un coste oculto. No debemos olvidar que solicitar una TC no es inocuo, pues supone para el paciente recibir una cantidad no despreciable de radiación ionizante. Una TC abdominal requiere una dosis efectiva equivalente a 500 radiografías de tórax o a la radicación natural de fondo de más de tres años. En el caso de la TC craneal que es la que habitualmente solicitamos, la exposición es menor, pero equivale a unas 115 radiografías de tórax, y a un año de radiación natural de fondo (2).
La población expuesta a distintos niveles de radiactividad tras las explosiones atómicas de Hiroshima y Nagasaki ha sido estudiada en profundidad y constituye un excelente modelo para correlacionar la exposición a la radiactividad y el riesgo de cáncer. Basándonos en este modelo puede afirmarse sin lugar a dudas que la dosis recibida durante la realización de una TC produce un aumento pequeño pero incuestionable de la incidencia de cáncer. Este aumento de riesgo puede ser pequeño referido al paciente de forma individual, pero tiene un efecto indudable a nivel poblacional. Algunos estudios atribuyen a la TC entre el 0% y el 6% de los tumores diagnosticados en los países occidentales (3). Se ha calculado que la TC genera en la población americana unas 7.200 muertes anuales. Suponiendo que un 30% de esas pruebas se hubieran pedido de forma no necesaria, estaríamos hablando de un exceso de al menos mil muertes evitables (4). Este aumento de riesgo es especialmente importante en los niños que son unas diez veces más sensibles a los efectos carcinógenos de la radiación (2). El hecho de que en numerosas ocasiones estas pruebas se pidan de forma innecesaria, por satisfacer la demanda del paciente, por razones legales o «por si acaso», debe hacernos reflexionar, sobre todo si tenemos en cuenta que al efecto carcinógenos, «fácilmente» medible, hay que sumar posibles efectos genéticos, mucho más difíciles de cuantificar que afectarán a las generaciones venideras (4).
Probablemente una de las situaciones más cotidianas en la que de forma innecesaria se solicita una TC es la parálisis oculomotora. Sabemos que en nuestro medio, cuando se trata de mononeuropatías, la mayor parte de estos procesos son de etiología isquémica, y la evolución espontánea a la curación es la norma. Por ello una actitud más racional que pedir la prueba de imagen (habitualmente un TC) de entrada es revisar al paciente dos semanas después, y sólo si no se ha producido la evolución esperada pedir la prueba de imagen. La corta edad, la afectación simultánea de varios pares craneales, los antecedentes oncológicos, la aparición de clínica neurológica asociada o la parálisis de III par craneal con afectación pupilar o con regeneración aberrante, constituyen excepciones a esta regla general.
RESONANCIA MAGNÉTICA (RM)
Los equipos de RM han ido evolucionando de forma espectacular en los últimos tiempos, y en este momento la RM constituye la técnica de imagen más sensible para la detección de patología neurológica. La resolución de las imágenes depende de la potencia del campo magnético aplicado. La mayor parte de los equipos actuales trabajan con una potencia magnética de 1.5 Teslas. Si tenemos en cuenta que el campo magnético terrestre es de aproximadamente 0.00005 Teslas, nos podemos hacer una idea de la potencia de estos imanes. También están comercializados aparatos de 3 Teslas, pero por su mayor coste su uso es mucho menos habitual. Cuanto más potente sea el campo magnético, mayor será la resolución y el número de cortes obtenidos. De este modo una RM de 0.6 Teslas genera cortes de 10 mm de grosor, la de 1.5 Teslas (habitual) reduce los cortes a 5 mm, y los aparatos de 3 Teslas generan secciones de entre 3 y 4 mm. Además al aumentar la potencia de los campos magnéticos, se reduce el tiempo de adquisición de las imágenes de forma sustancial y la aparición de artefactos debidos al movimiento del paciente. Por ello un aparato de RM de 3 Teslas es capaz de detectar un mayor número de lesiones desmielinizantes que uno de 1.5 Teslas (5).
Inicialmente existían dos secuencias de RM y se hablaba de resonancia magnética «potenciada en T1 o en T2», sin embargo en los últimos años se han ido desarrollando nuevas secuencias (FLAIR, SE, IR, RARE, FSE, FISP, FLASH, SMASH, SENSE, GRASS, SPGR…) que han aumentado la sensibilidad y especificidad de la técnica para la detección de determinadas lesiones.
Secuencia T1
Secuencia que permite visualizar mejor la anatomía. En esta secuencia, el agua genera poca señal (se ve oscura), en tanto que la grasa brilla. Por ello el vítreo, con alto contenido en agua se ve negro, mientras que la grasa orbitaria se ve muy brillante. Con el parénquima cerebral sucede algo muy similar, la sustancia blanca por su alto contenido en mielina aparece muy brillante, en tanto que la sustancia gris genera una menor señal y se ve menos brillante. En definitiva la sustancia gris se ve gris, y la blanca aparece blanca, y por ello la imagen generada es muy parecida a la anatómica (fig. 2).

Fig. 2: En esta comparativa, se aprecia el distinto aspecto que tienen las
secuencias más frecuentemente utilizadas. Las tres primeras imágenes
corresponden a un meningioma del nervio óptico. En T1 la grasa orbitaria aparece
brillante y el vítreo oscuro. La secuencia T1 da una imagen más anatómica que
T2. En T2 por el contrario el vítreo aparece brillante y la grasa da una señal
baja. La secuencia T2 resulta de gran utilidad para poner de manifiesto la
patología. Como puede apreciarse en T2 el tumor es más evidente. La cuarta
imagen corresponde a una secuencia FLAIR, esta secuencia es de elección para la
detección de patología desmielinizante.
Esta secuencia se usa en muchas ocasiones en combinación con gadolinio. El gadolinio no es un compuesto, sino que es el elemento número 64 de la tabla periódica. Son excepcionales las alergias a este contraste. Actúa tiñendo de forma totalmente inespecífica todo tipo de lesiones en las que exista una alteración de la permeabilidad o un exceso de vascularización. Por ello hace resaltar de forma indiscriminada tumores y procesos inflamatorios.
En nuestra especialidad, probablemente la indicación más habitual para solicitar una RM con gadolinio es la sospecha de neuritis retrobulbar. La visualización del nervio óptico por su pequeño tamaño, su movilidad y los artefactos generados por el líquido cefalorraquídeo, la grasa orbitaria, el hueso y el aire circundante resulta compleja (6). Por eso en este caso se precisa la supresión de la grasa orbitaria circundante, que resulta muy brillante en T1 (1).
Para saber si una RM en T1 se ha realizado o no con contraste, debemos fijarnos en los vasos sanguíneos, en los plexos coroideos y en las mucosas. Si aparecen blancos, eso quiere decir que se ha utilizado gadolinio (fig. 3).

Fig. 3: En el blefarospasmo esencial no es preciso solicitar prueba de imagen,
pero el espasmo hemifacial debe solicitarse una RM, pues en raras ocasiones
puede tratarse de la primera manifestación de un tumor del ángulo
pontocerebeloso. En esta imagen se ha utilizado contraste para realzar el tumor,
como puede apreciarse los vasos sanguíneos durales aparecen brillantes.
Secuencia T2
Las imágenes potenciadas en T2, resultan especialmente útiles para poner de manifiesto la patología. Esto es así porque en esta secuencia el agua aparece hiperintensa y la grasa genera muy poca señal, y la mayor parte de las lesiones inflamatorias y tumorales se caracterizan por un aumento de su contenido acuoso. La imagen generada, resulta anatómicamente más extraña (es como un negativo de la anatomía, la sustancia gris está blanca y la blanca gris), pero es una buena secuencia para la visualización de lesiones desmielinizantes (fig. 2).
Las lesiones desmielinizantes aparecen habitualmente en situación periventricular. Sin embargo en T2 el LCR próximo, aparece muy brillante e interfiere con la visualización de este tipo de lesiones, y por ello se ha desarrollado una nueva secuencia, llamada FLAIR (Fluid attenuated inversion recovery) (4) que precisamente atenúa el LCR para hacerlas destacar. En definitiva, el FLAIR es un T2 con LCR negro. Si existen lesiones desmielinizantes periventriculares (blancas), se visualizarán de forma excelente (fig. 2).
Las lesiones desmielinizantes se caracterizan por ser numerosas, de localización periventricular, orientación perpendicular a los ventrículos, y presentar un anillo hiperintenso que rodea a una zona hipodensa central (fig. 2).
Secuencia DWI
(«diffusion-weighted imaging»)Esta secuencia permite distinguir una difusión rápida de los protones (no restricción) de una difusión lenta de los mismos (restriccción). Durante su realización se aplican un par de pulsos de campo magnético, y ello permite diferenciar las moléculas de agua que tienen movilidad, de aquellas que no la tienen por estar situadas en una zona isquémica. Aunque puede tener cierta utilidad en el diagnóstico de tumores e infecciones, su indicación principal es la detección precoz de lesiones isquémicas.
ANGIOGRAFÍA DE SUSTRACCIÓN DIGITAL (DSA), ANGIO-RESONANCIA (MRA) Y ANGIOTC (CTA)
En los últimos tiempos también se ha producido un avance espectacular en lo que a las técnicas de imagen que permiten la visualización del trayecto de los vasos sanguíneos se refiere. Aunque la angiografía convencional (angiografía de sustracción digital) sigue siendo considerada el «gold standard», la aparición de nuevas técnicas cada vez más sensibles y específicas va restando día a día indicaciones a este procedimiento agresivo. En nuestra especialidad, la indicación más habitual para solicitar este grupo de técnicas son la sospecha de parálisis compresiva de III par craneal y la detección de trombosis de seno venoso en el contexto de la hipertensión intracraneal (7) (fig. 4).
![]()
Fig. 4: En el estudio de la hipertensión intracraneal benigna, es preciso
solicitar un angioRM en fase venosa (1) para descartar una posible trombosis de
seno venoso. Por la gran variabilidad del patrón venoso muchas veces resulta muy
difícil distinguir entre un seno hipoplásico y un seno trombosado. Asimismo,
determinados hallazgos en la RM o la ecografía, como el aplanamiento de la
esclera posterior (3) o la presencia de una silla turca vacía (2), presentan
combinados, una elevada sensibilidad y especificidad.
Angiografía de sustracción digital (DSA)
Es lo que habitualmente denominamos angiografía convencional. Sigue siendo la prueba más sensible para el estudio de gran parte de la patología vascular cerebral. Desgraciadamente todavía presenta un riesgo del 0,5% de complicaciones graves, por lo que el beneficio de su uso debe ser contrapesado con este riesgo, no despreciable de infarto cerebral.
Recientemente se han desarrollado nuevos algoritmos que permiten una reconstrucción simultánea en tres dimensiones del árbol vascular y las estructuras óseas adyacentes. Se realiza la reconstrucción tridimensional independiente del árbol vascular y las estructuras óseas y posteriormente ambas imágenes son fundidas en una sola. Esta técnica combina la extraordinaria resolución espacial de la DSA con las ventajas de la reconstrucción tridimensional y aporta más información que la DSA convencional en la evaluación de lesiones neurovasculares situadas en la base del cráneo como aneurismas cerebrales (8).
Angiorresonancia (AngioRM)
En sus dos versiones, TOF («time of flight») y PC («phase contrast»), utliza la capacidad de la RM para detectar el movimiento de las moléculas de agua, con el fin de obtener la información necesaria para generar una imagen en tres dimensiones que reproduce el árbol vascular.
AngioTC (AngioTC)
Genera unas imágenes similares a las de la angioRM, pero utilizando radiación ionizante. En lo que se refiere a la detección de aneurismas en el contexto de la parálisis compresiva del III par craneal, la sensibilidad y especificidad son similares a las de la angioRM, con la ventaja de ser menor el tiempo necesario para la obtención de la imagen, y con la desventaja de requerir el uso de radiación ionizante. Por ello el decantarse por una u otra técnica dependerá de la experiencia de los radiólogos de cada institución.
BIBLIOGRAFÍA
Lee AG, Brazis PW, Garrity JA, White M. Imaging for neuro-ophthalmic and orbital disease. Am J Ophthalmol 2004; 138: 852-862.
Hall EJ. Lessons we have learned from our children: cancer risks from diagnostic radiology. Pediatr Radiol 2002; 32: 700-706.
Berrington dG, Darby S. Risk of cancer from diagnostic X-rays: estimates for the UK and 14 other countries. Lancet 2004; 363: 345-351.
Cascade PN, Webster EW, Kazerooni EA. Ineffective use of radiology: the hidden cost. AJR Am J Roentgenol 1998; 170: 561-564.
Nielsen K, Rostrup E, Frederiksen JL, et al. Magnetic resonance imaging at 3.0 tesla detects more lesions in acute optic neuritis than at 1.5 tesla. Invest Radiol 2006; 41: 76-82.
Hickman SJ. Optic nerve imaging in multiple sclerosis. J Neuroimaging 2007;17 Suppl 1: 42S-45S.
Lee AG, Hayman LA, Brazis PW. The evaluation of isolated third nerve palsy revisited: an update on the evolving role of magnetic resonance, computed tomography, and catheter angiography. Surv Ophthalmol 2002; 47: 137-157.
Gailloud P, Oishi S, Murphy K. Three-dimensional fusion digital subtraction angiography: new reconstruction algorithm for simultaneous three-dimensional rendering of osseous and vascular information obtained during rotational angiography. Am J Neuroradiol 2005; 26: 908-911.