ACTUALIZACIONES TECNOLÓGICAS EN OFTALMOLOGÍA
Utilidad de la autofluorescencia en las formas atróficas de la degeneración macular asociada a la edad
FERNÁNDEZ MUÑOZ M1, MONTERO MORENO JA2
1 Doctora
en Medicina y Cirugía. Servicio de Oftalmología. Hospital Río Carrión, Palencia.
2 Doctor en
Medicina y Cirugía. Unidad de Retina-Vítreo. Instituto Oftalmológico de
Alicante. VISSUM. Servicio de Oftalmología. Hospital Pío del Río Hortega.
Valladolid.
E-mail: msm02va@wanadoo.es
RESUMEN
El estudio del fondo de ojo mediante autofluorescencia es un nuevo procedimiento de diagnóstico por imagen no invasivo que permite evaluar la distribución de la lipofuscina y de otros fluoróforos en el epitelio pigmentario de la retina (EPR), que se pueden asociar a los primeros cambios en ciertas patologías retinianas. El acúmulo de los gránulos de lipofuscina en el EPR implica una vía común de una serie de enfermedades, como la forma atrófica de la degeneración macular asociada a la edad (DMAE), y complementa la información obtenida mediante otras técnicas de imagen como la tomografía de coherencia óptica y la angiografía con fluoresceína. Se trata de un procedimiento diagnóstico que puede resultar de gran utilidad en el control de la evolución de la DMAE atrófica tanto en su historia natural como tras la intervención con las nuevas modalidades terapéuticas.
Palabras clave: Autofluorescencia, degeneración macular asociada a la edad, epitelio pigmentario, lipofuscina.
La autofluorescencia (AF) es una propiedad intrínseca de ciertas moléculas (denominadas fluoróforos) que se caracterizan por la emisión transitoria de luz cuando son estimuladas por una fuente exógena de una longitud de onda más corta (más energética). La AF del fondo de ojo permite obtener información sobre una única capa, el epitelio pigmentario de la retina (EPR) donde se localiza el fluoróforo dominante, la lipofuscina, representando su estado metabólico. Cuando se estimula la lipofuscina con una luz azul de 488 nm, se produce una fluorescencia de color amarillo característico de una longitud de onda en torno a los 500 nm. De esta forma, la AF ofrece información de una forma no invasiva acerca de la integridad del EPR y contribuye al conocimiento de la fisiopatología de diversas patologías retinianas, entre las que destaca la degeneración macular asociada a la edad (DMAE).
La autofluorescencia se puede observar mediante la ayuda de diferentes equipos de estudio del fondo de ojo. Por un lado la espectrofotometría desarrollada por Delori et al. estudiaba el espectro de excitación y la emisión de fluorescencia a partir de zonas de la retina de pequeño tamaño, pero apenas tiene aplicación en la clínica. En la práctica los sistemas más empleados se basan en la oftalmoscopía con láser de barrido confocal (CSLO, confocal laser scanning ophthalmoscope) y los retinógrafos. La CSLO fue desarrollada por Webb et al. utilizando una fuente de láser de baja energía para estudiar la retina, y la naturaleza confocal de la óptica aseguraba que la reflexión de la luz y la fluorescencia se correspondían con el mismo plano focal, suprimiendo la luz desenfocada (es decir, la fluorescencia procedente de los medios pre retinianos como cristalino o córnea).
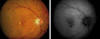
Fig. 1: Retinografía e imagen de autofluorescencia obtenidas mediante el
retinógrafo Zeiss FF450Plus IR con cámara megaplus 1.6i 10 bit. Degeneración
macular asociada a la edad atrófica en fase inicial con drusas y focos de
atrofia del EPR. La imagen de autofluorescencia muestra cuatro focos de hipo
fluorescencia bien definidos con un área difusa de hipo fluorescencia.
En la actualidad se dispone de tres sistemas diferentes de CSLO para el estudio de la autofluorescencia: el Heidelberg Retinal Angiograph (HRA; Heidelberg Engineering, Dossenheim, Alemania); el CSLO de Rodenstock (RcSLO; Rodenstock, Weco, Düsseldorf, Alemania); y el prototipo de Zeiss SM 30 4024 (ZcSLO; Zeiss, Obercochen, Alemania). De estos tres, el único que se encuentra comercializado con el sistema CSLO para la captura de imágenes de AF es el HRA de Heidelberg Engineering.
Los retinógrafos son herramientas diagnósticas habituales en la práctica oftalmológica para la adquisición de imágenes de retina o la realización de angiografías con fluoresceína o verde de indocianina. Por lo general no vienen equipados para la obtención de imágenes de AF. Para reducir las interferencias producidas por la AF del cristalino, al no poseer un sistema confocal que elimine la luz procedente de otros planos focales, Spaide modificó el filtro excitador (con un pico de 580 nm, entre 500-610 nm) y el de barrera (pico de 695 nm, entre 675-715 nm). Estos filtros fueron modificados nuevamente en 2007 con un filtro de excitación entre 535-580 nm, y uno de barrera entre 615-715 nm, con lo que se consiguió mejorar la calidad de la imagen. El empleo de longitudes de onda diferentes a las del CSLO permite la captación de AF procedente de otros fluoróforos de la retina.
La DMAE es un proceso multifactorial que cuenta como la primera causa de ceguera en adultos en países industrializados. Las primeras alteraciones visibles de la DMAE son la aparición de drusas e irregularidades del EPR. Los primeros estadios de la enfermedad pueden progresar a formas de atrofia geográfica (AG) o neovascularización asociándose a la pérdida progresiva de la agudeza visual. Actualmente no existe tratamiento para la AG aunque recientemente se están ensayando nuevas modalidades terapéuticas muy prometedoras para la regeneración del EPR y freno de la DMAE. Sin embargo muchas veces no resulta sencillo evaluar el estado del EPR y la progresión de la atrofia.
La integridad del complejo EPR/fotorreceptor es importante para conservar la visión. La principal función de las células del EPR es la fagocitosis durante toda la vida de los segmentos externos de los fotorreceptores. Durante este proceso, el material no degradable se acumula y forma gránulos de lipofuscina que se depositan en la porción basal de las células del EPR. El mayor componente de la lipofuscina es N-retinil-N-retinilidene etanolamina (A2E). El A2E puede desactivar la función de las células del EPR por varios mecanismos tóxicos, incluyendo daño fotooxidativo, inhibición de los procesos celulares clave, por daño directo al DNA, activación del complemento, y disrupción de membranas como resultado de su actividad detergente.
La acumulación de lipofuscina y de su mayor fluoróforo A2E se puede apreciar mediante AF. El aumento o disminución de intensidad de AF se asocia con los diferentes estadios de enfermedad de DMAE y permite trazar el mapa de las alteraciones del EPR a nivel del polo posterior y llevar a cabo la exploración no invasiva.
Aunque es cierto que existe una asociación entre la acumulación de lipofuscina y la patología del EPR, la naturaleza de la misma no está aún bien aclarada puesto que esta sustancia puede ser directamente responsable de la disfunción celular, o también podría ocurrir a la inversa, que la acumulación excesiva de lipofuscina fuera simplemente la expresión de una disfunción celular preexistente. En un estudio transversal de ojos con DMAE se observaba con mayor frecuencia un incremento de los acúmulos de material de fluorescencia a nivel del EPR en aquellos ojos que mostraban una atrofia geográfica en comparación con los ojos que presentaban otros tipos de manifestaciones de la DMAE. Ruckman et al. inicialmente describieron la presencia de marcada AF alrededor de las áreas de atrofia en ojos con DMAE. Además se pueden producir varias modalidades de cambios de la AF del fondo en las zonas adyacentes de la AG, en lo que sería un reflejo de la heterogeneidad en el proceso de la enfermedad subyacente.
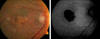
Fig. 2: Retinografía e imagen de autofluorescencia que muestran una zona de 1,5
áreas de papila de atrofia del EPR rodeada de drusas blandas. La imagen AF
revela un foco principal de hipo fluorescencia correspondiente al defecto del
EPR con un reborde de hiper fluorescencia del EPR dañado.
ATROFIA GEOGRÁFICA
La progresión de la AG en el tiempo ha sido descrita en varios estudios. En un estudio retrospectivo, Schatz y McDonald, encontraron una tasa de crecimiento de la propagación de la atrofia geográfica de 15 a 375 µm (promedio, 139 µm) por año, según el cual las zonas más pequeñas tienden a crecer más lentamente que las zonas más grandes de atrofia. En un estudio prospectivo de la historia natural de la progresión de la AG, Sunness et al. demostraron recientemente una ampliación media del total del área de AG de 2,2 áreas de papila (DA) en dos años. Sin embargo, sólo se puede especular hasta qué punto la atrofia llegaría a extenderse si el paciente pudiera ser observado durante un período mucho más allá de la expectativa normal de vida.
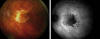
Fig. 3: Retinografía e imagen de autofluorescencia de una lesión geográfica de
atrofia del EPR y coriocapilar que permite ver los grandes vasos coroideos, con
desaparición de la AF e híper fluorescencia difusa del tejido perilesional
dañado.
Holz et al, realizaron un estudio prospectivo de tres años de duración sobre tres pacientes con el propósito de estudiar in vivo el aumento de la atrofia y su correlación con niveles de AF, obtenidos con un CSLO en ojos con DMAE atrófica. Estos autores observaron un aumento tanto de las áreas de atrofia como de la superficie total de AF anormal en el tiempo, concluyendo que la atrofia no crece más allá del área de AF anormal y que por lo tanto esta zona refleja la máxima extensión de la atrofia en el curso clínico posterior. Esta observación también puede reflejar la restricción común de la DMAE a la zona central de la retina. El aspecto de AF del área periférica a la zona de hiperfluorescencia anormal fue normal en todos los ojos estudiados, y en ninguno de ellos se produjeron lesiones en esas zonas. Si un aumento de contenido de lipofuscina precede la muerte celular, se puede deducir entonces que la propagación del área de atrofia puede ser mayor y más rápido hacia las zonas con mayor intensidad de AF.
Es decir, que si el aumento de la AF de fondo precede al desarrollo de AG, la detección de las variaciones topográficas de la AF de fondo mediante CSLO puede tener valor pronóstico y servir para la identificación de los pacientes con alto riesgo de aparición o de ampliación de escotomas absolutos, y por lo tanto de pérdida visual grave. Los resultados reflejan además el significado fisiopatológico de la acumulación excesiva de lipofuscina en las células del EPR, lo que puede proporcionar información importante para la comprensión de los mecanismos de la enfermedad y ser útil en el seguimiento de los efectos de futuras intervenciones terapéuticas.
Estos hallazgos preliminares sugieren que las áreas de aumento de AF preceden al desarrollo y la ampliación de la atrofia de la retina externa en los ojos con DMAE. Las observaciones indican que el exceso de acumulación de lipofuscina en el EPR puede ser de importancia en la patogenia de AG asociada a la DMAE.
Holz et al en el estudio FAM (Fundus Autofluorescence in AMD) sobre 195 ojos de 129 pacientes, realizaron una clasificación morfológica de los diferentes patrones de aumento de la AF en el margen de la atrofia geográfica. Estos autores concluyeron que los ojos que presentaban un patrón en banda (1,81 mm2/año) y el patrón difuso (1,77 mm2/año) de AF, tienen un mayor crecimiento de la atrofia que los ojos que no mostraban anormalidades en la AF (0,38 mm2/año) y el patrón focal (0,81 mm2/año). Dentro del patrón difuso distinguen un subgrupo que denominaban patrón difuso en goteo que mostraba un aumento del riesgo mayor que los anteriores (3,02 mm2/año).
Los resultados indican que los diferentes patrones fenotípicos de AF pueden tener un impacto en la progresión de la enfermedad en los ojos con DMAE atrófica y por lo tanto servir como determinantes de pronóstico. Los resultados subrayan la importancia de la imagen de AF y el papel patogénico del exceso de lipofuscina acumulado en las células del EPR en la AG. La historia natural y la identificación de características de alto riesgo pueden resultar de utilidad para diseñar los estudios de intervención destinadas a frenar la propagación de la atrofia.
BIBLIOGRAFÍA
-
Dorey KC, Wu G, Ebenstein D, Garsd A, Weiter JJ (1989). Cell loss in aging retina: relationship to lipofuscin accumulation and macular degeneration. Invest Ophthalmol Vis Sci 30,1691-1699.
-
Steffen Schmitz-Valckenberg MD, Frank G Holz MD, Alan C Bird MD, Richard F Spaide MD. Fundus autofluorescence imaging. Review and Perspectives. Retina 28: 385-409, 2008.
-
Von Rückmann A, Fitzke FW, Bird AC. Distribution of fundus autofluorescence with a scanning laser ophthalmoscope. Br J Ophthalmol 1995; 79: 407-12.
-
Delori FC, Dorey CK, Staurenghi G, Arend O, Goger DG, Weiter JJ. In vivo fluorescence of the ocular fundus exhibits retinal pigment epithelium lipofuscin characteristics. Invest Ophthalmol Vis Sci 1995; 36: 718-29.
-
Delori FC, Goger DG, Dorey CK. Age-related accumulation and spatial distribution of lipofuscin in RPE of normal subjects. Invest Ophthalmol Vis Sci 2001; 42: 1855-66.
-
Holz FG, Bellmann C, Rohrschneider K, Burk ROW, Völcker HE (1998). Simultaneous confocal scanning laser fluorescein- and indocyanine green angiography Am J Ophthalmol 125, 227-236.
-
Lois N, Owens SL, Coco R, Hopkins J, Fitzke FW, Bird AC. Fundus autofluorescence in patients with age-related macular degeneration and high risk of visual loss. Am J Ophthalmol 2002; 133: 341-9.
-
Delori FC, Fleckner MR, Goger DG, Weiter JJ, Dorey CK. Autofluorescence distribution associated with drusen in age-related macular degeneration. Invest Ophthalmol Vis Sci 2000; 41: 496-504.
-
Von Rückmann A, Fitzke FW, Bird AC. Fundus autofluorescence in age-related macular disease imaged with a laser scanning ophthalmoscope. Invest Ophthalmol Vis Sci 1997; 38: 478-86.
-
Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Fundus autofluorescence and development of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci 2001; 42: 1051-6.
-
Schmitz-Valckenberg S, Bindewald-Wittich A, Dolar-Szczasny J, Dreyhaupt J, Wolf S, Scholl HP, Holz FG. Fundus Autofluorescence in Age-Related Macular Degeneration Study Group. Correlation between the area of increased autofluorescence surrounding geographic atrophy and disease progression in patients with AMD. Invest Ophthalmol Vis Sci 2006; 47: 2648-54.
-
Holz FG, Bindewald-Wittich A, Fleckenstein M, Dreyhaupt J, Scholl HP, Schmitz-Valckenberg S. FAM Study Group. Progression of geographic atrophy and impact of fundus autofluorescence patterns in age-related macular degeneration. Am J Ophthalmol 2007; 143: 463-72.
-
Capella MJ, Elizalde J. Autofluorescencia y patología macular. An Inst Barraquer 2008; 37: 35-73.