Unidad de Cirugía Oculoplástica. Hospital de
Fuenlabrada. Madrid.
1 Licenciado en Medicina y Cirugía.
E-mail: ignaciogenol@gmail.com
2 Doctor en Medicina y Cirugía.
INTRODUCCIÓN
La obstrucción congénita del conducto nasolagrimal (OCCNL) es una entidad frecuente en la edad pediátrica, que puede llegar a afectar a un 20-30% de los recién nacidos (1,2) [aunque sólo el 1-6% de éstos presentan una obstrucción sintomática (3)], afectando a un 11% de los nacidos pretérmino (4). Aunque en la mayoría de las ocasiones la epifora no se trata de un problema importante, es cierto que genera bastante ansiedad a los padres del niño, sobre todo si se asocia a secreción y/o conjuntivitis de repetición o, en casos extremos, a dacriocistitis aguda.
Aunque el manejo de la OCCNL en pacientes menores de dos años parece estar más consensuado, en aquellos mayores de dos años de edad se ha mostrado especialmente controvertido (5). El objetivo de este trabajo es realizar una revisión de las diversas opciones terapéuticas, explicando las ventajas y desventajas de cada técnica. Finalmente se presenta una propuesta de guía terapéutica de la OCCNL basada en la edad de los pacientes, las manifestaciones clínicas del cuadro y la experiencia de los autores que no pretende ser mas que una herramienta de ayuda para el oftalmólogo.
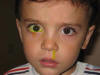
Dado que la causa más frecuente de OCCNL (fig. 1) es la imperforación de la válvula de Hasner, en la desembocadura del conducto nasolagrimal en el meato inferior, la mayoría de pacientes con obstrucción del drenaje son tratados empíricamente sin necesidad de solicitar pruebas de imagen ni otros tests de confirmación. Se recurrirá a éstos si sospechamos la presencia de dacriocele o si el paciente asocia alteraciones craneofaciales. No es recomendable realizar dacriocistografías en la edad pediátrica, prefiriéndose la realización de dacrioescintigrafías para casos muy seleccionados.
OPCIONES TERAPÉUTICAS: TRATAMIENTO CONSERVADOR
1. Observación
Son múltiples los trabajos que resaltan cómo la resolución espontánea de la epífora puede ocurrir hasta en un 96% de los pacientes con OCCNL durante el primer año de vida (6-7).
2. Masaje del saco lagrimal
La técnica más empleada es la descrita originalmente por Crigler (8) y consiste en la colocación de un dedo sobre el canto interno del ojo del niño, de manera que queda bloqueado el canalículo común evitando el reflujo al presionar el saco. A continuación, presionando sobre el saco, se desliza el dedo hacia abajo, produciéndose un aumento de la presión hidrostática que se transmite a la porción inferior del conducto nasolagrimal, provocando la ruptura de las obstrucciones localizadas en dicho conducto.
La efectividad del masaje del saco ha quedado demostrada por algunos autores, oscilando entre el 85% y el 95% (9-11) aunque no hay trabajos prospectivos que comparen la opción de observación con la del masaje, por lo que no se puede concluir que el masaje de la zona lagrimal mejore el porcentaje de resoluciones de las OCCNL respecto a los pacientes que simplemente se observan. Según estos autores las posibilidades de éxito de esta maniobra parecen disminuir a partir de los 9 meses de edad.
OPCIONES TERAPÉUTICAS: TRATAMIENTOS QUIRÚRGICOS
1. Sondaje e irrigación
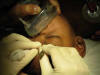
Existe un amplio consenso respecto a que el sondaje es el siguiente paso cuando la OCCNL no ha respondido al tratamiento conservador (12,13). Sin embargo, no está determinado el momento óptimo de realización del sondaje ni el tipo de inducción anestésica. La práctica de esta técnica (fig. 2) está ampliamente difundida entre todos los oftalmólogos y es fácil encontrar bibliografía sobre la técnica (14).
La principal complicación del sondaje es la creación de falsas vías (frecuentes en OCCNL complejas o en los sondajes realizados sin relajación anestésica del paciente) que conducen al fracaso del procedimiento (5).
El porcentaje de éxitos del sondaje es de aproximadamente un 85% (3,9,12) en niños menores de un año, disminuyendo el porcentaje de éxitos a partir de esa edad. Sin embargo, respecto a este último aspecto, existe controversia del porcentaje de éxitos observados según la edad del paciente. Así, mientras diferentes autores obtienen un porcentaje de éxitos similar (alrededor del 85%) en niños mayores de 1 año respecto a los menores (15,16), otros autores no obtienen los mismos resultados (17,18), consiguiendo un éxito del 89% en menores de 24 meses y del 72% en pacientes por encima de esta edad.
La realización de sondaje e irrigación en pacientes antes o después de los 12 meses de edad, tiene ventajas e inconvenientes.
Por un lado, el sondaje temprano presenta la ventaja de que la desaparición de la epífora y de las secreciones conjuntivales mejora mucho la posible dermatitis irritativa de los párpados y la cara del paciente. Secundariamente también aliviaría la ansiedad de los padres. Por otro lado, dependiendo del tamaño y la actividad del niño, podría realizarse sin la necesidad de anestesia, con una correcta inmovilización con una sábana en la consulta, con lo cual desde el punto de vista de relación coste-efectividad es la opción más económica (19) aunque presenta el inconveniente importante de la experiencia traumática, desde el punto psicológico, a la que se hace pasar al niño si no se le suministra anestesia. Ante el riesgo de movimientos bruscos de la cabeza que puedan favorecer la creación de falsas vías, en nuestra unidad, preferimos realizar los sondajes bajo sedación anestésica en quirófano pero sin manejar la vía aérea. Sin embargo, al realizar sondajes en menores de 12 meses estamos asumiendo la pérdida de la oportunidad de que la propia historia natural de la enfermedad resuelva el cuadro clínico. Además algunos autores han propuesto que el mantener una actitud conservadora en los 12 primeros meses de vida, no se traduce en un aumento de casos con epifora en edades más tardías (20).
Diferentes estudios han recogido la actitud de los padres ante el sondaje temprano. Así, según Stager (21) el 95% de los padres estimaron que el procedimiento había sido mucho más sencillo y menos cruento de lo que esperaban, el 86% estaban satisfechos con que el procedimiento se hubiera realizado en consulta y el 81% preferían la realización de un nuevo sondaje a esperar a la resolución espontánea. Recientemente se ha presentado un cuestionario de calidad de vida validado (22) en Estados Unidos que será útil para obtener resultados más estrictos en los futuros estudios clínicos de la OCCNL.
Uno de los problemas fundamentales a los que nos podemos enfrentar si realizamos un sondaje tardío es que ese mismo retraso puede provocar infecciones agudas con el consiguiente riesgo teórico de inflamación prolongada de la mucosa lagrimal y fibrosis secundaria de la vía lagrimal. Hay que destacar que cuando los síntomas persisten en mayores de 12 meses, este grupo de niños presentan obstrucciones más complejas (23) y esta es la causa más probable de fracaso tras sondaje (24). Por otro lado, Kassoff, al realizar un estudio similar (25) comprobó cómo el sondaje tardío, con anestesia general, era la estrategia de mayor coste para el hospital.
Cuando se produce el fracaso del primer sondaje la alternativa más común es repetir el sondaje pues como procedimiento aislado sigue teniendo un alto porcentaje de éxito [aproximadamente del 85% (26,27)] especialmente en los menores de 24 meses. Es en este punto, dependiendo de la edad del niño y de su sintomatología, podremos plantearnos asociar un procedimiento auxiliar al sondaje: intubación bicanalicular, irrigación de alta presión, dacrioplastia con balón o examen nasal con endoscopia intraoperatoria.
2. Intubación con tubos de silicona (fig. 3)
El porcentaje de éxito oscila entre el 77% y el 100% según los estudios (28-31). Además, este procedimiento preserva la anatomía de la vía lagrimal, por lo que se aconseja emplear esta técnica, que debe realizarse siempre bajo anestesia general, antes que otros procedimientos más invasivos. La mayoría de oftalmólogos mantienen la intubación de 2 a 5 meses (26,32,33), pero se han conseguido buenos resultados con la retirada precoz a las 6 semanas (34). El procedimiento estándar de intubación bicanalicular (IBCN) fue perfeccionado por Crawford (35) en 1989, definiéndose como principales complicaciones potenciales la aparición de áreas cicatriciales en el meato inferior, la perforación o laceración del canalículo y la extrusión del tubo de silicona. Una alternativa es la intubación monocanalicular por el canalículo superior, que, aunque tiene la ventaja de que es más fácil retirarlo y presenta un porcentaje de éxitos similar (90% en mayores de 24 meses) (36), también hay que considerar que se extruyen con facilidad (43%) (37). Un procedimiento descrito recientemente por Mauffray (38) consiste en la doble intubación bicanalicular, como paso previo a una DCR, con un 80% de éxito.

Fig. 3. Tubos de silicona para intubación canalicular.
Hay expertos como Geoffrey Rose (Londres) o Timothy J Sullivan (Brisbane) que no intuban a los pacientes por diferentes motivos (39):
-
Primero: no hay evidencias convincentes de que sean más eficaces que los sondajes aislados.
-
Segundo: los tubos de silicona pueden provocar reacciones inflamatorias que conduzcan a estenosis de la vía lagrimal, especialmente canaliculares, que son entidades bastante más difíciles de tratar.
-
Tercero: tener que retirar la intubación supone un trauma añadido en la vía lagrimal (con riesgo de lesionarla), especialmente cuando se retira a través del sistema canalicular debido al nudo.
3. Irrigación de alta presión (IAP) (40)
Es un método alternativo de reciente introducción (por lo que apenas hay experiencia ni resultados altamente concluyentes) en OCCNL en niños menores de 18 meses. Bajo anestesia tópica se inyecta suero por el punto lagrimal inferior con una jeringa de 10 ml y una cánula de 21G. Según el autor el porcentaje de éxito es del 80% en el primer intento y del 100% si se precisa una segunda IAP. No se describieron complicaciones en la serie publicada de 39 casos de OCCNL. Desde nuestro punto de vista, este procedimiento podría producir problemas pulmonares por aspiración inadvertida del fluido irrigado.
4. Dacrioplastia con balón (figs. 4 y 5)
Procedimiento descrito por Becker en 1996 (41) que ha demostrado ampliamente su utilidad (42-46) con un porcentaje de éxito entre el 75-95%. Se indica en pacientes con fracaso de 1 ó 2 sondajes previos, especialmente en niños mayores de 30 meses. La tasa de fracasos del sondaje en este grupo de edad es muy importante siendo los resultados esperanzadores. Recientemente, en un estudio bien diseñado, Alañón (47) defiende que es una técnica útil en un 83% de pacientes y que sus resultados no se afectan ni por el tipo de obstrucción ni por la edad del paciente, aunque es una técnica que prefieren reservar para los casos en los que han fracasado dos sondajes previos, asociando siempre intubación monocanalicular (48).

Fig. 4. Catéter dacrioplastia. Balón dilatado con salino (izquierda) y sin
dilatar (derecha).
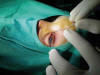
Fig. 5. Dacrioplastia por canalículo superior. Nótese las marcas en la sonda.
5. Endoscopia nasal y fractura del cornete inferior
Los fracasos tras sondaje suelen deberse básicamente a (tabla 1):

1. Entrada de la sonda en la submucosa creando falsas vías sin llegar a perforar la obstrucción.
2. La presencia de un cornete inferior que anatómicamente dificulte la entrada de la sonda en el meato inferior.
3. Por la presencia de flaps de mucosa nasal que tapizan el ostium en el meato inferior a modo de válvula.
Por ello, es altamente recomendable, realizar endoscopia nasal en casos que no responden a los primeros escalones terapéuticos para visualizar con detalle la anatomía del meato inferior. La fractura del cornete inferior se practica cuando queremos desplazarlo del ostium del conducto nasolagrimal, para que no suponga una obstrucción mecánica en el drenaje lagrimal empujando medialmente y hacia arriba el cornete con un elevador de Freer (49). Clásicamente se ha dicho que en pacientes donde fracasa el primer sondaje, se llega a conseguir un 88% de éxito cuando combinamos segundo sondaje y fractura del cornete inferior (50), pero lo cierto es que no es muy común la presencia de un cornete inferior grande y mal orientado como causa de la persistencia de la epifora, y por ello su desplazamiento no suele ser necesario en la mayoría de los casos (51). Bajo nuestro punto de vista, la endoscopia es una medida adyuvante útil en los casos en los que fracasa un segundo sondaje o en los que la historia clínica nos hace sospechar que hay una patología en la fosa nasal.
6. Dacriocistorrinostomía (DCR)
Este procedimiento se reserva para los casos en que todas las medidas anteriores han fracasado y la OCCNL está localizada en la porción inferior de la vía lagrimal, es decir, intrasacular en la unión del saco con el conducto o en el propio conducto (52). Otras indicaciones de DCR en la edad pediátrica son las atresias canaliculares, con o sin agenesia de punto lagrimal, y en patologías adquiridas de los canalículos (53). El uso de tubos de silicona para la intubación de los pacientes es debatida. Hay autores que no encuentran diferencias en el porcentaje de éxito entre los casos intubados respecto a los que se dejan sin intubar (54). Otros autores incluso creen que la intubación disminuye la tasa de éxito de la cirugía (55). En nuestra experiencia, preferimos usar los tubos de silicona para impedir el cierre de la osteotomía, pues los niños tienen un potencial de cicatrización más intenso que los adultos. Se realiza bajo anestesia general y puede realizarse abordaje tanto endoscópico como vía externa. El porcentaje de éxito en la DCR externa es similar a la obtenida en adultos (88-93%) (56). Respecto a la DCR endoscópica en niños hay pocas series publicadas y de número limitado (57,58), aunque con resultados muy buenos (92-95%). Bien es cierto que existe la creencia de que el porcentaje de éxito usando la vía endoscópica es menor, dado que a través de la nariz no se puede manipular quirúrgicamente el tercio superior del saco, pero la realidad es que no hay estudios concluyentes, pues las diferencias de criterios de inclusión entre los diferentes estudios hace que las comparaciones entre resultados sean delicadas. Siempre esperamos a que tengan más de 24 meses de edad (no hay una edad ideal para realizar la DCR), a pesar de que en las cirugías practicadas a niños entre 12 y 18 meses (52), no se producen alteraciones en el desarrollo óseo. Una última opción es la DCR LASER transcanalicular, que no parece ser un método efectivo, aunque las series son aún muy pequeñas (59).
CONCLUSIÓN Y ALGORITMO (esquema 1)
Paciente menor de 9 meses: siempre tratamiento conservador [observación, masajes según la técnica de Crigler (8)]. Sólo en pacientes en los casos excepcionales que la clínica sea muy florida y la ansiedad de los padres sea llamativa, planteamos un primer sondaje advirtiendo en el consentimiento informado las desventajas ya comentadas que tiene intervenir a tan temprana edad. La única indicación para realizar sondajes en menores de 9 meses es en los casos en los que el paciente presenta un dacriocele congénito (también conocido como dacriocistitis aguda neonatal o mucocele congénito del saco lagrimal).
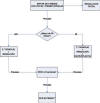
Esquema 1. Algoritmo propuesto en la OCCNL.
* Valorar si precisa fractura del cornete inferior.
** Dejamos intubación bicanalicular de 3 a 6 meses.
Paciente mayor de 9 meses: siempre sondaje de vía lagrimal como primera medida realizar bajo sedación sin manejo de vía aérea. ¿Qué hacemos si fracasa un primer sondaje? Tenemos 4 opciones terapéuticas: 1) repetir sondaje, 2) intubación con tubos de silicona, 3) dacrioplastia, 4) endoscopia nasal y fractura de cornete inferior. La IAP no la practicamos nunca. Según la edad del paciente y la facilidad del primer sondaje usamos una u otra técnica.
Como primer escalón tras el fracaso del primer sondaje siempre realizamos un segundo sondaje e irrigación suave bajo control endoscópico (se valora si hay que desplazar el cornete y se aspira el fluido con el que irrigamos). Si el niño tiene más de 30 meses además del sondaje hacemos una dacrioplastia con balón.
Si fracasa este primer escalón (2.º sondaje con o sin dacrioplastia), realizamos intubación bicanalicular (si tiene más de 30 meses, previamente en el mismo acto quirúrgico realizamos dacrioplastia) y retiramos los tubos a las 6 semanas en quirófano e irrigamos.
Si persisten síntomas después de estos procedimientos, realizaremos una DCR externa.