REVISIÓN ACTUALIZADA
Farmacología ocular durante la gestación y la lactancia (I)
GIL RUIZ MR1, ORTEGA USOBIAGA J2, GIL RUIZ MT3, CORTÉS VALDÉS C4
1
Doctora en Medicina y Cirugía. Médico Adjunto del Servicio de Oftalmología.
Hospital Nuestra Señora del Prado. Talavera de la Reina (Toledo).
2
Doctor en Medicina y Cirugía. Especialista en Oftalmología. Clíniva Baviera -
Instituto Oftalmológico Europeo. Bilbao (Bizkaia).
3
Doctora en Medicina y Cirugía. Jefa del Servicio de Análisis Clínicos. Hospital
Nuestra Señora del Prado. Talavera de la Reina (Toledo).
4
Doctor en Medicina y Cirugía. Jefe del Departamento de Oftalmología. Hospital
General Universitario Gregorio Marañón. Madrid.
INTRODUCCIÓN
Aunque el uso de fármacos tópicos oculares durante el embarazo es una cuestión relevante, la información existente en la literatura científica es limitada. Que muy pocas gestantes relacionen el efecto en el feto con el uso de la medicación tópica, el gran tamaño muestral que haría falta para concluir un efecto secundario como teratógeno y que los investigadores no puedan incluir embarazadas en sus estudios clínicos por motivos éticos, son algunas de las razones por las cuales el término «fármaco seguro para el feto» es controvertido (1). Puede existir evidencia en animales, o casos clínicos aislados de efectos indeseables, pero no existen estudios controlados y randomizados. La importancia del problema es evidente, teniendo en cuenta que según un estudio en la población canadiense, 1 de cada 5 mujeres embarazadas están expuestas a fármacos clasificados como categoría C, D o X (clasificación de la Food and Drug Administration de Estados Unidos, FDA; en castellano Administración de Alimentos y Drogas) (2).
Siguiendo el precepto latino «primum non nocere», deberíamos tener conocimiento de la seguridad de los fármacos que administramos a las mujeres embarazadas, puesto que pueden provocar consecuencias graves y/o irreversibles en el feto. En pocas palabras, «el tratamiento no debería ser peor que la enfermedad».
Pueden acontecer efectos secundarios en el feto al utilizar fármacos por vía tópica en el ojo, siempre que la absorción sistémica sea relevante, y no debemos subestimar la vía oftálmica en este aspecto. A pesar de esto, hemos de diferenciar el uso ocasional de un colirio que puede ser relativamente seguro, con el uso continuado que, en determinados casos, puede estar contraindicado por el riesgo de teratogenia. Así, se han descrito casos de malformaciones embrionarias graves por el uso de EDTA tópico ocular al 0,1% o al 3% a dosis de 6 veces al día, pero no es probable que dichos efectos se generen con una sola gota (3).
Respecto a la absorción sistémica de la instilación de un colirio, se han descrito casos clínicos que apoyan la importancia de esta vía de administración. Se ha publicado un caso de fallo renal en un recién nacido de bajo peso tras el uso de fenilefrina tópica para la exploración de la retinopatía del prematuro (4), concluyendo en el artículo que los fármacos midriáticos tópicos deben usarse en los recién nacidos con precaución, presionando la vía lagrimal para evitar la absorción sistémica y monitorizando al paciente durante la instilación de las gotas y mientras dure el efecto de éstas.
Además, hemos de recordar que antes de comercializar un nuevo fármaco, las industrias farmacéuticas casi nunca prueban el principio activo en embarazadas, por lo que es difícil conocer el efecto de estos en el feto. Asimismo, ¿hasta qué punto podemos extrapolar los resultados obtenidos en ensayos con animales al ser humano? El caso del misoprostol es un ejemplo de que existe la posibilidad, aunque remota, de que el fármaco dañe al feto humano y no afecte a animales (5).
Establecer hábitos de práctica clínica basados en la evidencia científica es esencial; sin embargo, los estudios sobre seguridad de los fármacos oculares en pacientes gestantes o lactantes son difíciles de realizar, debido a la imposibilidad de realizar ensayos clínicos en embarazadas por razones éticas y al elevado número de variables que intervienen en la toxicidad embrio-fetal y teratogenia. Ello hace muy difícil establecer protocolos terapéuticos durante la gravidez basados exclusivamente en la evidencia científica, ya que la falta de evidencia no implica necesariamente una falta de eficacia. La práctica basada en la evidencia consiste en «integrar la experiencia clínica individual con lo mejor de la evidencia externa» (6). Nunca dispondremos de ensayos clínicos randomizados para abordar cada cuestión clínica, factor de riesgo o medida preventiva, pero se puede hacer una integración entre lo razonable y lo mejor de la evidencia científica, para extraer un conjunto de medidas eficaces y aplicarlas en la práctica (7).
No obstante, en una revisión de todos los artículos publicados del 1966 al 2003 sobre riesgos potenciales de la medicación ocular materna para el feto (1) se concluye que, a pesar de todo, el riesgo de los fármacos por vía tópica en gestantes es bajo, sobre todo si se utilizan de forma esporádica y no continua.
CAMBIOS OCULARES EN EL EMBARAZO
La gestación puede desencadenar diversos cambios fisiológicos en órganos y sistemas, entre ellos el ojo. Es capaz de disminuir la sensibilidad (8) y grosor (9) corneal, aumentar su curvatura, generar intolerancia a las lentes de contacto, disminuir los valores de presión intraocular (PIO), especialmente en los últimos meses, e inducir cambios refractivos (10). Todas estas modificaciones desaparecen paulatinamente durante el post-parto.
Además, a nivel patológico el embarazo también puede ser responsable de la aparición o progresión de determinadas enfermedades. No sólo puede alterar el curso de enfermedades preexistentes, como la retinopatía diabética y las uveítis, sino que también puede desarrollar patologías específicas del embarazo, como la ceguera cortical, las anomalías visuales derivadas de la preeclampsia/eclampsia o precipitar la aparición de patologías no específicas de la gestación, como la coriorretinopatía serosa central (11). Todas estas patologías deben ser tratadas, y para ello es necesario conocer el arsenal terapéutico que está permitido utilizar en estas pacientes, evitando al máximo la toxicidad embrio-fetal, teratogenia e incluso la posibilidad de desencadenar un aborto espontáneo.
Respecto al impacto del embarazo sobre enfermedades preexistentes, las crisis uveíticas suelen desencadenarse con mayor frecuencia durante el primer trimestre de gestación o el post-parto. Otro concepto a tener en cuenta es que el curso de las uveítis durante el embarazo no puede preverse en función de la evolución pregestacional del proceso inflamatorio (11).
La preeclampsia, estado hipertensivo específico del embarazo, y su asociación a crisis convulsivas a la que llamamos eclampsia, puede asociarse a síntomas visuales. Una disminución de la visión, fosfenos y defectos en el campo visual se acompañan con frecuencia de una constricción focal o difusa de las arteriolas retinianas. El pronóstico visual en estos casos es bueno, recuperando la AV tras resolver el compromiso a nivel sistémico (12). Todo esto es importante que lo conozca el obstetra, no sólo para derivar precozmente al oftalmólogo, sino también como signos de alerta de un posible estado hipertensivo en la gestante. Por otro lado, el oftalmólogo, ante esta sintomatología, especialmente si la embarazada se encuentra en un momento gestacional igual o superior a la 20 semana, debe avisar al obstetra con urgencia, antes de iniciar su exploración, dada la gravedad del proceso.
La ceguera cortical es una manifestación inusual de la preeclampsia/eclampsia derivada de un compromiso vascular en la corteza occipital. Esta pérdida de visión con frecuencia es precedida o se acompaña de cefalea, y aunque existen casos que llegan a alcanzar las 192 horas de duración, suele resolverse sin dejar secuelas (13).
El embarazo es un importante factor desencadenante de la coriorretinopatía serosa central. Aunque el desprendimiento seroso macular se resuelve en los dos primeros meses tras el parto, el riesgo de recaída tras la gestación es superior tras dicho episodio (11).
De todo lo anteriormente comentado se extrae la conclusión de que sólo bajo un amplio conocimiento del impacto del embarazo sobre la fisiología ocular y las enfermedades preexistentes y de la seguridad que nos aportan los diversos principios farmacológicos, podemos realizar un correcto consejo y tratamiento para la madre durante la gestación.
CATEGORÍAS DE SEGURIDAD DE LOS FÁRMACOS SEGÚN LA FDA
La FDA es la agencia del gobierno de los Estados Unidos responsable de la regulación de productos biológicos, suplementos alimenticios, cosméticos, aparatos médicos, productos hemáticos, alimentos y medicamentos (estos dos últimos, para seres humanos y animales). Regula la comercialización de los fármacos, atestiguando la seguridad para los consumidores y la eficacia de los principios activos. La FDA requiere que cada nuevo medicamento supere las 4 fases que componen el ensayo clínico de seguridad y eficacia. La tercera fase es un paso primordial en la venta futura de una sustancia química, realizándose pruebas en unos 1.000 a 3.000 pacientes y deteniéndose la investigación al surgir efectos adversos relevantes.
Este organismo ha diseñado unas categorías de seguridad en función del riesgo que haya mostrado el fármaco (tabla 1). Existen 5 niveles (14):

a) Categoría A: los estudios controlados no han demostrado riesgos.
b) Categoría B: no existen pruebas de riesgo en la especie humana.
c) Categoría C: no se puede descartar la existencia de riesgo.
d) Categoría D: existen evidencias de riesgo para el feto humano. Su uso en la embarazada está justificado cuando exista riesgo vital, o no se puedan prescribir fármacos más seguros o son ineficaces.
e) Categoría X: los estudios en animales o humanos han demostrado alteraciones fetales o existen evidencias de riesgo fetal basándose en la experiencia humana, o ambas, sobrepasando claramente el riesgo a cualquier beneficio. Contraindicados en el embarazo.
En líneas generales, debe prescindirse de la utilización de fármacos durante el embarazo, por la posibilidad de que éstos atraviesen la barrera placentaria y dañen al feto. El primer trimestre es el período más vulnerable para el feto, al producirse en esas semanas la mayor parte de la organogénesis. En la práctica clínica, se acepta el uso en la gestación de los medicamentos de la categoría A –que son pocos en la actualidad– y B, en ausencia de alternativas más seguras y siempre bajo vigilancia médica (15).
Algunos medicamentos pueden excretarse por la leche materna, con potencial nocivo para el lactante. Son compatibles con la lactancia los principios activos que no pasan a la leche, aquellos que excretándose no producen efectos adversos en el lactante, o aquellos que aunque se eliminan por la leche, no es esperable que puedan perjudicarle debido a sus características (15).
A continuación se exponen los niveles de seguridad en la gestación y lactancia de los fármacos más comúnmente utilizados en el ámbito de la Oftalmología. Las letras A, B, C, D y X entre paréntesis indican las categorías de seguridad de los diferentes principios activos según el organismo de la FDA. Para no perder el objetivo fundamental de la exposición (marcar unas directrices básicas útiles en la práctica clínica diaria del oftalmólogo y el médico de Atención Primaria), esta revisión pretende dar una «pincelada» general acerca de las diferentes familias farmacológicas. Para obtener información pormenorizada de los principios activos, se aconseja recurrir a fuentes especializadas en el tema.
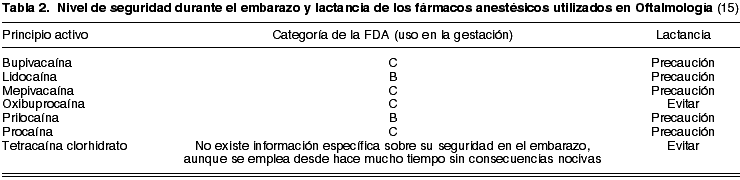
1. Anestésicos
En función del campo de acción y la vía de administración, estos fármacos se clasifican en anestésicos regionales o tópicos. Dentro de los anestésicos regionales, los más utilizados son: procaína (C), lidocaína (B), mepivacaína (C), prilocaína (B) y bupivacaína (C). Como tópicos destacan la oxibuprocaína (C) y la tetracaína clorhidrato (15).
En relación a la tetracaína, no se tiene información específica sobre la seguridad en el embarazo, aunque se emplea desde hace mucho tiempo sin consecuencias nocivas (15).
En general, los fármacos anestésicos deben usarse con precaución durante el período de lactancia, intentando evitar el uso de la tetracaína al no disponer de información suficiente (tabla 2).
2. Midriáticos
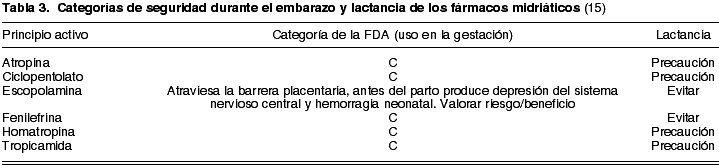
Los midriáticos tópicos pueden ser agentes parasimpaticolíticos (producen midriasis y cicloplejía) o simpaticomiméticos (sólo generan midriasis). Dentro del primer grupo destacan: la atropina como el fármaco de mayor potencia y duración (7-14 días), seguida de la escopolamina (hasta 3-5 días), la homatropina (24-36 horas), ciclopentolato (12-24 horas) y la tropicamida, de corta duración (4-6 horas) (16). De todos ellos, el más adecuado para la funduscopia en el embarazo es la tropicamida, por su efecto poco duradero (17). En el grupo de los agonistas del sistema simpático adrenérgico, se encuentra la fenilefrina (6-8 horas).
Como se comentó previamente, ha de diferenciarse el uso puntual de un principio activo para la exploración de fondo de ojo, que puede ser relativamente seguro, con el uso prolongado. Aún así, según la clasificación de la FDA todos estos fármacos son categoría C, es decir, estos medicamentos deben ser administrados solamente si el posible beneficio deseado justifica el riesgo potencial en el feto (14), excepto la escopolamina que debería evitarse al atravesar la barrera placentaria y poder deprimir el sistema nervioso central y favorecer la hemorragia neonatal.
Se han descrito casos de teratogenia asociados al uso de simpaticomiméticos (18) que, si bien no eran administrados vía oftálmica, sus efectos indeseables se debían a la absorción sistémica y al paso a través de la placenta al feto. Por ello, los autores desaconsejan dilatar a las gestantes con fenilefrina tópica.
Durante la lactancia, todos los fármacos midriáticos deben usarse con precaución, prescindiendo de la fenilefrina y la escopolamina (tabla 3).
3. Colorantes
Se utilizan en Oftalmología para diagnosticar enfermedades de la conjuntiva, córnea, vía lagrimal o corio-retinianas. Existe un amplio espectro de fármacos colorantes, tales como la fluoresceína sódica, rosa de Bengala, azul de metileno, azul alcián, azul tripán, verde lisamina, verde indocianina, proflavina, mercurocromo, argirol y violeta de genciana (19); de ellos, la fluoresceína es la más utilizada con diferencia.
Si bien el uso de la fluoresceína por vía tópica es seguro durante el embarazo y no irritante, no se conoce la posible teratogenia derivada de la vía intravenosa. A pesar de los artículos que defienden su inocuidad durante la gestación (20), debe valorarse el riesgo/beneficio en pacientes gestantes o lactantes.
Del resto de principios activos colorantes no existe experiencia suficiente en esta fase de la vida para poder llegar a una conclusión fiable.
4. Antibióticos
En la actualidad existe una gran cantidad de fármacos antiinfecciosos disponibles para uso oftálmico. Los fármacos que sean utilizados durante la gestación no deberían sobrepasar las categorías A y B de seguridad propuestas por la FDA. De este modo, de los antibióticos de uso frecuente en Oftalmología, ha mostrado un nivel de seguridad A únicamente el ácido fusídico. El nivel B lo presentan todas las penicilinas (como la amoxicilina y bencilpenicilina) y cefalosporinas (ceftazidima y cefuroxima, entre otras); la tobramicina como único aminoglucósido; eritromicina, azitromicina y roxitromicina, dentro del grupo de los macrólidos; las lincosaminas (lincomicina y clindamicina); y la rifampicina, como fármaco antimicobacteriano (tabla 4).
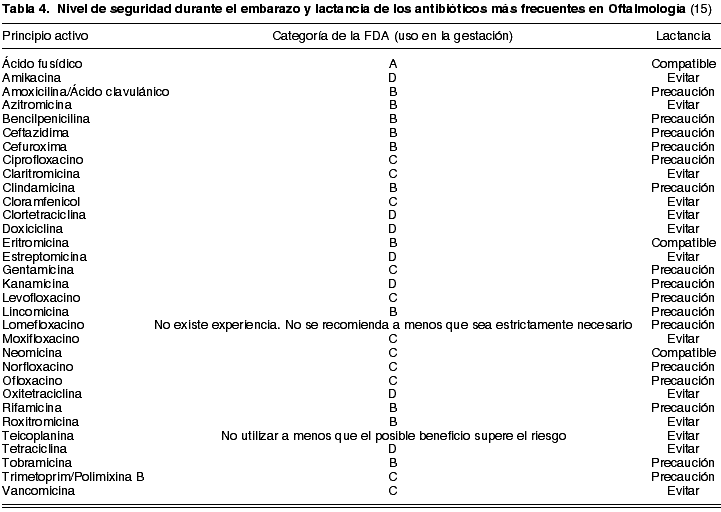
Los glucopéptidos (vancomicina y teicoplanina) están reservados para infecciones graves oculares. Concretamente, la vancomicina (C) se utiliza en forma de colirio reforzado para afecciones de la córnea y vía intravítrea en las endoftalmitis. La teicoplanina no debe prescribirse en el embarazo a menos que el posible beneficio supere el riesgo.
Los aminoglucósidos consiguen atravesar la barrera placentaria con facilidad (21) y administrados por vía parenteral son ototóxicos y nefrotóxicos. Excepto la tobramicina, que muestra nivel de seguridad B, los aminoglucósidos deben evitarse, ya que la neomicina y la gentamicina son C, y la estreptomicina, amikacina y kanamicina son D.
La administración de tetraciclinas (D) está contraindicada durante el embarazo, la lactancia y en pacientes menores de 8 años. Este grupo farmacológico muestra la capacidad de atravesar la placenta, se acumula en los dientes y huesos del feto y se excreta por la leche materna (tabla 4). En niños puede ser responsable de un oscurecimiento permanente de los dientes y retraso en la osteogénesis (22).
Con el uso de cloramfenicol (C) se han registrado casos de depresión de la médula ósea y anemia aplásica idiosincrásica en pacientes no gestantes (21). Por este motivo no es un fármaco de primera elección en la gravidez.
Los macrólidos carecen de potencial embriotóxico o teratógeno, mostrando un nivel de seguridad bastante aceptable durante la gestación (21). La eritromicina, azitromicina y roxitromicina exhiben categoría B de la FDA, mientras que la claritromicina es categoría C (tabla 4).
Las lincosaminas (lincomicina y clindamicina) al igual que todas las penicilinas y cefalosporinas, muestran nivel B de seguridad, por lo que en principio, podrían utilizarse con relativa confianza durante el embarazo. El ácido fusídico es el antibiótico de mayor seguridad (A), pero su espectro de acción reducido limita su aplicación.
Las 4 generaciones de quinolonas muestran nivel C. Las más utilizadas en Oftalmología son: lomefloxacino, norfloxacino, ofloxacino, ciprofloxacino, levofloxacino, moxifloxacino y gatifloxacino. Administradas por vía sistémica son capaces de alcanzar concentraciones terapéuticas en humor vítreo. Su uso no está permitido en la gestación, lactancia y niños, al depositarse en los cartílagos inmaduros (22).
El trimetoprim (C) se asocia a la polimixina B en el tratamiento de las infecciones de la superficie ocular. El cotrimoxazol puede producir colitis pseudomembranosa y anemia megaloblástica por déficit de ácido fólico, por lo que no se recomienda en embarazadas (22).
En relación a la lactancia, excepto el ácido fusídico, la eritromicina y la neomicina, que se han comprobado compatibles, el resto de antibióticos deberían utilizarse con precaución o evitarse (tabla 4).
5. Antifúngicos
Utilizados en queratitis causadas por hongos y en endoftalmitis fúngicas, se dividen en 5 grandes grupos: polienos, azoles, alilaminas, equinocandinas y un conjunto misceláneo. Los más frecuentes en Oftalmología son: nistatina (B) y anfotericina B (B) en el grupo de polienos; ketoconazol (C), itraconazol (C), fluconazol (C), voriconazol (C) y posaconazol (C) dentro de los antifúngicos tipo azol; terbinafina (B) como alilamina y caspofungina (C) como representante de las equinocandinas (ver tabla 5).
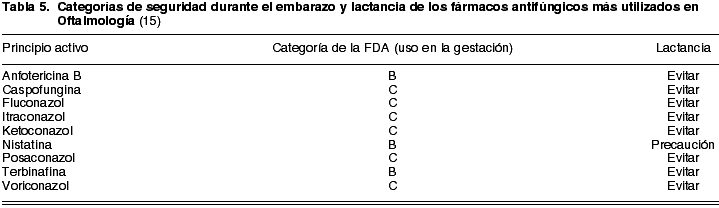
Se recomienda evitarlos todos durante la lactancia, excepto la nistatina, con la que se aconseja precaución.
6. Antivirales
Los virus son microorganismos intracelulares. Este hecho obliga al fármaco en cuestión a atravesar la pared de la célula invadida y buscar, con mayor o menor especificidad, la partícula vírica. De la capacidad para distinguir el huésped del virus deriva la toxicidad de estos principios activos (21).
Excepto el famciclovir que exhíbe categoría B, el resto –aciclovir, ganciclovir, valaciclovir, foscarnet, cidofovir– son C. Asimismo, el ganciclovir, famciclovir, foscarnet y cidofovir deben evitarse durante la lactancia, pudiendo utilizarse el resto tras valorar los riesgos y beneficios, aunque con cautela (tabla 6).

BIBLIOGRAFÍA
-
Chung CY, Kwok AKH, Chung KL. Use of ophthalmic medications during pregnancy. Hong Kong Med J 2004; 10: 191-195.
-
Yang T, Walker MC, Krewski D, Yang Q, Nimrod C, Garner P, Fraser W, Olatunbosun O, Wen SW. Maternal characteristics associated with pregnancy exposure to FDA category C, D and X drugs in a Canadian population. Pharmacoepidemiology and Drug Safety 2008; 17: 270-277.
-
Gasset AR, Akaboshi T. Embryopathic effect of ophthalmic EDTA. Invest Ophthalmol Vis Sci 1977; 16: 652-654.
-
Shinomiya K, Kajima M, Tajika H, Shiota H, Nakagawa R, Saijyou T. Renal failure caused by eyedrops containing phenylephrine in a case of retinopathy of prematurity. J Med Invest 2003; 50: 203-206.
-
Koren G, Pastuszak A, Ito S. Drug Therapy. TNEJM 1998; 338: 1128-1137.
-
Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn’t. BMJ 1996; 312: 71-72.
-
Schein OD. Prevention of endophthalmitis after cataract surgery: making the most of the evidence. Ophthalmology 2007; 114: 831-832.
-
Riss B, Riss P. Corneal sensitivity in pregnancy. Ophthalmologica 1981; 183: 57-62.
-
Weinreb RN, Lu A, Beeson C. Maternal corneal thickness during pregnancy. Am J Ophthalmol 1988; 105: 258-260.
-
Park SB, Lindahl KJ, Temnycky GO, Aquavella JV. The effect of pregnancy on the corneal curvature. CLAO J 1992; 18: 256-259.
-
Schultz KL, Birnbaum AD, Goldstein DA. Ocular disease in pregnancy. Curr Opin Ophthalmol 2005; 16: 308-314.
-
Saito Y, Tano Y. Retinal pigment epithelial lesions associated with choroidal ischemia in preeclampsia. Retina 1998; 18: 103-108.
-
Rahman J, Rahman W. Temporary blindness as a complication of eclampsia: observations on three cases. J Obstet Gynaecol 2002; 22: 87-88.
-
Abad FJ, Pons J, Micó M, Casterá DE, Bellés MD, Sánchez A. Categorías de riesgo de los medicamentos utilizados durante el embarazo: Guía rápida de consulta. FAP 2005; 3: 49-61.
-
Vademecum Internacional. 50ª edición; Madrid: CMP Medicom; 2009.
-
Cortés C, Cuesta T, Gil MR. Fármacos midriáticos: pautas de dilatación en cirugía de cristalino. En: Lorente R, Mendicute J. LXXXIV Ponencia Oficial de la Sociedad Española de Oftalmología. Cirugía del Cristalino. Madrid: Industria gráfica MAC LINE SL; 2008; I: 421-427.
-
Loukovaara S, Immonen I, Teramo KA, Kaaja R. Progression of retinopathy during pregnancy in type 1 diabetic women treated with insulin lispro. Diabetes Care 2003; 26: 1193-1198.
-
Gilbert-Barness E, Drut RM. Association of sympathomimetic drugs with malformations. Vet Hum Toxicol 2000; 42: 168-171.
-
Encinas JL, Cajigal C. Midriáticos. Colorantes. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 11-18.
-
Halperin LS, Olk RJ, Soubrane G, Coscas G. Safety of fluorescein angiography during pregnancy. Am J Ophthalmol 1990; 109: 563-566.
-
Arias A, García MC, Matilla M. Antiinfecciosos. Antimicrobianos, antifúngicos y antivirales. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 19-50.
-
De las Heras B, Arias A, Bañuelos J, García C. Antibióticos. En: Cortés C, Arias A, Encinas JL, García-Feijoó J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 77-108.