REVISIÓN ACTUALIZADA
Defectos refractivos en la infancia (I)
GRABOWSKA A1, NOVAL S2, VILLAFRANCA HOLGUÍN M3, GRANADOS FERNÁNDEZ M4, PERALTA J5
1
Licenciada en medicina. Servicio de Oftalmología. Hospital Universitario La
Paz/Universidad Autónoma de Madrid. Instituto de investigación IdiPAZ.
2 Doctor en medicina. Servicio de Oftalmología infantil. Hospital
Universitario La Paz/Universidad Autónoma de Madrid. Instituto de investigación
IdiPAZ.
3 Optometrista. Vissum Coorporación Oftalmológica. Madrid.
4 Licenciada en medicina. Servicio de Oftalmología infantil. Hospital
Universitario La Paz/Universidad Autónoma de Madrid. Instituto de investigación
IdiPAZ.
5 Doctor en medicina. Servicio de oftalmología infantil. Hospital
Universitario La Paz/Universidad Autónoma de Madrid. Instituto de investigación
IdiPAZ.
RESUMEN
La alteración del proceso de emetropización puede provocar el desarrollo de defectos refractivos como la miopía, la hipermetropía y el astigmatismo. Las investigaciones sugieren que los factores genéticos juegan un papel primordial en el desarrollo de la miopía y la hipermetropía. Sin embargo, también hay evidencias sobre la influencia de los factores ambientales. El papel de los factores genéticos en el desarrollo del astigmatismo es controvertido. En esta revisión se presenta la definición, la prevalencia y la etiopatogenia de los errores refractivos en la población pediátrica.
INTRODUCCIÓN
Se considera la emetropización como un proceso de coordinación entre la potencia de la córnea, el cristalino y la longitud axial, retroalimentado por los estímulos visuales, con el objetivo de que a la edad adulta el punto focal incida sobre el plano de la retina. El defecto refractivo medio a los tres meses de edad es de +2,16 dioptrías (D), con una desviación estándar (DE) de 1,30 (1). El modelo más aceptado en la actualidad considera que el desenfoque causado por este defecto hipermetrópico estimula el crecimiento ocular para reducir la hipermetropía (1). La longitud axial media cuando se alcanza la emetropía en la edad adulta es de 23,6 mm (DE 0,7 mm)2.
Entre los 6 meses y el año de edad se compensa el aumento de la longitud axial con cambios a nivel del polo anterior. La córnea disminuye su poder refractivo aumentando su radio, y la cámara anterior pasa de tener una profundidad de 2,4 mm al nacer a 3,5 mm al año, dando lugar a un aumento en la distancia entre la córnea y el cristalino que se traduce en una disminución global de 0,8 D de la potencia refractiva. A partir del año de edad y hasta el final de la emetropización, los ajustes recaen principalmente en el cristalino, de modo que el radio anterior pasa de 5 mm a 10 mm y el radio posterior de 4 mm a 6 mm al final de la emetropización. Habitualmente se alcanza la emetropía entre los 9 y los 14 años de edad (1,3).
Se han descrito dos mecanismos teóricos de emetropización: uno pasivo bajo control genético y otro activo bajo control ambiental. El modelo de emetropización activa por retroalimentación visual asume que el ojo modula su crecimiento en respuesta a estímulos producidos por errores en su longitud focal, intentando reducir dicho error. Actualmente se han identificado tres mecanismos de emetropización activa: por deprivación (4,5), por desenfoque (6), y por fármacos (7). El mecanismo de deprivación se observa tras la oclusión total o parcial de un ojo y el mecanismo por desenfoque por la aposición de una lente negativa en el eje visual. Ambos mecanismos regulan un crecimiento de la esclera, aumentando la longitud axial del globo ocular, mediado principalmente por el sistema colinérgico. El mecanismo inducido por fármacos puede variar. En el caso de topiramato (8), parece estar relacionado con su efecto inhibidor de la anhidrasa carbónica y por inducción de la efusión ciliocoroidea.
Una alteración en el proceso de emetropización puede provocar el desarrollo de defectos refractivos como la miopía, la hipermetropía y el astigmatismo. En los niños, la medición del error refractivo debe realizarse bajo cicloplejía, para evitar sobreestimar la miopía o subestimar la hipermetropía dada su gran capacidad de acomodación (9).
MIOPÍA
La miopía simple es una ametropía esférica, es decir, que el error refractivo es igual en todos los meridianos corneales, en la que los rayos paralelos procedentes del infinito en lugar de focalizar en la retina lo hacen por delante de ella.
La prevalencia de la miopía difiere en las series publicadas según su definición, la población estudiada y el método empleado para la refracción. La prevalencia de miopía en el primer año de vida se ha estimado entre un 4% y un 5% (10) y aumenta progresivamente con la edad. En un estudio sobre niños estadounidenses CLEERE (Collaborative Longitudinal Evaluation of Ethnicity and Refractive Error) (11), que incluía 2523 niños entre 5 y 17 años de edad, la prevalencia de miopía fue del 9,2%. La prevalencia fue mayor en los niños de raza asiática (18,5%), seguido por los latinoamericanos (13,2%) y los africanos (6,6%). La menor prevalencia se obtuvo en los niños de raza caucásica (4,4%). Los resultados del Estudio Refractivo Pediátrico en la India (12), Chile (13), África (14), Malasia (15) y China (16,17), confirmaron como una prevalencia baja (<5%) entre los 5 y 6 años aumenta significativamente hasta los 15 años. Destacó la alta prevalencia (>35%) de miopía en la población China de mayor edad y en el sexo femenino.
Múltiples estudios han demostrado que la miopización tiene una base genética. Los estudios sobre gemelos han observado un alto índice de herencia de los defectos refractivos y todos los componentes implicados (la longitud axial, la curvatura de la córnea y el poder del cristalino). Se han detectado nueve loci relacionados con la miopía, entre ellos siete con un patrón de herencia autosómico dominante (21q22.3, 18p11.31, 12q21-q23, 7q36, 17q21-q22, 4q22-q27, 2q37.1), uno autosómico recesivo (14q22.1-q24.2) y otro recesivo ligado al cromosoma X (Xq28, Xq23-q25) (18,19). Los estudios experimentales indican que estos genes expresan citoquinas, neurotransmisores, proteínas de la matriz escleral, el vítreo y mediadores del crecimiento del ojo (20-22). Aunque no se conoce el paralelismo real entre la miopía inducida en los animales con la miopía fisiológica humana, los estudios en animales nos conducen a una conclusión fundamental: que la emetropización es un proceso controlado genéticamente, aunque dependiente del entorno visual.
Hasta en un tercio de los casos existen evidencias sobre el papel del ambiente en el desarrollo de la miopía (23). En el pasado se sugirió que la exposición a la luz artificial durante los primeros dos años de vida constituía un factor patogénico importante. En el estudio de Quinn et al. (24), el 10% de los niños que dormían sin iluminación artificial, el 34% de lo que lo hacían con una lámpara de noche y el 55% de los niños que dormían con la luz de la habitación encendida, desarrollaron miopía. Los estudios de Gwiazda et al (25). y Zadnick et al. (26) no confirmaron estos resultados, lo que podía sugerir que la iluminación artificial nocturna tuviese cierto efecto protector. Las diferencias entre los estudios, como por ejemplo en la edad media de los niños incluidos, podían afectar a los resultados. Son necesarios más estudios para clarificar este tema.
Los hábitos de lectura y otras tareas de cerca no parecen relacionarse con el riesgo de desarrollar miopía en niños por debajo de los 6 años (27). Sin embargo, parecen influir en los niños por encima de esta edad. El estudio SCORM (Singapore Cohort Study of the Risk Factors for Myopia) (28), que valoró niños de entre 7 y 9 años de edad, concluyó que los niños que leían más que dos libros a la semana tenían más probabilidad de desarrollar miopía superior a 3,0 D. En otro estudio realizado en la población infantil china de Singapur y Sidney se demostró una correlación entre la disminución de las actividades exteriores y el riesgo de desarrollar miopía (29). Las diferencias entre el medio rural y las áreas urbanas confirmaron que la aparición de miopía está influenciada por factores ambientales (30).
El bajo peso al nacimiento y la gravedad de la retinopatía del prematuro se han asociado con un mayor riesgo de aparición de miopía. El 20% de los lactantes con muy bajo peso al nacer (inferior a 1.251 g), presentan miopía en los primeros 2 años de vida y el 4,6%, de tipo grave (>5,0 D) (31). En el estudio ETROP (Early Treatment for Retinopathy of Prematurity) (32) se observó como el riesgo del 48,4% de desarrollar miopía en los ojos con retinopatía del prematuro que había remitido sin tratamiento, aumenta a un 60,6% en aquellos tratados en estadio pre-umbral de alto riesgo y a un 80,9% en ojos tratados en estadio umbral.
Por último, la miopía se ha asociado con algunas anomalías oculares y enfermedades sistémicas (tabla 1) por cambios en la curvatura corneal, en el índice de la refracción del cristalino o en la longitud axial ocular. En el síndrome de Marfan, por ejemplo, se han descrito dos posibles mecanismos responsables: la migración anterior del diafragma irido-cristaliniano, que desplazaría el punto de enfoque del ojo anteriormente, y el engrosamiento del cristalino que aumenta su poder refractivo (33). Las alteraciones de los componentes elásticos de la esclera y la córnea, también podrían provocar un aumento de la longitud axial y en consecuencia miopía (34). Un mecanismo semejante sería el responsable del desarrollo de la miopía en otras enfermedades del tejido conectivo.
HIPERMETROPÍA
Se trata de una ametropía esférica donde teóricamente los rayos paralelos de luz procedentes de un objeto lejano se refractan de forma que convergen en un punto situado detrás del plano de la retina. La causa más frecuente es una disminución del eje antero-posterior del ojo (hipermetropía axial) determinada genéticamente, sin embargo existen otros tipos de hipermetropías (de curvatura, de índice y por alteración de la posición del cristalino) (tabla 1).

La hipermetropía leve es un estado fisiológico en la población infantil. A diferencia de la miopía, la hipermetropía suele disminuir con la edad. Mutti et al. (1) observaron en un grupo de 221 niños de 3 meses de edad que el 24,8% tenían una refracción ciclopléjica de al menos 3,0 D de hipermetropía. A los 9 meses la prevalencia había disminuido al 5,4% (35). En el estudio CLEERE (11), la prevalencia de la hipermetropía también disminuía con la edad. Sin embargo, existen también estudios que indican un aumento de la hipermetropía hasta los 7 años (36,37). En cuanto a la prevalencia de la hipermetropía (al menos +1,0 D) en diferentes grupos étnicos, por orden de frecuencia es mayor en niños caucásicos (32,4%), que en los latinoamericanos (20,7%), los áfrico-americanos (12,2%) y los asiáticos (12,0%) (11).
Varios estudios han analizado la incidencia de hipermetropía elevada y su importancia en el desarrollo de una función visual anómala (38,39). Los datos del estudio de Mutti et al. (1) sugieren que los niños con hipermetropía elevada (>5,0 D) no alcanzan la emetropización, frente a aquellos con baja hipermetropía que suelen llegar a ser emétropes.
En la actualidad, se considera que los factores genéticos juegan un papel primordial en el desarrollo de la hipermetropía. Los estudios demuestran un mayor índice de herencia de hipermetropía (1-7 D) en los gemelos monocigóticos que en los dicigóticos (40). Los estudios poblacionales también revelan agregación familiar (41). En una población de 34 recién nacidos que tenían un padre o un hermano con endotropía, a los 6 meses de edad el 38% tenía una hipermetropía de al menos 4 D, lo que supera la prevalencia para la población general a esta edad (42). La herencia difiere según el tipo de hipermetropía. En las hipermetropías débiles de hasta 6 D el patrón de herencia es autosómico dominante. En la hipermetropía elevada la herencia es autosómica recesiva y en ocasiones está relacionada con malformaciones oculares y generales.
Recientemente, se ha sugerido que el riesgo de desarrollar hipermetropía se asocia con el crecimiento de los niños, de modo que un retraso en el crecimiento general interrumpiría el proceso de emetropización dando lugar a una longitud axial corta (43). Esto podría explicar la alta prevalencia de hipermetropía en los niños con la deficiencia de la hormona de crecimiento (44).
ASTIGMATISMO
En el astigmatismo, los rayos de luz paralelos al ojo no se unen en un mismo punto de imagen sino que se focalizan en dos líneas focales, perpendiculares entre sí (astigmatismo regular) o sin focos definidos (astigmatismo irregular). Esto se debe a la superficie irregular o tórica de la córnea y del cristalino.
En la infancia, el astigmatismo es predominantemente corneal. Los recién nacidos tienen córneas pronunciadas y astigmáticas (generalmente contra la regla) (fig. 1). La ectopia del cristalino en el síndrome de Marfan constituye un ejemplo de astigmatismo no corneal.
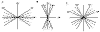
Fig. 1: A: Astigmatismo inverso o contra la regla: el meridiano de máxima
potencia es el meridiano horizontal (entre 30º y 150º), B: Astigmatismo directo
o según la regla: el meridiano de máxima potencia es el meridiano vertical
(entre 60º y 120º), C: Astigmatismo oblicuo: cuando los meridianos principales
se encuentran uno a 45º (±15º) y el otro a 135º (±15º).
La mayor prevalencia de astigmatismo se ha observado en el primer año de vida (45), especialmente en los recién nacidos con menor peso al nacimiento y de menor edad gestacional (46,47). El desarrollo del globo ocular tiende a corregir el astigmatismo en los primeros años. En el estudio CLEERE (11), la prevalencia del astigmatismo (la diferencia entre los dos meridianos corneales de al menos 1,0 D) difería también según el grupo étnico siendo del 20% en los africoamericanos, del 33,6% en los asiáticos, del 36,9% en los latinoamericanos y del 26,4% en los niños caucásicos.
La influencia de los factores genéticos es controvertida. Teikari et al. (48) no encontraron diferencias entre gemelos monocigóticos y dicigóticos, lo que reduciría la influencia de los factores genéticos frente a los ambientales en el desarrollo del astigmatismo. Sin embargo, los resultados sobre gemelos de Hammond et al. (49) indicaban todo lo contrario. Clement et al. (50) analizaron datos de 125 familias afectadas por astigmatismo y describieron un patrón de herencia autosómico dominante.
Cualquier patología capaz de producir una deformación en la córnea puede inducir astigmatismo, como un chalazión o un pterigión al alterar la relación entre los meridianos corneales. Robb et al. (51) describieron un aumento en el tiempo del astigmatismo en 16 de los 37 niños con hemangiomas palpebrales y orbitarios. La ptosis y su cirugía también han sido descritos como factores predisponentes al astigmatismo. Los pacientes con ptosis congénita tienen mayor grado de asimetría topográfica corneal, así como mayor grado de astigmatismo (52). Howland et al. (53) sugirieron que el astigmatismo corneal puede ser resultado de la desiguales fuerzas ejercidas por los músculos extraoculares sobre la córnea. También la tensión inducida por los párpados se ha propuesto como posible factor en el desarrollo del astigmatismo corneal. Esto explicaría la alta incidencia de astigmatismo en el síndrome Down y el aumento de su potencia con los años (54). La mayor prevalencia del astigmatismo oblicuo apoya esta teoría, ya que se ha visto la correlación entre el eje del astigmatismo y la inclinación superior del canto temporal (55).
CONCLUSIONES
Aún no se conocen las causas exactas de los defectos refractivos. Las investigaciones realizadas hasta ahora, sobre todo en gemelos, sugieren que los factores genéticos juegan un papel primordial en el desarrollo de la miopía y la hipermetropía. Sin embargo, también hay evidencias sobre la influencia de los factores ambientales. El papel de los factores genéticos en el desarrollo del astigmatismo es controvertido. La interacción entre los párpados y la tensión de los músculos extra-oculares parecen explicar el desarrollo de del astigmatismo en diversos grupos étnicos y enfermedades.
BIBLIOGRAFÍA
-
Mutti DO, Mitchell GL, Jones LA, Friedman NE, Frane SL, Lin WK, et al. Axial growth and changes in lenticular and corneal power during emmetropization in infants. Invest Ophthalmol Vis Sci 2005; 46: 3074-3080.
-
Gordon RA, Donzis PB. Refractive development of the human eye. Arch Ophthalmol 1985; 103: 785-789.
-
Wildsoet CF. Active emmetropization—evidence for its existence and ramifications for clinical practice. Ophthalmic Physiol Opt 1997; 17: 279-290.
-
Wiesel TN, Raviola E. Myopia and eye enlargement after neonatal lid fusion in monkeys. Nature 1977; 266: 66-68.
-
Smith EL 3rd, Hung LF. Form-deprivation myopia in monkeys is a graded phenomenon. Vision Res 2000; 40: 371-381.
-
Smith EL 3rd, Hung LF, Huang J, Blasdel TL, Humbird TL, Bockhorst KH. Effects of optical defocus on refractive development in monkeys: evidence for local, regionally selective mechanisms. Invest Ophthalmol Vis Sci 2010; 51: 3864-3873.
-
Metlapally S, McBrien NA. The effect of pirenzepine on positive- and negative-lens-induced refractive error and ocular growth in chicks. Invest Ophthalmol Vis Sci 2010; 51: 5438-5444.
-
Fraunfelder FW, Fraunfelder FT, Keates EU. Topiramate-associated acute, bilateral, secondary angle-closure glaucoma. Ophthalmology 2004; 111: 109-111.
-
Mutti DO, Zadnik K, Egashira S, Kish L, Twelker JD, Adams AJ. The effect of cycloplegia on measurement of the ocular components. Invest Ophthalmol Vis Sci 1994; 35: 515-527.
-
Atkinson J, Braddick OJ, Durden K, Watson PG, Atkinson S. Screening for refractive errors in 6-9 month old infants by photorefraction. Br J Ophthalmol 1984; 68: 105-112.
-
Kleinstein RN, Jones LA, Hullett S, Kwon S, Lee RJ, Friedman NE, et al. Collaborative Longitudinal Evaluation of Ethnicity and Refractive Error Study Group. Refractive error and ethnicity in children. Arch Ophthalmol 2003; 121: 1141-1147.
-
Murthy GV, Gupta SK, Ellwein LB, Muñoz SR, Pokharel GP, Sanga L, et al. Refractive error in children in an urban population in New Delhi. Invest Ophthalmol Vis Sci 2002; 43: 623-631.
-
Maul E, Barroso S, Munoz SR, Sperduto RD, Ellwein LB. Refractive error study in children: results from La Florida, Chile. Am J Ophthalmol 2000; 129: 445-454.
-
Naidoo KS, Raghunandan A, Mashige KP, Govender P, Holden BA, Pokharel GP, et al. Refractive error and visual impairment in African children in South Africa. Invest Ophthalmol Vis Sci 2003; 44: 3764-3770.
-
Goh PP, Abqariyah Y, Pokharel GP, Ellwein LB. Refractive error and visual impairment in school-age children in Gombak District, Malaysia. Ophthalmology 2005; 112: 678-685.
-
Zhao J, Pan X, Sui R, Munoz SR, Sperduto RD, Ellwein LB. Refractive error study in children: results from Shunyi District , China. Am J Ophthalmol 2000; 129: 427-435.
-
He M, Zeng J, Liu Y, Xu J, Pokharel GP, Ellwein LB. Refractive error and visual impairment in urban children in Southern China. Invest Ophthalmol Vis Sci 2004; 45: 793-799.
-
Montero JA, Ruiz-Moreno JM. Fisiopatología y clínica de la patología macular miópica. En: Armadá Maresca F. Patología y cirugía de la mácula. Madrid: Sociedad Española de Oftalmología; 2010; 805-807.
-
Hornbeaka DM, Young TL. Myopia genetics: a review of current research and emerging trends. Curr Opin Ophthalmol 2009; 20: 356-362.
-
Ashby RS, Feldkaemper MP. Gene expression within the amacrine cell layer of chicks after myopic and hyperopic defocus. Invest Ophthalmol Vis Sci 2010; 51: 3726-3735.
-
Frost MR, Norton TT. Differential protein expression in tree shrew sclera during development of lens-induced myopia and recovery. Mol Vis 2007; 13: 1580-1588.
-
Halfter W, Winzen U, Bishop PN, Eller A. Regulation of eye size by the retinal basement membrane and vitreous body. Invest Ophthalmol Vis Sci 2006; 47: 3586-3594.
-
Lopes MC, Andrew T, Carbonaro F, Spector TD, Hammond CJ. Estimating heritability and shared environmental effects for refractive error in twin and family studies. Invest Ophthalmol Vis Sci 2009; 50: 126-131.
-
Quinn GE, Shin CH, Maguire MG, Stone RA. Myopia and ambient lighting at night. Nature 1999; 399: 113-114.
-
Gwiazda J, Ong E, Held R, Thorn F. Myopia and ambient night-time lighting. Nature 2000; 404: 144.
-
Zadnik K, Jones LA, Irvin BC, Kleinstein RN, Manny RE, Shin JA, et al. Myopia and ambient night-time lighting. CLEERE Study Group. Collaborative Longitudinal Evaluation of Ethnicity and Refractive Error. Nature 2000; 404: 143-144.
-
Low W, Dirani M, Gazzard G, Chan YH, Zhou HJ, Selvaraj P, et al. Family history, near work, outdoor activity, and myopia in Singapore Chinese preschool children. Br J Ophthalmol 2010; 94: 1012-1016.
-
Saw SM, Chua WH, Hong CY, Wu HM, Chan WY, Chia KS, et al. Nearwork in early-onset myopia. Invest Ophthalmol Vis Sci 2002; 43: 332-339.
-
Rose KA, Morgan IG, Smith W, Burlutsky G, Mitchell P, Saw SM. Myopia, lifestyle, and schooling in students of Chinese ethnicity in Singapore and Sydney. Arch Ophthalmol 2008; 126: 527-530.
-
Ip JM, Rose KA, Morgan IG, Burlutsky G, Mitchell P. Myopia and the urban environment: findings in a sample of 12-year-old Australian school children. Invest Ophthalmol Vis Sci 2008; 49: 3858-3863.
-
Quinn GE, Dobson V, Repka MX, Reynolds J, Kivlin J, Davis B, et al. Development of myopia in infants with birth weights less than 1251 grams. The Cryotherapy for Retinopathy of Prematurity Cooperative Group. Ophthalmology 1992; 99: 329-340.
-
Davitt BV, Dobson V, Good WV, Hardy RJ, Quinn GE, Siatkowski RM, et al. Early Treatment for Retinopathy of Prematurity Cooperative Group. Prevalence of myopia at 9 months in infants with high-risk prethreshold retinopathy of prematurity. Ophthalmology 2005; 112: 1564-1568.
-
Dagi LR, Walton DS. Anterior axial lens subluxation, progressive myopia, and angle-closure glaucoma: recognition and treatment of atypical presentation of ectopia lentis. J AAPOS 2006; 10: 345-350.
-
Wheatley HM, Traboulsi EI, Flowers BE, Maumenee IH, Azar D, Pyeritz RE, et al. Immunohistochemical localization of fibrillin in human ocular tissues: relevance to the Marfan syndrome. Arch Ophthalmol 1995; 113: 103-109.
-
Tarczy-Hornoch K. The epidemiology of early childhood hyperopia. Optom Vis Sci 2007; 84: 115-23.
-
Slapter FJ. Age norms of refraction and vision. Arch Ophthalmol 1950; 43: 466-481.
-
Brown EVL. Net average yearly changes in refraction of atropinized eyes from birth to beyond middle life. Arch Ophthalmol 1938; 19: 719.
-
Pennie FC, Wood IC, Olsen C, White S, Charman WN. A longitudinal study of the biometric and refractive changes in full-term infants during the first year of life. Vision Res 2001; 41: 2799-2810.
-
Atkinson J, Anker S, Bobier W, Braddick O, Durden K, Nardini M, et al. Normal emmetropization in infants with spectacle correction for hyperopia. Invest Ophthalmol Vis Sci 2000; 41: 3726-3731.
-
Hammond CJ, Snieder H, Gilbert CE, Spector TD. Genes and environment in refractive error: the twin eye study. Invest Ophthalmol Vis Sci 2001; 42: 1232-1236.
-
Lee KE, Klein BE, Klein R, Fine JP. Aggregation of refractive error and 5-year changes in refractive error among families in the Beaver Dam Eye Study. Arch Ophthalmol 2001; 119: 1679-1685.
-
Aurell E, Norrsell K. A longitudinal study of children with a family history of strabismus: factors determining the incidence of strabismus. Br J Ophthalmol 1990; 74: 589-594.
-
Al-Bagdady M, Murphy PJ, Woodhouse JM. Development and distribution of refractive error in children with Down’s syndrome. Br J Ophthalmol 2010. doi:10.1136/bjo.2010.185827.
-
Parentin F, Tonini G, Perissutti P. Refractive evaluation in children with growth defect. Curr Eye Res 2004; 28: 11-15.
-
Howland HC, Sayles N. Photorefractive measurements of astigmatism in infants and young children. Invest Ophthalmol Vis Sci 1984; 25: 93-102.
-
Friling R, Weinberger D, Kremer I, Avisar R, Sirota L, Snir M. Keratometry measurements in preterm and full term newborn infants. Br J Ophthalmol 2004; 88: 8-10.
-
Isenberg SJ, Del Signore M, Chen A, Wei J, Christenson PD. Corneal topography of neonates and infants. Arch Ophthalmol 2004; 122: 1767-1771.
-
Teikari JM, O’Donnell JJ. Astigmatism in 72 twin pairs. Cornea 1989; 8: 263-266.
-
Hammond CJ, Sneider H, Gilbert CE, Spector TD. Genes and environment in refractive error: the twin eye study. Invest Ophthalmol Vis Sci 2001; 42: 1232-1236.
-
Clementi M, Angi M, Forabosco P, Di-Gianantonio E, Tenconi R. Inheritance of astigmatism: evidence for a major autosomal dominant locus. Am J Hum Genet 1998; 63: 825-830.
-
Plager DA, Snyder SK. Resolution of astigmatism after surgical resection of capillary hemangiomas in infants. Ophthalmology 1997; 104: 1102-1106.
-
Ugurbas SH, Zilelioglu G. Corneal topography in patients with congenital ptosis. Eye 1999; 13: 550-554.
-
Howland HC, Sayles N. Photokeratometric and photorefractive measurements of astigmatism in infants and young children. Vision Res 1985; 25: 73-81.
-
Haugen OH, Hovding G, Lundstrom I. Refractive development in children with Down’s syndrome: a population based, longitudinal study. Br J Ophthalmol 2001; 85: 714-719.
-
Gracia ML, Huang D, Crowe S, et al. Relationship between the axis and the degree of high astigmatism and obliquity of palpebral fissure. J AAPOS 2003; 7: 14-22.