COMUNICACIÓN SOLICITADA
TNF-a y fármacos anti TNF-a en oftalmología
RODRÍGUEZ-FEIJOÓ D1,3, PINAR SUEIRO S2,3, FONOLLOSA Á2,3
1
Servicio de Oftalmología. Hospital de Galdakao-Usansolo, Vizcaya. Licenciado en
Medicina.
2 Servicio de Oftalmología. Hospital de Cruces, Vizcaya.
3 Grupo de Oftalmo-Biología Experimental (GOBE), Universidad del País
Vasco (UPV/EHU). Vizcaya.
INTRODUCCIÓN
El factor de necrosis tumoral alfa (Tumor Necrosis Factor Alpha, TNF-a) es una citoquina proinflamatoria con múltiples funciones en la respuesta inmune. Desde su descubrimiento inicial como factor sérico causante de necrosis tumoral, se han encontrado múltiples funciones en la regulación del proceso inflamatorio. Este potente mediador inmunológico, tiene también un importante papel en la apoptosis celular y en la defensa contra agentes patógenos (1,2).
El TNF-a se sintetiza principalmente en monocitos/macrófagos y linfocitos T; y en menor medida en neutrófilos, células mastoides, células endoteliales, fibroblastos y células gliales. El TNF-a promueve la inflamación mediante un efecto citotóxico directo y también mediante efectos indirectos: regulación de la producción de otras citoquinas proinflamatorias, mediadores de ác. araquidónico, liberación de radicales libres de oxígeno y nitrógeno, metaloproteinasas, quimoquinas y factores antiangiogénicos (3).
Según el modelo clásico proinflamatorio, un fracaso en la regulación del TNF-a en el lugar dónde se está llevando a cabo la respuesta inmunológica, activará la inmunidad celular innata y la respuesta inflamatoria crónica. Esto tiene como resultado el daño tisular. Este modelo ha sido demostrado en experimentos con ratones transgénicos que sobreexpresan TNF-a en las articulaciones, desarrollando el 100% de estos ratones una poliartitis inflamatoria que respondía al tratamiento con fármacos utilizados en la artritis reumatoide (AR) humana (4).
La neutralización de la actividad TNF-a mediante fármacos en la práctica clínica conlleva: una desactivación de las citoquinas de la cascada proinflamatoria, una disminución del reclutamiento de células inflamatorias del torrente sanquíneo a la zona de inflamación, una disminución de la capacidad de angiogénesis mediada por el factor de crecimiento endotelial vascular (vascular endotelial growth factor, VEGF), alteraciónes en las quimoquinas y en la permeabilidad vascular. Los fármacos anti TNF-a se comenzaron a utilizar en medicina a finales de los años 90 para tratar la AR y la enfermedad de Chron (5,6). Actualmente estos fármacos también se utilizan para el tratamiento de artritis idiopática juvenil, artritis psoriásica, espondilitis anquilosante, colitis ulcerosa, y, en las uveítis en el campo de la oftalmología.
TNF-a: ESTRUCTURA Y FUNCIÓN BIOLÓGICA
La familia TNF engloba a 19 citoquinas con importantes funciones en inflamación y apoptosis (1). El subtipo TNF-a es una proteína de 17 KD compuesta por 185 aminoácidos. La actividad biológica del TNF-a está mediada a través de sus receptores TNFR1 (receptor TNF-a soluble, expresado en la mayoría de las células) y TNFR2 (receptor TNF-a asociado a membrana, presente sólo en algunos tipos celulares). Ambos receptores son glicoproteínas transmembrana con dominios extracelulares similares; sin embargo, su dominio intracelular es diferente y sólo el TNFR1 tiene un «death domain» (receptor situado en la superficie celular que transmite señales de apoptosis. Estos receptores pueden iniciar la apoptosis celular mediante la cascada de caspasas en pocos segundos desde la unión del ligando) importante en la mediación de la apoptosis celular mediante TNF-a. Debido a esto, inicialmente se creyó que el TNFR1 mediaba respuestas inflamatorias y de apoptosis y el TNFR2 respuestas de crecimiento celular y proliferación (7). Actualmente también existen estudios (8,9) que encuentran funciones protectoras mediadas por TNFR1. El tipo celular, el estado funcional de la célula, la concentración y duración de la exposición al TNF-a y el tipo de citoquinas presentes, va a determinar que se desencadene un tipo u otro de respuesta (esquema 1).
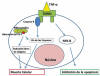
Esquema 1: La unión de TNF-a
a TNFR1 puede mediar muerte o supervivencia celular.
Se han encontrado receptores TNFR1 y 2 en células endoteliales, iris, cuerpo ciliar, nervio óptico e interfaz vítreo-retiniana en ratones (10). En humanos, se han encontrado receptores TNFR1 y 2 en vítreo, mientras que en cultivos de células de epitelio pigmentario de la retina se han encontrado receptores TNFR1, pero no del tipo 2 (11). El TNF-a, se ha detectado predominantemente en las capas internas de la retina, lo cual concuerda con el patrón de distribución de las células gliales en la retina: astrocitos y células de Müller. La presencia del receptor TNFR1 en las células ganglionares de la retina indica la susceptibilidad de las mismas al efecto citotóxico del TNF-a. Las bases del funcionamiento del TNF-a en la retina, se podrían asemejar al funcionamiento del TNF-a en el cerebro, dónde en situaciones normales actúa como neuromodulador, pero en situaciones de isquemia puede tener efectos neurotóxicos o neuroprotectores (7).
FUNCIÓN DEL TNF-a EN LAS ENFERMEDADES OCULARES
El TNF-a participa activamente en la patogénesis de enfermedades inflamatorias, en la producción de edema, neovascularización y enfermedades neurodegenerativas a nivel ocular y extraocular. La relación del TNF-a en las uveítis se ha demostrado mediante dos modelos animales, de uveítis autoinmune y de uveítis producidas por endotoxinas (12). También se han encontrado polimorfismos en el gen del TNF-a, que altera su expresión, sobreproduciéndose TNF-a por parte de los leucocitos en la enfermedad de Behçet (13).
Existe evidencia científica (surgida a partir de modelos animales, y del estudio de muestras humanas obtenidas durante cirugía vítreo-retiniana) del papel del TNF-a en la producción de neovascularización retiniana, vítreo-retinopatía proliferativa (VRP) y edema retiniano (14,15). Nos parece importante destacar el papel del TNF-a en la VRP, ya que ésta es una causa importante de fracaso de la cirugía del desprendimiento de retina regmatógeno. La síntesis de TNF-a está aumentada en los ojos con VRP y normalmente regula la expresión de factores de supervivencia celular que protegen a las células del epitelio pigmentario de la retina en la VRP. Recientemente se ha descrito un polimorfismo de nucleótido simple en el locus de TNF que se asocia fuertemente a la PVR (16).
FÁRMACOS ANTI TNF-a
Los fármacos anti TNF-a presentan: una rápida acción, un buen perfil de seguridad y pocas contraindicaciones (pero potencialmente muy graves), que siempre se deben tener en cuenta antes de comenzar su administración para prevenir posibles complicaciones severas: Tuberculosis no tratada correctamente, infecciones de repetición o infección grave reciente que fue tratada con antibióticos intravenosos, cáncer en los últimos 5 años (no incluído el carcinoma basocelular de piel), embarazo o periodo de lactancia, enfermedad cardíaca grave o enfermedad demielinizante.
A continuación se detallan los fármacos anti TNF-a disponibles actualmente (tabla 1):
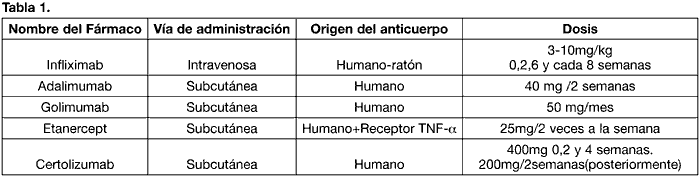
– Anticuerpos monoclonales anti TNF-a Infliximab (Remicade®): Anticuerpo monoclonal quimérico (IgG) derivado de un ADN recombinante, formado por una región constante de origen humano y otras variables de ratón. El Infliximab tiene una vida media en suero de 10 días (17). Se une y neutraliza a la porción tansmembrana y a la soluble de TNF-a, logrando interrumpir la cascada secuencial de activación de las vías inflamatorias mediadas por esta citoquina. La administración se realiza mediante perfusión intravenosa, combinado con un antihistamínico. La dosis recomendada es de 3-10 mg por kg de peso corporal. Se suele administrar una dosis en las semanas 0, 2 y 6 y cada 8 semanas a partir de entonces.
– Anticuerpos monoclonales anti TNF-a Adalimumab (Humira®): Es un fármaco biológico que bloquea específicamente el TNF-a. Su origen, completamente humano, explica que el Adalimumab induzca menos reacción inmunoalérgica (formación de anticuerpos anti-adalimumab, reacciones alérgicas) que el Infliximab. La dosis habitual de Adalimumab es de 40 mg cada 2 semanas, y se administra por vía subcutánea (18).
– Anticuerpos monoclonales anti TNF-a Golimumab (Simponi®): Es un anticuerpo monoclonal de origen completamente humano, aprobado en 2009 por la FDA para el tratamiento de AR y otras enfermedades autoinmunes. La vía de administración es subcutánea a una dosis de 50 mg una vez al mes (19).
– Receptor soluble de TNF-a Etanercept (Enbrel®): Es una molécula compuesta por una proteína dimérica recombinante unida a una porción del TNFR2 humano y a la fracción constante de la IgG humana (20). Su vida media es corta, en torno a 4 días. El Etanercept se une al TNF-a y lo inactiva biológicamente, impidiendo que el TNF-a se una a los receptores situados en las membranas de las células encargadas de la respuesta inflamatoria. La administración se realiza por vía subcutánea 2 veces por semana a una dosis de 25 mg en cada una de las inyecciones.
– Fragmento de anticuerpo recombinante anti TNF-a Certolizumab pegol (Cimzia®): Es un fragmento de anticuerpo monoclonal humano expresado en Escherichia coli y conjugado con polietinelglicol (PEG). La dosis de Certolizumab es de 400 mg (2 inyecciones de 200 mg cada una en un día) en las semanas 0, 2 y 4, seguido de una dosis de mantenimiento de 200 mg cada 2 semanas. La vía de administración es subcutánea (21).
Actualmente existe evidencia derivada de estudios experimentales en animales y de estudios en humanos que sugieren que el TNF-a tiene un papel específico en la inflamación ocular. El TNF-a está elevado en suero y/o humor acuoso en pacientes con uveítis comparados con los controles (22), también en pacientes con vasculitis (23) y oftalmia simpática (24). Debido a estos hallazgos, y al limitado éxito clínico/fracaso parcial de los esteroides e inmunosupresores para controlar la inflamación ocular en algunos pacientes (así como la elevada tasa de efectos secundarios de los esteroides y el éxito clínico que los fármacos anti TNF-a habían demostrado en otras patologías inflamatorias sistémicas) los oftalmólogos comenzaron a usar anti TNF-a para la inflamación ocular (25).
En la actualidad los fármacos anti TNF-a suelen reservarse para casos refractarios a inmunosupresores. En el caso de las uveítis asociadas a artritis idiopática juvenil, por ejemplo, existe un protocolo oficial de tratamiento de la Sociedad Española de Reumatología Pediátrica, consensuado por oftalmólogos y reumatólogos, en el que se recomienda tratar con anti TNF-a después del fracaso de los corticoesteroides y el metotrexato. Sin embargo, debido a las ventajas en términos de eficacia y calidad de vida que presentan respecto a los inmunosupresores clásicos, cada vez es más común introducir estos fármacos de forma más precoz con el objetivo de limitar al máximo el daño estructural.
Existen múltiples publicaciones científicas que documentan el efecto beneficioso de los fármacos anti TNF-a en inflamación ocular y orbitaria (26-31). En el caso de Etanercept, existen publicaciones que lo relacionan como agente productor de uveítis (32,33). Hasta la fecha no se ha publicado el uso de Certolizumab en inflamación ocular.
Finalmente, a pesar de su potencial utilidad en el campo de la uveítis y la neuromodulación de la señal apoptótica de las células ganglionares de la retina, hemos de reseñar algunos potenciales efectos adversos neuro-oftalmológicos asociados a la administración sistémica de infliximab, adalimumab y etanercept en forma de neuropatías ópticas anteriores, parálisis de nervios oculomotores (15,34,35). Además, a nivel sistémico se sabe que aumenta el riesgo de infecciones, de reactivación de tuberculosis latente, de neoplasias, de enfermedades cardiovasculares y de desarrollar enfermedades de patogenia autoinmune como la esclerosis múltiple (cosa a tener muy en cuenta en el manejo de las uveítis intermedias por su asociación con esta enfermedad), el lupus eritematoso sistémico o la sarcoidosis (36).
Todo ello nos empuja a seguir analizando el perfil de seguridad y la potencial utilidad de esta familia de fármacos.
RESULTADOS DE FÁRMACOS ANTI TNF-a EN UVEÍTIS
Se han publicado numerosos artículos que describen los beneficios de los fármacos anti TNF-a para el tratamiento de las uveítis. Estos fármacos se pueden introducir en el tratamiento de uveítis no infecciosas refractarias al tratamiento con corticoides e inmunosupresores.
Se han descrito efectos beneficiosos en términos de: disminución del número de recidivas, disminución de la dosis de corticoide, y mejor control de la enfermedad; con la infusión de Infliximab a dosis 3-10 mg/kg (en dosis única o múltiple) para casos de uveítis idiopáticas, o asociadas a: artritis idiopática juvenil, espondilitis anquilosante, enfermedad de Beçhet, sarcoidosis y enfermedad de Crohn (37-40). Este fármaco también ha demostrado su eficacia para tratar complicaciones secundarias a las uveítis como puede ser el edema macular quístico (EMQ). En el caso de la infusión de Infliximab a dosis de 5 mg/kg, se han publicado resultados favorables con mejorías en la agudeza visual y grosor macular en pacientes sin uveítis activa y con EMQ de larga evolución (14 meses) (41).
Otros autores (42), comunican efectos beneficiosos tanto a nivel ocular como a nivel sistémico, del tratamiento con Adalimumab en pacientes con uveítis posterior asociada a sarcoidosis, refractaria a tratamiento con corticoides y metrotexato. En uveítis asociadas a enfermedad de Beçhet, el Adalimumab también ha demostado una buena eficacia y se ha utilizado con éxito como alternativa a Infliximab, o como substituto del mismo en casos de pacientes bien controlados, sin disminuir el periodo de remisión de la enfermedad (43).
En las figuras 1 y 2 exponemos un caso clínico de fibrosis subretiniana progresiva en una mujer de 32 años, en la que se consiguió detener la progresión de la enfermedad tras el tratamiento con Adalimumab.
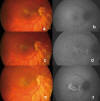
Fig. 1: Se aprecia progresión en las
retinografías y autofluorescencias (aèf) durante 7
meses, a pesar del tratamiento con prednisona, ciclosporina y azatioprina.
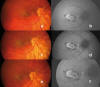
Fig. 2: Las retinografías y
autofluorescencias (aèf) muestran estabilización
de la lesión tras la introducción de Adalimumab. 5 meses de seguimiento.
CONCLUSIONES
Los anti TNF-a son los fármacos biológicos más comúnmente usados en reumatología. Debido a la mejor comprensión de la patogénesis de la inflamación ocular (tanto en los casos asociados a enfermedades sistémicas, como en los casos idiopáticos) el interés por estas terapias se ha incrementado en la oftalmología, y las publicaciones al respecto han ido en aumento. Los artículos publicados hasta la fecha muestran una elevada eficacia de los tratamientos anti TNF-a para la inflamación ocular y, quizás el futuro desarrollo de un vehículo diseñado específicamente para la administración ocular pueda abrir nuevas perspectivas terapéuticas en inflamación ocular u otras patologías oftalmológicas. Debido a las ventajas en términos de eficacia y calidad de vida que presentan respecto a los inmunosupresores clásicos, cada vez es más común introducir estos fármacos de forma más precoz con el objetivo de limitar al máximo el daño estructural.
Los fármacos anti TNF-a presentan un buen perfil de seguridad, pero debe realizarse un correcto estudio previo del paciente en colaboración con el reumatólogo o el internista, que es quien debe monitorizar el seguimiento de estos pacientes.
BIBLIOGRAFÍA
-
McDermott MF. TNF and TNFR biology in health and disease. Cell Mol Biol 2001; 47: 619-635.
-
Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther 2008; 117: 244-279.
-
Bazzoni F, Beutler B. The tumor necrosis factor ligand and receptor families. N Engl J Med 1996; 334: 1717-1724.
-
Keffer J, Probert L, Cazlaris H, Georgopoulos S, Kaslaris E, Kioussis D, Kollias G. Transgenic mice expressing human tumor necrosis factor: a predictive genetic model of arthritis. EMBO J 1991; 10: 4025-4031.
-
Feldmann M, Maini RN. Anti-TNF-a therapy of rheumatoid arthritis: what have we learned? Annu Rev Immunol 2001; 19: 163-196.
-
Sfikakis PP, Kollias G. TNF biology in experimental and clinical arthritis. Curr Opin Rheumatol 2003; 15: 380-386.
-
Fontaine V, Mohand-Said S, Hanoteau N, Fuchs C, Pfizenmaier K and Eisel U. Neurodegenerative and neuroprotective effects of tumor necrosis factor (TNF) in retinal ischemia: opposite roles of TNF receptor 1 and TNF receptor 2. J Neurosci 2002; 22: RC216.
-
Wajant H, Pfizenmaier K, Scheurich P. Tumor necrosis factor signaling. Cell Death Differ 2003; 10: 45-65.
-
Rath PC, Aggarwal BB. TNF-induced signaling in apoptosis. J Clin Immunol 1999; 19: 350-364.
-
Cunningham Jr ET, Stalder A, Sanna PP, Liu SS, Bloom FE, Howes Jr EL, Campbell IL, Margolis TP. Localization of tumor necrosis factor receptor messenger RNA in normal and herpes simplex virus-infected mouse eyes. Invest Ophthalmol Vis Sci 1997; 38: 9-15.
-
Sippy BD, Hofman FM, Wright AD, He S, Ryan SJ, Hinton DR. Soluble tumor necrosis factor receptors are present in human vitreous and shed by retinal pigment epithelial cells. Exp Eye Res 1996; 63: 311-317.
-
Smith JR, Hart PH, Williams KA. Basic pathogenic mechanisms operating in experimental models of acute anterior uveitis. Immunol Cell Biol 1998; 76: 497-512.
-
Ahmad T, Wallace GR, James T, Neville M, Bunce M, Mulcahy-Hawes K, Armuzzi A, Crawshaw J, Fortune F, Walton R, Stanford MR, Welsh KI, Marshall SE, Jewell DP. Mapping the HLA association in Behçet’s disease: a role for tumor necrosis factor polymorphisms? Arthritis Rheum 2003; 48: 807-813.
-
Grant MB, Afzal A, Spoerri P, Pan H, Shaw LC, Mames RN. The role of growth factors in the pathogenesis of diabetic retinopathy. Expert Opin Investig Drugs 2004; 13: 1275-1293.
-
Theodossiadis PG, Markomichelakis NN, Sfikakis PP. Tumor necrosis factor antagonists: preliminary evidence for an emerging approach in the treatment of ocular inflammation. Retina 2007; 27: 399-413.
-
Rojas J, Fernandez I, Pastor JC, Garcia-Gutierrez MT, Sanabria MR, Brion M, Coco RM, Ruiz-Moreno JM, Garcia-Arumi J, Elizalde J, Ruiz-Miguel M, Gallardo JM, Corrales RM, Carracedo A. A strong genetic association between the tumor necrosis factor locus and proliferative vitreoretinopathy: the retina 4 project. Ophthalmology 2010; 117: 2417-2423.
-
Calabrese LH. Molecular differences in anticytokine therapies. Clin Exp Rheumatol 2003; 21: 241-248.
-
Weisman MH, Moreland LW, Furst DE, Weinblatt ME, Keystone EC, Paulus HE, Teoh LS, Velagapudi RB, Noertersheuser PA, Granneman GR, Fischkoff SA, Chartash EK. Efficacy, pharmacokinetic, and safety assessment of adalimumab, a fully human anti-tumor necrosis factor-alpha monoclonal antibody, in adults with rheumatoid arthritis receiving concomitant methotrexate: a pilot study. Clin Ther 2003; 25: 1700-1721.
-
Boyce EG, Halilovic J, Stan-Ugbene O. Golimumab: review of the efficacy and tolerability of a recently approved tumor necrosis factor- inhibitor. Clin Ther 2010; 32: 1681-703.
-
Zhou H. Clinical pharmacokinetics of etanercept: a fully humanized soluble recombinant tumor necrosis factor receptor fusion protein. J Clin Pharmacol 2005; 45: 490-497
-
Kaushik VV, Moots RJ. CDP-870 (certolizumab) in rheumatoid arthritis. Expert Opin Biol Ther 2005; 5: 601-606.
-
Lacomba MS, Martin CM, Gallardo Calera JM, Gómez Vidal MA, Collantes Estévez E, Ramírez Chamond R, Omar M. Aqueous humor and serum tumor necrosis factor-a in clinical uveitis. Ophthalmic Res 2001; 33: 251-255.
-
Rahi AH, Al-Kaff A. Cytokine profile in uveitis: a point prevalence study. In: Whitcup SSM, Nussenblatt RB, Caspi RR, Gery I, eds. Advances in Ocular Immunology. International Congress Series. Amsterdam: Elsevier Science 1994: 369-372.
-
Palexas GN, Sussman G, Welsh NH. Ocular and systemic determination of IL-1 beta and tumour necrosis factor in apatient with ocular inflammation. Scand J Immunol Suppl 1992; 11: 173-175.
-
Rodrigues EB, Farah ME, Maia M, Penha FM, Regatieri C, Melo GB, Pinheiro MM, Zanetti CR. Therapeutic monoclonal antibodies in ophthalmology. Prog Retin Eye Res 2009; 28: 117-44.
-
Cordero-Coma M, Salom D, Díaz-Llopis M, López-Prats MJ, Calleja S. Golimumab for uveitis. Ophthalmology 2011; 118: 1892.
-
Ashok D, Ayliffe WH, Kiely PD. Necrotizing scleritis associated with rheumatoid arthritis: long-term remission with high-dose infliximab therapy. Rheumatology 2005; 44: 950-951.
-
Cazabon S, Over K, Butcher J. The successful use of infliximab in resistant relapsing polychondritis and associated scleritis. Eye 2005; 19: 222-224.
-
Diaz-Valle D, Miguelez Sanchez R, Fernández Espartero MC, Pascual Allen D. Treatment of refractory anterior diffuse scleritis with infliximab. Arch Soc Esp Oftalmol 2004; 79: 405-408.
-
El-Shabrawi Y, Hermann J. Anti-tumor necrosis factor-alpha therapy with infliximab as an alternative to corticosteroids in the treatment of human leukocyte antigen B27-associated acute anterior uveitis. Ophthalmology 2002; 109: 2342-2346.
-
Rubin PA, Foster CS. Etiology and management of idiopathic orbital inflammation. Am J Ophthalmol 2004; 138: 1041-1043.
-
Reddy AR, Backhouse OC. Does etanercept induce uveitis? Br J Ophthalmol 2003; 87: 925.
-
Fonollosa A, Artaraz J, Les I, Martinez-Berriotxoa A, Izquierdo JP, Saiz Lopez A, Gardeazaba J, Berasategui B, Martinez-Alday N. Sarcoid Intermediate Uveitis following Etanercept Treatment: A Case Report and Review of the Literature. Ocul Immunol Inflamm 2011; 21. [Epub ahead of print].
-
Chung J.H, Van Stavern GP, Frohman LP, Turbin RE. Adalimumab associated optic neuritis. J Neurol Sci 2006; 15: 133-136.
-
Suhler EB, Smith JR, Wertheim MS, Lauer AK, Kurz DE, Pickard TD, Rosenbaum JT. A prospective trial of infliximab therapy for refractory uveitis: preliminary safety and efficacy outcomes. Arch Ophthalmol 2005; 123: 903-912.
-
Ramos-Casals M, Perez Alvarez R, Diaz Lagares C, Cuadrado MJ, Khamashta MA, The BIOGEAS study group. Autoimmune diseases induced by biological agents: a double edge sword? Autoimmune Rev 2010; 9: 188-193.
-
Benitez-del-Castillo JM, Martinez-de-la-Casa JM, Pato-Cour E, Pato-Courm E, Méndez-Fernández R, López-Abad C, Matilla M, Garcia-Sanchez J. Long-term treatment of refractory posterior uveitis with anti-TNFalpha (infliximab). Eye 2005; 19: 841-845.
-
Deuter CM, Kötter I, Wallace GR, Murray PI, Stübiger N, Zierhut M. Behçet’s disease: ocular effects and treatment. Prog. Retin. Eye Res 2008; 27: 111-136.
-
Adán A, Hernandez V, Ortiz S, Molina JJ, Pelegrin L, Espinosa G, Sanmartí R. Effects of infliximab in the treatment of refractory posterior uveitis of Behçet’s disease after withdrawal of infusions. Int Ophthalmol 2010; 30: 577-81.
-
Bodaghi B, Bui Q, Wechsler B, Tran T, Cassoux N, Huong D, Thi L, Chosidow O, Herson S, Piette J, LeHoang P. Therapeutic use of infliximab in sight threatening uveitis: retrospective analysis of efficacy, safety, and limiting factors. Ann Rheum Dis 2005; 64: 962-964.
-
Markomichelakis NN, Theodossiadis PG, Pantelia E, Papaefthimiou S, Theodossiadis GP, Sfikakis PP. Infliximab for chronic cystoid macular edema associated with uveitis. Am J Ophthalmol 2004; 138: 648-650.
-
Erckens RJ, Mostard RL, Wijnen PA, Schouten JS, Drent M. Adalimumab successful in sarcoidosis patients with refractory chronic non-infectious uveitis. Graefes Arch Clin Exp Ophthalmol 2011; 27. [Epub ahead of print].
-
Mushtaq B, Saeed T, Situnayake RD, Murray PI. Adalimumab for sight-threatening uveitis in Behçet’s disease. Eye 2007; 21: 824-825.