REVISIÓN ACTUALIZADA
Farmacología ocular en pediatría
GIL RUIZ MR1, ORTEGA USOBIAGA J2, PÉREZ ANDÚJAR JÁ3, GIL RUIZ MI4, NEVADO CABALLERO A5
1 Doctora
en Medicina y Cirugía. Médico Adjunto del Servicio de Oftalmología. Hospital
General Nuestra Señora del Prado. Talavera de la Reina (Toledo).
2 Doctor en Medicina y Cirugía. Especialista en Oftalmología. Clínica
Baviera. Instituto Oftalmológico Europeo. Bilbao (Vizcaya).
3 Licenciado en Medicina y Cirugía. Médico Adjunto del Servicio de
Anestesiología y Reanimación. Hospital General Nuesra Señora del Prado. Talavera
de la Reina (Toledo).
4 Diplomada Universitaria en Enfermería. Hospital Universitario San
Agustín. Linares (Jaén).
5 Licenciado en Medicina y Cirugía. Jefe de Servicio de Oftalmología.
Hospital General Nuestra Señora del Prado. Talavera de la Reina (Toledo).
INTRODUCCIÓN
La utilización clínica ideal de un fármaco debe considerar tanto la eficacia como la seguridad de cada molécula. Las diferencias existentes en estos dos aspectos entre la edad pediátrica y la adulta surgen por los cambios en farmacocinética y farmacodinamia que el desarrollo del cuerpo humano incorpora. Estas modificaciones son máximas en el recién nacido. En general, el neonato presenta una absorción, una unión a proteínas, un metabolismo y una excreción del fármaco menor que el adulto, frente a un volumen de distribución mayor (1).
Grandes errores de la medicina han acaecido por la consideración errónea del niño como un adulto pequeño, tales como hipoacusias por la utilización de aminoglucósidos o síndrome gris del recién nacido por cloramfenicol. No es posible realizar extrapolaciones de las investigaciones realizadas en adultos al campo de la Pediatría. Como afirma la Organización Mundial de la Salud (OMS), los ensayos clínicos en niños son esenciales para desarrollar terapias e intervenciones específicas de la edad y para determinar y optimizar los mejores tratamientos médicos disponibles. Las consideraciones éticas y clínicas deben tenerse en cuenta en el diseño, la implementación y la evaluación de estos ensayos clínicos y sus resultados. En este aspecto, la OMS desarrolla desde finales de 2007 la campaña «Medicamentos a la medida de los niños», ampliando la investigación en este campo para que muchos de los medicamentos actuales se desarrollen para los niños y estén disponibles en forma y dosis adecuada.
La FDA (Food and Drug Administration) es la agencia del gobierno de los Estados Unidos responsable de la regulación de productos biológicos, suplementos alimenticios, cosméticos, aparatos médicos, productos hemáticos, alimentos y medicamentos (estos dos últimos, para seres humanos y animales). Regula la comercialización de los fármacos, atestiguando la seguridad para los consumidores y la eficacia de los principios activos. La FDA, asumiendo que todos los niños no presentan las mismas características anatómicas, fisiológicas y bioquímicas, ha dividido la población pediátrica en 5 grupos etarios: el período intrauterino, neonato (hasta el primer mes de vida), infante o lactante (hasta 2 años), niño (hasta el comienzo de la pubertad) y adolescente (desde el inicio de la pubertad hasta el período adulto). Las dosis de los medicamentos deben ser ajustadas por edad, peso y estado de la enfermedad, entre otros factores relevantes.
La administración de fármacos en Pediatría no sólo muestra diferencias de biodisponibilidad en las distintas edades, también puede perturbar el crecimiento normal del niño y afectar al resultado final del desarrollo biológico. Cualquier error en el ajuste de dosis puede desembocar en inefectividad, o peor aún, en inseguridad y toxicidad.
Pueden acontecer efectos secundarios en el niño al utilizar fármacos por vía tópica en el ojo, siempre que la absorción sistémica sea relevante, y no debemos subestimar la vía oftálmica en este aspecto. A pesar de esto, hemos de diferenciar el uso ocasional de un colirio que puede ser relativamente seguro, con el uso continuado que, en determinados casos, puede estar contraindicado por el riesgo de toxicidad.
Respecto a la absorción sistémica de la instilación de un colirio, se han descrito casos clínicos que apoyan la importancia de esta vía de administración. Se ha publicado un caso de fallo renal en un recién nacido de bajo peso tras el uso de fenilefrina tópica para la exploración de la retinopatía del prematuro (2), concluyendo en el artículo que los fármacos midriáticos tópicos deben usarse en los recién nacidos con precaución, presionando la vía lagrimal para evitar la absorción sistémica y monitorizando al paciente durante la instilación de las gotas y mientras dure el efecto de éstas.
Lo mínimo que puede instilarse de un colirio es una gota, adecuada para un adulto pero excesiva para un recién nacido que requiere un 50%, un niño de 3 años que necesita un 75% o uno de 6 años, que con el 90% de la dosis tiene suficiente (3). Este hecho junto con un menor volumen sanguíneo y la inmadurez del sistema enzimático y la barrera hematoencefálica, conllevan una elevación de la concentración plasmática del principio activo y unos efectos secundarios difíciles de prever.
Para no perder el fin de la exposición (marcar unas pautas básicas útiles en la práctica clínica diaria del oftalmólogo y el pediatra), esta revisión pretende dar una «pincelada» general acerca de las diferentes familias farmacológicas más utilizadas en niños. Para obtener información pormenorizada de los principios activos, se aconseja recurrir a fuentes especializadas en el tema.
1. MIDRIÁTICOS
Esta familia farmacológica, junto con la de antibióticos y los antihistamínicos, son sin duda las más utilizadas en niños. Los midriáticos tópicos pueden ser agentes parasimpaticolíticos (producen midriasis y cicloplejía) o simpaticomiméticos (sólo generan midriasis). Dentro del primer grupo destacan: la atropina como el fármaco de mayor potencia y duración (7-14 días), seguida de la escopolamina (hasta 3-5 días), la homatropina (24-36 horas), ciclopentolato (12-24 horas) y la tropicamida, de corta duración (4-6 horas) (4). En el grupo de los agonistas del sistema simpático adrenérgico, se encuentra la fenilefrina (6-8 horas). De todos ellos, el más adecuado para la funduscopia y estudio refractivo en Pediatría es el ciclopentolato, por su efecto poco duradero y capacidad para paralizar la acomodación.
La acción sistémica de la atropina es dosis dependiente y sus efectos secundarios pueden llegar a ser extremadamente graves, oscilando desde bradicardia y sudoración hasta ataxia y coma (5). La atropina se utiliza en el tratamiento de la ambliopía como penalizador en el ojo dominante, siendo efectivo y bien tolerado en casos en los que las oclusiones no funcionan (6).
Respecto al ciclopentolato, se han descrito alteraciones del sistema nervioso central con alucinaciones, desorientación, pérdida de memoria y estado de confusión. Estos efectos secundarios, además de ser dosis dependientes, también parecen mostrar una predisposición individual debida a hipersensibilidad del receptor (5). Asimismo, se ha descrito afectación del sistema gastrointestinal e incluso enterocolitis necrotizante en recién nacidos prematuros (7).
De todos modos y como se comentó previamente, ha de diferenciarse el uso puntual de un principio activo para la exploración de fondo de ojo, que puede ser relativamente seguro, con el uso prolongado.
La homatropina y la escopolamina prácticamente no se utilizan; la primera por no producir una cicloplejía satisfactoria en niños y la segunda por mostrar los mismos efectos secundarios que la atropina, pero con mayor frecuencia (6).
Tal y como ha quedado reflejado en la introducción, se ha publicado un caso de fallo renal en un recién nacido de bajo peso tras el uso de fenilefrina tópica para la exploración de la retinopatía del prematuro (2); por ello los fármacos midriáticos tópicos deben usarse en los recién nacidos con cuidado y especial atención, presionando la vía lagrimal para evitar la absorción sistémica y monitorizando al paciente durante la instilación de las gotas y mientras dure el efecto.
Durante la lactancia, todos los fármacos midriáticos deben usarse con precaución, prescindiendo de la fenilefrina y la escopolamina (8).
2. HIPOTENSORES
La neuropatía óptica glaucomatosa es una causa importante de ceguera en el niño y el adulto. El glaucoma congénito afecta a 1 de cada 10.000 recién nacidos vivos (3) y aunque el tratamiento del glaucoma congénito siempre es quirúrgico, el uso de fármacos puede ser útil antes de una goniotomía o en la espera de una cirugía.
Las únicas familias de hipotensores aprobadas por la FDA para el glaucoma en pacientes pediátricos son los beta-bloqueantes, los inhibidores de la anhidrasa carbónica y los mióticos (9). El principal inconveniente en estos pacientes es la alta frecuencia de efectos secundarios debido a las elevadas concentraciones plasmáticas del principio activo que se alcanzan al ser difícil calcular las dosis vía tópica. Ocluyendo el punto lagrimal es posible disminuir la absorción sistémica. Por otro lado, los tratamientos sistémicos pueden dosificarse con un mayor control en función del peso del paciente, lo que les hace extremadamente recomendables en los niños más pequeños.
La tabla 1 presenta de forma esquemática las pautas de tratamiento médico hipotensor en Pediatría. Los inhibidores de la anhidrasa carbónica son el tratamiento de elección en neonatos, prefiriéndose la vía oral a la tópica al poder calcular la dosis fácilmente. En el caso de ser necesarios los beta-bloqueantes, en pacientes asmáticos se prefieren las moléculas cardioselectivas, como el betaxolol. Las prostaglandinas han resultado ser menos eficaces que en adultos, aunque en glaucomas juveniles y cuanto mayor sea la edad del niño, consiguen reducir la presión intraocular de manera significativa (10).

Los fármacos alfa-adrenérgicos no deben utilizarse al poder acarrear depresiones graves del sistema nervioso central. La brimonidina puede causar miosis, hipotermia, mareo, agitación, ataxia, somnolencia, coma, apnea, hipo e hipertensión, bradicardia, depresión respiratoria y la muerte (11). Es frecuente el envenenamiento en niños, en el 84,3% por ingestión, el 5,7% vía ocular, en el 3,4% a través de la piel y se desconoce la vía en el resto de los casos (11). La naloxona, un antagonista opiáceo, se utiliza como antídoto en los casos más graves.
La Academia Americana de Pediatría ha aprobado la administración de beta-bloqueantes e inhibidores de la anhidrasa carbónica en el período de lactancia, aunque con cautela. Los agonistas alfa-adrenérgicos deben evitarse, al estar contraindicados en la edad pediátrica (12).
3. ANTIBIÓTICOS
La lista de fármacos antiinfecciosos disponibles para uso oftálmico en la actualidad es enorme. Las conjuntivitis bacterianas y las úlceras corneales y queratitis por traumatismos y cuerpos extraños son muy habituales en la consulta del oftalmólogo y del pediatra. Asimismo, la ophthalmia neonatorum, es decir, la conjuntivitis aguda muco-purulenta en el primer mes de vida y adquirida a través del canal del parto, aparece en el 1-12% de los recién nacidos. Este último hecho es tan relevante, que fue necesario establecer protocolos de profilaxis a todos los neonatos. Se han utilizado el nitrato en solución al 1%, tetraciclinas al 1% en solución, eritromicina al 1% en solución, povidona iodada al 2,5% y el ácido fusídico (13).
Es infrecuente utilizar los glucopéptidos en Oftalmología (vancomicina y teicoplanina) quedando reservados para infecciones graves oculares. Concretamente, la vancomicina se utiliza en forma de colirio reforzado para afecciones de la córnea y vía intravítrea en las endoftalmitis (14).
Los aminoglucósidos por vía parenteral son ototóxicos y nefrotóxicos. Excepto la tobramicina, neomicina y gentamicina, que muestran cierto nivel de seguridad, el resto deberían evitarse por los motivos citados.
La administración de tetraciclinas está contraindicada en la lactancia y en pacientes menores de 8 años. Estos principios activos se excretan por la leche materna y en niños pueden ser responsables de un oscurecimiento permanente de los dientes, hipoplasia del esmalte, retraso en la osteogénesis y toxicidad renal y hepática (14) (tabla 2).
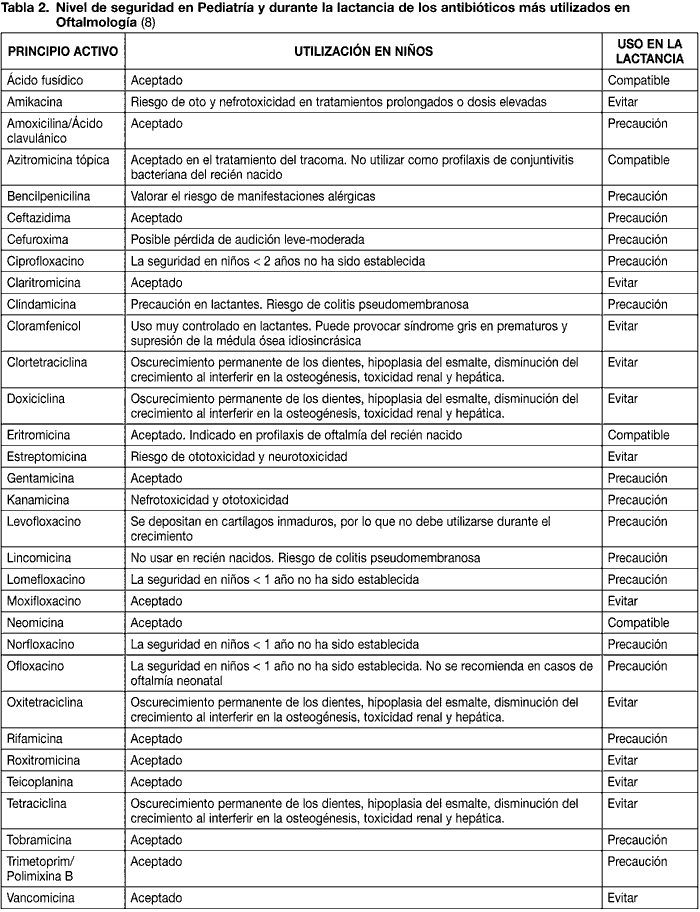
El uso de cloramfenicol en lactantes debe ser muy controlado. Puede provocar «síndrome del niño gris» en prematuros y supresión de la médula ósea de naturaleza idiosincrásica (15).
Los macrólidos conforman un grupo farmacológico bastante utilizado en Pediatría. La eritromicina puede utilizarse en la profilaxis de la ophthalmia neonatorum. La azitromicina tópica es tan eficiente y segura como vía oral en el tratamiento del tracoma en niños (16), aunque no debe protocolizarse para la profilaxis de las conjuntivitis neonatales.
Las lincosaminas (lincomicina y clindamicina) no deben utilizarse en neonatos por el riesgo que conllevan de colitis pseudomembranosa (8). El ácido fusídico es quizás la nueva promesa en el tratamiento de la ophthalmia neonatorum, aunque todavía no existen suficientes datos (16).
De las 4 generaciones de quinolonas, las más usadas en Oftalmología son: lomefloxacino, norfloxacino, ofloxacino, ciprofloxacino, levofloxacino, moxifloxacino y gatifloxacino. En general, no han sido estudiadas en niños de menos de 1 año y no deben utilizarse en Pediatría, al depositarse en cartílagos inmaduros y afectar al crecimiento (14). La única quinolona que ha mostrado seguridad clínica en solución oftálmica al 0,5% es el moxifloxacino(17), desde el tercer día de vida.
Se permite prescribir trimetoprim asociado a la polimixina B en el tratamiento de las infecciones de la superficie ocular en el período pediátrico (8).
En relación a la lactancia, excepto el ácido fusídico, la eritromicina y la neomicina, que se han comprobado compatibles, el resto de antibióticos deberían utilizarse con precaución o evitarse (tabla 2).
4. ANTIALÉRGICOS Y VASOCONSTRICTORES
La alergia ocular afecta a un 25% de la población general en los países desarrollados e incluye un grupo de patologías que pueden afectar a distintas áreas de la superficie ocular externa (18). El primer contacto con el alérgeno suele ocurrir en edades tempranas de la vida, por ello el conocimiento de las estrategias terapéuticas por parte de los pediatras es fundamental. El control de las formas crónicas y graves requiere a menudo un enfoque multidisciplinar.
Existen diversas familias dentro de los fármacos antialérgicos: los antagonistas de los receptores de la histamina, los inhibidores de la degranulación del mastocito y los fármacos multiacción (tabla 3).
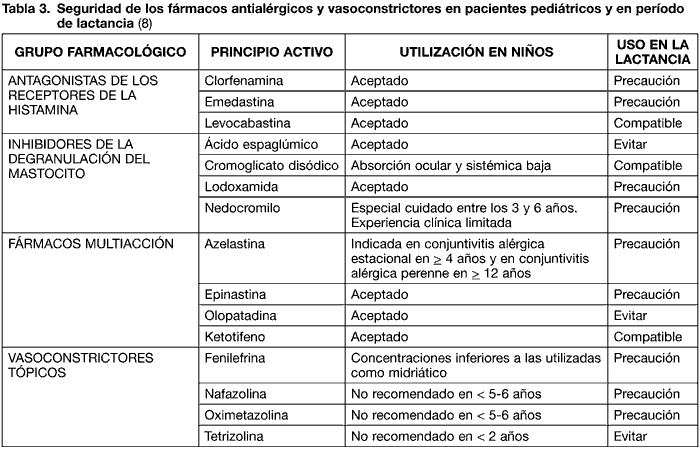
El primer grupo inhibe de modo competitivo los receptores de la histamina, pero no selectivamente, inhibiendo también los receptores colinérgicos y serotoninérgicos, entre otros. De este hecho se derivan sus efectos adversos (18). La levocabastina puede utilizarse en la lactancia, mientras que la clorfenamina y emedastina requieren precaución (8).
Dentro del grupo de los inhibidores de la degranulación del mastocito, el ácido espaglúmico debe evitarse en mujeres lactantes, puede prescribirse el cromoglicato disódico y con precaución la lodoxamida y el nedocromilo. El cromoglicato y nedocromilo muestran una absorción ocular y sistémica mínima. Este último principio activo debe usarse con moderación en edades comprendidas entre los 3 y 6 años, debido a la experiencia clínica limitada (8). A pesar de esta recomendación, se ha publicado un estudio comparativo con placebo, a doble ciego, con 2905 pacientes de 3 a 76 años. Los investigadores concluyen que el nedocromilo es más efectivo que el placebo y muestra buena tolerancia, sin efectos secundarios relevantes (19).
Los fármacos multiacción muestran actividad antihistamínica, estabilizadora de la membrana del mastocito y antiinflamatoria. La olopatadina debe evitarse en la lactancia, puede prescribirse el ketotifeno y con cuidado la azelastina y epinastina (8). La azelastina está especialmente indicada en el tratamiento de conjuntivitis alérgica estacional a partir de los 4 años de edad y en conjuntivitis alérgica perenne a partir de los 12 años.
Los fármacos vasoconstrictores tópicos (simpaticomiméticos) se prescriben como alivio sintomático de la hiperemia conjuntival. La fenilefrina, nafazolina y oximetazolina pueden usarlas con reserva las mujeres en período de lactancia; asimismo la tetrizolina deben evitarla. Este último principio activo se usa de manera indicriminada por la población, si bien es cierto que no se recomienda en menores de 2 años. La nafazolina y oximetazolina no deben utilizarse en niños de edades inferiores a los 5-6 años (8). La fenilefrina como agente vasoconstrictor se presenta a concentraciones inferiores a las usadas para conseguir midriasis.
5. ANTIINFLAMATORIOS
La inflamación es una respuesta inespecífica, defensiva y reparadora, propia de los tejidos conectivos vascularizados. Cuando este proceso se perpetúa en el tiempo puede llegar a ser dañino. Es en ese momento donde los antiinflamatorios (corticoideos y no esteroideos) actúan frenando dicha respuesta (20).
La edad pediátrica es un período muy sensible a los corticoides, con alta susceptibilidad para desarrollar una catarata subcapsular posterior o incrementar la presión intraocular de manera significativa. La administración tópica de estos principios activos, no asocia prácticamente efectos adversos sistémicos, dando una falsa sensación de seguridad y favoreciendo el uso indiscriminado. Esto eleva el riesgo de infecciones oportunistas y la toxicidad ocular anteriormente comentada. Por todo ello, deben evitarse las terapias continuadas en niños (21). Por vía sistémica y en tratamientos crónicos pueden desembocar en una inhibición adrenal.
La fluorometolona requiere especial cuidado si se utiliza en menores de 2 años de edad, mientras que la rimexolona no está aconsejada. En general, los corticoides deben evitarse durante el período de lactancia, aunque la dexametasona sí está permitida (8) (tabla 4).
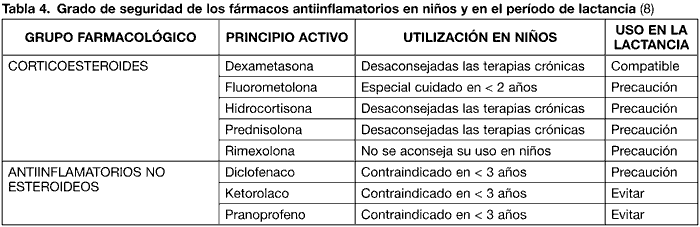
En relación con los antiinflamatorios no esteroideos, estos no están permitidos en niños menores de 3 años. El diclofenaco puede ser prescrito durante la lactancia con cautela; el ketorolaco y pranoprofeno están prohibidos (8).
6. OTROS AGENTES MODULADORES DE LA INFLAMACIÓN
La ciclosporina A es un fármaco inmunosupresor selectivo, que inhibe las células inmunocompetentes sin generar un efecto citotóxico directo. De todas sus posibles indicaciones, se maneja con relativa frecuencia en la consulta del oftalmólogo y en niños, para tratar queratoconjuntivitis vernales, atópicas e infiltrados corneales subepiteliales tras una conjuntivitis infecciosa.
Se desconoce si su administración tópica conlleva excreción del principio activo en la leche materna, por ello se desaconseja durante la lactancia (21).
El uso de ciclosporina A tópica en niños está permitido, al estar avalada su eficacia y seguridad por varios estudios, incluso a concentraciones del 2% (22,23) y en tratamientos largos. A pesar de ello, deben estudiarse de manera estrecha posibles infecciones oportunistas (24).
BIBLIOGRAFÍA
-
Flórez J. Farmacología humana. 3.ª edición; Barcelona: Masson; 2000.
-
Shinomiya K, Kajima M, Tajika H, Shiota H, Nakagawa R, Saijyou T. Renal failure caused by eyedrops containing phenylephrine in a case of retinopathy of prematurity. J Med Invest 2003; 50: 203-206.
-
Fernández-Vidal AM, Méndez CD, Martínez de la Casa JM, García-Feijoó J. Tratamiento médico del glaucoma congénito. En: Cortés C, Arias A, Encinas JL, García-Feijoó J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 285-286.
-
Cortés C, Cuesta T, Gil MR. Fármacos midriáticos: pautas de dilatación en cirugía de cristalino. En: Lorente R, Mendicute J. LXXXIV Ponencia Oficial de la Sociedad Española de Oftalmología. Cirugía del Cristalino. Madrid: Industria gráfica MAC LINE SL; 2008; I: 421-427.
-
Encinas JL, Cajigal C. Midriáticos. Colorantes. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 11-18.
-
Cortés C, Cortés I, Barrera C. Midriáticos y ciclopléjicos. En: Cortés C, Arias A, Encinas JL, García-Feijoó J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 69-76.
-
Bauer R, Trepannier MC, Stem L. Systemic cyclopentolate toxicity in the new born infant. Journal of pediatric Pharmacology and Therapeutics 1973; 82: 501-505.
-
Vademecum Internacional. 52ª edición; Madrid: CMP Medicom; 2011.
-
Maris PJ, Mandal AK, Netland PA. Medical therapy of pediatric glaucoma and glaucoma in pregnancy. Ophthalmol Clin North Am 2005; 18 (3): 461-468.
-
Enyedi LB, Freedman SF. Latanoprost for the treatment of pediatric glaucoma. Surv Ophthalmol 2002; 47 Suppl 1: S129-132.
-
Becker ML, Huntington N, Woolf AD. Brimonidine tartrate poisoning in children: frequency, trends, and use of naloxone as an antidote. Pediatrics 2009; 2: 305-311.
-
Urcelay JL. Tratamiento médico antiglaucomatoso en mujeres gestantes y lactantes. En: Cortés C, Arias A, Encinas JL, García J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 297-299.
-
Zuppa AA, D´Andrea V, Catenazzi P, Scorrano A, Romagnoli C. Ophthalmia neonatorum: what kind of prophylaxis? J Matern Fetal Neonatal Med 2011; 24 (6): 769-773.
-
De las Heras B, Arias A, Bañuelos J, García C. Antibióticos. En: Cortés C, Arias A, Encinas JL, García-Feijoó J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 77-108.
-
Arias A, García MC, Matilla M. Antiinfecciosos. Antimicrobianos, antifúngicos y antivirales. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 19-50.
-
Cochereau I, Goldschmidt P, Goepogui A, Afghani T, Delval L, Pouliquen P, Bourcier T, Robert PY. Efficacy and safety of short duration azithromycin eye drops versus azithromycin single oral dose for the treatment of tracoma in children: a randomised, controlled, double-masked clinical trial. Br J Ophthalmol 2007; 91 (5): 667-672.
-
Silver LH, Woodside AM, Montgomery DB. Clinical safety of moxifloxacin ophthalmic solution 0,5% (Vigamox®) in pediatric and nonpediatric patients with bacterial conjunctivitis. Surv Ophthalmol 50; 2005: S55-S63.
-
Gil MR, Cortés C. Antialérgicos y vasoconstrictores. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 65-70.
-
Kjellman NI, Stevens MT. Clinical experience with Tilavist: an overview of efficacy and safety. Allergy 1995; 50 (21 Suppl): 14-22.
-
Gil MR, Cortés C. Farmacología de la inflamación en Oftalmología. En: Cortés C, Arias A, Encinas JL, García-Feijoó J. LXXXIII Ponencia Oficial de la Sociedad Española de Oftalmología. Farmacología Ocular. Madrid: Industria Gráfica MAE SL; 2007: 163-178.
-
Arriola P, Díaz D, Benítez del Castillo JM. Antiinflamatorios. Corticosteroides, antiinflamatorios no esteroideos, otros agentes moduladores de la inflamación. En: García-Sánchez J, García-Feijoó J. Oftalmomecum 2009. Barcelona: P. Permanyer; 2009: 51-63.
-
Tatlipinar S, Akpek EK. Topical cyclosporine in the treatment of ocular surface disorders. Br J Ophthalmol 2005; 89: 1363-1367.
-
Foulks GN. Topical cyclosporyne for treatment of ocular surface disease. Int Ophthalmol Clin 2006; 46: 105-122.
-
Takamura E, Uchio E, Ebihara N, Okamoto S, Kumagai N, Shoji J, Nakagawa Y, Namba K, Fukushima A, Fujishima H, Miyazaki D, Ohasi Y. A prospective, observational, all-prescribed-patients study of cyclosporine 0,1% ophthalmic solution in the treatment of vernal keratoconjunctivitis. Nihon Ganka Gakkai Zasshi 2011; 115 (6): 508-515.