CAPÍTULO VII
GLAUCOMA
B. Pazos González, M. Sánchez Salorio, J. García Feijóo
I. BIOMICROSCOPIA ULTRASÓNICA DE LA CÁMARA ANTERIOR. ESTUDIO DEL ÁNGULO
II. CONTRIBUCIÓN DE LA BMU AL DIAGNÓSTICO DE LOS DIFERENTES TIPOS
DE GLAUCOMA
- II.1. Glaucomas de ángulo abierto.
- II.2. Glaucomas de ángulo cerrado.
- II.3. Glaucomas congénitos. Glaucoma juvenil.
III. CONTRIBUCIÓN DE LA BMU AL TRATAMIENTO DEL GLAUCOMA
(Planificación de la cirugía, mecanismos de acción, causas de fracaso)
- III.1. Glaucoma de ángulo cerrado: Iridotomía.
- III.2. Glaucoma de ángulo abierto.
- III.2.1. Trabeculectomía.
- III.2.2. Esclerectomía profunda no perforante.
- III.2.3. Implantes valvulares.
- III.2.4. Ciclocoagulación.
La aportación de la BMU al conocimiento del glaucoma puede ser considerada en dos apartados diferentes. Por un lado tenemos la información que se relaciona con el diagnóstico de los diferentes tipos de glaucoma y por otro el que se refiere a distintos aspectos del tratamiento quirúrgico.
En este capítulo expondremos sucesivamente la aportación de la BMU a:
1. El conocimiento de la morfología del ángulo y de la cámara anterior normales así como de la estructura interna y de las relaciones anatómicas de las formaciones que los componen.
2. El diagnóstico diferencial entre los diferentes tipos de glaucoma especialmente en el glaucoma por cierre angular y en los glaucomas secundarios.
3. El tratamiento quirúrgico del glaucoma tanto en lo que se refiere a su programación como al conocimiento de sus posibles mecanismos de acción y de las causas de su fracaso.
I. BiomicroscopIa Ultrasónica
DE LA CÁMARA ANTERIOR.
Estudio del ángulo
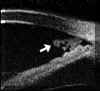
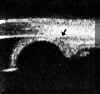
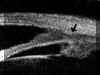
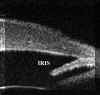
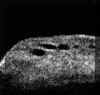
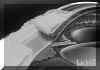
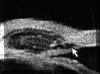
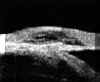
La BMU no permite discriminar las estructuras finas que es posible visualizar mediante gonioscopia pero facilita el estudio sin artefactos de las diferentes estructuras angulares (disposición del iris y relaciones de éste con los procesos ciliares y el cristalino) y ofrece la posibilidad de valorar su grado de apertura1 (FIGS 7.1, 7.2 y 7.3) y otros parámetros de importancia en el glaucoma2,3.
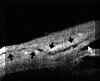
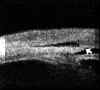
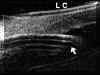
FIGURA 7.1: Corte radial a nivel limbar de un ojo normal: Periferia corneal (c), tejidos epiesclerales (ep), esclera (e), espolón escleral (ee), iris (i), cuerpo ciliar (cc), procesos ciliares (pc) y fibras zonulares (z). Distancia de apertura angular (DAA). (I.N.G.O.) FIGURA 7.2: Corte de BMU radial a nivel limbar de un ojo con ángulo abierto. La flecha señala el espolón escleral. (I.N.G.O.) FIGURA 7.3: Corte de BMU radial a nivel limbar de un ojo con ángulo estrecho. (I.N.G.O.)Una sección ultrasónica radial a nivel limbar, muestra las diferentes estructuras que conforman el ángulo y permite visualizar los procesos ciliares, el cuerpo ciliar y las zonas de la cámara posterior a las que no se puede acceder mediante otras técnicas de exploración (FIG 7.1).
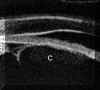
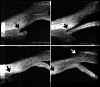
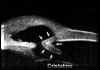
Pavlin y Foster2 describieron un método para evaluar la apertura angular tomando como referencia el espolón escleral. Estos autores definen la distancia de apertura angular (DAA) como la distancia desde un punto distante 500
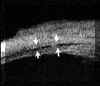
mm. del espolón (zona aproximada de la malla trabecular) al iris (valor normal 347±181 mm), y a partir de este parámetro hacen una estimación cualitativa y cuantitativa del ángulo en grados (30±11º) (FIG 7.1).Existe una elevada correlación entre la valoración angular gonioscópica4 usando las clasificaciones de Shaffer (ángulo en grados) o de Spaeth (apertura angular, configuración de la periferia del iris y localización de la inserción del iris) y la gonioscopia bioultrasónica4-6 (FIGS 7.2, 7.3 y 7.4). Esta correlación es de enorme interés cuando se precisa analizar el estado del ángulo en condiciones patológicas que afectan a la transparencia de los medios, y en ojos glaucomatosos con alteraciones en la base del iris (iris bombé, sinequias periféricas...) que impiden la visualización directa del ángulo7-9.
FIGURA 7.4: Corte de BMU radial a nivel limbar de un ojo con ángulo cerrado (la flecha señala la posición del espolón). (I.N.G.O.)
II. Contribución de la BMU
al diagnÓstico de los diferentes tipos de glaucoma
II.1. Glaucoma de ángulo abierto
La BMU es una herramienta útil para establecer el diagnóstico diferencial de los diferentes tipos de glaucoma de ángulo abierto (GAA) y para obtener información acerca de su etiopatogenia.
Las imágenes bioultrasónicas de los ojos con glaucoma crónico simple no difieren significativamente de las obtenidas en ojos normales. Esto es consecuencia de que las anormalidades estructurales que originan este tipo de glaucoma están fuera de los límites de la resolución de la BMU10. No obstante, mediante la BMU se comprobó que en el GAA primario juvenil el tamaño de la malla trabecular era inferior al normal11, apoyando así la hipótesis que asocia su origen a un desarrollo incompleto de la malla12.
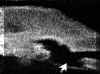
En el glaucoma por pseudoexfoliación capsular la BMU confirma la apertura normal del ángulo camerular. En ocasiones puede demostrar la existencia de material pseudoexfoliativo depositado en el borde pupilar, en la superficie posterior de la córnea (FIG 7.5) o en el ángulo camerular (FIG 7.6).
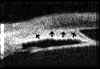
FIGURA 7.5: Glaucoma pseudoexfoliativo. Acúmulo de material pseudoexfoliativo depositado en la superficie posterior de la córnea. (I.C.) FIGURA 7.6: Glaucoma pseudoexfoliativo. Material ocupando el ángulo camerular a nivel de las 6 horas. La localización de los depósitos se interpreta como debida a la fuerza de la gravedad. (I.N.G.O.)En los ojos con glaucoma asociado al síndrome de dispersión pigmentaria, la BMU pone de manifiesto las relaciones anormales existentes entre los procesos ciliares y el epitelio pigmentario del iris13,14. Las primeras hipótesis sobre el origen de este síndrome indican que se debe a un contacto anómalo del iris con las fibras zonulares15 y a un bloqueo pupilar reversible16. Pavlin y col.17 observaron dos grupos de diferente comportamiento, un primer grupo en el que el iris está abombado hacia atrás lo que origina un contacto frecuente con las fibras zonulares y un aumento del área de contacto iridocristaliniano (FIG 3.6. Cp. III), y un segundo grupo con características similares a un ojo normal. Estos autores postulan que en este segundo grupo se reproducen las alteraciones del primero durante la acomodación14. Posteriormente se demostró mediante estudios ultrasónicos que los ojos con esta patología presentan un aumento del contacto irido-ciliar13, así como un desplazamiento posterior de la inserción del iris en el cuerpo ciliar18 (FIG 7.7).
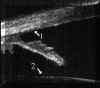
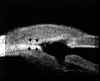
FIGURA 7.7: Síndrome de dispersión pigmentaria: Desplazamiento posterior de la inserción del iris en el cuerpo ciliar y aumento de la superficie de contacto de los procesos ciliares con la superficie posterior del iris. (I.N.G.O.)En el glaucoma por contusión del globo ocular, la recesión angular no siempre es apreciable clínicamente y se asocia con frecuencia a alteraciones en la transparencia de los medios que dificultan su diagnóstico. La BMU en estos casos es especialmente útil pues permite detectar de modo fiable la existencia de una recesión angular, de iridodiálisis o de ciclodiálisis, así como la presencia de sangre, fibrina, material inflamatorio o cristaliniano y cuerpos extraños a nivel de la cámara anterior2,7,19 (FIGS 7.8, 7.9 y 7.10).
FIGURA 7.8: Recesión angular y subluxación del cristalino tras contusión del globo ocular. (1) Desinserción del cuerpo ciliar a nivel del espolón escleral con desplazamiento hacia atrás de la raíz del iris y de los procesos ciliares. (2) Rotura de las fibras de la zónula, desplazamiento hacia atrás del cristalino, pérdida de contacto entre el iris y el cristalino. (I.N.G.O.) FIGURA 7.9: Iridodiálisis. Desinserción (flecha) del iris (I). El cristalino está luxado y empuja al iris desinsertado hasta contactar con la córnea (C). (I.N.G.O.) FIGURA 7.10: Hipema por contusión ocular. Coágulo central (masa de ecogenidad alta) situado delante del cristalino (C) y sangre (ecogenidad media) en el resto de la cámara anterior. (I.N.G.O.)
II.2. Glaucoma de ángulo cerrado (gac)
La BMU permite valorar objetivamente las características del ángulo en el GAC, lo que facilita el diagnóstico de diversas situaciones con cierre angular y el análisis de los mecanismos que los producen.
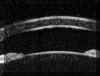
La configuración anatómica predisponente del glaucoma primario de ángulo cerrado se observa claramente: Situación anterior del diafragma iris-cristalino, cámara anterior poco profunda y entrada al ángulo camerular estrechada (FIGS 7.11 y 7.12). Estudios dinámicos realizados bajo control con BMU en estos pacientes demostraron que la convexidad del iris y la apertura del ángulo varían en función de la iluminación20.
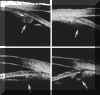
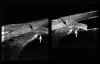
FIGURA 7.11: Ángulo camerular estrecho. (I.N.G.O.) FIGURA 7.12: Cámara anterior poco profunda y posición anterior del diafragma iridocristaliniano. (I.N.G.O.)En los ojos con glaucoma asociado a iris bombé la BMU además de permitir evaluar el estado del ángulo ayuda a esclarecer el mecanismo que lo causa con lo que se facilita la valoración de posibles soluciones terapéuticas. En ojo fáquicos con bloqueo pupilar la imagen de una sección ultrasónica muestra el perfil convexo del iris y permite estimar su curvatura2,13. Se observa que la distancia de apertura angular está disminuida, se incrementa el surco ciliar y la profundidad de la cámara posterior y generalmente disminuye la zona de contacto iridocristaliniana. En el bloqueo pupilar absoluto, la BMU confirma la existencia de sinequias posteriores entre el iris y la cápsula anterior del cristalino FIG 7.13). En ojos pseudofáquicos con LIO en cámara anterior, la BMU permite determinar las posibles causas del bloqueo como son la presencia de una membrana inflamatoria a nivel pupilar, la ausencia de la iridectomía o el bloqueo de la misma por el vítreo, u otras (FIGS 7.14a y 7.14b) . La presencia de vítreo en la cámara anterior se detecta por el hallazgo de una línea de reflectividad resultado de la interfase vítreo-humor acuoso1,7,21. En pseudofacos con LIO en cámara posterior, el bloqueo pupilar es menos frecuente pero puede producirse por desplazamiento hacia adelante de la parte óptica de la lente, aunque los hápticos permanezcan dentro del saco capsular (FIG 7.15).
FIGURA 7.13: Glaucoma por bloqueo pupilar en fáquico (composición de imágenes de BMU). Bloqueo producido por sinequias iridocristalinianas. Abombamiento anterior del iris y bloqueo completo del ángulo camerular. Aumento del sulcus iridociliar. (I.N.G.O.) FIGURA 7.14a: Bloqueo pupilar por LIO en cámara anterior. Un champiñón vítreo (flechas) penetra en la cámara a través de la iridectomía bloqueándola. (I.N.G.O.) FIGURA 7.14b: Mismo caso. Se produce un pseudobloqueo pupilar con abombamiento del iris periférico y bloqueo completo del ángulo. (I.N.G.O.) FIGURA 7.15: Bloqueo pupilar por LIO situada en cámara posterior (composición de imágenes de BMU). Facoemulsificación sin complicaciones con postoperatorio inmediato normal. En los meses siguientes la óptica de la lente se hernia hacia cámara anterior produciendo un bloqueo pupilar. Los hápticos permanecen en el saco capsular (flechas). Se realizó iridotomía periférica con YAG laser. (I.N.G.O.)La BMU contribuye también al diagnóstico diferencial del bloqueo en ojos afáquicos pues permite visualizar nítidamente las adherencias del margen pupilar a la hialoides anterior y el consiguiente aposicionamiento del iris contra el endotelio corneal22.
Tras un trauma ocular se puede producir un bloqueo angular por desplazamiento anterior del cristalino. La BMU pone en evidencia esta circunstancia (FIG 7.16).
FIGURA 7.16: Subluxación traumática del cristalino. El cristalino (C) se desplaza hacia adelante empujando el iris contra la córnea y bloqueando el ángulo. (I.N.G.O.)En el glaucoma asociado al iris en meseta ("iris plateau"), la BMU muestra el perfil plano característico del iris durante la miosis, la cámara anterior profunda en el centro y estrecha en la región próxima a la raíz del iris y la aproximación entre el trabéculum y el iris periférico23. Utilizando la BMU, Pavlin y col.24,25 contribuyeron a esclarecer la etiopatogenia del síndrome al comprobar que los procesos ciliares están desplazados anteriormente hasta contactar con el iris ocluyendo el surco ciliar y originando las alteraciones estructurales típicas del iris confirmándose así hipótesis sugeridas previamente. Esta aposición del cuerpo ciliar a la superficie posterior del iris es lo que hace que la iridotomía no resulte eficaz (FIGS 7.17a y 7.17b).
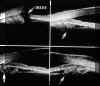
FIGURA 7.17a: Iris en meseta. Cortes a nivel del ángulo camerular en los cuatro cuadrantes. En todos ellos se demuestra la existencia de una rotación de los procesos ciliares hacia adelante contactando con la superficie posterior del iris y ocupando el surco iridociliar. En la imagen inferior derecha y superior izquierda (flechas) se observa una formación quística en los procesos ciliares. (I.C.) FIGURA 7.17b: Iris en meseta. Practicada una iridotomía con YAG laser no se modificó el cuadro. En este paciente también se apreciaron quistes en el cuerpo ciliar (imagen inferior izquierda, flecha). (IRIDT: iridotomía). (I.C.)La BMU ofrece una imagen nítida de las goniosinequias y del estado del ángulo oculto tras éstas (FIGS 7.18 y 7.19). Mediante este técnica no siempre es posible diferenciar, a nivel de la periferia del iris, las simples aposiciones del iris de las sinequias verdaderas pero el análisis de su relación con las demás estructuras ayudan a esclarecer el diagnóstico4. En el glaucoma por midriasis irreversible asociada a queratoplastia (Síndrome de Urrets-Zavalia) (FIGS 7.20a y 7.20b) los hallazgos ultrasónicos apoyan la hipótesis de que el cierre angular se produce por sinequias periféricas y de que se trate de un proceso inflamatorio que afecta al iris, el cual se muestra acortado y adelgazado, mientras que el cuerpo ciliar y los procesos ciliares mantienen su aspecto normal26.
FIGURA 7.18: Goniosinequias de origen inflamatorio (uveitis) que taponan la malla trabecular. La fecha señala la situación del espolón escleral. (I.N.G.O.) FIGURA 7.19: Goniosinequias postqueratoplastia en un caso de rechazo del injerto. Córnea aumentada de grosor. Casi todo el iris está sinequiado a la córnea (flechas). (I.N.G.O.) FIGURA 7.20a: Síndrome de Urrets-Zavalía. Iris en midriasis máxima, atrófico y sinequiado a la cara posterior de la córnea (flechas inferiores) en todos los cuadrantes (imagen de la izquierda corresponde a 9h, e imagen de la derecha a 6h). Cuerpo y procesos ciliares atróficos. Edema corneal y alteraciones en la zona de unión del injerto con la córnea receptora (flecha superior). (CRISTAL.: cristalino). (I.N.G.O.) FIGURA 7.20b: Síndrome de Urrets-Zavalía. Se realizó un nuevo injerto y una trabeculéctomía. Se observa la zona de la trabeculectomía (flecha izquierda) y la persistencia de las sinequias a la córnea (flecha derecha). (I.N.G.O.)La rotación anterior de los procesos ciliares y consiguiente oclusión del ángulo también puede observarse mediante BMU en el síndrome de efusión uveal. El fluido supraciliar de la efusión uveal se detecta como un espacio hipoecogénico entre el cuerpo ciliar y la esclera obervándose la presencia de finas membranas que, cruzando ese espacio, unen ambas estructuras y se corresponden histológicamente a láminas de colágeno23 (FIGS 7.21a y 7.21b). Este fluido empuja los procesos ciliares hacia el iris y en casos severos puede incluso desplazar anteriormente el diafragma iridocristaliniano. La efusión, que aparece asociada a numerosos procesos (inflamación severa, indentación escleral, panfotocoagulación...)27,28, no siempre se puede diagnosticar ecográfica o clínicamente pues no se asocia obligatoriamente a desprendimiento coroideo, sin embargo es posible detectarla con nitidez utilizando la BMU.
FIGURA 7.21a: Síndrome de efusión uveal. Corte BMU a 12 h: Fluido supraciliar (espacio hipoecogénico entre el cuerpo ciliar y esclera), secundario a un desprendimiento de coroides, que produce una rotación anterior de los procesos ciliares (flechas blancas) con oclusión del surco ciliar y cierre angular. (Flecha negra señala el espolón escleral). (I.N.G.O.) FIGURA 7.21b: Síndrome de efusión uveal. Corte BMU a 6 h: Situación similar a la descrita a 12h. (I.N.G.O.)La rotación anterior de los procesos ciliares también está presente en el glaucoma maligno secundario a la cirugía filtrante. En muchos de estos casos la BMU detecta la presencia de fluido supraciliar aunque no está claro si su aparición es previa o posterior a la del glaucoma maligno. Por ejemplo, en las trabeculectomías amplias se pude producir una efusión uveal que ocasione la rotación anterior de los procesos y su incarceración a nivel de la apertura interna de la trabeculectomía, generándose como consecuencia una glaucoma maligno. Sin embargo, en otros casos la efusión uveal no está presente, de lo que se deduce que aún no están claros los mecanismos que desencadenan este tipo de glaucoma. En la cirugía del desprendimiento de la retina la indentación circular con banda de silicona puede producir una glaucoma agudo con bloqueo angular y disminución de la profundidad de la cámara anterior. La BMU demuestra además la rotación anterior de los procesos ciliares29.
Aunque es inusual, se han descrito glaucomas por cierre angular secundarios a quistes múltiples que empujan anteriormente la periferia del iris hasta producir un cierre angular, reproduciendo un mecanismo similar al descrito en el iris en meseta30,31. Su diagnóstico diferencial puede realizarse fácilmente utilizando BMU (FIGS 7.22a y 7.22b).
FIGURA 7.22a: Glaucoma de ángulo cerrado bilateral producido por quistes del epitelio pigmentario del cuerpo ciliar. Reconstrucción del segmento anterior del ojo izquierdo: Múltiples quistes situados en los procesos ciliares desplazan hacia adelante la raíz del iris disminuyendo la profundidad de la cámara anterior y bloqueando el ángulo. (I.N.G.O.) FIGURA 7.22b: Corte BMU tangencial al limbo en el ojo derecho: Multiples quistes a nivel del surco ciliar. (C: cristalino). (I.N.G.O.) FIGURA 7.22c: Tras realizar iridotomía con láser YAG en el ojo izquierdo no modificó la presión ocular ni la situación angular. (I.N.G.O.) FIGURA 7.22d: El mismo caso, en ojo derecho. Tras realizar iridectomía con láser YAG no se modificó la presión ocular ni la situación angular. (I.N.G.O.)
II.3. Glaucoma congénito. Glaucoma juvenil
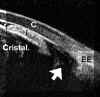
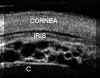
Aunque generalmente el estado corneal en los glaucomas congénitos permite una exploración adecuada del segmento anterior, en algunos casos la opacidad corneal lo impide. La BMU puede emplearse en estos casos para descartar alteraciones en este nivel. Así, por ejemplo, se pueden diagnosticar aniridias (FIGS 7.23 a y b) y otras malformaciones del polo anterior, como en el síndrome de Peters32 (FIG 7.24). Existen estudios publicados donde se utilizó esta técnica para estudiar glaucomas infantiles y se encontraron alteraciones comunes como una elongación y desplazamiento anterior de los procesos ciliares9. Otros estudios en glaucomas juveniles determinan una alteración estructural, con disminución de la longitud de la malla trabecular11. También se han descrito en los glaucomas juveniles alteraciones en el cuerpo ciliar33 (FIG 7.25).
FIGURA 7.23a. Glaucoma congénito Paciente de dos semanas de edad. El edema corneal impedía el estudio del polo anterior. El grosor corneal medido con la BMU era de 1,9 mm. La flecha señala restos pupilares. CRIST: cristalino. (I.C.) FIGURA 7.23b. El estudio bioultrasónico permitió además diagnosticar una aniridia. (I.C.) FIGURA 7.24: Síndrome de Peters. Opacificación corneal. En la imagen de la izquierda se observa cristalino subluxado (C) y alteraciones a nivel del endotelio (flecha). En la imagen derecha se detectan una sinequia iridocorneal (flecha). (I.N.G.O.) FIGURA 7.25. Glaucoma juvenil. La configuración normal del ángulo se ha perdido. En su lugar se aprecia un tejido triangular hiperreflectivo que se corresponde con los hallazgos histológicos (flechas). (I.C.)
III. Contribución de la BMU
al tratamiento
del glaucoma
La BMU ofrece interesantes posibilidades en la planificación y seguimiento del tratamiento del glaucoma. Al ampliar el conocimiento de los mecanismos etiopatogénicos del glaucoma, la BMU ayuda a seleccionar la mejor alternativa terapéutica para cada caso.
Tras el tratamiento, tanto médico como quirúrgico, la BMU permite analizar los cambios y las interrelaciones en las estructuras del segmento anterior implicadas, y en su caso puede permitir establecer las causas del fracaso quirúrgico2.
III.1. Glaucoma de ángulo cerrado. Iridotomía
En todos aquellos casos de glaucoma por cierre angular en los que actúa como mecanismo patogenético principal el bloqueo pupilar el tratamiento de elección es la iridotomía. El libre acceso del humor acuoso a la cámara anterior a través de la iridotomía restablece automáticamente la profundidad de la cámara y la apertura del ángulo normalizando la PIO si previamente no se habían tornado goniosinequias.
Aunque para realizar la iridotomía puede utilizarse el efecto térmico producido por el láser de Argón la práctica más habitual consiste en usar el Neodymium:YAG (Nd:YAG). El YAG láser provoca en el interior del iris ondas de shock que destruyen la estructura del tejido (Fotodisrupción). En iris muy vascularizados para evitar la probable hemorragia provocada por la fotodisrupción puede recurrirse a la combinación de ambos procedimientos.
La BMU permite confirmar la indicación de la iridotomía al demostrar la existencia de un bloqueo pupilar. También permite situar los impactos del láser en el lugar adecuado (iris abombado separado claramente del cristalino) y comprobar la eficacia de la intervención (iridotomía afectando todo el espesor del iris, desaparición del abombamiento, restablecimiento de la profundidad de la cámara anterior y aumento del área de contacto iridocristaliniana) (FIG 7.26).
FIGURA 7.26: Iridotomía con YAG laser. La BMU comprueba la permeabilidad de la iridotomía y la desaparición del abombamiento del iris. (I.N.G.O.)En el síndrome de iris en meseta se comprobó mediante la BMU que el posicionamiento anterior de los procesos ciliares no se modifica tras la iridotomía. Esta observación explica que en estos casos persista el cierre angular24 (FIG 7.17b).
Esta información es particularmente importante cuando existe opacidad corneal que impide una observación precisa de la superficie anterior del iris. Si la opacidad es tan importante que impide el paso del láser la información de la BMU puede indicar la conveniencia de realizar una iridectomía quirúrgica.
III.2. Tratamiento quirúrgico del glaucoma
de ángulo abierto
Históricamente la ultrasonografía de alta frecuencia representa la primera técnica de exploración que en vivo y de forma incruenta permite visualizar las modificaciones estructurales que producen en el interior de los tejidos los procedimientos utilizados en la cirugía filtrante del glaucoma. Estos hallazgos permiten hacernos una idea de los mecanismos a través de los que actúan las técnicas quirúrgicas y también conocer las causas anatómicas de sus fracasos.
En este apartado estudiaremos las aportaciones de la BMU en tres procedimientos quirúrgicos: la trabeculectomía, la esclerectomía profunda no perforante y los implantes valvulares.
III.2.1. Trabeculectomía
Desde su descripción por Cairns en 1968 la trabeculectomía constituye el procedimiento quirúrgico más frecuentemente utilizado en el glaucoma de ángulo abierto. La técnica consiste en tallar un colgajo escleral superficial extirpando a continuación en todo su espesor un bloque del tejido escleral subyacente penetrando en la cámara anterior (esclerectomía interna). El bloque extirpado se extiende desde la periferia de la córnea hasta la línea de Schwalbe por lo que se incluyen en él el trabeculum y el canal de Schlemm. Muchos cirujanos (Watson) amplían posteriormente la extirpación englobando en el bloque el espolón escleral34.
A través del orificio escleral así creado se entra en la cámara anterior y se practica una iridectomía periférica. El colgajo escleral superficial se sutura intentando el cierre hermético de las incisiones. El ideal de la trabeculectomía consiste en conseguir una filtración "interna" a través de las vías de evacuación del humor acuoso situadas río arriba del canal de Schlemm pero muchas veces no se consigue el cierre hermético de las incisiones accediendo a su través el humor acuoso directamente desde la cámara anterior al espacio subconjuntival.
Los resultados de la trabeculectomía pueden considerarse como buenos en el glaucoma crónico de ángulo abierto (porcentaje de éxitos superior al 75%) como regulares en el glaucoma de la afaquia - pseudofaquia (alrededor del 50%) y como malos en el glaucoma neovascular (inferior al 25%).
Aunque es opinión comúnmente aceptada que la extensión de la esclerectomía interna hacia atrás no mejora los resultados y aumenta las complicaciones postoperatorias, algunos cirujanos (J. García Sánchez, M. Sánchez Salorio) no comparten esa opinión practicando lo que han denominado como "macrotrabeculectomía"35. La resección de la esclera profunda se amplía en su parte posterior hasta dejar libre el espacio supraciliocoroideo de modo parecido a como ahora se propugna en la esclerectomía profunda no perforante.
En la trabeculectomía la BMU aporta información útil para:
a) La planificación preoperatoria
b) El conocimiento de los mecanismos a través de los cuales actúa la trabeculectomía.
c) El conocimiento de las causas de fracaso de la trabeculectomía.
a. Aportaciones de la BMU en la planificación preoperatoria de la trabeculectomía
En aquellos casos en los que la córnea no es transparente o en los que por cualquier otra causa no puede visualizarse el ángulo camerular la BMU permite conocer si existen goniosinequias y su localización. Esta información permite situar la esclerectomía interna de la trabeculectomía en zonas libres de sinequias. En la FIG 7.27 se muestra un caso de glaucoma secundario a una queratoplastia con rechazo del implante y goniosinequias en prácticamente los 360º, excepto en una pequeña zona que fue seleccionada para realizar la trabeculectomía.
FIGURA 7.27: Corte radial a nivel limbar de un ojo con rechazo de injerto corneal y tensión elevada. Se aprecia el edema de la córnea donante y receptora (engrosamiento y aumento de la ecogenicaidad), la zona de unión entre ambas alterada (flecha blanca) y el iris sinequiado a la cornea ocluyendo el ángulo en todos los cuadrantes excepto en el nasal superior (Figura arriba y derecha), lugar seleccionado para realizar la trabeculéctomía. (Fleha negra señala la posición del espolón escleral). (I.N.G.O.)
b. Aportación de la BMU al conocimiento
de los mecanismos a través de los cuales actúa
la trabeculectomía
El mecanismo a través del cual actúa la trabeculectomía dista mucho de haber sido definitivamente aclarado. La hipótesis originaria consistía en pensar que la excisión del bloque de esclera en el que se incluían el trabeculum y el canal de Schlemm permitía el acceso directo del humor acuoso al canal de Schlemm a través de los dos orificios del canal que quedaban abiertos a ambos lados de la excisión. El humor acuoso, sin la resistencia del trabeculum, entraría en el canal de Schlemm y después se evacuaría por la vía convencional: colectores, espacio subconjuntival, venas epiesclerales.
Esta hipótesis es muy poco plausible. En condiciones normales el humor acuoso no "circula" por el canal siguiendo el trayecto de su luz sino que lo "atraviesa" pasando de la cámara anterior a los colectores a través del trabeculum y del propio canal.
La presencia en muchos casos de una ampolla de filtración muy evidente hizo pensar que la trabeculectomía actuaba a través de una filtración externa de modo similar a como lo hacían las operaciones fistulizantes clásicas. En algunos casos, con la lámpara de hendidura, podemos observar como las incisiones practicadas en el tapete escleral superficial se mantienen abiertas y es de suponer que el humor acuoso en esos casos pasa directamente desde la cámara anterior hasta el espacio subconjuntival (Trabeculectomía como cirugía fistulizante protegida).
Pero en otros casos es imposible detectar esa abertura. Puede incluso no existir ampolla de filtración evidente y la tensión ocular mantenerse perfectamente controlada. Todo parece indicar, que al menos en algunos casos, la trabeculectomía actúa a través de una "filtración interna". Esto quiere decir que la intervención permite la utilización de la vías de drenaje normales o que crea otras nuevas.
Siguiendo el esquema clásico de Spencer se señalan las posibles rutas de evacuación del humor acuoso en la trabeculectomía36 (FIG 7.28).
FIGURA 7.28: Posibles rutas de drenaje en la trabeculectomía:Orificios abiertos del canal de Schlemm (1).
Colgajo escleral superficial y colectores intraesclerales (2).
Incisión lateral del colgajo superficial (3).
Ruta intraescleral (4).
Ruta uveoescleral (5).
(I.N.G.O.)
1. Acceso directo del humor acuoso al interior del canal de Schlemm a través de los orificios abiertos del canal. Ya hemos visto que esa hipótesis no es verosímil.
2. Salida del humor acuoso a través del tapete escleral superficial. El humor acuoso podría atravesar directamente el tejido escleral adelgazado o utilizar los colectores intraesclerares.
3. Salida a través del espacio creado por la disección escleral necesaria para llegar al limbo. Esta ruta apenas ha sido considerada porque se suponía que el colgajo escleral superficial cicatrizaba sobre la esclera profunda allí donde esta no había sido extirpada. Los resultados de nuestros estudios con la BMU en el postoperatorio precoz y tardío de la trabeculectomía parecen indicar, no solamente que esa ruta existe en la mayoría de los casos, sino que también es muy importante para el éxito de la intervención.
4. Salida del acuoso a través de la ruta úveo-escleral. En los casos en los que en la esclerectomía interna se incluye el espolón escleral se produce una desinserción de las fibras longitudinales del músculo ciliar creando una posible comunicación entre la cámara anterior y el espacio supraciliocoroideo.
La BMU no resuelve definitivamente la cuestión de cual es el mecanismo de acción de la trabeculectomía pero hace más verosímiles algunas de esas hipótesis pues es el primer método de exploración que permite visualizar la vía de tránsito del drenaje interno tras la cirugía filtrante37. Basándonos en nuestros propios estudios creemos que puede asegurarse lo siguiente :
1. La trabeculectomía no modifica la profundidad de la cámara anterior ni la amplitud del ángulo10. Por el contrario, en la cirugía combinada (trabeculectomía + EECC del cristalino) aumenta de modo significativo tanto la profundidad de la cámara anterior como la amplitud del ángulo10,38 (FIGS 7.29a y 7.29b).
FIGURA 7.29a: Aumento de la profundidad de la cámara anterior tras la cirugía combinada glaucoma - catarata (trabeculectomía + E.E.C.C.). Imagen de la izquierda previa a la cirugía, imagen de la derecha posterior a ella. (CRISTAL.: cristalino). (I.N.G.O.) FIGURA 7.29b: Aumento de la amplitud del ángulo en el mismo caso. Imagen de la izquierda previa a la cirugía, imagen de la derecha posterior a ella. (I.N.G.O.)2. Permite detectar, localizar y medir el ostium interno (espacio creado por la esclerectomía interna)2,39 (FIGS 7.30a y 7.31 a 7.33). También permite conocer si ha sido extirpado el espolón escleral así como la relación de la iridectomía con el ostium.
FIGURA 7.30a: Corte radial a nivel de una trabeculectomía funcionante. Se aprecia una amplia iridectomía (1), la apertura interna de la trabeculectomía (2), la ruta escleral (línea hipoecogénica) (4) y una ampolla de filtración de baja ecogenicidad debido a un elevado contenido de líquido (3). (I.N.G.O.) FIGURA 7.30b: Mismo caso. Corte tangencial a nivel de la ampolla. Se observa una ampolla esponjosa con acúmulo de líquido (espacio hipoecogénico) y debajo la esclera y los procesos ciliares (flecha). (I.N.G.O.) FIGURA 7.31: Trabeculectomía funcionante: Iridectomía amplia (flecha), ostium interno, ampolla de filtración alta y de baja reflectividad (aspecto esponjoso). (I.N.G.O.) FIGURA 7.32: Trabeculectomía funcionante: Iridectomía amplia, ostium interno, ampolla de filtración poco elevada y de reflectividad media-baja. Ruta de drenaje patente (flechas). (I.N.G.O.) FIGURA 7.33: Postoperatorio del caso de la figura 7.24. Se aprecia el ostium y la ruta de drenaje a nivel de la trabeculectomía (flecha), pero ausencia de ampolla de filtración. Fracaso de cirugía filtrante (IR: iris). (I.N.G.O.)3. En la mayoría de los casos en que se ha conseguido controlar la presión intraocular la BMU demuestra la existencia de un espacio ecogénicamente vacío entre el tapete escleral superficial y la esclera profunda10,30,39,40. Este espacio se extiende desde el ostium interno hasta la incisión posterior y se denomina "ruta de drenaje intraescleral". Aunque este espacio ecogénicamente vacío podría estar ocupado por vasos o por colágeno muy laxo lo más probable es que se trate de acumulación de fluido que llega directamente desde el ostium interno. El humor acuoso podría ser reabsorbido en el espacio (plexos vasculares intraesclerales, vasos neoformados) o salir de él a través de las incisiones del tapete escleral superficial (FIGS 7.30a, 7.32 y 7.34a).
FIGURA 7.34a: Trabeculectomía funcionante: Iridectomía amplia, ostium interno (flecha blanca), ampolla de filtración de elevación y reflectivida medias, y ruta de drenaje patente (flechas negras). (I.N.G.O.) FIGURA 7.34b: El mismo caso. Zona hipoecogénico en el espacio supracoroideo (fluido supracoroideo de drenaje uveoescleral). (I.N.G.O.)Aunque en los casos exitosos se observa casi siempre la ruta transescleral patente y la ampolla de filtración en algunos existe ruta intraescleral y no ampolla, lo que argumenta a favor de la posibilidad de filtración interna a ese nivel38.
4. En ocasiones aparece un espacio hipoecogénico en el espacio supraciliocoroideo41. Aunque la imagen pudiera corresponderse con un desprendimiento seroso del cuerpo ciliar su persistencia hace pensar que se trate de una ruta de drenaje del humor acuoso hacia el espacio supracoroideo (vía uveoescleral) (FIG 7.34b).
5. La BMU permite conocer las distintas características de la ampolla de filtración (altura, reflectividad interna) y también la existencia de tabicaciones y espacios quísticos en su interior10,39,40 (FIGS 7.30a y b, 7.35).
FIGURA 7.35: Corte tangencial a nivel de una ampolla de filtración esponjosa y elevada. Se observan espacios quísticos en su interior. (I.N.G.O.)La baja reflectividad y la altura de la ampolla de filtración valoradas mediante BMU también han sido relacionados con un buen funcionamiento de la cirugía filtrante10,30,39,42.
c. Contribución de la BMU al conocimiento de las causas de fracaso de la trabeculectomía
Las razones del fracaso de las trabeculectomías no está siempre claras y la BMU aporta información sobre las posibles causas del fracaso. Contribuye a determinar si la causa radica en el proceso cicatricial de la conjuntiva con la consiguiente obliteración de la ampolla, mostrando la inexistencia de ruta de drenaje intraescleral sin ampolla de filtración o bien con una ampolla de filtración encapsulada o fibrosada (FIGS 7.33 y 7.36). Muestra también si el fracaso es secundario a otras circunstancias como la obstrucción de la apertura interna de la trabeculectomía por incarceración o enclavamiento del iris, la hernia del iris a través de la esclerectomía o la hernia de un háptico a nivel de la apertura interna en casos de cirugía combinada, entre otros38 (FIGS 7.37, 7.38 y 7.39).
FIGURA 7.36: Trabeculectomía no funcionante. Se visualiza la zona de iridectomía con el iris próximo a la apertura interna (2) de la trabeculectomía, la ruta escleral (1) y ausencia de ampolla de filtración. (I.N.G.O.) FIGURA 7.37: Trabeculectomía no funcionante. Iris incarcerado a nivel de la apertura interna de la trabeculectomía. (flecha) (I.N.G.O.) FIGURA 7.38: Trabeculectomía no funcionante. Iris bloqueando la entrada al ostium. (I.N.G.O.) FIGURA 7.39: Hernia del iris (flechas) a través de la apertura interna de la trabeculectomía. Ampolla llena de líquido y con paredes adelgazadas. (I.N.G.O.)
Macrotrabeculectomía
La macrotrabeculectomía es una modificación de la técnica de Watson propugnada entre otros por el Prof. J. García Sánchez35. En ella el tamaño del colgajo escleral es de 11x6 mm. alcanzando el límite de la inserción del recto superior y la trabeculectomía tiene un tamaño de 4x4 a 5x5 mm, asimismo se realiza una extirpación del espolón escleral y del tejido epicoroideo; la iridectomía es basal longitudinal de la misma extensión que la pieza de la trabeculectomía. El estudio de las macrotrabeculectomías funcionantes y no funcionantes mediante la BMU puede ayudar a comprender sus mecanismos de acción43-47. Utilizando la copa orbitaria48, es fácil observar el orificio interno de la trabeculectomía, examinar la ampolla y llegar al borde posterior del colgajo escleral. No todas las trabeculectomías funcionantes tienen las mismas características bioultrasonográficas. Del mismo modo, en la macrotrabeculectomía existen varios mecanismos de acción, que muchas veces combinados entre si van a producir el descenso de la PIO. Los principales hallazgos son:
1. Atrofia del cuerpo ciliar. Este hallazgo únicamente se hace patente en las macrotrabeculectomías a largo plazo (FIG 7.40).
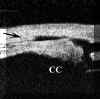
FIGURA 7.40. Macrotrabeculectomía funcionante de 18 años de evolución. Se puede apreciar una atrofia casi total del cuerpo ciliar (flecha) y una disminución del grosor escleral en la zona (flecha negra). El grosor de la conjuntiva es normal, indicando la ausencia de ampolla conjuntival. (I.C.)2. Aparición de un espacio virtual esclero-uveal. Hallazgo prácticamente constante en la macrotrabeculectomía a corto plazo (FIGS 7.41 y 7.42).
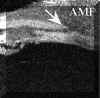
FIGURA 7.41. Macrotrabeculectomía funcionante de 28 meses de evolución. Se aprecia una comunicación directa entre el reservorio (tejido escleral resecado) y el espacio supracoroideo (flecha) reflejando la vía uveoescleral de evacuación del humor acuoso. No existe ampolla conjuntival. CC: cuerpo ciliar. (I.C.) FIGURA 7.42. Macrotrabeculectomía de 2 meses de evolución. Reconstrucción. Se puede apreciar la amplia comunicación entre la cámara anterior y el espacio supracoroideo. La PIO en este paciente era de 10 mm Hg., sin que existieran complicaciones durante el postoperatorio. CONJ: Conjuntiva. SUT CONJ: Sutura conjuntival. CC: cuerpo ciliar. OR: Ora serrata. (I.C.)3. Ampolla conjuntival. Aparece como un espacio hipoecogénico heterogéneo que no está presente en todos los casos (FIG 7.43).
FIGURA 7.43. Macrotrabeculectomía funcionante de 24 meses de evolución. Ampolla conjuntival evidente (AMP) y filtración por el borde posterior del tapete escleral (flecha). (I.C.)Estos hallazgos no son constantes y además pueden coexistir. En ocasiones no es posible encontrar ningún dato que pueda explicarnos el funcionamiento de la cirugía a largo plazo. Para intentar dar una explicación a estos casos, estamos realizando un estudio prospectivo46.
III.2.2. Esclerectomía profunda no perforante
La Esclerectomía Profunda no Perforante (EPNP) es un procedimiento quirúrgico en el que la disminución de la presión intraocular se consigue mejorando la filtración del humor acuoso sin penetrar en ningún momento en la cámara anterior. La técnica (FIGS 7.44a y 44b) consiste en abrir y disecar la conjuntiva tallando un colgajo escleral superficial muy fino. Después se extirpa la esclera subyacente en todo su espesor dejando tan sólo unas laminillas esclerales sobre la coroides y el cuerpo ciliar. En la porción más anterior la disección extirpa las estructuras que se corresponden con el techo del canal de Schlemm penetrando un milímetro en el estroma corneal dejando en el plano profundo nada más que la membrana de Descemet (Escleroqueratectomía profunda). La filtración del humor acuoso se realiza a través del trabeculum que ha sido respetado en toda su integridad y probablemente también a través de la membrana de Descemet. El fluido pasa desde la cámara anterior al lago intraescleral creado por la esclerectomía profunda y desde ese espacio podría seguir varias rutas. Puede ser reabsorbido en el propio lago intraescleral a través de plexos vasculares preexistentes o neoformados. Puede llegar al espacio subconjuntival a través del colgajo escleral superficial muy fino o a través de las incisiones no herméticamente cerradas. Podría utilizar también la ruta uveo-escleral ya que el lago en su nivel más profundo contacta con el espacio supraciliocoroideo.
FIGURA 7.44a: Esclerectomía profunda no perforante (sin implante asociado de colágeno). Esquema. (I.N.G.O.) FIGURA 7.44b: Esclerectomía profunda no perforante (sin implante asociado de colágeno) tras suturar el colgajo escleral superficial. Esquema. (I.N.G.O.)
Con el fin de mejorar la filtración e impedir que la fibrosis postoperatoria bloquée el lago intraescleral puede utilizarse un implante de colágeno además del uso de los implantes comerciales diseñados específicamente para cumplir ese objetivo, uno de nosotros (M. Sánchez Salorio) ha experimentado la utilización de un fragmento de una lente de colágeno corneal. El carácter no penetrante del procedimiento hace que puedan usarse con relativa seguridad agentes antiproliferativos (mitomicina C).
Las indicaciones de la EPNP. son similares a los de la trabeculectomía exceptuando aquellos casos en los que el existen alteraciones pretrabeculares.
Aportaciones de la BMU a la esclerectomía profunda no perforante (EPNP)
De modo similar a lo que ocurre en la trabeculectomía en la esclerectomía profunda no perforante la BMU aporta información útil para:
(a) Aportaciones de la BMU en la planificación preoperatoria.
(b) Aportaciones de la BMU al conocimiento de los mecanismos de la EPNP.
(c) Contribución de la BMU al conocimiento de las complicaciones y causas de fracaso de la EPNP.
(a) Aportaciones de la BMU en la planificación preoperatoria.
La BMU preoperatoria permite conocer si existen alteraciones que impiden el acceso del humor acuoso al trabeculum (goniosinequias, proliferación neovascular) y que contraindican la práctica de una EPNP. También informa sobre el estado de la esclera sobre la que actuará la intervención. Por ejemplo, en un glaucoma secundario con ectasias esclerales (estafiloma uveal) permite elegir las zonas normales evitando las adelgazadas. Permite también conocer perfectamente la posición del espolón escleral y por lo tanto localizar el canal de Schlemm.
(b). Aportaciones de la BMU al conocimiento de los mecanismos de acción de la EPNP.
En el ojo operado de EPNP la BMU permite48-50:
1. Constatar la normalidad de la profundidad de la cámara anterior y de la apertura del ángulo así como la integridad del plano trabeculum-membrana de Descemet (FIGS. 7.45, 7.46 y 7.47).
FIGURA 7.45: Esclerectomía profunda no perforante (EPNP) sin implante asociado de colágeno (2ª semana). Se observa el trayecto de la esclerectomía (flechas negras) y la integridad del plano trabéculum-membrana de Descemet (flecha blanca). (I.N.G.O.) FIGURA 7.46a: EPNP sin implante asociado de colágeno (3.er mes). Acúmulo de líquido (lago intraescleral hipoecogénico). Se intuye la ruta intraescleral. Integridad del plano trabéculum-membrana de Descemet (flecha). (I.N.G.O.) FIGURA 7.46b: El mismo caso. Acúmulo de líquido en el espacio supracoroideo (flechas). (I.N.G.O.) FIGURA 7.47: EPNP sin implante asociado de silicona. Pequeña ampolla de filtración sobre el área de la esclerectomía. Integridad del plano trabéculum-membrana de Descemet (flecha). (I.N.G.O.)2. Seguir en la mayoría de los casos la ruta de la esclerectomía (FIG 7.45).
3. Observar y cuantificar la amplitud del lago intraescleral así como conocer sus posibles modificaciones a lo largo del paso del tiempo (FIG 7.46).
4. Valorar la amplitud y las características internas de las ampollas de filtración (FIG 7.47).
5. Sugerir, sólo en algunos casos, la participación de la ruta uveoescleral en el drenaje del humor acuoso (acúmulo de líquido en el espacio supracoroideo) (FIG 7.36b).
En aquellos casos en los que se ha utilizado un implante de colágeno permite analizar su progresiva disolución y reabsorción (FIGS 7.48 a y b, 7.49).
FIGURA 7.48a: EPNP con implante intraescleral de colágeno (fracción de lente de colágeno plegada) (10 día). El implante se ve como líneas hiperecogénicas en el espacio intraescleral. Lago intraescleral (flecha). (I.N.G.O.) FIGURA 7.48b: El mismo caso 2 meses después. Reabsorción parcial del material intraescleral. Persiste el lago intraescleral. (I.N.G.O.) FIGURA 7.49: EPNP con implante intraescleral de colágeno (industrial). Lago intraescleral (flecha). (I.N.G.O.)
(c). Contribución de la BMU al conocimiento de las complicaciones y causas de fracaso de la EPNP.
Una de las posibles complicaciones intraoperatorias de esta técnica es la microperforación del trabeculum. Cuando esto ocurre caven dos actitudes, continuar con la misma técnica o reconvertirla a una trabeculectomía convencional. La BMU detecta el punto de la microperforación, y en caso de reconversión de la técnica, visualiza las alteraciones que se producen a nivel de las estructuras afectadas (FIGS 7.50 y 7.51).
FIGURA 7.50: EPNP complicado con microperforación (flecha) a Cámara Anterior. Lago intraescleral y ampolla de filtración similar a la descrita en la trabeculectomía. (I.N.G.O.) FIGURA 7.51: EPNP complicado con microperforación y reconvertida a trabeculectomía. Se observan los cambios secundarios a las dos técnicas. (1) Cámara anterior, (2) Iridectomía y ostium interno, (3) Ruta intraescleral y sobre ella una ampolla con contenido líquido, y (4) Acúmulo de líquido en el espacio supracoroideo (desprendimiento de coroides subclínico). (I.N.G.O.)
III.2.3. Implantes valvulares
En aquellos casos en los que una trabeculectomía asociada a medicación antifibrótica ha fracasado o en los que razonablemente puede presuponerse el fracaso (glaucoma neovascular avanzado, causticación extensa de la conjuntiva limbar, glaucoma postqueratoplastia o postvitrectomía, uveítis hipertensivas) el único recurso de que disponemos para reducir la presión intraocular consiste en colocar un implante valvular o en producir una atrofia controlada del cuerpo ciliar (ciclocoagulación). El implante valvular está diseñado para conseguir una comunicación directa entre la cámara anterior y el espacio subconjuntival. Un tubo penetra en la cámara anterior a través de un esclerotomía y el humor acuoso fluye hacia un reservorio implantado en el espacio espiescleral.
Para evitar la posible hipotonía los implantes denominados restrictivos disponen de un dispositivo valvular que regula el drenaje del humor acuoso permitiendo la salida del mismo sólo cuando la presión de la cámara anterior alcanza un determinado nivel. En el implante que nosotros hemos utilizado (válvula de Ahmed) la presión teórica de apertura es de 12 mmHg51.
Aunque los implantes valvulares representan un procedimiento quirúrgico generalmente aceptado para el tratamiento de glaucomas refractarios a cualquier otro tipo de procedimiento en el postoperatorio pueden presentarse diversas complicaciones. Las más importantes son: hipotonía, descompensación corneal del implante y bloqueo del sistema de drenaje bien sea por obstrucción del tubo o por una fibrosis excesiva en los tejidos que rodean al implante.
Aportación de la Biomicroscopia Ultrasónica
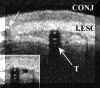
En el preoperatorio la BMU permite elegir la posición más adecuada donde situar el implante51. En el postoperatorio nos informa sobre la posición del tubo y su relación con las estructuras vecinas y ayuda a conocer las causas de las complicaciones y del fracaso de la cirugía51,52. Mediante la BMU se puede observar el trayecto tubo del implante valvular. El tubo se visualiza como dos pares de líneas paralelas hiperreflectivas.
Cuando su colocación es correcta el tubo penetra en la cámara anterior a la altura del limbo y su boca se sitúa libremente en cámara anterior dirigiéndose hacia atrás para evitar el contacto con el endotelio (FIG 7.52).
FIGURA 7.52: Válvula de Ahmed. El tubo valvular (dos parejas de líneas paralelas hiperrefletivas) penetra correctamente en la cámara anterior a la altura del limbo. La boca del tubo se sitúa libremente en cámara anterior y se dirije hacia atrás, alejándose del endotelio (flecha blanca). El paciente fué explorado con una LC terapéutica (línea hiperrefleciva delante de la córnea) (LC). (I.N.G.O.)Cuando la posición del tubo o su salida a cámara anterior es incorrecta, la BMU permite visualizar el problema (FIG 7.53).
FIGURA 7.53: El mismo caso de la Figura 6.30. Válvula de Ahmed. Se observa el tubo del implante bajo una conjuntiva engrosada y una córnea opacificada. La flecha superior señala localización del limbo y la inferior la zona del espolón. Cuando penetra en la cámara anterior la pared del tubo contacta en todo su trayecto con el endotelio, el bisel mira hacia la córnea, pero su boca está libre. (I.N.G.O.)La información aportada por la BMU es especialmente importante en los casos de glaucoma postqueratoplastia (FIG 7.27) penetrante pues suelen asociarse a opacidad de la córnea, distorsión anatómica y secuelas quirúrgicas que dificultan la exploración y la elección del lugar donde debe situarse el implante valvular.
En aquellos casos en los que a pesar de usar implante restrictivo se produce una marcada hipotonía la BMU puede demostrar que su causa radica en la filtración del humor acuoso alrededor del tubo con lo que su flujo se produce sin ningún tipo de restricción tensional (FIG 7.54).
FIGURA 7.54: Corte transversal del tubo de una válvula de Ahmed en un caso de hipotonía (PIO 2 mmHG) mantenida en el postoperatorio inmediato. En el recuadro se muestra un corte más próximo a la cámara anterior, donde se aprecia un área hiporreflectiva que refleja la filtración de humor acuoso alrededor del tubo. T: Tubo valvular. I.ESC: Implante escleral. CONJ: Conjuntiva. La flecha señala un cabo de la sutura del implante de esclera. (I.C.)
III.2.4. Ciclocoagulacion Transescleral
Uno de los problemas de los procedimientos ciclodestructivos consiste en determinar con precisión el lugar de su aplicación53. Aunque en los procedimientos externos los aplicadores tienen referencias para localizar el lugar del impacto uno de nosotros (J. García Feijóo) diseñó un sistema experimental de aplicación coaxial de la BMU con el terminal del láser lo que permite situar el impacto en el lugar deseado sin los inconvenientes de las técnicas microinvasivas43-45 (FIGS 7.55 y 7.56). Además la BMU nos informa sobre el efecto conseguido con la criocoagulación al permitir observar a lo largo del tiempo los cambios producidos en el cuerpo ciliar.
FIGURA 7.55: Sistema coaxial de aplicación de láser de diodo transescleral. La punta del aplicador está señalada por la flecha blanca. La marca del impacto realizado momentos antes es hiporreflectivo, y se señala por la flecha negra. (I.C.) FIGURA 7.56: Corte transversal de un impacto reciente del láser de diodo en un ojo de conejo. (I.C.)
BIBLIOGRAFÍA
1. Pavlin CJ, Foster FS. Ultrasonics Biomicroscopy of the eye. New York. Springer-Verlag Publishing 1995; 3-15.
2. Pavlin CJ, Harasiewicz K, Foster FS. Ultrasound biomicroscopy of anterior structures in normal and glaucomatous eyes. Am J Ophthalmol 1992; 113: 381-389.
3. Pavlin CJ, Harasiewicz K, Sherar MD, Foster FS. Clinical use of ultrasound biomicroscopy. Ophthalmology 1991; 98: 287-295.
4. Spaeth G, Aruajo S, Azuara A. Comparison of the configuration of the human anterior chamber angle, as determined by the Spaeth gonioscopic grading system and ultrasound biomicroscopy. Trans Am Ophthalmol Soc 1995; 93P: 337-47.
5. Bker T, Shegem J, Rauwolf M, Wegwner A. Anterior chamber angle biometry: A comparation of Schimpflug photografy and ultrasound biomicroscopy. Ophthalmic Res 1995; 27 sp 1: 104-9.
6. Pazos B, Sánchez-Salorio M. Aplicaciones de la biomicroscopia Ultrasónica en el Glaucoma. In: Moreno J. Técnica diagnósticas y tratamiento del glaucoma. Eunsa. Navarra 1998; 79-89.
7. Pazos González MCB, Sánchez-Salorio M, Suárez Núñez A, Rodríguez Ares. Biomicroscopia ultrasónica en la planificacion de la queratoplastia. Arch Soc Esp 1997; 72: 841-848.
8. Kobayashy H, Kiryu J, Koboyashy K, Kondo T. Ultrasound biomicroscopic measurement of anterior chamber angle in premature infants. British J Ophthalmol 1997; 81: 460-464.
9. Azuara-Blanco A, Spaeth GL, Araujo S, Augsburger JJ, Katz LJ, Calhoun JH, Wilson RP: Ultrasound biomicroscopy in infantile glaucoma. Ophthalmology 1997; 104: 1116-1119.
10. Martínez Belló C, Pazos González MCB, Pérez García R, Martínez García A, Sánchez Salorio M. Exploración con Biomicroscopia Ultrasónica (BMU) en la cirugía del glaucoma. Arch Soc Esp (en prensa).
11. Steegman Z, Sokol J, Liebman JM, Cohen H, Tello C, Ritch R. Reduced trabecular meshword height in juvenile primary open-angle glaucoma. Arch Ophthalmol 1996; 114: 660-663.
12. Tawara A, Inomata H. Developmental immaturity of the trabecular meshwork in congénical glaucoma. Am J Ophthal 1981; 92: 508-512.
13. Potash SD, Tello C, Liebmannj, Ritch R: Ultrasound biomicroscopy in the pigment dispersion syndrome. Ophthalmology 1994; 101: 332-339.
14. Pavlin cj, Harasiewicz k, Foster FS: Accommodation produces posterior iris bowing in pigmentary dispersion syndrome. Am J Ophthalmol 1994; 118(1): 114-116.
15. Campbell DG. Pigmentary dispersion and glaucoma: a new theory. Arch Ophthalmol 1997; 97: 1667-1672.
16. Karickhoff JR. Pigment dispersion syndrome and pigmentary glaucoma: a new mechanism concept, a new treatment, and a new technique. Ophthalmic Surg 1992; 23: 269-273.
17. Pavlin CJ, Macken P, Trope G, Feldman F, Harasiewicz K, Foster FS. Ultrasound biomicroscopic features of pigmentary glaucoma. Can J Ophthalmol 1994; 29 (4): 187-192.
18. Sokol J, Stegman Z, Liebmann JM, Ritch R. Location of the iris insertion in pigment dispersion syndrome. Ophthalmology 1996; 103: 289-293.
19. Nouby-mahmoud G, Silverman RH, Coleman DJ. Using high-frecuency ultrasound to characterize intraocular foreign bodies. Ophthal Surg 1993; 24: 94-99.
20. Pavlin C, Harasiewicz K, Foster FS. An ultrasound biomicroscopic dark-room provocative test. Ophthalmic surgery 1995; 26(3): 253-255.
21. Pazos-González MCB, Suárez-Campos A, Santos-Insúa L, Rodriguea-Ares T, Capeans-Tomé C, Sánchez-Salorio M. Biomicroscopia ultrasónica. Un nuevo método para la exploración del segmento anterior. St Opthal 1995; 14(4): 329-337.
22. Ritch R, Shields MB. The glaucomas. 2.ª ed; St. Louis: Mosby; 1996; II: 471-490.
23. Pavlin CJ, Easterbrook M, Harasiewicz K, Eng P, Foster FS. An ultrasound biomicroscopic analysis of angle-closure glaucoma secundary to ciliochoroidal effusion in IgA nephropathy. Am J Ophthalmol 1993; 116: 341-345.
24. Pavlin CJ, Ritch R, Sherar MD, Foster FS. Ultrasound biomicroscopy in plateau iris syndrome. Am J Ophthalmol 1992; 113: 390-395.
25. Wand M, Pavlin CJ, Foster FS. Plateau iris syndrome ultrasound biomicroscopic and histologic study. Ophthalmic Surgery 1993; Feb: 129-131
26. González F, Suárez-Peñaranda JM, Díez-Feijóo E, Pazos B, Sánchez-Salorio M. Histophalogical and ultrasound biomicroscopy findings in a case of irreversible mydriasis after keratoplasty in keratoconus. Acta Ophthalmol Scan 1997; 75: 474-476.
27. Pavlin CJ, Rutnin SS, Devenyi R, Wand M, Foster S. Supraciliary effusion and ciliary body thickening after scleral buckling procedures. Ophthalmology 1997; 104: 433-438.
28. Krzystolik MG, Kuperwasser M, Low RM, Dreyer EB. Anterior-segment ultrasound biomicroscopy in a patient with AIDS and bilateral angle-closure glaucoma secundary to uveal effusions. Arch Ophthalmol 1996; 114: 878-879.
29. Trope GE, Pavlin CJ, Bau A, Baumal CR, Foster FS: Malignant glaucoma: Clinical and ultrasound biomicroscopic features. Ophthalmology 1994; 101: 1030-1035.
30. McWhae JA, Crichton ACS. The use of ultrasound biomicroccopy following trabeculectomy. Can J Ophthalmol 1996; 31(4): 187-191.
31. Azuara-Blanco A, Spaeth GL, Araujo SV, Augsburger JJ, Terebuh AK. Plateau iris syndrome associated with multiple ciliary body cysts. Arch Ophthalmol 1996; 114: 666-668.
32. Haddad AM, Greendield DS, Stegman Z, Liebmann JM, Ritch R. Peter´s amonaly : Diagnosis by ultrasound biomicroscopy. Ophthalmic Surgery and Lasers 1997; 28(4): 311-312.
33. García Feijoó J, Arias Puente A, García Sánchez J, Andrés Simón MV. BMU en el glaucoma juvenil. Reunión Anual de la Sociedad Oftalmológica de Madrid, Noviembre 1996.
34. Ritch R, Shields MB, Krapin T. The glaucomas. Glaucoma therapy. Mosby. St. Louis. 1996. III 2º de. 1661-1693.
35. García Sánchez J. Tratamiento quirúrgico. En: García Sánchez J. Tratamiento del glaucoma. Madrid. Talleres gráficos Vda. Bermejo, 1979; 209-238.
36. Spencer WH. Histologic Evaluation of Microsurgical Glaucoma Techniques. Tr Am Acad Ophth & Otol 1972; 76: 389-397.
37. Pavlin CJ, Foster FS. Ultrasound Biomicroscopy in glaucoma. Acta Ophthalmol Suppl 1992; 204: 7-9.
38. Martínez Bello C. Biomicroscopia Ultrasónica (BMU) en la cirugía filtrante glaucomatosa. U.S.C. Santiago 1998.
39. Yamamoto T, Sakuma T, Kitazawa Y. An ultrasound biomicroscopic study of filtering blebs after mitomycin C trabeculectomy. Ophthalmology 1995; 102: 1770-1776.
40. Chi T, Grayson DK, Potash S, Tello C, Liebmann RR. High resolution ultrasound biomicroscopy of filtration blebs. Association for research in vision and ophthalmolgy 1993 (May); 152-63.
41. Sánchez-Salorio M, Martínez-Belló C, Pazos B, Rodríguez-Ares T, Capeans C, Santos Insúa L. An ultrasound biomicroscopic study of supraciliochoroidal effusion after trabeculectomy. JERMOV. Montpellier, 1997 Oct.
42. Sánchez-Salorio M, Pazos B, Martínez-Belló C, Rodríguez-Ares T, Capeans C. Ultrasound biomicroscopy after glaucoma filtration surgery. JERMOV. Montpellier, 1996 Oct.
43. García Sánchez J, García Feijóo J. Biomicroscopia ultrasónica en el glaucoma. Ann Inst Barraquer 1998 (aceptado para su publicación).
44. García Feijóo J. Biomicroscopia ultrasónica en el glaucoma. En: García Sánchez J, Arias Puente A, García Feijóo J. Estrategia terapéutica antiglaucomatosa. JAIRPO. Madrid 1998.
45. García Feijoó J, Andrés Simón MV, García Sánchez J, Arias Puente A. Biomicroscopia ultrasónica en el glaucoma. LXXII Congreso de la S.E.O. Madrid, 1996, Oct.
46. Cuiña Sardiña R, García Feijóo J, García Sánchez J. Macrotrabeculectomía: estudio bioultrasonográfico. LXXIV Congreso de la S.E.O. Alicante, 1998, Oct.
47. García-Feijóo J, Martín-Carbajo M, Benítez del Castillo JM, García-Sánchez J. Orbital cup: A device to facilitate ultrasound biomicroscopic examination of pars plana and peripheral retina. Arch Ophthalmol 1997; 115: 1475-76.
48. Pazos MCB, Sánchez-Salorio M, Pérez V, Rodríguez-Ares MT. Hallazgos de la B.M.U. en la esclerectomía profunda no perforante. Correlato funcional. LXXIV Congreso de la S.E.O. Alicante, 1998, Sept.
49. Sanchez E, Schnyder CC, Sickenberg M, Chiou AGY, Hédiguer SEA, Mermoud A. Deep sclerectomy : results with and without collagen implant. International Ophthalmology 1997; 20: 157-162.
50. Chiou AG, Mermoud A, Hediquer SE, Schnyder CC, Faggioni R. Ultrasound biomicroscopy of eyes undergoing deep sclerectomy with collagen implant. Br J Ophthalmol 1996; 80(6): 541-544.
51. Pazos MCB, Sánchez-Salorio M, Touriño MR, Rodríguez-Ares MT, Díez-Feijóo E. Biomicroscopia Ultrasónica en el Control del Implante Valvular asociado a Queratoplastia. LXXIV Congreso de la S.E.O. Alicante, 1998, Sept.
52. Crichton ACS, McWhae, Reimer J. Ultrasound biomicroscopy for the assessment of Molteno tube position. Ophthalmic surgery 1994; 25(9): 633-635.
53. Brancato R, Carassa RG, Bettin P, Fiori M, Trabucchi G. Contact transscleral cyclophotocoagulation with diode laser in refractory glaucoma. Eur J Ophthalmol 1995; 5: 32-9.