
16
INFECCIONES BACTERIANAS
16
Juan A. Durán de la Colina
![]() Introducción
Introducción
![]() Epidemiología
Epidemiología
![]() Patogenia
Patogenia
![]() Clínica
Clínica
![]() Diagnóstico
Diagnóstico
![]() Estudios de laboratorio
Estudios de laboratorio
![]() Tratamiento
Tratamiento
![]() Prevención
Prevención
![]() 1. INTRODUCCIÓN
1. INTRODUCCIÓN
La infección corneal es, sin duda, la complicación más grave del uso de LC (1). Aunque su frecuencia no es elevada y es bien cierto que la inmensa mayoría de los usuarios no va a sufrir esta complicación, se ha ido incrementando a medida que lo ha hecho la población portadora de LC, es decir, un 435% desde 1950 (2). La gravedad de la complicación se basa en la disminución visual que provoca, que puede llegar a ser definitiva. Por su parte, las diferentes modalidades de porte han ido incidiendo en la atención al problema, pues tanto el porte permanente como la irrupción de las lentes desechables no han sido ajenas a esta complicación. El uso de LC ha podido ser identificado como el factor de riesgo más potente para el desarrollo de queratitis microbiana en el mundo occidental (3,4), aunque otros estudios apuntan que la causa más frecuente es la cirugía ocular previa (5).
En personas jóvenes el mayor factor de riesgo para sufrir una queratitis bacteriana es el uso de lentes de contacto. |
![]() 2. EPIDEMIOLOGÍA
2. EPIDEMIOLOGÍA
Antes de la aplicación de las LC en las últimas décadas, las úlceras corneales microbianas eran consecuencia de traumatismos o de enfermedades de la superficie ocular. En una revisión acerca de la proporción que, sobre todas las úlceras corneales, se asocian al uso de LC, se encontró que entre 1970 y 1979 era del 5-31%, para incrementarse al 15-52% en los diez años siguientes, según los estudios. Del mismo modo y en los mismos periodos, el riesgo de úlcera corneal por 100.000 habitantes/año pasó del 3’8 al 11, mientras que la población que utilizaba LC se incrementaba del 2-4% al 8-10% (1). Las últimas cifras estiman que en los últimos años las LC se han constituido en el primer factor de riesgo para sufrir una queratitis bacteriana, alcanzando en EE.UU. entre un 40 y un 80% del total de las infecciones corneales (Lemp M. Comunicación oral, ECLSO 1998).
Se tiende a trivializar el uso de las LC, lo que disminuye la información y el cumplimiento de las normas de su uso y mantenimiento. La presión comercial y las bases de la demanda dificultan las iniciativas para centrar correctamente este problema que en algún caso se ha considerado incluso como de salud pública, por el enorme número de usuarios, estimado en más de 40 millones en todo el mundo hace 9 años (6) y que actualmente llega a 75 millones.
Las primeras series de complicaciones infecciosas por uso de LC fueron publicadas antes de la década de los 70 pero su importancia en cuanto a problema de amplia repercusión no fué destacado hasta esa década, multiplicándose los estudios y el interés a lo largo de los años (1). En 1966 se describieron tan solo 14 casos entre un total de 50.000 portadores de lentes de PMMA (7). Posteriormente se comenzó a evidenciar que los portadores de lentes de hidrogel tenían mayor riesgo de infección (8). En la década de los 80, con el incremento de usuarios de LC se destacó su importancia como causa de queratitis microbiana y se iniciaron estudios de investigación para conocer mejor los mecanismos patogenéticos. En un interesante estudio, Wilson y cols asociaron la incidencia de úlceras con el uso de suero sin conservante y demostraron que las bacterias que se encontraban en las úlceras corneales eran con frecuencia del mismo serotipo que las aisladas de las LC y sus estuches (9). Por su parte Cooper y Constable destacaron la coincidencia de mayor frecuencia de úlceras en aquellos que utilizaban las LC de forma permanente o prolongada, alertando sobre esta modalidad de uso (10). Estas primeras impresiones (importancia de las lentes hidrogel, utilización de soluciones sin conservante y uso continuado de las LC) fueron posteriormente analizadas más a fondo para determinar su importancia real.
No obstante y a pesar de los estudios epidemiológicos realizados, se desconocen todavía muchos de los datos más relevantes debido, en parte, a los cambios habidos en los modos de uso de las LC. Tambien se ha de considerar que los primeros estudios no delimitaban las úlceras corneales infecciosas y las no infecciosas. En la más amplia revisión sobre este asunto se ha cifrado la incidencia anual de keratitis por LC de la siguiente forma (11): RGP-UD 6’8/10.000, RGP-UC 23’9/10.000, LCB-UD 5’2/10.000, LCB-UC 18’2/10.000 y LCB-UC para afaquia 49’8/10.000.
Algunos estudios ya han dejado bien definida la incidencia de queratitis en portadores de LC. El ya clásico estudio de Poggio y cols en Nueva Inglaterra (12) y el de Nilsson y Montan en Suecia (13) revelaban los siguientes datos:

De ambos estudios, aunque de resultados distintos, se confirma que el uso de LC en porte prolongado incrementa el riesgo de infección de una forma muy significativa y que el riesgo se incrementa con los dias continuados de porte. Estos datos obligaron a una cierta precaución en las indicaciones del uso prolongado, que la FDA limitó a 7 dias desde los 30 dias aprobados en un primer momento.
Los estudios multivariables han permitido delimitar los factores de riesgo para la queratitis asociada al uso de LC: (3,14-16).

Aparte del porte continuado o, más exactamente prolongado, se han identificado como tales: la situación socioeconómica baja, el sexo masculino y el ser fumador. No se ha podido demostrar que la edad o el incumplimiento de las normas de higiene y cuidado en el de porte prolongado fueran factores de riesgo (17), pero es muy significativo el incumplimiento en usuarios de porte diario (18).
El factor de riesgo más potente para el desarrollo de queratitis bacteriana en usuarios de lentes de contacto es el porte prolongado. |
Tras el trabajo de Wilson y cols que demostraban el mismo germen en la úlcera y el líquido de mantenimiento, se pudo observar que cuando no se utilizan estos medios en el cuidado de las LC desechables el riesgo de infección se incrementa diez veces (19). Se ha observado que tambien en ciertos usuarios que cumplen estrictamente el régimen de limpieza, se aislan bacterias o amebas en alguno de los elementos de su sistema (20). De los métodos de desinfección, los que usan el método térmico presentan un 29% de contaminación, con el peróxido el 50% y con los métodos químicos hasta el 79% (21). Estos datos permiten reconocer ciertas limitaciones para la prevención de la contaminación de las LC.
Las enfermedades sistémicas pueden constituir un factor de riesgo. Considerando la mayor fragilidad epitelial que ocurre en los diabéticos, se ha podido confirmar que cuando son portadores de LC tienen un mayor riesgo de infección corneal (22).
En lo referente a las LC terapéuticas el riesgo se incrementa, pues casi siempre su empleo se indica en situaciones que se acompañan de defecto epitelial. Este mismo problema puede existir en córneas con traumatismos o queratoplastia previa. Tal y como se expone en los capítulos , se debe realizar una prevención específica en estos casos.
![]() 3. PATOGENIA
3. PATOGENIA
El epitelio corneal es una eficaz barrera a la penetración bacteriana, por lo que es necesaria su rotura para que se inicie una infección. El porte de LC puede ser un motivo suficiente para provocar dicha rotura y además, la misma LC puede ser el vehículo de la bacteria. Así pues, parece necesario este efecto doble en la patogenia de la queratitis.
Ya se ha comentado la limitación de los métodos para mantener desinfectados todos los elementos del sistema (estuche, líquidos y LC) (21) y la coincidencia serológica de los gérmenes aislados en las úlceras y los estuches (9). El estuche de las LC albergan en su medio húmedo con facilidad tanto bacterias como hongos y amebas, constituyendo un indicador de este hecho la presencia de suciedad (12). Por su parte entre el 40 y el 70% de los usuarios no siguen correctamente el régimen de limpieza, pero no siempre ha sido posible implicar esta falta de higiene con una mayor incidencia de infecciones (23). Por ejemplo, la contaminación de los sistemas es independiente del tipo de LC, incluyendo rígidas permeables, blandas convencionales y blandas desechables. De los muchos estudios realizados, las variaciones encontradas pueden deberse a factores climáticos, hábitos de uso o técnicas de laboratorio (24). La contaminación se debe tanto al incumplimiento de las normas de higiene y a la eficacia relativa de los métodos de desinfección, siendo el más eficaz el térmico, seguido por los peróxidos y los químicos en menor grado (25). Los detergentes surfactantes no erradican los gérmenes, por lo que no pueden constituir los únicos elementos de limpieza.
Una vez la LC se encuentra en un medio contaminado puede actuar de vehículo de microorganismos hasta el ojo. Si bien en un primer momento se detectaron algunas lentes contaminadas en el envase de origen, no se considera que actualmente esto sea relevante. Los contaminantes proceden de otras fuentes: flora conjuntival, dedos, maquillaje, etc. Ya se ha expuesto un capítulo previo la modificación de la flora microbiana durante el uso de LC y, en breve y ante las disparidad de datos entre los estudios, no se puede deducir que sean un elemento perturbador en grado significativo, pero pudieran suprimir o interferir con algunos de los factores que inhiben el crecimiento bacteriano.
La fuente de los microorganismos es variado. Los párpados y la conjuntiva albergan un número importante de bacterias, la mayoría de ellas cocos gram + (S Aureus y S epidermidis), con fácil acceso a la LC y a la córnea. Los pacientes con blefaritis crónica presentan una carga estafilocócica superior y están sometidos a una mayor riesgo de infección corneal. En personas con procesos respiratorios crónicos existe un elevado riesgo de infección por S pneumoniae. P aeruginosa y S marcescens se encuentran en lugares húmedos, como lavabos y en áreas hospitalarias, contaminando sueros y colirios. Son capaces de resistir la acción de sustancias antisépticas y de sobrevivir en lugares con escasos nutrientes y oxígeno. Se aislan con frecuencia en los estuches de las LC (26).
Las bacterias pueden adheririse a las LC tras un breve tiempo de exposición (Figura 1) (27). Parece que los depósitos que se forman sobre la lente tras el porte puede incrementar la colonización, pero tambien intervienen la propia composición de la lente y su contenido en agua. Las RGP tienen más capacidad para atrapar bacterias, pero tambien sufren una desinfección más eficaz (28).
Las bacterias forman además un biofilm o glicocalix que las protege de agentes externos, como los agentes antimicrobianos de las soluciones o las sustancias de la lágrima y permiten que las bacterias crezcan y se adhieran con gran intensidad. La capacidad y la rapidez con que se desarrolla esta barrera depende de la bacteria, nutrientes, sustrato y otros factores, siendo inferior a una hora para la P aeruginosa sobre una LC hidrogel (29). Dentro del biofilm los organismos pueden adaptar diferentes fenotipos y procesos enzimáticos que limitan su destrucción (23). La presencia del biofilm podría explicar la contaminación de los sistemas a pesar de un correcto cumplimiento de las normas de higiene y cuidado de las lentes.
Una vez la LC está contaminada, el microorganismo necesita pasar a la córnea para iniciar la infección. Aunque los primeros estudios demostraban la necesidad de un defecto epitelial para que las bacterias tengan capacidad de adherencia, más recientmente se ha puesto de manifiesto que son tan solo necesarios ciertos cambios en la membrana celular. El uso de la lente proporciona múltiples ocasiones de disrupción epitelial: abrasión accidental, toxicidad de las soluciones, hipoxia o lente muy cerrada. El que los portadores de uso prolongado se encuentren dentro de los grupos de riesgo es atribuible a la hipoxia y a los cambios que provoca en la membrana celular, al retraso en la descamación de células terminales. La P aeruginosa posee ligandos similares a la lectina que se adhieren a receptores específicos de la membrana celular. Se ha podido ver que estos receptores se incrementan en condiciones de hipoxia (30). No parece entonces imprescindible la rotura de la barrera epitelial para que adherencia bacteriana tenga lugar. Los cambios epiteliales durante el uso de LC han sido más extensamente tratados en el capítulo "Influencia de las lentes de contacto en la fisiología corneal". Posiblemente otros factores sistémicos y locales pueden incrementar el riesgo, como la diabetes o la cirugía corneal previa.
En estudios experimentales se ha empleado mayoritariamente Pseudomonas aeruginosa como microorganismo, por ser el que con más frecuencia se aisla de las úlceras en portadores. La colocación de una LC contaminada acompañada de cierre palpebral puede llegar a causar infección (31). Cuando se coloca una LC sobre una córnea con abrasión epitelial tambien se produce una queratitis, que no se desarrolla en una córnea normal tras varias horas de porte (32).
Aunque es necesario un defecto epitelial para que la infección corneal se inicie, las bacterias tienen capacidad citotóxica cuando se encuentran entre la LC y la córnea. |
La cornea en estado normal presenta barrera para las infecciones que incluye la pared celular del epitelio, los componentes de la lágrima y la acción del parpadeo. Los múltiples elementos que utilizan las bacterias para adherirse a la célula incluyen pili, adhesinas no piliadas, proteinas, lipolisacáridos y flagelos. La unión a la pared celular se hace en forma de una interacción estructural o química entre la pared celular y un receptor en la pared celular. La mayor frecuencia de infecciones corneales por P aeruginosa, S aureus y S pneumoniae, es precisamente debido a la mayor capacidad de estas bacterias para adherirse al epitelio corneal (33). Algunas glicoproteínas de superficie pueden actuar como receptores específicos y por lo tanto estar involucradas en la adherencia de la P aeruginosa en la cornea, que se lleva a cabo en pocos minutos y, en segundo periodo, comienza la replicación y la invasión del estroma (Figura 2). En este segundo alojamiento se encuentra a salvo de algunas de las defensas del huésped. La migración por el estroma es rápida. por la acción de las enzimas, que lo destruyen muy eficazmente. Para otras bacterias el mecanismo es similar pero emplean otras toxinas y enzimas alternativos (figura 3).
El hecho de portar una LC va a modificar la mucina de la lágrima que es inhibidor de la adherencia bacteriana, impide el efecto abrasivo del parpadeo para arrastar las bacterias y dificulta la llegada de la respuesta inflamatoria (23). En estudios experimentales se ha podido demostrar que los polimorfonucleares llegan en menor cantidad en ojos infectados y que portan LC que en los que no portan (34). Es probable que todo ello contribuya a las peculiaridades en la presentación, cuadro clínico y evolución de estas úlceras infecciosas.
![]() 4. CLINICA
4. CLINICA
Los síntomas iniciales de la infección corneal son inespecíficos de cualquier inflamación corneal dolor, lagrimeo, fotofobia y disminución de la visión. La secreción mucopurulenta puede no ser excesiva en un primer momento y el paciente puede notar una mancha blanca en el ojo. Desde ese momento debemos establecer unas pautas de diagnóstico que incluyan
* Examen externo aspecto general del paciente, examen de la cara, párpados y conjuntiva, estesiometría corneal.
* Examen con lámpara de hendidura borde palpebral (inflamación, distiquiasis,…), puntos lagrimales, conjuntiva (hiperemia, secreción,…), córnea (morfología, localización, defecto epitelial, infiltración, tamaño y profundidad de la úlcera, vascularización, depósitos endoteliales) y cámara anterior (reacción inflamatoria, hipopion, fibrina).
El aspecto típico de la úlcera corneal en una portador de LC, es el de un infiltrado supurativo, con un defecto epitelial en general importante. Los márgenes no están bien delimitados y se puede acompañar de un edema estromal más o menos marcado (Figura 4). Puede existir alrededor un infiltrado no ulcerado en forma de anillo o de semiluna que revela la reacción inflamatoria. En la cámara anterior se aprecia una reacción inflamatoria celular y un grado variable de hipopion.
Sin embargo el cuadro puede presentarse en circunstancias que su diagnóstico se vea dificultado. En el caso de las LC terapéuticas, al emplearse en varias alteraciones de la córnea, el cuadro puede presentarse de otra forma por la enfermedad preexistente, más aún si se ha empleado una tratamiento corticoideo o antibiótico profiláctico.
El microorganismo responsable deteminará tambien las características de la infección. Tanto el S epidermidis como el S aureus son frecuentes agentes infecciosos de la córnea, más si se asocian a traumatismos o suturas expuestas. La mayor parte de las veces se acompañan de una blefaritis, fuente del gérmen. El infiltrado es muy blanco, de bordes mal delimitados, secreción muy blanca y con presencia de hipopion moderado o placa inflamatoria endotelial. S pneumoniae es frecuente cuando la infección ocurre en pacientes con trastornos respiratorios, en general de edad. Es típico encontrar una úlcera amplia pero poco profunda y un hipopion muy marcado.
P aeruginosa se ha asociado a las infecciones relacionadas con el uso de LC (35,36). Su agresividad sobre la cornea es notoria, dando origen a una úlcera que progresa rápidamente, con un plastrón mucopurulento en su superficie y con una evolución hacia la perforación corneal (Figura 5). En contra de lo usualmente descrito, puede cursar de forma más tórpida, pudiéndose incluso confundir con infiltrados (Figura 6).
La infección por P aeruginosa no es necesariamente muy agresiva pero requiere siempre un tratamiento de urgencia intenso y una monitorización por su posible rápida evolución hacia la perforación |
Ciertos patógenos son responsables de úlceras más tórpidas. S viridans crece en el estroma lentamente, sobre todo en ojos tratados con corticoterapia previa, y dan lugar a un aspecto típico de helecho o queratopatía cristalina. Cuando se trata de hongos, aunque raros en usuarios de LC (37), el curso es lento y muestran unos infiltrados algodonosos difusos, múltiples y profundos. Se ha involucrado tambien a P acnes en las úlceras corneales de portadores de LC, pero su papel patogénico no está suficientemente comprobado (38).
Se han descrito cuadros menos agresivos clínicamente, con aspecto de infiltrado y sin defecto epitelial. Los organismos aislados eran menos frecuentes (S marcescens, A xylosoxidans y otros) y la evolución favorable tras antibioterapia (39).
![]() 5. DIAGNÓSTICO
5. DIAGNÓSTICO
El primer paso que se debe cumplimentar ante una sospecha de infección corneal en un portador de LC es la confirmación diagnóstica y, en un segundo paso, la detección del agente etiológico. Entre el ilfiltrado estéril y la infección existen algunos puntos en común y unas distinciones no siempre bien definidas en la clínica. Por una parte, el mal cumplimiento de las normas higiénicas y el porte prolongado es más frecuente en ambas patologías (40). Algunas claves pueden contribuir a distinguir estas dos lesiones.

El infiltrado tiende a ser menor en tamaño, periférico, sin defecto epitelial y no progresa. La tendencia natural es hacia la mejoría una vez que se ha retirado la LC. Desde los estadíos iniciales la infección corneal da lugar a una importante reacción inflamatoria, con abundante secreción purulenta. La mayoría de las células inflamatorias provienen del limbo, algunas de las cuales se quedan en esa zona dando lugar a unos puntos blacos visibles con la lámpara de hendidura. La reacción en la cámara anterior tambien es notoria pero en algunos casos poco intensa.
Las úlceras indolentes, tórpidas, causadas por algunos microorganismos como S viridans, hongos o Acantamoeba no cumplen ese esquema clínico, por lo que son los que más confusión crean, a lo que contribuyen los estudios negativos de laboratorio. Cualquier duda diagnóstica obliga a un seguimiento continuado, evitando medicamentos que puedan empeorar el cuadro (antiinflamatorios) o a contribuir a un futuro cultivo negativo (antibióticos).
![]() 6. ESTUDIOS DE LABORATORIO
6. ESTUDIOS DE LABORATORIO
La rutina de referir los pacientes a centros especializados y el uso sistemático de métodos de laboratorio ha sido puesta en duda recientemente. Muchas infecciones corneales responden adecuadamente a antibióticos de amplio espectro en preparación comercial, dando lugar a un incremento de los costes y molestias si se realiza un cultivo. Por otra parte, la eficacia del laboratorio ha sido puesta en duda por el alto índice de resultados inciertos o incluso erróneos. Sin olvidar estos hechos, el laboratorio ofrece unas ventajas innegables aisla la mayor parte de las veces el germen responsable de la infección, selecciona el antibiótico adecuado y permite realizar estudios clínicos, microbiológicos y epidemiológicos. De ahí que la tendencia sea hacia la selección de los casos, bien para ser tratados por el mismo oftalmólogo general, bien para ser enviados a centros especializados que incluyan el diagnóstico del laboratorio (41). Aunque también dentro de esta línea selectiva, se ha recomendado que las infecciones corneales asociadas al uso de LC reciban una consideración aparte, debido a la agresividad y alta resistencia de los gérmenes implicados (42).

Como premisas importantes en el manejo y la evaluación de los resultados, en las úlceras corneales el material disponible es mínimo y se deberán priorizar las pruebas según el aspecto clínico. Así, la toma para una tinción tendrá prioridad cuando se sospeche un hongo, pero puede evitarse en otras circunstancias. El tratamiento inicial será empírico y no debe estar influido por el resultado del Gram. Tambien se empleará un número limitado de medios, haciendo las inoculaciones en el orden de la probable etiología.
Los resultados atenderán tanto a esta escasez de material inoculable y a las características de los microorganismos que se aislen, pues en ocasiones bacterias consideradas no patógenas pueden causar infección en el ojo. En cuanto al antibiograma, se ha de considerar la disponibilidad y la toxicidad de los antibióticos recomendados.
Debido al limitado material para cultivo, se ha de establecer un orden en los medios que se utilizen atendiendo al criterio clínico. |
Se enviarán al laboratorio las LC, su estuche y los líquidos de mantenimiento, teniendo en cuenta si estos contienen conservante pues frenará el crecimiento bacteriano en el medio. En cuanto a esto, sería ideal el poder disponer de colirio anestésico sin conservante para la toma de las muestras, pero no es imprescindible. El estudio de la conjuntiva y bordes palpebrales ipsi y contralaterales ha demostrado no aportar ninguna utilidad par el diagnóstico y tratamiento de las queratitis infecciosas, por lo que no debe ser incluido (43). La toma de la muestra se hará con una espátula estéril o el reverso de una hoja de bisturí, raspando tanto los bordes como el fondo de la úlcera. Se recomienda seguir en estos casos un método riguroso de inoculación, marcando en el agar varias C en línea tras una misma toma. En otra toma se hará otra línea similar. Esto ayuda a diferenciar el microorganismo de la toma (crece en las marcas y en menor cantidad según se han ido inoculando) de un posible contaminante (localizado fuera de las marcas). Con la hoja de bisturí o con un bastoncillo de alginato impregnado en caldo se hará una última toma para ser introducida en el tioglicolato. En algunas úlceras tórpidas y profundas es muy útil la biopsia corneal pues permite tanto la detección del germen causal como la eliminación de material infeccioso y tóxico (Figura 7).
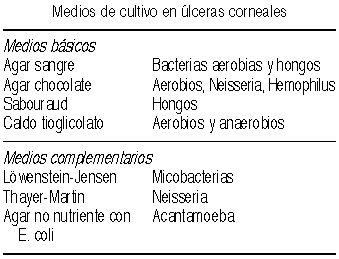
Los medios serán incubados a temperaturas de 35-37ºC para bacterias y amebas, y a 25ºC para hongos, examinándolos a diario para detectar el crecimiento. Las bacterias responsables de las úlceras en portadores de LC varían en relación a otras causas, siendo aproximadamente la mitad por cocos gram + y la otra mitad por gram-, especialmente P aeruginosa (44,45). Es importante insistir en que el uso de LC es el factor de riesgo principal para la infección corneal por Acantamoeba, por lo que se debe considerar la inclusión del medio apropiado en el primer estudio si existen indicios de su presencia.
![]() 7. TRATAMIENTO
7. TRATAMIENTO
El tratamiento inicial debe ser muy constante para casi todos los casos de sospecha de infección corneal y se basa en el empleo de antibióticos de ampio espectro por vía tópica. El primer resultado de las tinciones puede ayudar a descartar otras etiología no bacterianas pero no debe modificar la pauta terapéutica.
La elección del o de los antibióticos es motivo de controversia pues si bien hasta hace pocos años no cabía duda de que los antibióticos concentrados eran el tratamiento de elección, el empleo de fluoroquinolonas comerciales ha sido asumido como correcto (46,47). Esta alternativa presenta varias ventajas, como es su fácil acceso y su baja toxicidad, pero en su contra se ha cuestionado su eficacia ante ciertos patógenos, como streptococci y anaerobios, debiendo evitarse en pacientes con dacriocistitis, edema corneal pseudofáquico y abscesos en suturas (48). Cuando se usan antibióticos concentrados se recomienda la combinación de una cefalosporina (p.e., cefazolina) y un aminoglucósido (p.e., tobramicina) con lo que se cubren casi todos los patógenos posibles de la córnea. Esta opción está recomendada en aquellas queratitis más agresivas o que se encuentran en un estadío más avanzado.

Como alternativa a la cefalosporina se puede utilizar vancomicina, pero tiene problemas de toxicidad debido a su alta acidez. Otros aminoglucósidos como gentamicina o amicacina serán la elección dependiendo de las resistencias de los gérmenes gram (-) encontradas en una zona concreta. Los antibióticos concentrados tienen una caducidad de 7 dias y se recomienda que se mantengan en lugar fresco o en nevera.
La dosificación en cualquier caso será de una gota cada 5 minutos durante la primera hora para lograr una concentración elevada lo antes posible. Durante los dos primeros dias se recomienda una gota cada hora (cada dos horas durante la noche). Es importante destacar que el tratamiento inicial es determinante para el resultado final de estas úlceras (49).
El tratamiento inicial más eficaz en las queratitis bacterianas graves es la combinación de dos antibióticos concentrados, con frecuentes instilaciones durante los primeros dos dias. |
Solo si no es posible esta pauta terapéutica se realizará un tratamiento subconjuntival con dosis de 100 mg de cefazolina y 20 mg de tobramicina, repetida a las 24 horas. Además de producir un dolor intenso, la inflamación se incrementa y disminuye la concentración de antibiótico en la zona infectada durante algunas horas. Las lentes de contacto hidrogel o de colágeno empapadas con antibióticos actúan como reservorios del medicamento pero estos métodos no permiten controlar los niveles del medicamento por no poderse modular su liberación. Además no se conocen los efectos negativos que puedan tener en estos casos, como el atrapamiento de secreciones, limitación del aporte de oxígeno, interacción con la actividad bacteriana, etc. Tampoco se debe plantear el uso del antibiótico por vía sistémica, que solamente se recomienda si existe riesgo de perforación o se ha afectado la esclera, como puede ocurrir en infecciones por P aeruginosa.
Como tratamiento asociado, se han de emplear ciclopléjicos-midriáticos, que disminuirán la reacción inflamatoria de la cámara anterior y los síntomas dolorosos. Los antiinflamatorios no se han de utilizar en esta fase inicial de tratamiento, pero cuando la infección se encuentra clínicamente controlada su utilización a dosis bajas mejora los síntomas y reduce en cierta medida la opacidad residual (50).
A las 48 horas de su inicio se debe replantear el tratamiento, según la evolución clínica y los resultados de laboratorio. Cuando se aisla un microorganismo, se debe retirar el antibiótico menos eficaz y se iniciará la reducción de la dosis, que se debe prolongar un mínimo de dos semanas. Cuando la evolución y el resultado microbiológico son negativos, se procederá a un nuevo cultivo o a una biopsia, que será decidida según el aspecto clínico. Para ello es importante retirar la medicación con 24 horas de antelación para aumentar el crecimiento bacteriano. Ciertas infecciones tórpidas de crecimiento estromal se benefician de una biopsia, que permite aislar el germen y actúa terapéuticamente. Se debe recordar la alta posibilidad de infección por ameba en usuarios de LC, mientras que es mucho más infrecuente la posibilidad de una etiología fúngica.
Ante una mala evolución de la úlcera se deberán retirar los antibióticos y proceder a una nueva toma para cultivo, seleccionando los medios según los criterios clínicos. |
Cuando, incluso a pesar de una mejoría de los signos infecciosos, la córnea se adelgaza hasta perforarse, se debe utilizar un adhesivo (cianoacrilato) para mantener la integridad del globo ocular. Este se aplica sobre la úlcera, tras la limpieza de la misma, y se coloca después una LC blanda para evitar el roce con el párpado. El adhesivo es una alternativa muy útil a la intervención quirúrgica y tiene además un efecto antibacteriano.
Las queratitis bacterianas en usuarios de LC, una vez controladas tienden a no demostrar defectos persistentes por lo que esta eventualidad es posible que sea debida a una toxicidad medicamentosa, a una insuficiencia de células primordiales, a una disfunción lagrimal o a un proceso vírico previo.
Cuando el proceso ha cicatrizado es frecuente la necesidad de una queratoplastia penetrante para restablecer la función visual. En ocasiones el eje visual se encuentra conservado y no es necesaria la intervención, pudiéndose plantear de nuevo la corrección con LC, teniendo como mayor inconveniente la posible neovascularización que puede empeorar y provocar una degeneración por depósitos lipídicos y calcáreos. El mayor inconveniente para una alternativa refractiva es el adelgazamiento corneal residual, que tambien puede dificultar la técnica de la queratoplastia. No obstante, esta última se puede considerar de buen pronóstico, siendo peor cuando la neovascularización es abundante.
![]() 8. PREVENCIÓN
8. PREVENCIÓN
Conociendo los factores de riesgo y la patogenia de la infección, se pueden hacer unas recomendaciones que son válidas a todos los usuarios de LC (1). De hecho, el mayor conocimiento de los mecanismos patogénicos y de los factores de riesgo ha propiciado el que durante los últimos años haya disminuido la incidencia de úlceras corneales infecciosas en usuarios de LC en los últimos años (52).
Todos aquellos factores que incrementan la posibilidad de un defecto epitelial serán tenidos en cuenta pues aumentan el riesgo de infección: ojo seco, uso prolongado, cirugía previa, hipoestesia corneal, etc. Durante la adaptación de las LC se deberá optar por aquellas que ofrezcan un mejor Dk/l, para permitir disminuir el riesgo de hipoxia y se optará preferentemente por el porte diario (1). Aquellos usuarios de porte permanente deberán ser examinados con más frecuencia para reconocer signos de hipoxia corneal y no llevarán las LC más de 7 dias seguidos. Los pacientes a los que se coloca una lente terapéutica deberán ser especialmente monitorizados mientras no finaliza la reepitelización.
La educación del paciente es una parte fundamental de la prevención, pues tanto el uso, el mantenimiento y el recambio dependen de él mismo. Es importante aconsejar el uso de gafas alternativas, que deberán estar correctamente graduadas, para evitar que el uso de las mismas no se limite más que a situaciones extremas. Ante una sensación de enrojecimiento, secreción, disminución visual o dolor, deberán retirar las LC y acudir al especialista lo antes posible, sin iniciar tratamientos ni ocluir el ojo con vendaje (53).
Consejos para el usuario de lentes de contacto
1. Lavarse las manos antes de cada manipulación de la lente
2. Utilizar las lentes un número de horas limitado
3. Limpiar y desinfectar la lente cada vez que se retira
4. Limpiar y cambiar regularmente el estuche de las lentes
5. Evitar humedecer la lente antes de la inserción con soluciones no estériles
6. Realizar revisiones regulares y cambiar las LC con regularidad
7. Retirar la lente si aparecen síntomas de irritación ocular
![]() Bibliografía
Bibliografía
1. Wilhelmus KR. Microbial keratitis associated with contact lens wear. En: Contact lenses. The CLAO Guide. (Ed P Kastl) Kendall-Hunt. 1995, Vol III, pp 19-48.
2. Erie JC, Nevitt MP, Hodge DO et al. Incidence of ulcerative keratitis in a define population from 1950 to 1988. Arch Ophthalmol 1993;11:1665-1671.
3. Dart JK, Stapleton F, Minassian D. Contact lenses and other risk factors in microbial keratitis. Lancet 1991;338:650-653.
4. Sugar J. Contact lenses and corneal ulcers clinical and laboratory correlations (editorial). Arch Ophthalmol 1994112173-174.
5. Cheung J, Slomovic AR. Microbial etiology and predisposisng factors among patients hospitalized for corneal ulcerations. Can J Ophthalmol 199530251-255.
6. Smith SE, McRae SM. Contact lenses-convenience and complications. N Engl J Med 1989;321:824-826.
7. Dixon JM, Young CA, Baldone JA, et al. Complications associated with the wearing of contact lenses. JAMA 1966;195:901-903.
8. Ruben M. Acute eye disease secondary to contact lens wear. Lancet 1976;7951:138-140.
9. Wilson LA, Schlitzer RL, Ahearn DG. Pseudomonas corneal ulcers associated with soft contact lenses. Am J Ophthalmol 1981;92: 546-552.
10. Cooper RL, Constable JJ. Infective keratitis in soft contact lens wearers. Br J Ophthalmol 1977;61250-254.
11. McRae S, Herman C, Stulting RD et al. Corneal ulcer and adverse reaction rates in premarket contact lens studies. Am J Ophthalmol 1991;111:457-465.
12. Poggio EC, Glynn RJ, Schein OD et al. The incidence of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses. N Engl J Med 1989;321:779-783.
13. Nilsson SE, Montan PG. The annualized incidence of contact lens induced keratitis in Sweden and its relation to lens type and wear schedule: results of a 3-month prospective study. CLAO J 1994;20:225-230.
14. Schein OD, Glynn RJ, Poggio EC, et al. The relative risk of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses: a case-control study. The Microbial Keratitis Study Group. N Engl J Med 1989;321:773-778.
15. Matthews TD, Frazer DG, Minassian DC, et al. Risks of keratitis and patterns of use with disposable contact lenses. Arch Ophthalmol 1992;110:1559-1562.
16. Schein OD, Buehler PO, Stamler JF, et al. The impact of overnight wear on the risk of contact lens-associated ulcerative keratitis. Arch Ophthalmol 1994;112:186-190.
17. Liesegang TJ. Contact lens-related microbial keratitis. Part I: Epidemiology. Cornea 1997; 16:125-131.
18. Schein OD, Glynn RJ, Poggio et al. The relative risk of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses: a case-control study. The Microbial Keratitis Study Group. N Engl J Med 1989;321:773-778.
19. Garwood PG. Complications with daily wear disposable contact lenses. Contact Lens J 1991;19:137-.
20. Donzis PB, Mondino BJ, Weissman BA, et al. Microbial contamination of contact lens care systems. Am J Ophthalmol 1987;104:325-333.
21. Campbell RC, CarolinePJ. Inefficacy of soft contact lens disinfection techniques in the home enviroment. Contact Lens Forum 1990;15:17-26.
22. Spoor TC, Hartel WC, Wynn T, et al. Complications of continous-wear soft contact lenses in a nonreferral population. Arch Ophthalmol 1984;9:1312-1316).
23. Liesegang TJ. Contact lens-related microbial keratitis. Part II: Pathophysiology. Cornea 1997;16:265-273.
24. Gray TB, Cursons RC, Sherwan JF, et al. Acanthamoeba, bacterial and fungal contammination of contact lens storage systems. Br J Ophthalmol 1995;79:601-605.
25. Clark BJ, Harkins LS, Munro FA, et al. Microbial contamination of cases used for storing contact lenses. J Infect Dis 1994;28: 293-304.
26. Farris RL. Is your office safe No. Cornea 19909S44.
27. Durán JA, Refojo MF, Gipson IK, et al. Pseudomonas attachment to new hydrogel contact lenses. Arch Ophthalmol 1987;105:106-109.
28. Miller MJ, Wilson LA, Ahearn DG. Adherence of Pseudomonas aeruginosa to rigid gas-permeable contact lenses. Arch Ophthalmol 1991;109:1447-1448.
29. Stapleton F, Dart JK, Matheson M, et al. Bacterial adherence and glycocalyx formation on unworn hydrogel lenses. J Br Contact Lens Assoc 1993;113-117.
30. Latkovic S, Nilsson SEG. The effect of high and lox Dk/L soft contact lenses on the glycocalix layer of the corneal epithelium and on the membrane associated receptors for lectins. CLAO J 199723185-191.
31. Imayasu M, Petroll WM, Jester JV, et al. The relation between contact lens oxygen transmissibility and binding of Pseudomonas aeruginosa to the cornea after overnight wear. Ophthalmology 1994;101:371-388.
32. Durán JA, Refojo MF, Kenyon KR. Hydrogel contact lens induced Pseudomonas keratitis in a rabbit model. Cornea 1987;6:258-260.
33. Reichert R, Stern G. Quantitative adherence of bacteria to human corneal epithelial cells. Arch Ophthalmol 19841021221-1225.
34. Lawin-Bruessel CA, Refojo MF, Leong FL et al. Scanning electron microscopy of the early host inflammatory response in experimental Pseudomonas keratitis and contact lens wear. Cornea 199514355-359.
35. Galentine PG, Cohen EJ, Laibson PR et al. Corneal ulcers associated with contact lens wear. Arch Ophthalmol 1984102891-894.
36. Alfonso E, Mandelbaum S, Fox MJ et al. Ulcerative keratitis associated with contact lens wear. Am J Ophthalmol 1986101429-433.
37. Wilson LA, Ahearn DG. Association of fungi with extended wear soft contact lenses. Am J Ophthalmol 1986101434-436.
38. Morel C, Harrabi S, Chaumeil C et al. Prelevements corneens positifs a Propionibacterium acnes et keratitis. J Fr Ophtalmol 1996 194-7.
39. McLeod SD, Goei SL, Taglia DP, et al. Nonulcerating bacterial keratitis associated with soft and rigid contact lens wear. Ophthalmology 1998105517-521.
40. Stapleton F, Dart JK, Minassian D. Risk factors with contact lens related suppurative keratitis. CLAO J 199319204-210.
41. McLeod SD, Koladouz-Isfahani A, Rostamian K et al. The role of smears, cultures and antibiotic sensitivity testing in the management of suspected infectious keratitis. Ophthalmology 199610323-28.
42. Rodman RC, Spisak S, Sugar A, et al. The utility of culturing corneal ulcers in a tertiary referral center versus a general ophthalmology clinic. Ophthalmology 19971041897-1901.
43. Levey SB, Katz HR, Abrams DA et al. The role of cultures in the management of ulcerative keratitis. Cornea 199716383-386.
44. Cohen EJ, Laibson PR, Arentsen JJ et al. Corneal ulcers associated with cosmetic extended wear soft contact lenses. Ophthalmology 198794109-114.
45. Wilhelmus KR. Review of clinical experience with microbial keratitis associated with contact lenses. CLAO J 198713211-214.
46. Leibowitz HM. Clinical evaluation of ciprofloxacin 0’3% ophthalmic solution for treatment of bacterial keratitis. Am J Ophthalmol 1991 112S34-S47.
47. O’Brien TP, Maguire MG,Fink NE et al. Efficacy of ofloxacin vs cefazolin and tobramycin in the therapy for bacterial keratitis. Arch Ophthalmol 1995 1131257-1265.
48. Donnenfeld ED. Discussion comparison of ciprofloxacin ophthalmic solution 0’3% to fortified tobramycin-cefazolin in treating bacterial corneal ulcers. Ophthalmology 1996 1031854-1863.
49. McLeod SD, LaBree LD, Tayyanipour R et al. The importance of initial management in the treatment of severe infectious corneal ulcers. Ophthalmology 19951021943-1948.
50. Leibowitz HM, Kupferman A. Topically administered corticosteroids. Effect on antibiotic-treated bacterial keratitis. Ophthalmology 1980981287-1290.
51. Weissman BA, Mondino BJ. Is daily wear better than extended wear Arguments in favor of daily wear. CLAO J 19909S25-S27.
52. Stern GA. Contact lens assoiated bacterial keratitis past, present and future. CLAO J 19982452-56.
53. Schein OD. Contact lens abrasions and the nonophthalmologist. Am J Emerg Med 1993 11606-608.