
7
EFECTOS DE LAS LENTES DE CONTACTO SOBRE LA LÁGRIMA
7
Juan Murube, Lucía ChenZhuo , Enrique Murube, Carlos Montoya
![]() INTRODUCCIÓN
INTRODUCCIÓN
![]() LA CUENCA Y EL MAR LACRIMAL
LA CUENCA Y EL MAR LACRIMAL
![]() CAMBIOS DEL MAR LACRIMAL POR LENTES DE CONTACTO
CAMBIOS DEL MAR LACRIMAL POR LENTES DE CONTACTO
![]() VOLUMEN DEL MAR LACRIMAL
VOLUMEN DEL MAR LACRIMAL
![]() CANTIDAD DE SECRECIÓN LACRIMAL
CANTIDAD DE SECRECIÓN LACRIMAL
![]() ELIMINACIÓN LACRIMAL
ELIMINACIÓN LACRIMAL
![]() DIÓPTRICA LACRIMAL
DIÓPTRICA LACRIMAL
![]() TEMPERATURA DEL MAR LACRIMAL
TEMPERATURA DEL MAR LACRIMAL
![]() pH DEL MAR LACRIMAL
pH DEL MAR LACRIMAL
![]() PRESION OSMÓTICA
PRESION OSMÓTICA
![]() TENSIÓN SUPERFICIAL DEL MAR LACRIMAL
TENSIÓN SUPERFICIAL DEL MAR LACRIMAL
![]() ISLOTES DE DESECACIÓN Y
TISC/BUT
ISLOTES DE DESECACIÓN Y
TISC/BUT
![]() AGRESION A LA SUPERFICIE OCULAR Y A LAS
DACRIOGLÁNDULAS POR LAS LENTES DE CONTACTO
AGRESION A LA SUPERFICIE OCULAR Y A LAS
DACRIOGLÁNDULAS POR LAS LENTES DE CONTACTO
![]() OXIGENACIÓN DE LA LÁGRIMA
OXIGENACIÓN DE LA LÁGRIMA
![]() LENTES DE CONTACTO Y COMPONENTES LACRIMALES
LENTES DE CONTACTO Y COMPONENTES LACRIMALES
![]() DEPÓSITOS
DEPÓSITOS
![]() MEDICAMENTOS Y LÁGRIMA
MEDICAMENTOS Y LÁGRIMA
![]() LENTILLAS, LÁGRIMA Y AMBIENTE
LENTILLAS, LÁGRIMA Y AMBIENTE
![]() LÁGRIMAS ARTIFICIALES
LÁGRIMAS ARTIFICIALES
![]() CIRUGÍA DEL OJO SECO
CIRUGÍA DEL OJO SECO
![]() LENTILLAS DE CONTACTO COMO TRATAMIENTO DEL OJO SECO
LENTILLAS DE CONTACTO COMO TRATAMIENTO DEL OJO SECO
![]() 1. INTRODUCCIÓN
1. INTRODUCCIÓN
La lágrima apareció en los vertebrados terrestres para formar una película lisa que cubriese las irregularidades del epitelio corneal y permitiese una refracción óptica regular. Simultánea o posteriormente comenzó a cumplir otras muchas misiones, que aunque inicialmente secundarias, se han hecho imprescindibles: lubricante, nutriente, antimicrobiana, limpiadora, etc. Indirectamente, la lágrima ejerce otras funciones como tamponadora, antialérgica, aclarante, fibrinolítica, fotoabsorbente, histolítica, etc., sin estar claro en la mayoría de los casos si es una acción con finalidad biológica o es un hecho accidental.
La superficie ocular mantiene su complejo equilibrio fisiológico en presencia de la lágrima, con la que forma un todo. La inmersión de una lente de contacto (LC) en este complejo sistema rompe el equilibrio preexistente.
Si se compara el complejo superficie ocular/película lacrimal/aire con un lago poco profundo, la LC es como un barco hundido cuyo casco toca el fondo y cuya cubierta sobresale en la superficie y es cubierta intermitentemente por el oleaje.
![]() 2. LA CUENCA Y EL MAR LACRIMAL
2. LA CUENCA Y EL MAR LACRIMAL
Se denomina cuenca lacrimal al saco formado entre la superficie anterior del ojo y la superficie posterior de los párpados. En la cuenca lacrimal vierten sus secreciones las 3 variedades de dacrioglándulas: glándulas lacrimales acuosas, células caliciformes mucíparas, y glándulas lípidas.
Se denomina mar lacrimal al contenido líquido de la cuenca lacrimal (Figura 1). El mar lacrimal tiene una porción subpalpebral y otra expuesta. La parte expuesta tiene un componente meniscal que rodea el margen palpebral (cisterna, rivus superior, rivus inferior y lago lacrimales) y un componente prebulbar que cubre la córnea y los trígonos conjuntivales medial y lateral (películas precorneal y preconjuntival).
La película lacrimal prebulbar está formada por un estrato anterior, lípido, de 0’25 mm de espesor; un estrato medio, acuoseroso, que oscila entre 6 y 30 mm; y un estrato posterior, mucínico, de 0’03 mm. Este estrato mucínico se adhiere al glycocalix o mucina epitelial que forma parte de la membrana externa de las células epiteliales superficiales.
El estrato lípido de la lágrima, que sólo cubre la superficie ocular expuesta, constituye el 0’02% del volumen de ella, y se forma en el borde palpebral por las glándulas de Meibomio y, en menor proporción, por las glándulas de Zeis y de Moll y por las glándulas lípidas carunculares. El estrato acuoseroso es el 99’78 % del volumen de la película lacrimal, y se forma en las glándulas lacrimales principales y accesorias. El estrato mucínico –que es el más fino, pero el más extenso de los 3 estratos-, es el 0’20 % del volumen lacrimal, y se forma en las células caliciformes de la superficie conjuntival. Tras esta mucina conjuntival está el glycocalix.
![]() 3. CAMBIOS DEL MAR LACRIMAL POR
LENTES DE CONTACTO
3. CAMBIOS DEL MAR LACRIMAL POR
LENTES DE CONTACTO
Cuando se inserta una LC sobre la córnea, la lentilla –pese a tener mucho más espesor que la película lacrimal- queda sumergida en el mar lacrimal porque éste modifica su estructura. En las lentillas de diámetro corto, toda ella queda en el mar expuesto, salvo a veces un pequeño segmento superior que queda cubierto por el borde del párpado superior. En las lentillas de diámetro largo, sus segmentos superior e inferior quedan permanentemente bajo los respectivos párpados. En ambos tipos de LC, a cada parpadeo, toda la lente pasa momentáneamente a ser cubierta por los párpados.
La inmersión de una LC en el mar lacrimal altera grandemente el equilibrio preexistente, casi siempre con repercusiones de escasa trascendencia clínica, pero ocasionalmente con alteraciones importantes. |
El mar lacrimal, cuando se coloca en él una LC, se descompone en una película prelental, una película retrolental, un menisco circumlental, y un contenido intralental.
La película prelental carece inicialmente de estrato mucínico, hasta que el parpadeo repetido extiende mucina conjuntival sobre la lente. Obviamente, siempre faltará glycocalyx en este estrato, puesto que el glycocalyx es una parte de la membrana celular epitelial. El estrato acuoso adquiere un espesor de 2 a 5 mm, mayor en las lentes hidrofílicas que en las duras. El estrato lípido de la película prelental es más fino que en el ojo natural, y muy inestable.
En el ojo sin LC, el fenómeno de las irisaciones interferenciales puede ser observado en el estrato lípido de la película lacrimal debido a su escaso espesor, y a la regularidad de sus superficies anterior y posterior. La capa acuosa de la película sin lentilla no produce irisaciones debido a que su superficie posterior es muy irregular por cubrir el epitelio córneo-conjuntival, que es anfractuoso y refleja la luz diversamente. Sin embargo, cuando se coloca en el ojo una LC, la película acuosa que queda ante ella sí puede producir irisaciones interferenciales, dado que esta película queda limitada por dos interfases lisas.
La película retrolental carece de estrato lípido. Su estrato acuoso tiene un espesor muy variable, entre 3 y 50 o más mm, en las lentillas rígidas y semirrígidas; y un espesor de aproximadamente 3 mm en las lentillas blandas. Su estrato mucínico es rico en glycocalix, pero escaso en mucina conjuntival, especialmente en las lentillas blandas, en las que el recambio lacrimal retrolental es escaso. Las células descamadas del epitelio situado bajo las lentillas quedan retenidas en las lentillas blandas por su escasa movilidad y por la falta de arrastre del parpadeo; estas células son parcialmente eliminadas en las lentillas rígidas, arrastradas por la circulación retrolental por bombeo.
Alrededor de la LC se forma un menisco circumlental anular de lágrima, limitado periféricamente por un adelgazamiento de la película lacrimal, similar al adelgazamiento de McDonald-Brubaker (1) paralelo a los meniscos lacrimales palpebrales. Al colocar una LC, el menisco lacrimal circumlental se forma rápidamente tomando lágrima de la película prebulbar y de los meniscos palpebrales, los cuales enseguida se repondrán con la lágrima de secreción refleja inducida por la colocación de la lentilla.
La longitud circunferencial del menisco circumlental es de:
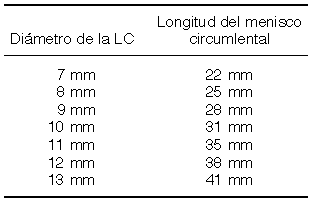
La altura del menisco depende de la del borde de la lentilla. La concavidad de la superficie del menisco en contacto con el aire tiene un radio de curvatura que depende de los siguientes parámetros: tensión superficial del líquido del mar lacrimal (lágrima natural, líquidos conservantes, lágrimas artificiales), tensiones superficiales críticas del material de la lentilla, y de la superficie ocular subyacente al menisco, altura del borde de la lentilla, y aire. Para una lentilla de 7 mm de diámetro, si el borde de la lentilla mide 50, 100 ó 200 mm de espesor, el volumen del menisco circumlental será aproximadamente de 0’025, 0’1 y 0’4 ml respectivamente. Para una LC de 13 mm de diámetro, si el borde mide 50, 100 ó 200 mm de espesor, el volumen del menisco circumlental será aproximadamente de 0’05, 0’2 y 0’8 ml respectivamente. Estas cifras son aproximadas y variarán dependiendo de los valores de los distintos parámetros en consideración, tales como tensión superficial de la lágrima y energías de superficie del epitelio y la LC.
La lágrima intralental es la que queda en el interior de las lentillas hidrofílicas y porosas. Si se considera una lentilla HEMA de 12 mm de diámetro y 50 mm de espesor -por tanto con un volumen de 5’6 mm3-, si su contenido en agua es del 50%, contiene 2’8 ml del fluido. En el momento de insertar una LC, ésta está imbibida del líquido conservante, el cual paulatinamente irá siendo substituido por la lágrima del portador; sin embargo, tras un porte de 16 horas todavía queda parte del líquido conservante, y en lentillas de porte continuado, aún quedan trazas de él a los 10 días de su uso.
El volumen de líquido de una lentilla HEMA disminuye aproximadamente un 1-2 % entre el momento de inserción y el de remoción varias horas después, lo que parece estar ligado a un ligero aplastamiento mecánico de la lente y no a fuerzas físico-químicas intrínsecas.
Al retirar una LC, la película lacrimal prebulbar se reconstruye rápidamente, con algunas características anormales iniciales, que se irán normalizando paulatinamente. El epitelio que había estado cubierto por la lentilla tiene un glycocalix deficiente, carece de mucina caliciforme y contiene células epiteliales descamadas retenidas; el parpadeo limpia y reconstruye paulatinamente este estrato. El estrato acuoso se reforma por una hipersecreción inicial producida reflejamente por el acto de la remoción. El estrato lípido también se reforma, primero con un patrón amorfo, que se normaliza en unos minutos.
Tras la retirada de una lente de contacto quedan modificaciones en la superficie corneal caracterizadas por un glycocalix deficiente, ausencia de mucina y retención de células descamadas. |
![]() 4. VOLUMEN DEL MAR LACRIMAL
4. VOLUMEN DEL MAR LACRIMAL
El volumen medio del mar lacrimal sin lentilla es de 10 ml, incluyendo la lágrima subpalpebral, la meniscal y la película prebulbar.
Cuando se coloca en un ojo una lentilla dura, ésta no se adapta a las irregularidades corneales y crea una cámara retrolental tanto mayor cuanto mayor es la diferencia de radios de curvatura entre la superficie posterior de la lentilla y la superficie anterior de la córnea, y cuanto mayor es el astigmatismo corneal. Esto, sumado al menisco circumlental, incrementa el mar lacrimal, que puede alcanzar los 15 ml y aún más. Cuando se coloca una LC blanda, la cámara retrolental suele ser menor que la de la lentilla dura, el menisco circumlental mayor, y el contenido intralental pasa a formar parte del mar lacrimal, de manera que el volumen total del mar lacrimal puede superar los 15 ml. Winder y cols., en 1977 (2) publicaron en ojos con LC blandas un volumen de 70 ml o más, lo que en portadores con buena tolerancia nos parece inusual.
Roth (3) ha observado recientemente que los portadores de LC que tienen ojo seco pierden las lentillas más frecuentemente que los que tienen secreción lacrimal normal. Pensamos que esto puede deberse a que las fuerzas capilares disminuyen por la escasez de mar lacrimal, y resultan a veces incapaces de superar las fuerzas de roce del parpadeo -que a su vez están aumentadas-, y como consecuencia la lentilla se desplaza. Por otra parte, el paciente de ojo seco tiene molestias que le llevan a frotar a veces sus párpados, y facilitan el desplazamiento y pérdida de la lentilla.
![]() 5. CANTIDAD DE SECRECIÓN LACRIMAL
5. CANTIDAD DE SECRECIÓN LACRIMAL
La secreción lacrimal normal ronda en cada ojo 1’5 ml por día. Tiene fluctuaciones diarias, y es mínima durante la noche. Cuando se coloca una lentilla corneal, aparece de inmediato una hipersecreción lacrimal refleja que está provocada por la manipulación del ojo y por el contacto de la lentilla. Esta hipersecreción reactiva es menor en portadores habituados y hábiles que en los inexpertos. Como la cuenca lacrimal necesita mayor volumen de mar lacrimal cuando tiene una lentilla, toda o parte de esta hipersecreción inicial es retenida por la lentilla (menisco circumlental, película retrolental, etc.). Si la hipersecreción reactiva es mínima y no llega a cubrir el incremento requerido por la lentilla, la producción normal inicial es retenida por la lentilla en detrimento de la eliminada por las vías lacrimales, hasta que se completan las necesidades de una cuenca lacrimal con lentilla.
Si la lentilla recién colocada no irrita el ojo y por tanto no produce una lacrimación refleja, el ojo pasa paulatina pero rápidamente a tener una ligera disminución de la secreción. Dos factores son bien conocidos para esta hiposecreción: 1) la disminución del estímulo del frote del parpadeo sobre la superficie anterior del ojo, y 2) la isotermización de la lágrima que cubre la córnea. Además, es frecuente que se desarrolle una hipoestesia corneal ligera, que es más marcada con las lentillas duras que con las blandas, y que parece debida a la habituación sensorial, al agotamiento de los sensorreceptores y al ligero sufrimiento metabólico de las terminaciones nerviosas. Si a ello se añade que el portador de LC suele tener una anormalidad de la capa lípida, una hiperproducción mucínica, un epitelio desequilibrado y una ausencia de contacto del párpado con la superficie corneal, los cinco posibles componentes deficitarios de la clasificación "amlei" de ojo seco (acuoso, mucoso, lípido, epiteliopatía, incongruencia párpado/globo) (4) están alterados, por lo que un cierto grado de ojo seco es una manifestación frecuente en el portador crónico de LC.
En el portador de lentes de contacto se encuentran alterados los cinco posibles componentes deficitarios del ojo seco: acuoso, mucoso, lípido, epiteliopatía e incongruencia párpado/globo. |
El ojo portador habitual de LC desarrolla a veces una hipersecreción lacrimal por irritación (mecánica por roce, alérgica por detritos, tóxica por líquidos de limpieza y conservación, etc.). Puede ocurrir esto en ojos previamente algo secos, en cuyo caso esta hipersecreción reactiva puede enmascarar el estado de hiposecreción que existiría sin lentillas.
![]() 6. ELIMINACIÓN LACRIMAL
6. ELIMINACIÓN LACRIMAL
La eliminación del mar lacrimal se hace por deflujo por la vía lacrimal, por evaporación y por absorción a través de la superficie ocular. Es posible que, en el portador de LC, el calentamiento corneal y la homotermización de la córnea (falta de variaciones de temperatura al parpadear) influyan disminuyendo el número de parpadeos, y con ello la eliminación de lágrima hacia la vía lacrimal cuando la cantidad de lacrimación es normal. Cuando hay sobreproducción, esta vía es la que elimina el sobrante lacrimal.
La evaporación del mar lacrimal fue cuantificada por Schirmer en 1903, (5) en 0’27 g diarios. Hoy se sabe que en una película lacrimal normal, en ambiente de 40% de humedad, se evaporan 0,05 -0,07 ml/min/cm2, lo que considerando una superficie ocular expuesta del ojo en posición primaria de la mirada de 2 cm2, corresponde aproximadamente al 10 % de la lágrima que se produce.
La evaporación de lágrima está incrementada durante el porte de lentes de contacto, más aún cuando el ritmo de parpadeo disminuye. |
En el ojo portador de LC, la evaporación lacrimal aumenta en parte porque la capa lípida prelental y la de las zonas no cubiertas por la lente son escasas e inestables (6, 7). Además, los portadores crónicos de lentillas suelen desarrollar una disfunción meibomiana (con blefaritis) que empeora la secreción lípida.
El aumento de superficie del mar lacrimal expuesto al aire por llevar lentillas también influye en la mayor evaporación. Por ejemplo, con una lentilla de 8 mm de diámetro, espesor medio de 300 mm y espesor de bordes de 100 mm, la superficie expuesta aumenta en 15 mm2, lo que supone un incremento del 7’5% sobre la superficie expuesta del ojo sin lentilla. Este aumento de superficie se debe al mayor radio de curvatura de la superficie de la película lacrimal del complejo córnea-LC, y a la mayor superficie del menisco circumlental.
![]() 7. DIÓPTRICA LACRIMAL
7. DIÓPTRICA LACRIMAL
La principal función de la lágrima fue inicialmente la de formar una película delgada, de superficie muy lisa por la tensión superficial de la lágrima, que facilitase la refracción del ojo de los vertebrados en el medio aéreo. De no existir la película lacrimal, las irregularidades de la superficie anterior de la córnea, cuyo epitelio está en permanente proceso de descamación, determinarían una imagen retiniana más imperfecta.
Cuando un rayo luminoso que atraviesa un medio llega a la superficie de separación con otro medio, el rayo es parcialmente transmitido a este segundo medio y parcialmente reflejado hacia el primer medio. La proporción en que intervienen cada una de estas posibilidades depende del ángulo de incidencia de la luz, del índice de refracción de los dos medios, de la longitud de onda de la luz y del grado y orientación de polarización de la luz. Cada uno de estos rayos es atenuado en los distintos medios a lo largo de su recorrido.
Cuando la luz natural encuentra el ojo de un vertebrado terrestre, la primera superficie con la que tropieza es la película lacrimal. La gran diferencia entre el índice de refracción del aire (1’000) y el de la lágrima (1’334) hace que la mayoría de la refracción del ojo se produzca aquí. La pequeña diferencia de índice de refracción entre la lágrima y la córnea (1’376) hace jugar a esta segunda interfase un menor papel refractivo. Cuando un sujeto tiene colocada una lentilla de contacto, estas proporciones varían; por ejemplo, una lentilla de contacto de PMMA, cuyo índice de refracción es 1’490, hace que esta segunda interfase tenga aún un menor papel. El efecto refractivo total de la superficie ocular será la suma del producido en las 4 interfases: aire-lágrima prelental, lágrima prelental-lentilla, lentilla-lágrima retrolental y lágrima retrolental-córnea.
Por otra parte, tiene gran importancia el efecto dióptrico de la lágrima retrolental debido no ya a su índice de refracción, sino a su forma (8, 9). Una LC blanda se adapta grosso modo a la superficie corneal, haciendo que la forma de la lágrima retrolental sea equivalente a una lente plana. Pero las lentillas duras y semirrígidas forman una "lente" de lágrima retrolental, que será negativa (o de equivalente cóncavo) si la curvatura de la LC es más plana que la de la córnea, y que será positiva (o de equivalente convexo) si la curvatura de la LC es mayor que la de la córnea (Figura 2). Esta "lente" de lágrima retrolental suma su potencia a la de la LC, de forma que para obtener la graduación emetropizante la lentilla debe tener una potencia distinta a la inicialmente prevista por la graduación con gafas o con lentillas de distinta curvatura.
Otro tema a mencionar es el de los astigmatismos irregulares. Estos son corregidos muy imperfectamente con lentes de gafas, pero son aceptablemente corregidos con LC, ya que la lágrima retrolental rellena las irregularidades de la superficie anterior de la córnea, y debido al parecido índice de refracción de la lágrima y la córnea, minimiza el indeseado efecto refractivo de la irregularidad corneal.
![]() 8. TEMPERATURA DEL MAR LACRIMAL
8. TEMPERATURA DEL MAR LACRIMAL
El már lacrimal tiene una temperatura que es el resultado del calor que recibe de los tejidos de la cuenca lacrimal y del que pierde por su contacto con la atmósfera y por la evaporación. Ya a finales del siglo pasado se calculó que el mar lacrimal tenía una temperatura de 35º (5, 10), y por ello, ésta era la temperatura que se recomendaba hace un siglo que tuviesen los colirios.
Con métodos termográficos más precisos, hoy se sabe que en situación de normalidad fisiológica del paciente, en ambiente de 24º sin viento y con humedad relativa del 40%, la temperatura de la lágrima subpalpebral fornicial es 35º; la de la subpalpebral marginal, 34’5º; la de la cisterna y lago lacrimales, 34º-34’5º; la de los meniscos lacrimales, 33º; la del limbo yuxtatrigonal, 32’5º, la de los trígonos conjuntivales, 32’5-32º, y la del vértex corneal, 32º (Figura 3). A veces hay una ligera asimetría térmica, por algunas décimas de grado más en el ojo derecho que en el izquierdo (11). En el momento del parpadeo, la temperatura de la córnea sufre un incremento de 1 a 2º.
Cuando se coloca una lentilla, ésta provoca un efecto invernadero, y las temperaturas de la lágrima retrolental y de la superficie corneal suben aproximadamente 1º, pasando a 33-34º. La termoconducción de cada tipo de material es distinta; así, las lentillas de silicona son muy termoconductoras, y por tanto, menos hipertermizantes.
La moderada hipertermia provocada por las lentillas tiene escaso efecto en el metabolismo epitelial corneal, en el crecimiento microbiano y en la desnaturalización de los depósitos proteicos. La isotermización de la lágrima retrolental y de la superficie anterior de la córnea sí tiene un mayor efecto en el funcionalismo lacrimal, pues provoca una disminución de la secreción lacrimal refleja y del parpadeo.
![]() 9. pH DEL MAR LACRIMAL
9. pH DEL MAR LACRIMAL
El pH de la lágrima normal es de 7’47 en horas de vigilia (12). Durante las horas de sueño baja a 7’30, debido a la retención parcial del CO2 eliminado por la superficie ocular. El sistema tampón de la lágrima es bastante débil. Los cambios moderados de pH por cualquier razón no se han mostrado incómodos para el porte de LC (13).
Hace más de medio siglo, von Györffy (14) encontró con las lentillas de apoyo escleral hechas de cristal o de resinas artificiales que se usaban entonces, que el líquido con que se rellenaba el espacio entre la lentilla y la córnea se acidificaba por la eliminación corneal de CO2. No ocurre lo mismo con las actuales LC, que eliminan rápidamente el CO2 por bombeo o por diaforesis translental, y no alteran el pH lacrimal; por ello, cuando se coloca una LC el pH no suele modificarse.
![]() 10. PRESION OSMÓTICA
10. PRESION OSMÓTICA
La presión osmótica de la lágrima normal es de 300-310 mOsm/l. Durante el sueño desciende para acercarse a la del suero (290 mOsm/l) En el portador de LC la presión osmótica desciende algo, al menos durante los primeros días (15). Probablemente, el principal condicionante sea la hiperlacrimación refleja.
Los portadores habituales de LC tienen una osmolaridad lacrimal normal durante el porte, aunque la mayor evaporación lacrimal y el moderado descenso de la secreción refleja harían suponer que su osmolaridad estaría aumentada. No se ha encontrado explicación a este hecho, lo que lleva a pensar que algunos de los conceptos actuales deben someterse a revisión.
![]() 11. TENSIÓN SUPERFICIAL DEL MAR
LACRIMAL
11. TENSIÓN SUPERFICIAL DEL MAR
LACRIMAL
La tensión superficial de la fase acuoserosa de la lágrima es de aproximadamente 39 dinas/cm. Para que se pueda extender sobre una superficie sólida es necesario que la energía superficial del sólido sea superior a 39 dinas/cm. Por ello, la lágrima se extiende fácilmente sobre las lentillas hidrofílicas HEMA (hidroxietilén-metacrilato) y ABC (acetato-butirato de celulosa), cuya tensión superficial crítica es muy alta; se extiende en un equilibrio muy inestable sobre las lentillas duras PMMA (poli-metil-metacrilato), cuya tensión superficial crítica es de 39 dinas/cm; y no se extiende sobre las lentillas de silicona hidrófoba, cuya tensión superficial crítica es de 19-21 dinas/cm. La dacriofilia de las lentillas HEMA disminuye con el uso por la lipofilia de este material, que hace que se cubran fácilmente de colesterol y otros ésteres de la capa lípida de la película lacrimal y bajen su tensión superficial crítica a 30 dinas/cm, haciéndose dacriófobas.
Al principio de insertar una LC de silicona o de PMMA, el inestable equilibrio de la película lacrimal prelental hace que aparezcan rápidamente islotes de desecación en la superficie anterior de la lente. Cuando el parpadeo consigue que la mucina conjuntival quede adsorbida sobre la superficie anterior de la lentilla, esta superficie se hace dacriófíla, de forma que incluso las de silicona, aunque inicialmente rechacen la lágrima, acaban haciéndose mojables.
![]() 12. ISLOTES DE DESECACIÓN Y
TISC/BUT
12. ISLOTES DE DESECACIÓN Y
TISC/BUT
El TISC (Tempus Initii Siccitatis Corneae: tiempo de inicio de la desecación corneal) o BUT (Break-up Time: tiempo de ruptura) es el tiempo transcurrido entre un parpadeo y la aparición del primer islote de desecación en la película lacrimal precorneal. Los valores claramente normales están sobre 21 segundos. Valores entre 21 y 15 segundos pueden ser dudosos; entre 14 y 8 segundos, indican una cierta inestabilidad de la película lacrimal; y bajo 7 segundos, una clara alteración.
Sobre la lentilla aparecen islotes de sequedad antes que sobre el epitelio corneal sin lentilla. Se debe ello principalmente al menor espesor de la película prelental en relación con la película lacrimal normal, a la mayor evaporación acuosa relativa a través de la capa lípida, y a la menor dacriofilia de la superficie lental anterior en comparación con el epitelio corneal sano.
A ello se añade la posible succión que ejerce un menisco circumlental deficitario (16) que presenta una curvatura mayor, y por lo tanto, para recuperar la curvatura de equilibrio ejerce una fuerza que succiona líquido de las inmediaciones, facilitando los islotes de desecación sobre la lentilla. Es característico de los islotes inducidos por un menisco circumlental deficitario no sólo su aparición precoz, sino que se localizan en la periferia media de la lentilla, con mayor frecuencia cerca del área de conjunción del menisco circumlental con los meniscos palpebrales, y que se extienden con mayor rapidez que los islotes no relacionados con menisco deficitario.
Cuando la capa acuosa prelental se desplaza para dejar un islote de desecación, la capa lípida no la sigue, de forma que queda depositada sobre la escasa mucina que recubre la lentilla. Si el tiempo que pasa hasta un nuevo parpadeo es corto, la nueva afluencia de componente acuoso vuelve a separar hacia delante la capa lípida, siendo poco el componente lípido que ha interaccionado con el mucoso o que ha quedado adsorbido a la lentilla. Pero si el tiempo es largo, gran parte de la capa lípida quedará adsorbida sobre la lentilla, degradando su superficie, provocando depósitos y haciéndola paulatinamente dacriófoba.
Una vez que se extienden los islotes de desecación y confluyen entre sí dejando la superficie anterior de la lentilla seca, quedan algunas lagunas de película prelental aisladas, que tienden a retraerse y tomar forma gutelar, hasta que por evaporación desaparecen, si un nuevo parpadeo no reconstruye la película lacrimal prelental.
Los islotes de desecación aparecen en todas las lentillas antes que sobre el epitelio corneal normal, especialmente en las de silicona y en las de PMMA. Ocurre esto, en las de silicona, por su hidrofobia (que se atenúa con modificaciones previas de la silicona o al cubrirse de mucina); y en las de PMMA, porque estas lentillas, según decíamos, captan fácilmente la grasa de la película lacrimal, rebajando la tensión superficial crítica de la lentilla bajo 39 dinas/cm y haciéndola dacriófoba (17).
Durante el porte de la LC, el epitelio que queda tras la lentilla no se remucifica. Tampoco lo hace el que queda bajo el menisco circumlental e inmediaciones, pues el relieve de la lentilla impide que el párpado, al parpadear, lo pula y remucifique. Por ello, al quitar la lentilla aparecen con facilidad sobre el epitelio corneal islotes de desecación con TISC/BUT cortos. Cuando la zona desmucificada y con baja tensión superficial crítica coincide con la franja de adelgazamiento de McDonald-Brubaker (1), los islotes de desecación suelen aparecer allí. Después, y conforme el epitelio descamado va siendo arrastrado por el parpadeo, el glycocalix se normaliza, la mucina conjuntival se extiende sobre el glycocalix, y en conjunto se rehace la película lacrimal y se recuperan los valores normales.
Si se correlacionan el espesor del estrato lípido y la estabilidad de la película lacrimal, se ve que aquellos portadores de LC que tienen una capa lípida más gruesa (patrón amorfo en la medición por franjas cromáticas interferenciales) presentan una mayor estabilidad (7).
Algunos contactólogos encuentran que los portadores de LC, aunque lleven varias horas o días sin lentillas, tienen un TISC/BUT algo más corto que los no portadores, y piensan que ello puede deberse a que presentan una sensibilidad corneal algo disminuida, por lo que parpadean menos, lo que favorece la ruptura de la película lacrimal.
El tiempo de rotura de la película lagrimal precorneal siempre es más corto en portadores de lentes de contacto por: mayor hidrofobia de la lente, modificación de las capas de la película, menor espesor de la película y succión de lágrima desde el menisco circumlental. |
El TISC/BUT es una de las pruebas que algunos consideran imprescindibles durante el estudio de adaptación de LC (18), pero otros le dan poco valor, por depender de multitud de factores y por su gran variabilidad.
![]() 13. AGRESION A LA
SUPERFICIE OCULAR Y A LAS DACRIOGLÁNDULAS POR LAS LENTES DE CONTACTO
13. AGRESION A LA
SUPERFICIE OCULAR Y A LAS DACRIOGLÁNDULAS POR LAS LENTES DE CONTACTO
Los portadores crónicos de LC desarrollan paulatinamente una epiteliopatía corneo-conjuntival, una conjuntivitis y una blefaritis (19). Esto significa que de las tres variadades de dacrioglándulas (acuosas, mucínicas y lípidas), las dos últimas se afectan.
El daño de las LC sobre las células madres limbales se manifiesta en queratitis punctata y queratitis límbica superior (20,21) y en epiteliopatía corneal en vórtice (22). El epitelio limbal disminuye su tasa de replicación de células madres, lo que se manifiesta en una minusvalía del epitelio conjuntival (23). Desde que se piensa que en el limbo también están parte de las células madres del epitelio conjuntival (24), este trastorno hay que suponerlo también en el epitelio conjuntival.
Las dacrioglándulas mucínicas, es decir, las células caliciformes, se sabe desde Virchow en 1910 (25) que suelen aumentar en número y producción en situaciones de irritación conjuntival. Este aumento también ha sido comprobado en portadores de LC. El incremento de mucina lacrimal sólo raramente tiene repercusión clínica.
Las dacrioglándulas lípidas, es decir, las glándulas de Meibomio y en menor medida las de Zeis y Moll, se alteran, modificando el estrato mucoso de la película lacrimal.
Las lentillas pueden dañar la superficie ocular por agresión mecánica (abrasión por frote, daño con el borde), hipoxia (sufrimiento celular, edema epitelial y ectocorneal), alergia (conjuntivitis folicular, conjuntivitis papilar gigante, queratoconjuntivitis límbica superior, disfunción meibomiana, etc.) o agresión química por las soluciones de las lentes (26). A estas causas propuso uno de nosotros (27) añadir la de succión meniscal, por la presión negativa que ejerce el menisco circumlental, cuando es deficitario, sobre las células epiteliales que cubre:
• En un ojo portador de LC, alrededor de la lentilla se forma un menisco lacrimal. La curvatura de equilibrio de la superficie en contacto con el aire de este menisco es cóncava, y depende de diversos factores tales como la composición de la lágrima, el material de la lentilla, la altura del borde de la lentilla, y la energía de las superficies sólidas en juego. Cuando la cantidad de lágrima es la adecuada, la superficie cóncava del menisco tiene una curvatura de equilibrio para las características de la lágrima y las superficies sólidas que la limitan. Cuando la cantidad de lágrima es muy abundante por producción excesiva o por obstrucción de la vía evacuadora, la superficie al aire del menisco se hace menos cóncava, o incluso momentáneamente plana o convexa, pues las fuerzas capilares no son suficientes para mantener este volumen de lágrima, y por lo tanto, el exceso de menisco es drenado por acción de la fuerza gravitatoria y el parpadeo, hasta recuperar el menisco su curvatura normal. Por el contrario, cuando la cantidad de lágrima es deficitaria (Figura 4), la superficie aérea del menisco circumlental es más cóncava que la curvatura de equilibrio, lo que produce una disminución de la presión dentro del menisco, originando así un flujo convergente hacia el menisco, que atrae hacia él lágrima de las inmediaciones (lágrima prelental, lágrima retrolental, película lacrimal prebulbar). Este fenómeno lo hemos comprobado experimentalmente con trazadores en sistemas modelos que permiten visualizar el flujo inducido por meniscos deficitarios. Esta presión de succión altera el equilibrio metabólico de las células de la superficie epitelial, y las daña allí donde se ejerce con intensidad suficiente.
Se ha cuantificado esta presión de succión del menisco deficitario, y se ha determinado sobre datos teóricos (Paterson, comunicación personal):
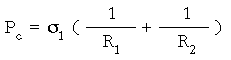
donde Pc es la presión capilar; _1 es la tensión superficial de la película lacrimal; y R1 y R2 son los radios principales del menisco (R1, el perpendicular al borde de la lentilla, y R2, el concéntrico a la circunferencia de la lentilla).
Al producirse la evaporación, la superficie del menisco aumenta, y con ello, la Pc.
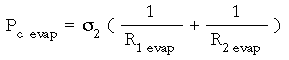
Suponemos que s1 = s2 , o sea, que la evaporación no produce cambios de tensión superficial antes (s1) y después (s2) de producirse. También suponemos que:
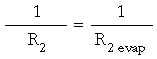
Veamos en cuánto varía la presión (?P):
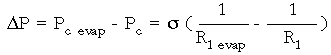
Escribimos:
![]()
es decir, es igual a R1 menos un e (e es el % de variación) de R1
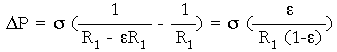
Si e = 0,1, o sea, R1 evap = 10% R1 (el radio varió un 10%)
![]()
![]() 14. OXIGENACIÓN DE LA LÁGRIMA
14. OXIGENACIÓN DE LA LÁGRIMA
La superficie ocular recibe el oxígeno necesario para su metabolismo en parte de la sangre de los capilares circundantes (que lo toma del aire pulmonar), y en parte de la película lacrimal (que lo toma directamente del aire). Cuando sobre la córnea se coloca un impedimento para la llegada del oxígeno, el rico metabolismo aerobio de las células epiteliales se resiente, el metabolismo anaerobio resulta insuficiente, y aparecen un sufrimiento epitelial y un edema corneal.
El oxígeno es aproximadamente la quinta parte de la composición del aire (21% de oxígeno, 79% de nitrógeno). Por ello, si la presión atmosférica es de 760 mmHg, la presión parcial de oxígeno (pO2) del aire es de 159 mm Hg. Esta es aproximadamente la pO2 de la película lacrimal normal cuando los ojos están vigiles y abiertos; durante el sueño, la pO2 de la lágrima puede bajar a entre 55 y 35 mmHg, según sea la presión atmosférica ambiental. La pO2 de la película lacrimal puede considerarse uniforme en todo su espesor, pues 1 mm de espesor de agua o de lágrima disminuye sólo 0’001 mmHg la pO2, lo que es despreciable si se considera el reducido espesor de la película lacrimal.
La presión atmosférica y la consiguiente pO2 disminuyen con la altitud geográfica. Así en Manila (a nivel del mar), estos valores son respectivamente de 760 y 159 mmHg; en Madrid (a 650 m de altitud), son de 706 y 148 mmHg; y en ciudad de Méjico (a 2200 m de altitud), de 575 y 120 mmHg. Un avión de pasajeros suele desplazarse a 10.000 m de altitud, pero se presuriza a equivalencias de 3.000 m de altitud, lo que según algunos autores contribuye a que los portadores de LC comiencen a sentir molestias. No obstante, Eng y cols. (28) introdujeron durante 3 horas a portadores de LC blandas en cámara hipobárica a presiones similares a 9.000 m de altitud, y observaron que no se afectaba el porte de lentillas
La hipoxia de la superficie ocular comienza a hacerse clínicamente evidente cuando la pO2 de la película lacrimal baja a 10-20 mmHg. Por ello se ha establecido convencionalmente que la tensión parcial de oxígeno de la lágrima retrolental no debe bajar de 20 mmHg (29).
Las LC duras de PMMA son prácticamente impermeables al O2 (0,000006 ml O2 por cm2/hora/mmHg). Mayor permeabilidad tienen las de ABC (0,0002 ml por cm2/hora/mmHg) y las de HEMA con 40% de agua (0,0003 ml por cm2/hora/mmHg). Las de PVP-co-MMA y el agua tienen casi la misma permeabilidad (0,003 ml por cm2/hora/mmHg). Las de silicona hidrófoba son muy permeables al oxígeno (0,02 ml por cm2/hora/mmHg).
El mecanismo por el que la película lacrimal retrolental adquiere su contenido de oxígeno es de dos tipos. En las lentillas duras de PMMA, el movimiento de deslizamiento y balanceo de la lentilla bombea lágrima circumlental (que está cargada de oxígeno) al espacio retrolental. En las lentillas blandas de hidrogel y silicona, que tienen muy poca movilidad sobre la córnea, el oxígeno llega por difusión a través de la lentillas , pero también por recambio lacrimal a partir del menisco circumlental. En las lentillas de ABC ,que son semirrígidas y muy permeables al oxígeno, se comparten ambos mecanismos casi por igual.
La hipercapnia de la superficie ocular del portador de LC, debida a acumulación de CO2 procedente del metabolismo aerobio, tienen poca transcendencia clínica, pues se eliminan fácilmente hacia la lágrima y de ésta a la atmósfera. Más importancia tiene la hiperlactatodacria del metabolismo anaerobio.
![]() 15. LENTES DE CONTACTO Y
COMPONENTES LACRIMALES
15. LENTES DE CONTACTO Y
COMPONENTES LACRIMALES
El sodio y el potasio – cuyos valores en lágrima normal son respectivamente de 133 y de 24 mOsm/l- aumentan ambos en la lágrima de los portadores de LC, tal vez por el agravio que la lentilla hace al epitelio de la superficie ocular o por un bombeo electrolítico sobre córnea y conjuntiva.
El calcio –cuyo valor en lágrima normal es de 0’8 mOsm/l- no suele afectarse por el porte de LC, y las ligeras diferencias publicadas son contradictorias, aunque mínimas.
Algunos enzimas del mar lacrimal proceden del epitelio de la superficie ocular, y por ello su exceso en lágrima puede medir el grado de agresión a este epitelio. Se ha intentado evaluar la aceptación de las lentillas por los valores de lactatodeshidrogenasa (EC 1.1.1.27 y 28), pero los resultados no son significantes.
Los portadores de LC con menores niveles de lactoferrina en lágrima tienen más tendencia a desarrollar conjuntivitis papilar gigante que los que los tienen más altos (30).
Se puede afirmar que, en general, la abrasión de los epitelios corneo-conjuntivales aumenta los componentes séricos que se difunden a la lágrima.
![]() 16. DEPÓSITOS
16. DEPÓSITOS
Los depósitos de las LC proceden de algunos componentes lacrimales. Los lípidos (colesterol, ácidos grasos insaturados) oxidan los grupos oxidrilo de la lentilla y la despolimerizan. Los depósitos lípidos varían según los materiales de las lentillas (31); las lentillas más contaminables por lípidos son las de silicona, seguidas de las de hidrogeles.
Los prótidos (aminoácidos, muramidasa, glicoproteínas) se desnaturalizan y dan fácilmente reacciones alérgicas. Los mucínicos (glicoproteínas) suelen englobar células, cuerpos extraños y gérmenes.
El calcio es el mineral más depositado sobre las lentillas, y esto ocurre aunque sus niveles lacrimales se alteran poco. Para que se deposite, parece necesario que la lentilla se haya deteriorado previamente por lípidos, que a su vez captarán el Ca. Según Ruben y cols. (32), la captación de Ca por una LC blanda puede superar los 0’25 mg, depositándose e infiltrándola en forma de carbonato y de fosfato (apatitos).
Algunos productos anormales que se eliminan por la lágrima pueden depositarse en las lentillas, tal es por ejemplo el caso de la rifampicina sistémica, usada como antibiótico en pacientes con tuberculosis y otras infecciones, la cual puede teñir las lentillas de rosa o naranja (33).
Todos los depósitos sobre las lentilla rebajan la transmisibilidad óptica de las mismas.
![]() 17. MEDICAMENTOS Y LÁGRIMA
17. MEDICAMENTOS Y LÁGRIMA
Muchos medicamentos actúan disminuyendo la secreción lacrimal, haciendo que el portador de lentillas de contacto se haga intolerante a ellas; la discontinuación de la medicación devuelva la tolerancia.
17.1. Medicamentos sistémicos
En este grupo se han señalado (34):
Ansiolíticos: Aplakil (oxacepam), Buscopax (oxacepam), Lexatin (Bromazepam), Librium (clordiazepóxido), Tranxilium (clorazepato dipotásico), Valium (diazepam).
Antidepresivos: Tofranil (imipramina), Tryptizol (amitriptilina), Sinogan (levomepromazina).
Antipsicóticos: Clorpromazina (fenotiazínico), Largactil (fenotiazínico), Haloperidol .(butirofenona), Meleril (tioridazina), Nobritol (amitriptilina), Tryptizol (amitriptilina).
Antiparkinsonianos: Akineton (biperideno), Artane (trihexifenidilo), Largatrex (clorpromazina, heptaminol, benzhexol), Madopar (levodopa, benserazida), Simenet.
Antihistamínicos: Atarax (hidroxicina), Celesemine (dexclorfeniramina, flufenazina, betametasona), Fenergan (prometazina), Hismanal (astemizol), Polaramine (dexoclorfeniramina, pseudoefedrina, guayacolato de glicerilo), Zyrtec (cetirizina).
Anticolinérgicos: Atropina, Baralgin (pitofenona, fenpiverinium, dipirona), Buscapina (hioscina), Fortasec (loperamida), Protector (difenoxilato, atropina), Salvacolina (atropina, opio, neomicina, dihidrostreptomicina, tanato de albúmina).
Antihipertensivos arteriales: Aldactone (espironolactona), Aldomet (metildopa), Ameride (hidroclorotiazida, amilorida), Catapresan (clonidina), Higrotona (clortalidona), Minipres (prazosina), Seguril (furosemida).
Diuréticos: Aldactone (espironolactona), Alopresin (captopril), Ameride (hidroclorotiazida, amilorida), Diurex (xipamida), Higrotona (clortalidona), Seguril (furosemida).
Antiestrógenos: Tamoxifeno (tamoxifen).
Tranquilizantes: Mogadon (nitrazepam).
Derivados de la vitamina A. Algunos derivados de la vitamina A, como el ácido 13-cis-retinoico (isoretinoin), el retinilpalmitato, el retinilacetato y el etretinato -o su principal metabolito, la acitretina- se ha reportado que disminuyen las secreciones lacrimales acuosa y meibomiana. El ácido todo-trans-retinoico o ácido de la vitamina A parece ser el único derivado de la vitamina A capaz de mejorar la secreción lacrimal y el metabolismo epitelial corneal.
17.2. Medicamentos tópicos
Algunos medicamentos tópicos pueden desarrollar ojos secos reales o tantálicos por epiteliopatía, que provocan intolerancia a las LC. Entre ellos se han descrito:
Anestésicos: tetracaína, proparacaína, benoxinato, cocaína y lidocaína.
Antimicrobianos: neomicina, anfotericina y iodo-desoxiuridina.
Anticolinérgicos: atropina y su derivado escopolamina.
Alfa-adrenérgicos: noradrenalina, fenilefrina, adrenalina (epinefrina), efedrina, nafazolina,
tetrahidrozolina, orciprenalina y metaproterenol.
Vasoconstrictores: fenilefrina, nafazolina, antazolina, tetrazolina.
Beta-bloqueantes: timolol, propranolol, oxprenolol y mepindolol.
![]() 18. LENTILLAS, LÁGRIMA Y AMBIENTE
18. LENTILLAS, LÁGRIMA Y AMBIENTE
18.1. Grado higrométrico
La humedad más fisiológica, es decir, la que se considera idónea para el cuerpo humano, ronda el 40% de los valores de saturación ambiental. Con estos valores, se evapora en cada ojo un volumen de lágrima de 0’12 ml/min, es decir, aproximadamente el 10 % de la lágrima que se produce. Si el ambiente es más seco, como ocurre en oficinas con aire acondicionado y en aviones de pasajeros, donde el grado higrométrico suele oscilar entre el 5 y el 15%, se evaporará más lágrima. Runge y cols. (35) encontraron que la mayoría de los vuelos de pasajeros a 11.000-13.000 m de altitud, tienen en cabina una humedad de sólo el 3-4 %, lo que explica la intolerancia a las lentillas de contacto en algunos casos.
18.2. Polución
En ambientes abiertos, la bruma fotoquímica produce descenso del pH lacrimal y de la lisozima lacrimal e inestabilidad de la capa lípida. Los principales oxidantes de la polución ambiental son el ozono (O3), óxido nítrico (NO), peróxido de nitrógeno (NO2), trióxido de nitrógeno (NO3), dióxido de azufre o anhídrido sulfuroso (SO2), tetraóxido o peróxido de azufre (SO4), acroleína, formaldehido, nitrato de peroxiacetilo y nitrato de peroxipropionilo.
En ambientes cerrados, como domicilios, oficinas, escuelas y cabinas de avión, son polutantes frecuentes el dióxido de carbono (CO2), monóxido de carbono (CO), nitrógeno (N), humo de tabaco, productos de limpieza, emisiones de los muebles, emisiones de suelos y paredes, hongos y bacterias. A ello, se añaden frecuentemente el aire acondicionado y las temperaturas moderadas/altas, lo que disminuye las capas lípida y acuoserosa de la película lacrimal, y produce un síndrome oficinario de sequedad ocular (sick building syndrome) (36).
En ambientes cerrados con bajo índice higrométrico (aire acondicionado, aviones,...), la tolerancia a las lentes de contacto disminuye. El efecto se incrementa por las corrientes de aire no percibidas |
18.3. Corrientes de aire
Las corrientes de aire aumentan la evaporación ocular y empeoran la tolerancia a las LC. Con fines prácticos, las corrientes de aire se clasifican en dos tipos: 1) las percibidas por el sistema sensorial de la piel (viento atmosférico, ventiladores de habitaciones, ventanillas de coches abiertas, aire acondicionado rápido de coches y alcobas) y 2) las no percibidas (aire acondicionado lento, cabinas de aviones, pasillos y puertas de interiores, inmediaciones de hornos y barbacoas). El daño producido por las primeras se debe a su intensidad. El daño producido por las segundas se debe a que pasan desapercibidas y el paciente se expone largo tiempo a ellas.
![]() 19. LÁGRIMAS ARTIFICIALES
19. LÁGRIMAS ARTIFICIALES
En pacientes con ojo seco, el porte de LC puede ser mejorado con colirios hipersecretantes y con lágrimas artificiales. Las lágrimas muy viscosas pueden quedar parcialmente atrapadas tras la lentilla, añadiendo un lentículo retrolental en las duras, y cambiando la curvatura de la superficie lental en las blandas, por lo que al principio pueden producir desenfoque y producir una ametropía bilateral o una anfimetropía pasajeras. Esta razón, y no el daño a la lentillas o al ojo, es la que hace que algunos laboratorios aconsejen no simultanear la instilación de lágrimas artificiales y la inserción de LC. En cualquier caso, es aconsejable que las lágrimas artificiales no contengan conservantes, por el poder acumulativo a que pueden dar lugar.
Las nebulizaciones medicamentosas (Lipo Nit: liposomas con ácidos grasos y vitaminas. DEO: carbonato cálcico, petrolatum, glicerol) aplicados sobre la piel palpebral, alcanzan por flujo supracutáneo los meniscos y la película lacrimal (3,37) y mejoran el porte de lentillas en casos de sequedad ocular.
![]() 20. CIRUGÍA DEL OJO SECO
20. CIRUGÍA DEL OJO SECO
En pacientes de ojo seco portadores de LC, se ha comprobado que la oclusión de los puntos lacrimales mejora la tolerancia (38-41). La oclusión de los puntos lacrimales puede hacerse por parcheo con conjuntiva autóloga, que es lo que mejores resultados da (42) (Figura 5), o en su defecto, por cauterización o con tapones.
![]() 21. LENTILLAS DE CONTACTO COMO
TRATAMIENTO DEL OJO SECO
21. LENTILLAS DE CONTACTO COMO
TRATAMIENTO DEL OJO SECO
El ojo seco leve (con síntomas de sequedad, sin signos biomicroscópicos) no se beneficia del porte de LC, ya sean lentillas ópticas, ya terapéuticas (lentillas vendaje). Los ojos secos medio (signos biomicroscópicos reversibles) y grave (lesiones corneales persistentes) tampoco tienen beneficio por el uso de LC, salvo ocasionalmente, cuando aparecen abrasiones epiteliales y ulceraciones por la sequedad ocular y queratitis neuroparalítica (43).
Para evitar o tratar estas lesiones epiteliales de los ojos secos medios y graves, las lentillas duras y las semipermeables no se emplean, pues empeoran evidentemente el daño de la superficie ocular. Por el contrario, sí se usan ocasionalmente las lentillas hidrofílicas con 50% o más de contenido acuoso, pero su porte debe acompañadas de una continua rehidratación de la lentilla y del mar lacrimal; esta rehidratación se consigue por frecuente instilación de lágrimas artificiales, por la oclusión de los puntos lacrimales por parcheo, y por cisternoplastias.
![]() RECONOCIMIENTOS
RECONOCIMIENTOS
El presente trabajo ha sido elaborado con una beca de la Fundación Rizal de Investigación Oftalmológica, de Madrid.
Agradecemos la colaboración de la Dra Agnes Paterson, de la Sección de Fluidos del Instituto Pluridisciplinar, de Madrid, becada por la Unión Europea ERBFMBICT950173 en el Grupo del Prof. Manuel G. Velarde.
![]() BIBLIOGRAFÍA
BIBLIOGRAFÍA
1. MacDonald JE Brubaker S. Meniscus induced thinning of tear films. Am J Ophthalmol 1971;72:139-146.
2. Winder AF, Ruben M. Laboratory studies in the management of soft contact lens use. Trans Ophthalmol Soc UK 1977;97:153-156.
3. Roth HW. Clinical problems of dry eye contact lens wear. In: Murube J (ed.). Ojo seco-dry eye. Madrid. ASEO. 1997. pp 97-98.
4. Murube J. Clasificación clínica del ojo seco. En: Murube J (ed.): Ojo seco-dry eye. Madrid, ASEO, 1997, pp 43-44 y 116.
5. Schirmer O. Studien zur Physiologie und Pathologie der Tränenabsonderung und Tränenabfuhr. Graefe’s Arch Ophthalmol 1903;56: 197-291.
6. Korb DR. Tear film-contact lens interactions. Adv exp Med Biol 1994;350:403-410.
7. Guillon M, Styles E, Guillon JP, et al. Preocular tear film characteristics of nonwearers and soft contact lens wearers. Optom Vis Sci 1997;74:273-279.
8. Murube J. Lentillas de contacto. En: Dacriología Básica. A.S.E.O. Madrid. 1982. pp 732-743.
9. Parafita MA, Pérez MV, Yebra Pimentel E, Giráldez MJ, González J. Estudio retrospectivo sobre la influencia de la lágrima en el cálculo de la potencia esférica de las lentes de contacto para astigmatismo. Rev Españ Contactol 1997;7:9-16.
10. Berger E. Névroses de sécrétion de la glande lacrymale. Larmoiement et sécheresse de la conjonctive dans le goître exophtalmique. Arch Ophtalmol (Paris) 1894;14:101-110.
11. Alió y Sanz JL. La teletermografía en oftalmología: Estudio del patrón termográfico de normalidad y del valor de la técnica en el diagnóstico diferencial tumoral. Thesis doctoralis. Univ Complutense. Madrid. 1980.
12. Murube J. pH de la lágrima. En: Dacriología Básica. A.S.E.O. Madrid. 1982. pp 487-495.
13. Eriksen D, Randeri K, Ster J. Behavior of hydrophilic soft contact lenses under stress conditions of pH and tonicities. Symposium sobre lentillas flexibles. Bitonte JL, Keates RH (eds.), St. Louis. 1972, p. 216.
14. von Gyorffy S. Acerca del papel desempeñado por el líquido que se emplea en los cristales de contacto. Klin Monatsbl Augenheilk 1942;108:328-335. (en alemán; traducción española en Arch Soc Oftalmol Hisp-Amer. 1943;2:393.
15. Mastman GJ, Baldes EJ, Henderson JW. The total osmotic pressure of tears in normal and various pathologic conditions. Arch Ophthalmol (Chicago) 1961;65:509-513.
16. Murube J. Dacryologia Basica. A.S.E.O. Madrid 1982, p.733.
17. Fernández Refojo M. Contact lens materials. Int Ophthalmol Clin 1973;13:263-277.
18. Buonfiglio Marabottini R, Panzieri M. Breakup time (B.U.T.) e lenti corneali. Boll Ocul(Italia) 1977; 56:265-275.
19. González Tomás J. Tratamiento de la fragilidad del epitelio corneal con un colirio de vitamina B12 500 Gammas. Arch Soc Españ Oftalmol 1972;32:429-436.
20. Sendele DD, Kenyon KR, Mobilia EF, et al. Superior limbic keratoconjunctivitis in contact lens wearers. Ophthalmology 1983;90: 616-622.
21. Stenson S. Superior limbic keratoconjunctivitis associated with soft contact lens wear. Arch Ophthalmol 1983;101:402-404.
22. Bloomfield SE, Jakobiec FA, Theodore FH. Contact lens induced keratopathy: a severe complication extending the spectrum of keratoconjunctivitis in contact lens wearers. Ophthalmology 1984;91:290-294.
23. Clinch TE, Goins KM, Cobo LM. Treatment of contact lens-related ocular surface disorders with autologous conjunctival transplantation. Ophthalmology 1992;99:634-638.
24. Pe’er J, Zajicek G, Greifner H, et al. Streaming conjunctiva. The Anatomical Record 1996;245:36-40
25. Virchow H. Conjunctiva. In:Graefe-Saemisch (eds): Handbuch der Augenheilkunde, 2ªº ed. 3rd Abschnitt. Ed. W. Engelmann. Leipzig. 1910, p. 431.
26. Kenyon KR, Tseng SCG. Limbal autograft transplantation for ocular surface disorders. Ophthalmology 1989;96:709-723.
27. Murube J. Ojo seco-dry eye. Madrid, ASEO, 1997, p. 110.
28. Eng WG, Rasco JL, Marano JA. Low atmospheric pressure effects on wearing soft contact lenses. Aviat Space & Envir Med 1978;49:73-75.
29. Jáuregui M, Fatt I. Estimation of the in vitro oxygen rate of the human corneal epithelium. Am J Optom Physiol Opt 1972;49:507-511.
30. Velasco Cabrera MJ, García Sánchez J, Bermúdez Rodríguez FJ. Lactoferrin in tears in contact lens wearers. CLAO J 1997;23:127-129.
31. Ho CH, Hlady V. Fluorescence assay for measuring lipd deposits on contact lens surfaces. Biomaterials 1995;16:479-482.
32. Ruben M, Tripathi RC, Winder AF. Brit J Ophthalmol 1975;59:141. Citado por Winder AF, Ruben M. Laboratory studies in the management of soft contact lens use. Trans Ophthalmol Soc UK 1977;97:153-156.
33. Lyons, RW. Orange contact lenses from rifampin. New Eng J Med 1979;300:372
34. Shalaby O, ChenZhuo L. Ojos secos farmacológicos y tóxicos. En: Murube J (ed.). Ojo seco-dry eye. Madrid. ASEO, 1997. Pp.69-71.
35. Runge JW, Friedrich HH. Wearing of contact lenses during flights. Problems for crew members and passengers. Philipp J Ophthalmol 1979;11:77-82.
36. Kreiss K. The epidemiology of building-related complaints and illness: Occupational Medicine 1989;4:575-591.
37. MacKeen DL, Roth HW, Doane MG, et al. Supracutaneous treatment of dry eye patients with calcium carbonate. Schepens Eye Research Institute. Boston. 1996.
38. Rashid RC. Rashid argon laser dye canaliculoplasty for conversion of contact lens failures to successful wearers. Acta XXV Congr Ophthalmol Universale (Roma 1986). Amsterdam. Kugler & Ghedini. 1987. pp 2738-2739.
39. Fayet B, Bernard JA , Louka B et al. Traitement symptomatique des keratites filamenteuses par occlusion réversible des méats lacrymaux. Bull Soc Ophtalmol Fr 1989; 89:939-947.
40. Giovagnoli D, Graham SJ. Inferior punctal occlusion with removable silicone punctal plugs in the treatment of dry-eye related contact lens discomfort. J Am Assoc 1992;63:481-485.
41. Virtanen T, Huotari K, Harkonen M, Tervo T. Lacrimal plugs as therapy for contact lens intolerance. Eye 1996; 10:723-731.
42. Murube J, Murube E. Treatment of dry eye by blocking the lacrimal canaliculi. Surv Ophthalmol 1996;40:463-483.
43. ChenZhuo L, Shalaby O. Ojos secos por déficits neurológicos. En: Murube J (ed.). Ojo Seco-Dry Eye. Madrid. ASEO. 1997, pp 79-82.