| Estas pruebas se han convertido en una
herramienta muy útil para el diagnóstico del ojo seco y de otras muchas enfermedades de
la superficie ocular, debido a su máxima sensibilidad (Rivas y cols 1995). En las primeras fases del ojo seco, las
alteraciones halladas en la superficie ocular pueden deberse a alteraciones cualitativas
de la secreción de la glándula lagrimal. Esto implica que el recambio de la película
lagrimal o el volumen de secreción lagrimal no siempre disminuye en las primeras fases
del ojo seco, lo que retrasa el diagnóstico clínico (Maurice, 1971).
A pesar de la diversidad de procesos
patológicos que producen la aparición del ojo seco, los cambios morfológicos en el
epitelio conjuntival humano son bien conocidos. En su fase clínicamente activa,
manifiesta una histopatología monomorfa a nivel del epitelio conjuntival, caracterizada
por un proceso de metaplasia escamosa. Este es un proceso continuo y reversible de
diferenciación epitelial anormal, que indica el grado de severidad de la enfermedad.
Entre las pruebas histológicas destacan
la citología de impresión y la biopsia. Estas dos pruebas son complementarías, pero sus
resultados no son comparables.
El grado de afectación de la pared
córneo-conjuntival indica la severidad de la enfermedad. Un ojo seco afectado únicamente
en su epitelio, en principio, se le considera que sufre una severidad media, mientras que
cuando el tejido conectivo llega a alterarse, la severidad de este ojo seco es grave
(figuras 33-1a, 1b y 1c).
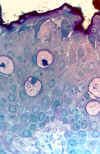
Figura 33-1a. Epitelio normal
con abundantes células caliciformes y células epiteliales no secretoras muy juntas.
Existe una capa de mucina ancha sobre la superficie epitelial. Grado: normal (0). Aumentos
de la foto: x100.
Figura 33-1b. Epitelio
moderadamente alterado. No se observan células caliciformes y las células están más
separadas. La capa de mucina sobre la superficie epitelial es muy fina. Grado de
metaplasia: 2 (moderado). x100 aumentos.
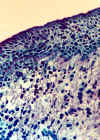
Figura 33-1c. Conjuntiva de
paciente con ojo seco severamente alterada. No se observan células caliciformes y las
células están muy separadas. El tejido conectivo posee fibras de colágeno
desorganizadas, gran número de linfocitos y menor tamaño de los vasos. Grado: severo
(3). x40 aumentos.
CITOLOGÍA DE IMPRESIÓN
El término citología de impresión es
utilizado para describir la técnica por la cual las capas más superficiales del epitelio
córneo-conjuntival son recogidas por la aplicación de papeles de filtro (Adams y cols.,
1989) (figura 33-2).
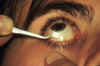
Figura 33-2. Forma de toma de la
citología de impresión sobre la conjuntiva bulbar central inferior, con papel millipore
sujetado con una pinza.
La citología de impresión ha permitido
descubrir las alteraciones celulares del epitelio ocular en múltiples enfermedades de la
superficie ocular, principalmente en el diagnóstico del ojo seco y para poder indicar las
diferencias entre las enfermedades que lo componen (Bron y Mengher, 1989; Robert, 1991;
Rivas y cols., 1992b); también, puede ayudar a determinar la influencia de factores
añadidos tales como la blefaritis, uso de lentillas, etc (Nelson, 1989; Rivas y cols.,
1992b).
Las virtudes de la citología de
impresión residen en que permiten mantener la morfología de la superficie
córneo-conjuntival, la relación célula célula y la interacción entre estas células
epiteliales y otros componentes celulares (células inflamatorias, etc), así como conocer
la morfología celular.
Clínicamente, la queratinización es
rápidamente reconocida por exámenes biomicroscópicos, pero la metaplasia escamosa que
es un fenómeno anterior a la queratinización, puede ser demostrada por la impresión
citológica, lo que la convierte en una prueba de gran valor para el diagnóstico y, lo
más importante, descubrir la enfermedad en sus fases más tempranas, antes de la
aparición de algún signo clínico, facilitando su tratamiento.
Esta técnica no es invasiva, es fácil
de realizar, causa mínimas molestias al paciente y puede ser utilizada a lo largo del
tiempo. Asimismo, permite recoger hasta tres capas de células de la superficie
conjuntival y una de la córnea (Nelson y cols., 1983b; Tseng, 1985).
Historia: La investigación
histórica de la conjuntiva humana está generalmente basada en biopsias invasivas que
provocaban ciertas molestias al paciente, lo que limitaba su aplicación clínica diaria.
Posteriormente, se utilizó el raspado conjuntival como método de diagnóstico, pero
aunque no era una técnica invasiva ocasionaba ciertas molestias a los pacientes y no
permitía conservar una disposición bidimensional de las células en el epitelio. Su
principal utilización, durante muchos años, fue el estudio de procesos inflamatorios en
las conjuntivitis (Thatcher y col., 1977).
El término de citología de impresión
fue introducido por Egbert y cols. (1977), considerándola como una simple biopsia
conjuntival. Posteriormente, diversos autores han ido realizando modificaciones según sus
necesidades. Adams (1989) describió el uso de esta técnica para estudiar la pureza del
mucus sobre la superficie conjuntival. Marner (1980) fue el primero en describir cambios
en la cromatina nuclear de las células epiteliales, en el síndrome de Sjögren (figura
33-3). Nelson (1982) describió esta técnica en los exámenes de las superficie ocular de
pacientes con penfingoide ocular y, en 1983, otros estados de sequedad ocular. Hatchell y
Sommer (1983) y Wittpenn y cols. (1986) sugirieron que la citología de impresión podía
ser usada para detectar una deficiencia temprana de vitamina A. Posteriormente, Maskin y
Bode (1986) han usado la citología de impresión y la microscopía electrónica para
diagnosticar mucopolisacaridosis.
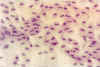
Figura 33-3. Citología de
impresión de un paciente con ojo seco, donde se aprecian gran número de cromatina
nuclear serpentiforme (snake-like). Grado de metaplasia: moderado. x40, aumentos. Tinción
PAS-hematoxilina.
Técnica: Las muestras se recogen
sobre papel de acetato de celulosa Millipore HAWP304. El uso de un oftalmodinamómetro
permite aplicar una presión normalizada, de 40 g sobre la conjuntiva bulbar y de 70 g
sobre la superficie del párpado inferior. El papel de filtro, que tiene forma de disco,
se mantiene presionado durante 2 segundos sobre la superficie conjuntival (Nelson, 1988).
Si no se dispone de este aparato se puede
utilizar tiras de papel de filtro de 5x3 mm de tamaño, con una esquina en pico para su
mejor manejo y para poder establecer la perfecta orientación de la muestra recogida. Las
tiras de papel se colocan sobre las distintas áreas de la superficie ocular durante unos
3 segundos, haciendo una ligera presión con la punta de las pinzas (Tseng, 1985; Rivas y
cols., 1991a).
Previa anestesia tópica de la superficie
ocular con una gota de propacaína al 0,5%, instilada en el fondo de saco, se obtienen las
muestras, fijándolas con alcohol de 96% durante, al menos, 10 minutos. La tinción más
utilizada es el PAS-hematoxilina, que pone de manifiesto la mucina de las células
caliciformes y las estructuras celulares basófilas. También, se puede utilizar la
técnica del Papanicolau o de la hematoxilina eosina, aunque con peores resultados. Si se
desea conservar permanentemente las muestras, se deshidratan y se montan en resina.
Graduación de la metaplasia escamosa:
El grado de metaplasia escamosa nos informa del estado de la superficie ocular, yendo
paralelo a la severidad de la enfermedad. Aunque el proceso de metaplasia escamosa es
continuo, se ha dividido en diversos grados para una mejor comprensión. De hecho, lo
podemos resumir en un proceso en el cual existe: a) disminución de la densidad de
células caliciformes y, por lo tanto, deficiencia de mucina; b) aumento del tamaño y
alargamiento anormal de las células epiteliales no secretoras; c) incremento de la
estratificación celular; d) cambios metacromáticos en la tinción citoplasmática; e)
separación intercelular; f) cambios morfológicos del núcleo; g) incremento de la
relación núcleo-citoplasma de las células epiteliales y; h) aparición de
queratinización. Todos estos cambios celulares sirven para la determinación de la
severidad de la enfermedad (Tseng, 1987; Alvarez y cols., 1996a).
Muchos autores piensan que, entre las
distintas alteraciones que pueden graduar la metaplasia escamosa, la densidad de células
caliciformes en la conjuntiva es el mejor indicador para determinar el estado de salud de
la superficie ocular, tanto en las enfermedades mucodeficientes como acuodeficientes (Lemp
y Holly, 1970; Kinoshita y cols., 1983; Rivas y cols., 1991b).
Existen dos sistemas de graduación de la
metaplasia escamosa seguidos por la mayoría de los autores: uno, descrito por Nelson
(1983b) y otro por Tseng (1985). La principal diferencia entre ambos está en que Nelson
describe la existencia de células caliciformes en todos los grados, hasta en los estados
más severos de la enfermedad, mientras que Tseng sólo las describe en las primeras fases
de la enfermedad, haciendo gran incapié en la presencia de queratinización en los tres
últimos grados de su escala.
Nelson ha desarrollado una escala
de cuatro grados, basándose en el número de células caliciformes y el aspecto de las
células epiteliales. El grado 0 es considerado normal; el 1, ligeramente alterado; el 2,
medianamente alterado y el 3, severamente alterado:
- Grado 0. Las células epiteliales
son pequeñas y redondas, de límites bien definidos, formando sábanas sin espacios
intercelulares entre ellas, con el citoplasma eosinófilo. El núcleo es grande, con una
relación núcleo/citoplasma de 1/1 a 1/2. Las células caliciformes son abundantes
(>500 células/mm2), ovales y gruesas, con un citoplasma intensamente PAS positivo
(figura 33-4a).
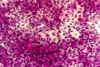
Figura 33-4a. Citología de
impresión de una persona sana. Las células epiteliales están juntas y el número de
células caliciformes es muy abundante. Grado de metaplasia: normal (0). x40 aumentos.
Tinción PAS-hematoxilina.
- Grado 1. Las células epiteliales
son ligeramente mayores y más poligonales, de límites bien definidos, con citoplasmas
eosinófilos. Aunque siguen manteniendo su disposición en placa, existen ligeros espacios
intercelulares. El núcleo es menor, con una relación núcleo/citoplasma de 1/3. El
número de células caliciformes es ligeramente menor (350-500 células/mm2); sin embargo,
mantienen su forma globosa y oval con una tinción PAS positiva (figura 33-4b).
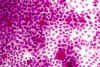
Figura 33-4b. Citología de
impresión con leves síntomas de sequedad ocular. El número de células caliciformes es
menor y polimórfico. Las células epiteliales son ligeramente mayores de tamaño y
presentan leves espacios intercelulares. Grado de metaplasia: leve (1). x 40 aumentos.
Tinción PAS-hematoxilina.
- Grado 2. Las células epiteliales
son mayores y poligonales, ocasionalmente binucleadas, con límites poco definidos. Las
células se disponen con una mayor separación, dejando grandes espacios intercelulares
entre ellas. El citoplasma se tiñe de forma variable. El núcleo es más pequeño, con
una relación núcleo/citoplasma entre 1/4 y 1/5. No existe queratinización. Las células
caliciformes están marcadamente disminuidas (100-350 células/mm2), son más pequeñas,
con bordes poco definidos y una tinción PAS menos intensa (figura 33-4c).
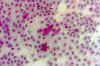
Figura 33-4c. Citología de
impresión de un paciente con ojo seco moderado. Las células son mayores con mayor
relación núcleo-citoplasma. Estas dejan mayores espacios intercelulares. Se observan
escaso número de células caliciformes con límites celulares poco definidos. Grado de
metaplasia: moderado (2). x40 aumentos. Tinción PAS-hematoxilina.
- Grado 3. Las células epiteliales
suelen ser muy grandes, poligonales y polimorfas, y generalmente aisladas. El citoplasma
es basófilo. Los núcleos son pequeños, a veces binucleados, picnóticos (grados
variables) y, en muchas células, puede estar totalmente ausente. La relación
núcleo/citoplasma es superior a 1/6. Las células caliciformes están marcadamente
disminuidas o incluso ausentes (<100 células/mm2). Puede existir queratinización, que
variará en intensidad.
La otra graduación, según Tseng,
establece 6 estados de metaplasia escamosa (figuras 33-4d y 4e):
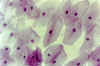
Figura 33-4d. Citología de
impresión de un paciente con ojo seco severo. No se observan células caliciformes. Las
células epiteliales no secretoras son de gran tamaño con una altísima relación
núcleo/citoplasma. La mayoría de los núcleos están alterados. Grado de metaplasia:
severo (3). x40 aumentos. Tinción PAS-hematoxilina.

Figura 33-4e. Citología de
impresión de un paciente con ojo seco severo. Se observan gran número de células
anucleadas de gran tamaño. Grado de metaplasia:severo (3). x40 aumentos. Tinción
PAS-hematoxilina.
- Grado 0. El epitelio conjuntival es
normal, con moderado o abundante número de células caliciformes dispuestas entre las
células epiteliales no secretoras. El citoplasma es eosinófilo.
La proporción núcleo/citoplasma es de 1/1.
- Grado 1. Disminución marcada y
temprana de células caliciformes. Las células epiteliales no secretoras presentan un
leve alargamiento. El citoplasma es eosinófilo. La relación núcleo/citoplasma es de 1/2
a 1/3. No existe queratinización.
- Grado 2. Pérdida total de células
caliciformes. Las células epiteliales presentan un moderado alargamiento y aplastamiento.
El citoplasma es eosinófilo-basófilo. La relación núcleo/citoplasma es de 1/4. No
existe queratinización.
- Grado 3. Todo las células
epiteliales presentan una pronta y leve queratinización; algunas células tienen visibles
filamentos de queratina. El citoplasma sufre un moderado aplanamiento, y es
metacromático. En este estado aparecen células con núcleos levemente picnóticos. La
relación núcleo/citoplasma es de 1/6.
- Grado 4. Las células epiteliales
son de gran tamaño, alargadas y presentan una moderada queratinización; muchas de ellas
con densos paquetes de filamentos de queratina y núcleos picnóticos. El citoplasma es
metacromático, tendiendo a ser basófilo. La relación núcleo/citoplasma es de 1/8.
- Grado 5. Las células epiteliales
presentan una avanzada queratinización, con densos paquetes de filamentos de queratina y
núcleos marcadamente picnóticos o ausentes. El citoplasma es basófilo.
Valores celulares de la superficie
ocular: Hay que tener siempre mucho cuidado con las variaciones individuales, debidas
a las diferentes condiciones ambientales y a las distintas variaciones de las técnicas,
lo que pueden dar lugar a resultados muy diferentes. Así, dentro de un mismo paciente la
variabilidad en la densidad de células caliciformes es muy grande en las diferentes
áreas conjuntivales. Por ello, sólo se debe comparar los valores en las mismas áreas
(Rivas y cols., 1991c).
Si la densidad de células caliciformes
en el área bulbar interpalpebral es inferior a 350 células/mm2 sugiere una enfermedad de
ojo seco. Si, además, existe una densidad de células caliciformes en el área palpebral
inferior menor a 500 células/mm2 puede indicar una enfermedad primaria de la superficie
ocular, como el penfigoide cicatricial ocular, el síndrome de Stevens Johnson o la
queratoconjuntivitis limbal superior (Nelson y Wright, 1984; Nelson, 1988). Otros autores
consideran que estos valores son demasiado altos (Rivas y cols., 1991c).
En enfermedades oculares extrínsecas,
debidas a una disminución de la secreción acuosa, como la queratoconjuntivitis seca, la
superficie conjuntival bulbar expuesta al medio exterior es la primera en alterarse,
mientras que la conjuntiva palpebral inferior, que es la más protegida, se ve afectada
más tardíamente. En casos muy severos de queratoconjuntivitis seca, la conjuntiva
palpebral inferior puede llegar, incluso, a presentar metaplasia escamosa. Sin embargo, en
la mayoría de los casos en que la queratoconjuntivitis seca no va acompañada de
complicaciones u otras enfermedades la superficie palpebral inferior no se ve afectada
severamente. La presencia de un exudado córneo-conjuntival sugiere que hay un componente
inflamatorio, que puede ser debido a blefaritis, medicamentos o toxicidad de los
conservantes, o a la existencia de una enfermedad ocular intrínseca. La abundancia de
células inflamatorias está directamente relacionada con la actividad de la enfermedad
(Nelson, 1988).
Al contrario, las enfermedades
intrínsecas de la superficie ocular, como son el penfigoide ocular, el síndrome de
Stevens Johnson, los ojos expuestos a aire acondicionado o/a quemaduras químicas severas,
presentan un epitelio afectado severamente tanto en la superficie palpebral como en las
bulbares. Si la densidad de células caliciformes en la superficie ocular palpebral
inferior es menor de 500/mm2, se puede sospechar la presencia de una enfermedad
intrínseca de la superficie ocular.
Pacientes con penfigoide ocular y
síndrome de Stevens-Johnson moderadamente severo, presenta una pérdida casi total de
células caliciformes, tanto en la zona bulbar como en la palpebral inferior. De hecho, en
estados tempranos de penfigoide ocular, la superficie ocular palpebral inferior exhibe, a
menudo, metaplasia escamosa, junto con la presencia de células inflamatorias.
BIOPSIA CONJUNTIVAL
El estudio de la superficie
córneo-conjuntival en pacientes con ojo seco, a través de una biopsia, tiene
innumerables ventajas: es muy fácil de obtener, con mínimas molestias para el paciente,
que no requiere cuidado especial tras la toma de la muestra y es la menos agresiva entre
las biopsias descritas para el estudio del ojo seco. Como contrapartida, proporciona la
mejor información morfofuncional del estado córneo-conjuntival de la enfermedad a nivel
celular (figura 33-5); también, es la única manera de observar directamente el estado de
la capa mucínica de la película lagrimal, íntimamente relacionada con el glucocáliz
(figuras 33-1a y 33-6). Esta técnica puede ayudar a los oftalmólogos en el diagnóstico
de pacientes con signos mucodeficientes en el curso de una enfermedad con alteraciones
clínicas acuodeficientes o lipodeficientes.

Figura 33-5. Unión de la zona
limbal (ancha) y la córnea (estrecha). No se observan células calciformes en el área
limbal. Las células superficiales son más aplanadas que en las otras áreas. Grado de
metaplasia: normal (0). x100 aumentos.

Figura 33-6. Epitelio
severamente alterado en un paciente con ojo seco. No se observan células caliciformes y
la mayoría de las células superficiales están muy aplanadas con núcleos alterados. Las
células están muy separadas. No se observa capa mucínica. Grado de metaplasia: severo
(3). x100 aumentos.
La obtención de biopsias conjuntivales
requieren anestesia tópica. El tamaño de la muestra deber ser, más o menos, como la
cabeza de un alfiler. La misma pieza sirve para el estudio óptico y ultraestructural. Con
esta técnica se conserva la disposición global del epitelio y del tejido conectivo,
permitiendo así un exacto diagnóstico de la enfermedad (Egbert y cols., 1977) y del
estado de la interfase mucina-glucocáliz de la película lagrimal (Nichols y cols.,
1985).
Técnica: El protocolo general
sugiere una fijación y estabilización de la fase mucina-glucocáliz de la película
lagrimal a la superficie epitelial en glutaraldehido al 1,5% en tampón cacodilato sódico
0,1 M, pH 7,3-7,4, conteniendo también sacarosa al 0,5% y bromuro de
hexadeciltrimetilamonio (HTAB). Posteriormente, se realiza una nueva fijación y
estabilización en glutaraldehido al 1% en el mismo tampón con ácido tánico al 1%. A
partir de la tercera fijación, en tetróxido de ósmio al 1%, se siguen los pasos de
cualquier protocolo general de anatomía patológica.
El seccionamiento y tinción de las
muestras para el estudio a nivel óptico está enfocado principalmente para comparar los
resultados con la citología de impresión, y para localizar la zona de la preparación
que se desea estudiar a nivel ultraestructural. Se realizan cortes histológicos semifinos
de un grosor aproximado entre 1,5 a 2 micras. A continuación se tiñen para su
observación.
Los cortes ultrafinos para el estudio
ultraestructural se realizan de un grosor comprendido entre 60-80 nanómetros.
Posteriormente, se tiñen con citrato de plomo.
BIOPSIA DE GLÁNDULA LACRIMAL
Es una prueba relativamente fácil de
obtener y una de las que más y mejor información ofrece para diagnosticar el estado
morfofuncional de las enfermedades de ojo seco. Es moderadamente agresiva. La biopsia se
realiza bajo anestesia tópica seguida de una inyección subconjuntival y supratemporal de
lidocaína al 2% con adrenalina. Se prolapsa el lóbulo palpebral de la glándula lagrimal
y se abre una incisión a través de la conjuntiva y la cápsula. Se extirpa un pequeño
fragmento de tejido y se coloca en líquido fijador. No hace falta sutura.
Es una prueba muy útil para el
diagnóstico de síndromes autoinmunes, entre el que destaca el de Sjögren.
En el estudio histológico, la
puntuación de un foco mayor o igual a 1 en una biopsia es compatible con el diagnóstico
de síndrome de Sjögren. Un foco es definido por un aglomerado de al menos 50 linfocitos;
la puntuación del foco está definida por el número de focos en 4 mm2 de tejido
glandular (Nelson, 1994; Vitali y cols., 1996).
La técnica es la misma que para la
biopsia conjuntival.
BIOPSIA DE GLÁNDULAS SALIVALES
MENORES
Habitualmente, la biopsia de glándulas
salivares labial es usada para sustituir a la biopsia de glándula lagrimal, a pesar de
ser más agresiva (figura 4-5).
Esta prueba es igualmente útil para
confirmar el diagnóstico del síndrome de Sjögren y, frecuentemente, presenta
modificaciones paralelas a las existentes en las glándulas lagrimales; por ello, es
desaconsejable la realización simultánea de biopsias en ambas glándulas. El
oftalmólogo debe elegir en cada caso, en base a su criterio profesional, cual de las dos
biopsias debe realizar.
Hay discrepancias en cuanto a la
agresividad de esta biopsia. Es igual de lenta de diagnosticar que la de glándula
lagrimal. La incisión es mayor que en la biopsia de la glándula lagrimal y puede
necesitar sutura, a pesar de lo cual Nelson (1994) considera que, probablemente, sea tan
inócua y cómoda como la biopsia de la glándula lagrimal.
La técnica no es difícil, aunque sí
más laboriosa. Se inyecta por vía submucosa lidocaína al 2% con adrenalina. Se coloca
una pinza grande de chalazión en el labio para aminorar el sangrado. Se abre una
incisión a través de la mucosa hasta que las glándulas salivares menores se prolapsen
en la herida. Se extirpan cinco lóbulos glandulares y se colocan en el líquido fijador.
Se cierra la incisión con una sutura submucosa continua.
La puntuación en las biopsias de
glándulas salivares menores es la misma que la utilizada en las biopsias de la glándula
lagrimal. Una puntuación de focos superior a 1 es compatible con el diagnóstico del
síndrome de Sjögren (Nelson, 1994; Vitali y cols., 1996).
PRUEBAS INMUNOLÓGICAS
Este grupo de pruebas sólo es
aconsejable cuando el ojo seco puede estar asociado a: a) patogénesis inmunitaria mediada
por anticuerpos, como el síndrome de Sjögren, el lupus eritematoso sistémico, el
pénfigo vulgar, la uveítis inducida o el penfigoide cicatricial; b) si está asociado a
enfermedades reumatoides (artritis reumatoide juvenil, espondilitis anquilosante, artritis
reumatoide, enfermedad de Reiter; c) a otras enfermedades sistémicas como la esclerosis
sistémica (esclerodermia), vasculitis o alteraciones del tiroides; d) por infecciones del
sistema inmunitario, como el linfoma o el SIDA.
PRUEBAS INMUNOHISTOQUÍMICAS
Son pruebas que por su complejidad
requieren un personal cualificado y un anatomopatólogo que las interprete. En la mayoría
de los centros hospitalarios se dispone de este personal. Estas pruebas se realizan por
técnicas de incubación, según el método de anticuerpos enzima-conjugados.
Las posibilidades del estudio
inmunohistoquímico en la conjuntiva de pacientes con ojo seco son muy amplias, por lo que
el oftalmólogo debe elegir entre las múltiples técnicas: a) que confirman el estado
fisiopatológico de la pared ocular externa y b) que manifiestan el posible componente
autoinmune de la enfermedad. Dentro de las primeras, destaca el estudio de las proteínas
de "choque térmico" (HSPs). Las segundas pueden complementar el diagnóstico
del ojo seco asociado a patogénesis inmunitaria mediada por anticuerpos, como el
síndrome de Sjögren, el lupus eritematoso sistémico, el pénfigo vulgar, la uveitis
inducida o el penfigoide cicatricial.
Proteínas de "choque
térmico" (HSPs): Estas proteínas se encuentran en todos los organismos. Ante
situaciones adversas, tanto internas como externas, incluyendo inflamación, fiebre,
irradiación, infección viral, transformación maligna, exposición a agentes oxidantes,
a iones metálicos fuertes, a etanol y falta de oxígeno (Foster y col., 1988), las
células responden aumentando o induciendo la síntesis de proteínas de
"stress", siendo las más importantes las HSPs.
La presencia de HSPs en el citoplasma
celular de los epitelios, así como su mecanismo de acción, induce a pensar en un
importante papel de estas proteínas dentro del contexto de los procesos degenerativos;
teniendo dos aspectos muy importantes que serían: en primer lugar, un papel de posible
citoprotección, y en segundo lugar, ser un marcador temprano de alteración y/o
degeneración celular.
La determinación cuantitativa de HSPs en
biopsias de conjuntiva, mediante técnicas de inmunoperoxidasa y/o inmunofluorescencia,
puede ayudar a diagnosticar el grado de severidad del ojo seco, ya que la presencia de
esta proteína en pacientes es significativamente mayor que en personas sanas, lo que
implica un posible papel activo o pasivo de esta proteína como marcador patológico.
Como sabemos, en el ojo seco aparecen una
serie de estructuras celulares típicas compuestas por proteínas anormales que se
acumulan debido a alteraciones en su degradación o alteraciones estructurales
características del la metaplasia escamosa. Son pocos los datos existentes en la
bibliografía sobre estudios inmunohistoquímicos de las HSPs en pacientes con ojo seco,
pero se espera un mayor uso de estas técnicas debido a los prometedores resultados
obtenidos en otros órganos.
Entre las técnicas más importantes para
el diagnóstico del ojo asociado a enfermedades autoinmunes, destacan:
Determinación de la expresión de CD4
y CD8: Mediante la técnica de inmunoperoxidasa se ha observado que en el epitelio
córneo-conjuntival de personas sanas hay un número pequeño de células mononucleares;
la mayoría son células T, principalmente CD8. En el tejido conectivo de estos controles
aparece aproximadamente el mismos número de células CD4 y CD8 tanto en las glándulas
lagrimales, como en las glándulas salivares, en la córnea y en la conjuntiva
(Vandesande, 1979; Cordell y col., 1984; Hoang-Xuan y col., 1990). Sin embargo, en la
superficie córneo-conjuntival de pacientes con enfermedades inmunopatológicas, como la
conjuntivitis vernal, el penfigoide cicatricial ocular y la úlcera de Moorens, mediante
técnicas de inmunoperoxidasa, se observa que en el epitelio córneo-conjuntival, hay un
aumento significativo de células T CD4, macrófagos y células B. Y en el tejido
conectivo de estos pacientes hay un mayor número de células T CD8, CD4, de macrófagos y
de células B. Todo esto produce un significativo incremento en la relación CD4/CD8 en el
epitelio y en el tejido conectivo córneo-conjuntival de estas enfermedades autoinmunes
(Foster y col., 1991), excepto en el penfigoide cicatricial ocular, donde la relación
CD4/CD8 en el tejido conectivo córneo-conjuntival apenas presenta variación respecto al
existente en las personas sanas (Rice y Foster, 1990).
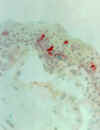
Figura 33-7a. Aumento en la
expresión del CD8 en un paciente con ojo seco.
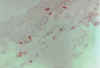
Figura 33-7b. Expresión del CD4
en un paciente con ojo seco semejante a un individuo control.
En pacientes con RCS no asociada a
enfermedades autoinmunes hay un pequeño aumento del número de linfocitos CD8, sin
modificación del número de células CD4. Esto implica una disminución no significativa
en la relación CD4/CD8 respecto a los ojos controles; tampoco hay modificaciones
significativas de otros tipos de células inflamatorias (Fong y cols. 1991).
Inmunofluorescencia directa: El
diagnóstico de un ojo seco asociado o no a un proceso autoinmune, mediante la técnica de
la inmunofluorescencia directa, sirve como complemento al obtenido con las técnicas de
inmunoperoxidasa, aunque posee ciertas desventajas respecto a la técnica de
inmunoperoxidasa, puesto que el marcaje sólo dura de 3 a 6 meses.
Se suele utilizar esta técnica para
diagnosticar el penfigoide cicatricial ocular, observándose una hipergammaglobulinemia,
sintetizándose grandes cantidades de anticuerpos contra IgG, IgM y complemento,
depositados a lo largo de la membrana basal del epitelio córneo-conjuntival afectado
(Rice y Foster, 1990).
Esta técnica se realiza sobre biopsias
de piel o de la conjuntiva, a nivel de microscopía óptica.
También, se puede estudiar la
inmunofluorescencia de los tejidos, mediante microscopía electrónica (Vandesande, 1979).
Determinación de los linfocitos B y
células plasmáticas: El aumento del número de linfocitos B y/o células
plasmáticas, mediante las técnicas de inmunoperoxidasa, en las biopsias de glándula
lagrimal o de conjuntiva sirve de apoyo al diagnóstico de ojo seco asociado a una
enfermedad autoinmune.
Agradecimientos: El autor agradece
la ayuda prestada por las Dras Ana Isabel Sanz Sanz y María Antonia Oroza Alonso en la
realización de este capítulo. |