| DACRIOALJIBES Los dacrioaljibes son depósitos de lágrima
artificial que alojados en las gafas, en un bolsillo, o pendientes de un collar, llevan su
líquido mediante un tubo a la cuenca lacrimal, suministrándolo bien por la abertura
interpalpebral o bien por vía quirúrgica subcutánea
A nuestro saber el primer dacrioaljibe
fue hecho por McLean (1945), quien con un receptáculo fijado a unas gafas intentaba la
humectación continua del ojo. Más tarde, el padre Flynn (Flynn et al 1967, Flynn 1968)
aplicó una bomba de perfusión, y Trevor Roper 1967, Dohlman et al 1971, Rao 1974, Flynn
1975, Charleux et al 1973, 1977, Ralph et al 1975, Tautin et al 1981, etc. añadieron
sucesivas modificaciones.
Nosotos hemos utilizado microbombas de
infusión lenta para diabéticos (Bomba Infusa D-SLT, Medis, Milán, Italia), con
capacidad para 10 y 20 ml, que cargada de BSS y colgadas al cuello, llevan el substitutivo
lacrimal al ojo por un tubo que penetra bajo la piel detrás de la oreja, y
subcutáneamente alcanza la cuenca lacrimal por el fórnix lateral (figura 40-1). Es
necesario usar una bomba para cada ojo, pues si se usa una sóla para ambos, pequeños
diferencias posicionales de la resistencia de los tubos hace que todo el líquido fluya
hacia un ojo sólo. Las dificultades de porte, las infecciones, el arrancamiento o
movilización accidental de los tubos, la molestia de cuerpo extraño de la desembocadra
del tubo en el fórnix conjuntival o la eventual abrasión conjuntival o corneal, hicieron
que ninguno de nuestros casos pudiese alcanzar un porte de los dacrioaljibes de 6 meses,
por lo que abandonamos su uso.
Figura 40-1. Colocación de un
dacrioaljibe. A, Creación de una apertura en el fórnix conjuntival lateral y de un
túnel subcutáneo que alcanza la región retroauricular superior. B, Tubo de silicona con
una boquilla en Y, que conectará la cuenca lacrimal con la bomba de perfusión de
lágrima artificial. C, El tubo es colocado a lo largo del túnel subconjuntival con la
boquilla asomando a la cuenca lacrimal. D, La boquilla se sitúa en el fórnix lateral, y
allí se sutura a la conjuntiva. E, El tubo de silicona sale por detrás de la oreja donde
se sujeta con esparadrapo o con una vuelta a la oreja. F, El otro extremo del tubo conecta
a una bomba de perfusión continua. G, La bomba se transporta por el paciente en una bolsa
colgada al cuello. Cada ojo lleva un sistema de perfusión separado.
TRANSPLANTES LACRIMOCITOS
Herzog et al 1976b creemos fue el primero
en cultivar lacrimocitos de rata. Introdujeron algunos lóbulos de glándula lacrimal en
un medio con colagenasa, hialuronidasa y tripsina y obtuvieron la desintegración de los
lóbulos y disociación de las células. En el resultante, 80 % eran lacrimocitos; 10 %,
células de los conductos ductulares; y 10 %, células mioepiteliales. Por centrifugación
aislaron los lacrimocitos y los conservaron en medio de Eagle. En el cultivo, los
lacrimocitos conservan la orientación de su morfología, con un polo basal con el núcleo
y un polo mundial con los microvilli (figura 40-2), y al cabo de unas horas tienden a
contactar por sus caras laterales.
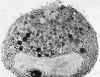
Figura 40-2. (Herzog et al
1976). Lacrimocito de rata aislado en medio de cultivo (x7300).
Posteriormente, diversos investigadores
han cultivado lacrimocitos de múridos y felinos (Oliver 1980, Fritz et al 1980, Ohashi et
al 1985, Oliver et al 1987). Así, Hann et al 1989 aislaron lacrimocitos de rata
disociándolos con colagenasa, hialuronidasa y DNasa; por centrifugación obtuvieron un
90-95 % de lacrimocitos, que a continuación cultivaron en medio de Dulbecco-Eagle,
encontrando , como los anteriores autores, que su proliferación era difícil.
Más tarde, otros autores han hecho
cultivos de lacrimocitos, pero nunca se han empleado hasta el presente para
transplantarlos al humano y tratar de corregir las insuficiencias de la glándula
lacrimal. No obstante nada hace pensar que esto no vaya a ser posible en un futuro. Para
ello, podrían usarse auto-lacrimocitos, alo-lacrimocitos o xeno-lacrimocitos cultivados y
hechos inmunoadecuados en el laboratorio por modificación genética.
SUMINISTRO DE SALIVA
Las glándulas salivales se dividen
clásicamente en mayores (parótidas, submandibulares y sublinguales) y menores (labiales,
genianas, linguales anteriores, linguales posteriores y palatinas) (figura 40-3).
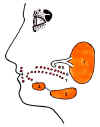
Figura 40-3. Disposición de las
glándulas salivales. 1, Parótida. 2, Submandibular. 3, Sublingual. 4, Labiales
superiores e inferiores. 5, Geniana. 6, Palatinas. 7, Linguales anteriores y posteriores.
La producción diaria de saliva es de 1
litro. En circunstancias basales, el 15 % se produce en la parótidas, 30 % en las
submandibulares, 5 % en las sublinguales y 50 % en las glándulas menores.
La producción es muy diversa en unas y
en otras glándulas salivales: la de la parótida es acuoserosa; la de la submandibular,
90 % acuoserosa y 10 % mucosa; la de la sublingual, 90 % mucosa y 10 % acuoserosa; la de
las labiales inferiores y superiores, acuoserosas y mucosas; las linguales anteriores,
acuoserosas y mucosas; las linguales posteriores de von Ebner, acuoserosas, las linguales
posteriores de Weber, mucosas; las palatinas, mucosas; las genianas, acuoserosas y
mucosas. Estas diferencias en la naturaleza de la secreción se manifiestan en diferencias
bioquímicas y biofísicas. Así, la viscosidad del segregado es de 1'5 centipoises en las
parótidas, 3'5 cps en las submandibulares y 13 cps en las sublinguales.
La saliva total es un complejo de
secretados multiglandulares que tienen unas fluctuaciones cualitativas muy superiores a
las que suele tener la lágrima. Las características bioquímicas y biofísicas de la
saliva total no se separan mucho de las de la lágrimas, y en aquellos parámetros en que
más se separan, la experiencia ha mostrado que son bien tolerados por la superficie
ocular.
| |
Lágrima |
Saliva total |
| Peso específico |
1004-1008 |
1002-1012 |
| Tensión superficial |
40 dinas/cm |
15-26 dinas/cm |
| Presión osmótica |
300-310 mOsm/l |
200-310 mOsm/l |
| pH |
7'47 |
6'75-7'25 |
| Viscosidad a 37ºC |
1 centipoise |
2-3 centipoises |
Los componentes orgánicos
de la saliva son seroalbúmina, seroglobulina, urea, ácido úrico, creatinina, mucina y
algunos aminoácidos y enzimas tales como triptófano, amilasa salival (ptialina) y
lisozima. Los componentes inorgánicos más importantes son cloruro sódico, cloruro
potásico, bicarbonato sódico, fosfatos monosódico y disódico, fosfato cálcico y
sulfocianato potásico. Desde milenios atrás se sabe que el ojo tolera satisfactoriamente
la saliva (Evangelio de San Marcos 8,23, Evangelio de San Juan 9,6)
TRANSPOSICIÓN DEL CONDUCTO DE STENON
Filatov et al 1951 publicaron la
transposición del conducto excretor de la parótida a la cuenca lacrimal. Su técnica
inicial fue modificada por numerosos autores. A nuestro entender, las dos aportaciones
técnicas más importantes han sido la prolongación del conducto de Stenon con mucosa
bucal y el cambio del abordaje externo con una amplia incisión preauricular por el
abordaje intrabucal.
La técnica se desarrolla como sigue
(figura 40-4): Tras abrir la boca con un forceps bucal, se identifica la desembocadura del
conducto parotídeo en las inmediaciones del segundo molar superior; cuando no es bien
visible, la identificación se facilita comprimiendo la parótida externamente sobre la
piel y observando donde aflora en la mucosa geniana una gota de saliva. Una vez que se
identifica la desembocadura del conducto de Stenon, se da sobre ella un punto de sutura
cuya finalidad es servir de reparo y no perder su localización

Figura 40-4. Transposición del
conducto parotídeo a la cuenca lacrimal. A, identificación de la desembocadura del
conducto de Stenon. B, Aislamiento por vía intrabucal del conducto. C, Creación de un
túnel subcutáneo hasta el fórnix conjuntival inferolateral. D, Extracción por el
fórnix conjuntival del embudo de mucosa bucal que se continúa con el conducto de Stenon;
sutura entre sí de las mucosas bucal y conjuntival. E, Situación definitiva unos meses
después.
Alrededor de este punto, se pinta sobre
la mucosa bucal con violeta de genciana un circulo de 1'5 cm de diámetro. El circulo se
corta con bisturí y a partir de él la mucosa se despega del tejido subyacente con
tijeras.
Se introduce una sonda retrogradamente
por el conducto y se hunde lo más posible, cuidando de no hacer una falsa vía. Después
se continúa la disección alrededor del conducto de Stenon, profundizando lo más
posible, aproximadamente 3-3'5 cm.
A partir de este punto, y siempre desde
dentro de la boca, se va abriendo con tijeras un tunel subcutáneo desde la superficie
lateral del músculo masetero hasta la mitad lateral del fórnix inferior, donde las
puntas de las tijeras se exteriorizan a lo largo de una herida de 1 cm de largo en la
parte más profunda del fórnix inferolateral.
Por la periferia del círculo de mucosa
bucal que rodea la desembocadura del conducto de Stenon se pasan 4 puntos de seda
simétricamente distribuidos a lo largo de su circunferencia. Los 8 cabos resultantes,
dejándoles al menos 5 cm de longitud a cada uno, se pasan a lo largo del túnel
subcutáneo y se exteriorizan por el fórnix conjuntival. Estos hilos arrastrarán la
mucosa oral y el conducto de Stenon a lo largo del túnel subcutáneo.
El círculo de mucosa oral toma una forma
plegada infundibular. Las 4 suturas se cosen a los bordes de la herida conjuntival, una en
cada extremo de la herida lineal y las otras en el centro de los labios de la herida.
Cuatro suturas entre las cuatro previas aseguran una buena continuidad entre las mucosas
oral y conjuntival. Las suturas se quitan una semana después.
Complicaciones posibles son la
restricción de los movimientos oculares si el conducto de Stenon tracciona del labio
posterior de la herida conjuntival, y entropion, si tracciona del labio anterior. La
sección accidental de lóbulos parotídeos puede producir un seroma subcutáneo. La
estimulación de la parótida al comer produce lágrimas de cocodrilo; si tras algunos
meses las lágrimas de cocodrilo resultan muy molestas, puede hacerse la denervación del
nervio auriculotemporal (figura 40-5); si esta denervación no resuelve el problema del
lloro prandial por la existencia de fibras inervatorias que siguen otro camino, la
transposición puede revertirse, y devolver el conducto a su lugar natural.
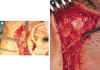
Figura 40-5. Extirpación de un
trozo de nervio auriculotemporal para evitar las lágrimas de cocodrilo. A, Apertura
cutánea en la región preauricular. B, Identificación y aislamiento del nervio
auriculotemporal; extirpación del mismo.
La derivación del conducto de Stenon es
útil incluso en pacientes con moderada boca seca, porque una pobre secreción para la
boca (una glándula parótida normal produce 75 ml/día) puede ser suficiente para el ojo
(una glándula lacrimal normal produce 5-10 ml/d). La secreción parotídea es casi
totalmente acuoserosa.
TRANSPLANTES DE GLÁNDULAS SALIVALES
Los transplantes de glándula salival
tienen varias limitaciones importantes . Si el xeroftalmos se debe a una enfermedad
exocrina autoinmune, las glándulas salivales están también afectadas; por ello, los
autotransplantes se seguirán destruyendo parcialmente, y los heterotransplantes
necesitarán un tratamiento inmunosupresor cuyos pros y contras habrá que sopesar. Otro
tanto ocurre en las enfermedades mucosinequiantes, en las que si se mantiene la evolución
de la enfermedad, los transplantes glandulares salivales se atrofian, tal vez por cierre
de sus conductos excretores.
La secreción es diferente para cada tipo
de glándula, lo cual puede permitir seleccionar el tipo de glándula a transplantar
según las necesidades del ojo.
La secreción producida es escasa. En los
pacientes transplantados con fragmentos de glándulas salivales la prueba de Schirmer
aumenta aproximadamente sólo 1 mm por centímetro cúbico de glándula transplantada en
caso de glándula sublingual y aproximadamente el doble si la glándula es submandibular o
parótida. Para apovechar este escaso aumento de la secreción es conveniente preceder o
simultanear la operación de transplante del parcheo de los puntos lacrimales, de una
cisternoplastia o de una operación reductora de la abertura palpebral. La secreción de
los fragmentos transplantados no aumenta por estímulos reflejos ni emocionales, pues la
glándula permanece denervada, pero sí aumenta por la instilación tópica de
pilocarpina.
Para conocer la pervivencia del tejido
glandular transplantado se puede recurrir a varias pruebas (1) La mejoría de los
síntomas y signos de ojos seco, lo que es bastante impreciso, aunque digno de tener en
cuenta. (2) La biopsia de un fragmento de tejido transplantado y comprobación de acinos
funcionantes es prueba clara de funcionamiento (Murube et al 1990b, 1991), pero no puede
repetirse a menudo pues el tejido transplantado es escaso. (3) El aumento de la amilasa
vertida al mar lacrimal (Murube et al 1994), ha mostrado que el líquido recogido de la
cuenca lacrimal del ojo transplantado tenía valores medios de amilasa de 5.148 U/l,
mientras que en los ojos controles adelfos no transplantados estos niveles eran de 635
U/l.
Se han hecho alotransplantes de glándula
submandibular tanto en forma de transplante con anastomosis vascular como de fragmentos
sin anastomosis vascular (Murube et al 1994).
TRANSPLANTES DE GLÁNDULA TOTAL CON
ANASTOMOSIS VASCULAR
Esta técnica es quirúrgicamente
compleja, y sólo justificable en casos de ojo seco grado 3 con normalidad de las
glándulas salivales. La glándula más fácil de transplantar es la submandibular (figura
40-6).
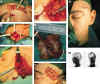
Figura 40-6. Transplante de
glándula submandibular a la fosa temporal, con anatomosis vascular. A, Apertura de la
fosa temporal, extracción de su masa muscular anterior, perforación con fresa de la
pared ósea lateral de la órbita y conexión con la cuenca lacrimal. B, Incisión
cutánea submandibular. C, Disección de la glándula y del conducto de Wharton. D,
Aislamiento de la rama del nervio facial vecina, sin herirla. E, Extracción de la
glándula in toto. F, Colocación de la glándula, ya procesada, en la fosa temporal,
sutura vasculo-vascular, y sutura del conducto de Wharton a la conjuntiva. G, Cierre de la
herida. H, Escintilografía mostrando la captación de isótopos radioactivo y el
funcionamiento de la glándula transplantada unos meses después.
Se prepara el lecho receptor afeitando el
cuero cabelludo temporal. Se hace una incisión de 6 cm aproximadamente horizontal desde
el inicio de la zona pilosa a la altura de la ceja. Se localizan la arteria y vena
temporales superficiales, se cortan y se pinzan. Se extirpa la masa muscular de la parte
anterior de la fosa temporal en cantidad aproximada de 10 ml. Se perfora la pared externa
de la órbita por detrás del reborde orbitario y se abre la conjuntiva adyacente para
conecta la herida de la fosa temporal con el fórnix conjuntival lateral. Se deja
momentáneamente una gasa húmeda sobre este campo quirúrgico.
Después se cambia de campo, y se hace
una incisión de 3 cm que sigue la parte interna de la rama horizontal del maxilar, por
delante de su ángulo. Se atraviesa el músculo platisma. Se identifica la rama
maxilo-bucal del nervio facial y se desplaza para exponer el polo posterior de la
glándula submandibular; la manipulación excesiva o la distentensión del nervio puede
producir una leve paresia del lado homolateral de la boa durante algunas semanas la
sección del nervio produce una parálisis permante homolateral de la boca. La glándula
salival submandibular se va disecando, y cuando se localiza el ganglio submandibular
adherido a su superficie, con aspecto de un pequeño grano de arroz blanquecino, se cortan
sus raíces proximales dejando el ganglio adherido a la glándula (sección nerviosa
preganglionar). La disección de la glándula se continúa hacia adelante y adentro a lo
largo de 4-5 cm, y se sigue alrededor del conducto de Wharton hasta debajo de la lengua,
incluyendo un poco de la mucosa que bucal que rodea la desembocadura del conducto.
Después, se seccionan la arteria y vena principal de la glándula y se extrae ésta.
Inmediatamente, la vena se perfunde con solución fría (5ºC) de heparina y con perfadex
y se transplanta al lecho previamente preparado en la fosa temporal.
Una vez colocada la glándula
submandibular en la fosa temporal se suturan sus vasos a la arteria y vena temporales
superficiales (que habían sido previamente pinzadas) con alrededor de 20 puntos de nylon
10-0 cada anastomosis. Terminada la sutura se desclampan los vasos y si hay algún escape
sanguíneo se corrige con nuevas suturas. El conducto de Wharton se pasa por el agujero
abierto en la pared lateral de la órbita y la mucosa bucal que rodea su desembocadura y
se cose a la conjuntiva del fórnix conjuntival lateral. Finalmente se cierra el cuero
cabelludo sobre la glándula transplantada.
El tratamiento postoperatorio con
antibióticos, corticoides y perfusión venosa de Dextrán 70 se aplica durante varios
días. El tiempo de protrombina debe mantenerse entre 10 y 20 segundos durante un mes. Si
no se hizo autotransplante, sino alotransplante, hay que añadir tratamiento
inmunosupresor.
La glándula transplantada tiene una
denervación parasimpática pregangliónica (por sección del nervio lingual) y
ortosimpática postgangliónica (por sección de su arteria nutricia), y produce una buena
secreción basal sin ritmo prandial. Esta técnica fue introducida por nosotros en el
conejo y en el humano en autotransplante (Murube 1986a) y en alotransplante (Murube
1988a), y su eficacia, en cuanto a supervivencia histológica ha sido ratificada
experimentalmente en modelo animal por Kumar et al 1990 (Murube et al 1995, Murube 1996e).
TRANSPLANTES DE FRAGMENTOS DE
GLÁNDULA SALIVAL SIN ANASTOMOSIS VASCULAR
El transplante de una glándula
sublingual salival en un bloque, colocándolo en el fórnix conjuntival superior entre el
elevador del párpado superior y el techo orbitario, se sigue de necrosis por dificultades
de revascularización. Por el contrario hay una revascularización espontánea si se
transplantan fragmentos de glándulas salivares mayores (sublingual, submandibular y
parótida) a la cuenca lacrimal (Murube 1986a, 1988a, 1994, 1995a, 1996e).
La técnica es sencilla (figura 40-7). Se
inicia con la preparación del lecho receptor palpebral. Para ello, se evierten los
parpados (el superior con doble eversión con separador de Desmarres). Previa inyección
subconjuntival de suero salino o sin ella, se secciona la conjuntiva a lo largo del borde
orbital de los tarsos y se diseca en dirección a los fórnices, separándola del músculo
de Müller y la aponeurosis del elevador en el párpado superior, y del músculo tarsal
inferior y fascia cápsulo-palpebral en el párpado inferior.
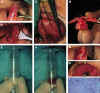
Figura 40-7. Transplante de
glándula sublingual, en fragmentos sin anastomosis vascular. A, Se prepara el lecho
receptor, evertiendo el párpado superior con retractor de Desmarres. B, Se secciona la
conjuntiva a lo largo del borde orbital del tarso y se despega del tejido subyacente. C,
Extracción de una glándula sublingual. D, Fragmentación de la glándula en rodajas. E,
El tejido a transplantar se cubica usando una jeringuilla con BSS y F, introduciéndolo en
ella, y midiendo el ascenso del nivel líquido. G, Los fragmentos glandulares se colocan
sobre el lecho palpebral previamente preparado, y H, se recubren de conjuntiva. I, El
tejido transplantado regenera y sobrevive, como se aprecia en esta biopsia, realizada
meses después.
Después, se toma un bloque de glándula
salival mayor de 1-2 ml de volumen. Si la glándula es la submandibular o la parótida el
bloque glandular debe incluir solo parénquima secretorio y su estroma interno; si la
glándula es sublingual, que sólo está separada de la cavidad bucal por la mucosa bucal,
se extirpa la glándula incluyendo esta mucosa en un bloque, de forma que los pequeños
conductos excretores de la glándula no se separan de la mucosa que atraviesan.
La glándula más fácil de tomar es la
sublingual. Se abre la boca con un separador de Gosset. La glándula sublingual hace
relieve bajo la lengua, a cada lado del frenulum linguae.
Después, los bloques glandulares tomados
se cortan en 2-5 rodajas más o menos paralelas a la dirección de los conductos
excretores, de 1-2 mm de espesor. La porción distal de cada rodaja debe marcarse con un
colorante vital o con una sutura, excepto en las glándulas sublinguales en las que la
mucosa sirve de reparo. Estas rodajas se colocan sobre el lecho cruento palpebral, unas al
lado de otras, hasta cubrir el lecho, orientando sus conductos excretores hacia el borde
del tarso, y se suturan al lecho con tres o cuatro puntos de sutura reabsorbible para
asegurar que se mantengan extendidas. Finalmente, se repone la conjuntiva septal cubriendo
los fragmentos y se cose con la conjuntiva tarsal. Cuando la glándula es submandibular o
parótida, la conjuntiva cubre todo el fragmento, pero cuando la glándula es sublingual y
cada fragmento conserva la conjuntiva que lo tapiza, se deja que este fragmento de mucosa
quede tapizado la cuenca lacrimal entre las conjuntivas tarsal y septal
El proceso de regeneración del tejido
fue establecido en injertos de glándulas sublinguales en conejos, por Moriche 1988 y
Moriche et al 1988, 1989, mostrando una primera fase de necrosis del injerto seguida de
otra de regeneración, y observando que la mejor regeneración se hace en los fragmentos
del injerto situados junto al tejido muscular del parpado.
TRANSPLANTES GLÁNDULOMUCOSOS DE
GLÁNDULAS SALIVALES MENORES
Consiste este tipo de transplante en
transferir al ojo un fragmento de glándula salival menor sin separarlo de la mucosa que
lo reabre. La mayor ventaja de los transplantes glándulo-mucosos es que no se fragmentan
los lobulillos secretorios y que los conductos de desagüe permanecen intactos. Venimos
usando este tipo de transplante desde hace 2 años, no habiendo hecho hasta el presente
ninguna comunicación sobre ello. Hemos usado las glándulas palatinas y las labiales
superiores e inferiores, siendo estas últimas las que preferimos por su fácil
accesibilidad quirúrgica (figura 40-8).
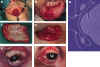
Figura 40-8. Tansplantes
glándulo-mucosos en bloque único. A, Toma de tejido de glándulas palatinas. B, Toma de
tejido de glándulas labiales inferiores. C, Bloque glándulo-mucoso visto por su cara
mucosa. D, bloque glándulo-mucoso visto por su cara glandular. E, El transplante se lleva
a un lecho palpebral como el de la figura 40-7 B, y se sutura su mucosa bucal a la
conjuntival. En este caso se han hecho sendos transplantes a los fórnices superior e
inferior. F, El mismo transplante, dos meses después. G, Esquema de la disposición final
del transplante.
Se prepara el lecho ocular como para un
transplantes de fragmentos glandulares, es decir, separando la conjuntiva del substrato
musculoseptal, a partir del borde tarsal. Después, se secciona un fragmento de mucosa
oral con sus glándulas adheridas. En el caso de las glándulas labiales inferiores, los
lobulillos secretorios, situados unos junto a las otros, forman un manto casi continuo que
cubre en altura desde el labio hasta el surco gingivo-labial, y en anchura desde
aproximadamente una comisura labial hasta la otra. Cada lobulillo tiene aproximadamente
3x3x3 mm, por lo que un fragmento de mucosa labial de 2x3 cm con sus correspondientes
glándulas adheridas suministran 0'6 c.c. de tejido glandular. El bloque de tejido
mucoglandular se obtiene haciendo una incisión fusiforme con eje mayor horizontal de
2-2'5 cm y eje menor vertical de 1 cm. Así se obtiene un bloque paralelepipédico que se
lleva al lecho previamente preparado en el párpado, y que se coloca con su cara glandular
o cruenta sobre el lecho preparado en los párpados, y con su cara mucosa hacia el
interior de la cuenca lacrimal en continuación con la conjuntiva. El transplante se fija
cosiendo la mucosa bucal a la mucosa conjuntival con varios puntos de sutura y se mantiene
el ojo cerrado durante 7-14 días.
Este tipo de transplantes es el que hasta
el presente ha dado mejores resultados
TRANSPLANTE DE MUCOSA
La mucosa bucal no es un buen sustituto
de la mucosa de la cuenca lacrimal, ya que carece de células caliciformes en la mayor
parte de su superficie. Sin embargo, ha sido muy usada para reconstruir la cuenca
lacrimal, con lo que se obtiene un buen resultado tectónico, pero no mucosecretor.
La mejor mucosa para transplantes mucosos
es la proveniente de la conjuntiva del ojo contralateral (Lemp 1987), pero esto no es
siempre posible. La de la fosa nasal (Murube 1993b, 1995a) puede tomarse del septum nasi,
de la pared lateral o del cornete inferior (figura 40-9). Es mucho más gruesa, opaca y
rojiza que la conjuntiva, por lo que se usa sólo para los fórnices.
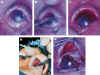
Figura 40-9. Transplante de
células mucíparas. A, ojo afecto de simblefaron por causticación. B, Preparación del
lecho del transplante, separando el párpado de tejido episcleral cicatricial. C, Lecho
preparado. D, Toma de mucosa nasal, pasado el vetibulum nasi. E, Colocación y sutura de
la mucosa.
TRANSPLANTE DE GLÁNDULAS LÍPIDAS
Con motivo de una pequeña tumoración en
la carúncula de un ojo, hemos hecho desde 1990 tres transplantes de media carúncula del
ojo contralateral, incluyendo en el fragmento formaciones pilosas y glándulas lípidas
carunculares (figura 40-10). Con ello pretendíamos recuperar la morfología del mar
lacrimal más parecida a la normal, y suministrar al mismo tiempo lípidos y mucina a un
área que naturalmente los tiene,

Figura 40-10. Transplante de
carúncula. A, Extirpación de la carúncula de un ojo. B, Extirpación de media
carúncula del ojo contralateral. C, Sutura del fragmento caruncular en el primer ojo. D,
Estado final meses después.
Como las funciones bioquímicas y
biofísicas de la carúncula y de sus glándulas permanecen en el terreno de las
hipótesis, el fundamente para hacer esta intervención no tenía grandes apoyos, pero
tampoco nada que lo contraindicase.
Los pacientes evolucionaron normalmente y
su flujo lacrimal y superficie ocular son normales y no tienen manifestaciones de ojo
seco. Tal vez habría ocurrido lo mismo si no se hubiese hecho el autotransplante. |