|
INTRODUCCIÓN
A) Finalidad: La queratoplastia penetrante sustituye parte o la
totalidad de la superficie corneal del paciente en todo su espesor por tejido
corneal de un donante homólogo (alogénico; homotransplante: córnea de
cadáver) o, en raras ocasiones, emplea una córnea del mismo individuo
(autotransplante), utilizando la córnea sana de un ojo adelfo sin posibilidades
visuales significativas (autotransplante contralateral) o la córnea del ojo en
cuestión una vez rotada para mejorar su transparencia y/o regularidad
(autotransplante rotacional). Puede indicarse por 4 finalidades principales:
Ópticas: Proporcionar un eje visual transparente con una
superficie corneal homogénea sin defectos refractivos severos.
Terapéuticas: Eliminar una patología corneal (p. e. una
queratitis micótica o un edema corneal).
Tectónicas: Solucionar una perforación o adelgazamiento corneal
que amenaza la integridad del globo ocular.
Cosméticas: Eliminar cicatrices o depósitos corneales
antiestéticos (rara vez se indica por esta finalidad: se prescriben lentes de
contacto cosméticas inicialmente).
Estas finalidades coinciden y se superponen a menudo: La segunda y la tercera
finalidad buscan secundariamente un resultado óptico-refractivo óptimo, si
bien éste es considerablemente más difícil de obtener dadas las patologías
implicadas y las complicaciones que suelen asociarse. La queratoplastia
tectónica es ya una terapéutica. Una queratoplastia mejora la cosmesis del
globo si el injerto se mantiene transparente.
La QPP se indica por estas 4 finalidades, siendo las dos primeras las más
frecuentes en la práctica clínica.
B) QPP versus queratoplastia del adulto: La QPP se diferencia de la
del adulto en numerosos aspectos:
1. Patologías corneales: En la población infantil aparecen ciertas
patologías específicas tales como: distrofia polimorfa posterior, distrofia
hereditaria endotelial congénita, esclerocórneas, disgenesias del segmento
anterior (incluyendo la anomalía de Peters), el trauma obstétrico, la
infección connatal o la córnea del glaucoma congénito. Estas patologías
pueden llevar asociadas otras alteraciones oculares o sistémicas que
condicionan decisivamente la supervivencia del injerto.
2. Receptor pediátrico. Caracterizado por:
Falta de colaboración en las exploraciones, el tratamiento y en la
referencia de clínica oftalmológica asociada al rechazo. Es necesaria la
colaboración de los padres o tutores en el tratamiento y seguimiento
postoperatorios.
Posibilidad de sufrir ambliopía deprivacional o refractiva por la
patología corneal y postransplante. Si la opacidad es congénita, debe ser
intervenida precozmente. Es necesaria una refracción cuidadosa y terapia
oclusiva hasta los 7-8 años.
Necesidad de anestesia general para el procedimiento y la retirada de
suturas.
Dificultad en el manejo del globo abierto, con tendencia al colapso
escleral y extrusión de contenidos intraoculares (1-4). Hace necesario el
empleo de anillos de soporte escleral.
Dificultad en el manejo de la córnea receptora, sumamente elástica.
Dificulta una sutura continua regular, que además podría ser seccionada
accidentalmente por el niño. Por lo tanto, se tiende a suturar con puntos
sueltos (5-7), en mayor número proporcionalmente que en un adulto.
Frecuente necesidad de practicar procedimientos asociados, derivada de la
complejidad de las indicaciones: Sinequiolisis, iridoplastias, lensectomía,
vitrectomía, cirugía del glaucoma.
Mayor tasa de endoftalmitis que en los adultos (5,6,8).
Menor porcentaje de supervivencia del injerto que en los adultos: El
primer año un 75% (7,8) versus un 90% (para el grupo 1 de Buxton) (9). Por
tanto, existe una mayor probabilidad de necesitar retransplantes.
La pérdida de transparencia de injerto tiende a ocurrir sin signos de
rechazo endotelial (precipitados queráticos, uveítis, línea de Khodadoust)
(10).
De este modo la QPP se incluye en los grupos pronósticos 3 y 4 de Buxton
(9), con un porcentaje de éxitos no superior al 80%, y frecuentemente inferior
al 50%.
3. Factores parentales. Es preciso considerar que:
Los padres o responsables legales deben comprender el pronóstico de la
QPP en su caso concreto según la etiología de la queratopatía, uni o
bilateralidad y otras patologías concomitantes. Deben conocer además que la AV
postquirúrgica promedio en las opacidades congénitas es de percepción de luz,
y 0,1 en las adquiridas (10).
Es previsible que el niño necesite varias intervenciones, incluyendo
retiradas de puntos, nuevas suturas y retransplantes. El número de consultas
será muy elevado. Todo ello conlleva una importante inversión en tiempo y
dinero.
Los factores psicológicos en los padres desempeñan un importante papel
y pueden llevarles a solicitar la cirugía en casos de pésimo pronóstico (por
considerarse culpables, por pena, por temor a recriminaciones futuras, etc.).
Estos factores deben ser comprendidos y analizados conjuntamente con los padres.
No puede descartarse a priori una queratoplastia por estos motivos («póngase
usted en mi lugar»).
Los padres son imprescindibles en el cuidado postoperatorio ya que
instilarán los tratamientos tópicos, realizarán las oclusiones necesarias y
vigilarán los signos de rechazo. Si no son colaboradores por incapacidad mental
o desidia, la queratoplastia está abocada al fracaso. Por eso necesitan conocer
la dureza del camino que van a emprender, y el cirujano debe investigar si
tienen suficiente motivación para ello.
INDICACIONES
Está clara la indicación en las QPP planteadas por motivos terapéuticos
y/o tectónicos. Antes de indicar una QPP por motivos ópticos deben
considerarse los siguientes puntos:
1. Uni o bilateralidad:
Los casos bilaterales son generalmente de etiología congénita
(lo cual motivaría un tratamiento precoz), y frecuentemente padecen una
afectación asimétrica. Normalmente se indica primero la cirugía del ojo más
severamente afectado para después plantear la cirugía en el otro ojo según su
evolución o incluso practicar un retransplante si el injerto ha evolucionado
desfavorablemente. Se trata de que al menos un ojo tenga posibilidades de
visión útil, siendo prudente intervenir los dos para incrementar así esta
probabilidad. Determinados cirujanos intervienen los dos ojos en el mismo acto
quirúrgico para que ambos po sean las mismas oportunidades visuales desde el
comienzo (11). Ésta puede ser una opción válida si están similarmente
afectados, hecho infrecuente. Además conlleva varios problemas:
Se deben conseguir dos córneas donantes, situación complicada.
Se prolonga el acto quirúrgico extraordinariamente, con el riesgo vital
que ello puede originar y la fatiga para los cirujanos y ayudantes.
Ambos ojos se exponen a complicaciones quirúrgicas que pueden conducir a
un resultado funcional peor que el estado prequirúrgico.
Los casos unilaterales han sido considerados inoperables por
ciertos autores (5). No obstante, actualmente se intervienen si la visión del
niño es (o se calcula) inferior a 1/10, y siempre que otros medios no
proporcionen resultados satisfactorios (p.e. lentes de contacto). La finalidad
de la cirugía es mantener un ojo con visión útil como reserva en caso de
daño del ojo sano. La cirugía debe ser precoz en los casos de opacidades
congénitas.
2. Severidad del cuadro: Como norma orientativa, la indicación
quirúrgica se reserva para opacidades severas que condicionen una AV inferior a
1/10, y no tratables por otros medios más conservadores, como las lentes de
contacto o las iridectomías ópticas.
3. Etiología: Las indicaciones según la etiología se dividen
tradicionalmente en tres grupos, con importancia pronóstica (4) y terapéutica
(figura 1):

Figura 1. Diversas indicaciones etiológicas de la queratoplastia
pediátrica: a) Anomalía de Peters; b) Esclerocórnea; c) Trauma penetrante; d)
Causticación corneal; e) Herpes simple; f) Queratocono.
Opacidades congénitas: En nuestro medio las causas más frecuente
son la anomalía de Peters (con las disgenesias asociadas) y las
esclerocórneas. Este grupo es el que ofrece resultados anatómicos y
funcionales más pobres (4,10,12), si bien existen discrepancias sobre la
anomalía de Peters (13). Frecuentemente existen malformaciones oculares
asociadas y la incidencia de glaucoma es importante (12). El momento de la
intervención limita poderosamente el resultado funcional, ya que una cirugía
tardía no puede evitar una ambliopía deprivacional profunda. Los mejores
resultados se obtienen con una cirugía precoz, antes de los 4 meses de vida
(10).
Opacidades adquiridas postraumáticas: Este grupo ofrece
resultados mejores que el anterior, aunque estos ojos requieren cirugías
complejas (reconstrucción del segmento anterior, sinequiotomías,
iridoplastias, extracción de catarata-implante de LIO, vitrectomía) (14), todo
lo cual puede amenazar la supervivencia del injerto (8).
Opacidades adquiridas no postraumáticas: Es el grupo que ofrece
los mejores resultados (4). En nuestro medio las etiologías más frecuentes son
la queratopatía postherpética y el queratocono.
CONSIDERACIONES PREQUIRÚRGICAS
A. Examen oftalmológico preoperatorio: Es indispensable para conocer
anomalías asociadas a la queratopatía, planificar la cirugía o bien
descartarla. Concretamente es preciso obtener información acerca de:
Anomalías iridianas asociadas: El iris protege al cristalino en
la trepanación corneal. Por otra parte, las sinequias iridocorneales
periféricas se relacionan directamente con el glaucoma postransplante (15),
además de comprometer la supervivencia del injerto (16).
En niños pequeños utilizamos una lámpara de hendidura portátil para
practicar la biomicroscopia.
Tensión ocular: La hipertensión ocular (HTO) prequirúrgica es
un factor asociado directamente a la HTO postransplante (17), pudiendo limitar
así el resultado visual final de la queratoplastia. La HTO se debe controlar en
lo posible previamente al transplante con el fin de evitar complicaciones preoperatorias (10). Si la causa de la HTO es desconocida o se debe a una
anomalía permanente como sinequias anteriores periféricas, presumible daño
trabecular postinflamatorio, o disgenesias del segmento anterior (p. e.
anomalía de Peters), se debe planificar una cirugía combinada de
queratoplastia y procedimiento filtrante. Nosotros preferimos la inserción
concomitante de una válvula de Ahmed para el glaucoma (VAG). La cirugía
filtrante tiene la finalidad de controlar la PIO postoperatoria sin necesidad de
medicación antiglaucomatosa en la medida de lo posible. La queratoplastia en un glaucoma congénito primario debe considerarse una medida extrema, con un
pronóstico pobre, y a realizar como último recurso visual en un ojo con
opacidad corneal severa y con PIO ya controlada.
Practicamos la tonometría con el tonómetro de aplanación de Perkins en
consulta, sin sedación y consideramos 25 mm Hg el límite superior de la PIO
normal en un niño agitado. Si existen dudas se repetirá la determinación en
quirófano bajo sedación. En las córneas irregulares utilizamos el Tono-Pen®,
que emplea el principio tonométrico por aplanación de Mackay-Marg.
Evaluación del cristalino: La extracción del cristalino
cataratoso se debe planificar previamente a la cirugía con el fin de calcular
el poder de la LIO a implantar y disponer del material adecuado, incluyendo
vitrectomo.
Para conocer el poder dióptrico de la LIO se emplea la biometría
ultrasónica en los niños mayores, aplicando posteriormente la fórmula de
regresión empírica SRK II. En los niños más pequeños se emplea la
ecografía para realizar la ecometría, y del cálculo basado en el SRK II se
practica una reducción según la edad.
Evaluación de vítreo y retina: Si la oftalmoscopia es
dificultosa se realizará una ecografía, y si existen dudas acerca de la
funcionalidad retiniana, se recurrirá a pruebas electrofisiológicas
(Potenciales Evocados Visuales —PEV— principalmente).
B. Examen pediátrico: Se debe solicitar en los casos en que se
sospeche una alteración sistémica asociada, como en la anomalía de Peters o
en las esclerocórneas (18).
C. Examen anestesiológico preoperatorio.
D. Consentimiento informado: Deben discutirse con los padres los
factores ya comentados, particularmente lo referido a:
El pronóstico anatómico y funcional de la QPP en general y del caso
concreto en particular.
La necesidad para el niño de múltiples anestesias generales e
intervenciones, y múltiples consultas para todos.
La obligatoria participación de los padres en los tratamientos
postransplante.
La responsabilidad en la vigilancia diaria de los signos de rechazo.
E. Selección de la córnea donante: Es práctica común emplear en la
QPP córneas de donantes jóvenes, idealmente menores de 30 años, porque el
número de células endoteliales en ellas es mayor (19), y ello resulta
conveniente en queratoplastias de alto riesgo. Las córneas de los niños
menores de 3 años son difíciles de manejar por su elasticidad (5,8,20), si
bien su elevado poder dióptrico las hace útiles en ojos afáquicos por la
miopía que inducen (20-22), particularmente si el injerto es mayor que la
trepanación del receptor (23). Es responsabilidad última del cirujano
comprobar al menos macroscópicamente el estado de la córnea que se va a
implantar, con el fin de descartar córneas con graves desepitelizaciones o
sometidas a cirugías refractivas previas.
F. Momento de la cirugía: La ambliopía deprivacional se instaura en
los ojos afectos de opacidades corneales de larga evolución, si el niño es
menor de 8 años. De ahí la importancia de la cirugía precoz. Por otra parte,
existe un período de maduración visual crítico durante los 3-4 primeros meses
de vida. La deprivación en esta época conduce a una ambliopía irreversible
(10), que afecta también a los casos bilaterales. Por tanto, la cirugía en los
casos congénitos debe ser lo más precoz posible, anterior al 4.º mes de vida.
En los casos de rechazo se reintervendrá, si está indicado el retransplante,
una vez que haya remitido la inflamación, sin dejar transcurrir más de 3
meses.
G. Preparación quirúrgica:
1. Pupila:
Si se anticipa una lensectomía y/o vitrectomía se procederá a una
midriasis de modo similar al adulto, si bien en niños menores de un año
deberá reducirse la dosis y se empleará ciclopentolato al 0,5% y fenilefrina
al 2,5% (24,25).
Si no se prevé una cirugía sobre el cristalino o no se conoce su estado
es recomendable utilizar pilocarpina al 2% para provocar miosis y de este modo
protegerlo.
Si el ojo es afáquico no se administrarán ni midriáticos ni mióticos,
a no ser que se prevea una cirugía sobre vítreo o retina.
Se puede proceder al manejo pupilar por medio de fármacos intracamerulares
del mismo modo que en el adulto, una vez que se ha trepanado en alguna
extensión la córnea.
En muchas ocasiones el iris no posee motilidad en todo o en parte de su
superficie, especialmente si existen sinequias posteriores previas, como en los
casos postraumáticos, postinflamatorios (p.e. queratouveítis herpética) o en
los retransplantes. También ocurre en los casos disgenésicos, como la
anomalía de Peters, en la que existen sinequias iridocorneales centrales (12).
En estos casos se aplican los principios anteriores en lo posible.
2. Hipotensión ocular: Si bien es importante el control crónico de
la PIO con el fin de no comprometer el resultado funcional de la QPP (26), no lo
es menos conseguir una hipotensión ocular durante la cirugía. Ello pretende
impedir que la tendencia natural al colapso escleral expulse contenidos
intraoculares (1-4,10,27) y es una medida complementaria al uso de anillos de
soporte escleral. Se utilizan los siguientes medios:
Hiperventilación del paciente por parte del anestesista, que produce una
hipotensión ocular (28). Asimismo la posición anti-Trendelenburg con la cabeza
más elevada que los pies facilita el retorno venoso orbitario y la hipotensión
ocular.
Hipotensores osmóticos: Se utiliza el manitol a dosis de 1gr/kg de peso
en infusión lenta, alrededor de 1/2-1 hora antes de la incisión.
Compresión del globo ocular, por medio del masaje digital o balón de
compresión tipo Honan (29,30). Esta maniobra previene, además, la pérdida de
células endoteliales (31).
3. Antibióticos y profilaxis de la endoftalmitis:
En un intento de prevenir la endoftalmitis postquirúrgica precoz se han
utilizado antibióticos tópicos profilácticos (32) durante algunos días
previos a la cirugía, pero hoy en día se cree que tiene el mismo valor el
empleo de povidona yodada al 5% en los momentos previos a la incisión (33).
Sin embargo, actualmente se cree que la fuente principal de endoftalmitis
precoz postqueratoplastia es la contaminación del botón donante, existiendo
una correlación entre los cultivos microbiológicos de muestras intraoculares y
los cultivos obtenidos de la zona periférica del donante (34,35). Por tanto, se
remitirán estas zonas para cultivo. No todos los cultivos positivos
desarrollarán endoftalmitis (35,36), pero parece prudente realizar un
seguimiento especial de los ojos receptores de las córneas aparentemente
contaminadas. Los cultivos positivos, con sus antibiogramas, pueden orientar el
tratamiento precoz de la endoftalmitis.
Los antibióticos profilácticos de los medios de conservación corneal
no son activos frente a gérmenes Gram+ a la temperatura de preservación de
4°C (37,38), o bien los gérmenes pueden resultar resistentes (35). Una
estrategia interesante destinada a activar los antibióticos del medio de
conservación es el calentamiento de la córnea donante a temperatura ambiente
desde una hora previa a la cirugía (39), si bien este lapso de tiempo puede
resultar insuficiente (37).
4. Corticoides: En los casos de queratitis bacteriana activa se ha
recomendado el empleo de corticoides tópicos desde las 24 horas previas a la
queratoplastia (40).
METODOLOGÍA DE LA QUERATOPLASTIA
A. Instrumental: Se puede emplear el mismo instrumental utilizado para
la queratoplastia del adulto pero con las siguientes consideraciones:
1. Es necesario el empleo de anillos de soporte escleral, de diámetro
especialmente pequeño en muchas ocasiones. Nosotros utilizamos los tipo
Flieringa, en juegos de diámetros que van desde los 12 mm hasta abarcar los del
adulto. Los tamaños inferiores se emplean en la vitrectomía «a cielo
abierto» de la retinopatía del prematuro y en la QPP de ojos con
microcórnea-microftalmos.
2. Los trépanos deben abarcar ciertos diámetros inusuales en los
adultos. En una QPP se tiende a respetar los 1,5-2 mm de córnea receptora
periférica, lo cual puede significar el empleo de trépanos de 6 mm de
diámetro, factor que debe ser considerado por cuestiones logísticas. La
determinación de los diámetros corneales se realiza intraoperatoriamente con
el niño anestesiado, siendo el referente el diámetro inferior. Actualmente
nuestra preferencia son los trépanos de vacío tipo Hessburg-Barron que
permiten estabilizar en cierta medida la presión de succión sobre la córnea
trepanada minimizando el efecto que la hipo e hipertensión oculares puedan
ejercer, y evitando así cortes mayores de lo previsto (globos hipertensos) o
cortes biselados (globos hipotónicos). Las córneas infantiles tienden a
retraerse por su elasticidad, y de este modo se amplía el diámetro de la
trepanación. Esto debe ser considerado al elegir el diámetro del botón
donante.
3. Discrepancia receptor-donante. El empleo de un botón donante 0,5
mm mayor que la trepanación receptora tiene los siguientes efectos:
Suple una posible deficiencia de tejido si la trepanación receptora es
más grande de lo previsto (según el apartado anterior).
Facilita la aposición de los tejidos disminuyendo el número de suturas
necesarias para lograr la estanqueidad de la herida quirúrgica (41).
Disminuye el número de sinequias anteriores (42), las cuales, como queda
referido, se relacionan con el fracaso del injerto y el glaucoma
postquirúrgico.
Disminuye la incidencia del glaucoma postqueratoplastia (43).
Sin embargo, induce una miopía. Esto puede ser beneficioso en los ojos
afáquicos, pero es problemático en los queratoconos, que se asientan en
córneas con ectasia generalizada.
Es necesario siempre considerar que las cór neas donantes trepanadas desde
el endotelio tienen de hecho 0,25 mm menos de diámetro que el valor nominal del
trépano utizado debido a la compresión ejercida durante la trepanación
(27,44).
Ciertos autores recomiendan preparar un botón donante 1 mm mayor que la
trepanación receptora de la QPP (45), con el fin de reducir el número de
sinequias anteriores y aumentar las posibilidades de supervivencia del injerto.
B. Técnica: El procedimiento debe realizarse en niños bajo anestesia
general.
1. Realización de procedimientos combinados previos.
Cirugía filtrante: Si se va a realizar una trabeculectomía parece
preferible esperar a finalizar la sutura corneal, pero en la inserción de la
válvula de Ahmed para el glaucoma (VAG) es preferible realizar inicialmente la
peritomía, sutura de los hápticos de la válvula a la esclera y la
elaboración del colgajo escleral. Todo queda preparado para la colocación
final del tubo que se realizará bajo visualización «a cielo abierto» tras la
trepanación del receptor. De este modo no varía la PIO previa a la
trepanación, no se interfiere en la queratoplastia y tampoco se dificulta la
sutura de la VAG por hipotonía ocular.
Estabilización corneal (córneas perforadas): Si se dispone de trépanos
de vacío los problemas que conlleva la manipulación de un ojo hipotónico se
minimizan (44). En caso de no disponer de ellos, es prudente recubrir los
defectos corneales pequeños (hasta 2 mm de diámetro) con cianoacrilato (figura
2), a fin de conservar el tono ocular para realizar así una trepanación más
precisa y regular. Pueden utilizarse otros materiales para este fin, incluyendo
esclera, fascia lata y duramadre.

Figura 2. Estabilización corneal tras perforación: a) Úlcera
neurotrófica postherpética; b) Aplicación de cianocrilato; c) Resultado
final.
2. Higiene de la superficie ocular con povidona yodada al 5%, del modo
habitual.
3. Colocación de blefarostato, que debe separar y no comprimir el
globo bajo ningún concepto.
4. Colocación del anillo de Flieringa. No existe uniformidad de
criterios en el modo y lugar de colocación.
Se tiende a suturar sobre la esclera, aproximadamente, a una distancia
intermedia entre el limbo y las inserciones musculares, cuidando que no sea
comprimido por el blefarostato, pues transmitiría presión al globo y
generalmente de modo asimétrico, por lo que además induciría una deformación
corneal en la trepanación y el consecuente astigmatismo.
Se utilizan entre 4 y 8 suturas de seda de 6/0; la aguja espatulada se
pasa aproximadamente por la mitad de espesor escleral. El anillo debe poder
rotarse entre las suturas con facilidad, lo cual indica que no comprime el
globo. Asimismo, no debe traccionar el globo a través de las suturas ya que
ello supondría una deformación del mismo.
Ciertos autores prefieren utilizar cabos largos en algunas de las suturas
con el fin de facilitar la colocación del globo en la posición adecuada (27).
Estos cabos se fijan al campo quirúrgico del modo habitual.
5. Determinación del tamaño corneal en los dos diámetros
principales y del diámetro del trépano necesario, según los principios
antedichos.
6. Trepanación del donante (figura 3). Se elige un trépano de
diámetro superior a la trepanación receptora, como queda ya expuesto.

Figura 3. Trepanación del botón donante.
Es importante recomprobar el estado macroscópico de la córnea donante
antes de proceder a la trepanación.
Se debe inspeccionar el estado del trépano y comprobar que es del
diámetro elegido.
Si se va a utilizar un disco de soporte de Teflón se comprueba que no
tiene cortes o rugosidades que puedan inducir una desepitelización. Se
inspecciona y además se palpa con el dedo. Conviene que la superficie esté
levemente húmeda, para proteger el epitelio. En los trépanos de vacío no
existen estos problemas, ya que su superficie es de plástico liso.
La córnea donante debe centrarse meticulosamente sobre el disco de
Teflón o la superficie plástica sobre la que se aplica la aspiración en los
trépanos de vacío.
En los trépanos de vacío, al liberar la jeringa de aspiración, la
córnea donante queda fijada en el lugar elegido gracias a la succión que se
produce.
La trepanación se hace con un movimiento rápido, con decisión,
buscando el corte completo.
Con los trépanos clásicos sin sistema de vacío es frecuente que la
córnea trepanada quede adherida al trépano obturándolo. El mejor modo de
manejarla es irrigar la córnea pacientemente y sin violencia desde el lado
endotelial, hasta que se despegue y caiga sobre un receptor preparado.
Una vez obtenido el botón donante se coloca sobre un lecho de
viscoelástico en una placa de Petri, con el endotelio hacia arriba y
protegiendo éste con abundante viscoelástico. La placa se tapa
convenientemente para evitar la contaminación. En los botones mayores no suelen
existir problemas para la identificación del endotelio dada la forma de
casquete esférico que poseen, pero en los de 6 mm de diámetro ello es más
difícil, por lo que se recurre a un convenio prefijado de colocación. Por el
mismo motivo no somos partidarios de sumergir el botón donante en el líquido
de conservación en espera de su utilización.
¿Qué hacer con la zona períférica del donante? Se puede destinar a
transplante de limbo alogénico, devolviéndolo al medio de conservación. En
todo caso, actualmente se remite al menos un fragmento para cultivo
microbiológico.
7. Trepanación del receptor. Puede realizarse de diversas maneras:
En las QPP destinadas a ser excéntricas por tratarse de autotransplantes
rotacionales o porque se desee eliminar una patología periférica (QPP
terapeúticas), se visualiza sobre la córnea el límite de la trepanación al
apoyar sobre el epitelio el trépano, asegurándose así de su colocación y
adecuación del tamaño elegido.
En el resto de QPP debe marcarse el centro de la córnea utilizando la
pupila como referencia del eje óptico, pudiendo recurrir a las medidas de
diámetros principales como ayuda. El centro corneal marcado puede visualizarse
a través del interior de los trépanos de vacío, que cuentan además con un
«punto de mira» para ayudar al centrado.
Se comprueba la colocación del trépano visualizando su posición con
respecto al limbo en todos los cuadrantes. Adicionalmente, puede utilizarse su
marca sobre el epitelio. En los trépanos de vacío no suele emplearse esta
técnica, ya que se utiliza el centrado interno descrito (figura 4). En éstos,
la cuchilla se dispone para estar retraída mínimamente en el momento del apoyo
corneal y no dañarse prematuramente.
La fijación a la córnea del trépano de vacío se produce al soltar el
émbolo de una jeringa de succión unida al cuerpo del trépano, y en
comunicación con una cámara de aire entre la cuchilla interna y la carcasa
externa.
Una vez que el trépano se encuentra en contacto con la córnea, se
procede a la trepanación. En los trépanos clásicos sin sistema de vacío, se
rota delicadamente el mango en el sentido de las agujas del reloj. En el sistema
Hessburg-Barron, la cuchilla se avanza rotando su base, de material plástico y
dotada de 4 ejes radiales, también de plástico. Cada vuelta completa equivale
a 0,25 mm de avance de la cuchilla.
Las preferencias en la profundización de la trepanación varían según
los autores. Nosotros intentamos obtener la mayor circunferencia de trepanación
completa posible siempre que exista seguridad para las estructuras
intraoculares. En muchas ocasiones, debido a una irregularidad en el grosor
corneal, la trepanación se consigue en una zona pequeña. A partir de entonces
se procede al llenado de la cámara anterior con viscoelástico y se termina el
corte corneal con tijeras tipo Katzin (46) (figura 5). En las perforaciones
corneales no selladas preferimos el llenado de la cámara anterior con
viscoelástico inicial e intento de trepanación completa si no se colapsa la
cámara peligrando las estructuras intraoculares. Si se anticipan estos
problemas, preferimos marcar la circunferencia a trepanar, perforar la córnea
con cuchillete de 22,5° y proseguir con tijeras.
A partir del momento de la paracentesis inicial se puede manipular
farmacológicamente la pupila mediante medicación intracamerular.
Una vez extraído el botón trepanado de la córnea receptora se suele
depositar al menos un tiempo en el líquido de conservación con el fin de
disponer de él en caso de un hipotético percance con el botón donante (p.e.
caída al suelo). Una vez que se ha fijado con éxito el donante, al menos en
los puntos cardinales, se puede remitir el botón del receptor en todo o en
parte a anatomía patológica y/o microbiología según la patología de la
córnea.

Figura 4. Trepanación de la córnea receptora con el sistema de
vacío tipo Hessburg-Barron.

Figura 5. Sección corneal con tijeras tipo Katzin.
8. Procedimientos asociados. Los principales son los siguientes:
A. Cirugía sobre el cristalino con/sin implantación de LIO (figura 6).
Básicamente se procede a la extracción extracapsular de la catarata «a cielo
abierto» mediante capsulorrexis circular continua anterior (CCC),
facoaspiración, CCC posterior, implante de LIO en saco capsular y captura de la
óptica de la LIO por detrás de la CCC posterior según la técnica descrita
por Gimbel (47). En niños menores de 4 años se asocia vitrectomía
retrocapsular sistemática. En niños mayores de 7 años con capacidad de
cooperación para capsulotomía YAG se puede omitir la capsulotomía posterior.

Figura 6. Procedimientos sobre el cristalino: a) Facoaspiración; b)
Vitrectomía retrocapsular; c) Inserción de LIO.
B. Implante de válvulas o procedimientos de derivación para el glaucoma.
Nosotros empleamos la válvula de Ahmed para el glaucoma (VAG). Como queda
referido, el anclaje escleral y el tallado del colgajo escleral se realizan
previamente. Una vez que se ha trepanado la córnea receptora se procede a la
inserción del tubo bajo visualización directa «a cielo abierto». La
paracentesis se realiza bajo el colgajo escleral con una aguja de 23-G dirigida
en un plano paralelo al iris. El tubo de silastic se introduce por la
paracentesis y se recorta una vez situado en la cámara anterior, quedando
dentro de ella entre 2 y 3 mm y con un bisel hacia el endotelio corneal. No son
recomendables tubos largos que puedan contactar hipotéticamente con el
endotelio de la córnea donante.
C. Procedimientos sobre el iris.
Dada la propensión de las QPP a sufrir inflamaciones postoperatorias
violentas es recomendable realizar una iridectomía periférica (figura 7) en
todos los casos (10).
En las anomalías de Peters (figura 8) son casi constantes las sinequias
desde el borde pupilar a la periferia del defecto corneal central; es obvia la
necesidad de seccionarlas para liberar la córnea trepanada.
La reconstrucción iridiana postraumática persigue la creación de un
diafragma iridiano tenso con una función pupilar si resulta posible (14). Ello
implica liberar sinequias anteriores periféricas (SAP) mediante disección
roma, iridectomías en sector en las zonas de mayor adherencia, iridoplastias de
los restos iridianos para reconstruir la pupila (figura 9), y suturar a la
esclera las zonas de iridodiálisis. Si el iris recupera cierta tensión el
riesgo de nuevas SAP se reduce (10,48).

Figura 7. Iridectomía periférica.

Figura 8. Sección de sinequias iridocorneales centrales en la
anomalía de Peters.

Figura 9. Iridoplastia.
D. Liberación de sinequias anteriores periféricas (SAP). Íntimamente
relacionada con la reconstrucción iridiana, como es lógico, y de importancia
ya comentada. La mayoría de los autores prefieren una disección roma,
empleando Kenyon esponjas de celulosa y pinzas (14), y otros autores espátulas
de ciclodiálisis. Debe minimizarse la hemorragia durante la sinequiolisis en lo
posible.
E. Procedimientos sobre vítreo y retina. Descartando la vitrectomía «a
cielo abierto» en la retinopatía del prematuro, las QPP combinadas con
vitrectomías se realizan generalmente tras traumatismos severos. La cirugía
consiste en una vitrectomía convencional vía pars plana empleando una
queratoprótesis temporal que se fija a la periferia de la córnea receptora y
se sustituye al final de la cirugía por el botón donante. Existen dos modelos
principales de queratoprótesis temporal: La de Landers-Foulks (figura 10), de
PMMA (49), y la de Eckardt, de silicona (50). Últimamente han aparecido modelos
que permiten realizar la infusión de la vitrectomía (51).

Figura 10. Empleo de la queratoprótesis temporal de Landers-Foulks.
9. Sutura del botón donante. Se realiza con la técnica de puntos
sueltos (figura 11), según queda referido. Normalmente son necesarios 16 puntos
de nylon de 10/0 para los tamaños de trépanos empleados, aunque en
determinados casos pueden llegar a ser 24. La técnica básica consiste en:

Figura 11. Sutura del botón donante con puntos sueltos.
Replección de la cámara anterior con viscoelástico para la protección
del botón donante.
Colocación del botón donante en su posición definitiva, reduciendo al
máximo la manipulación sobre él.
Colocación del punto de las 12 horas. Es el punto más difícil de
ejecutar ya que el botón no posee ninguna fijación en ese momento. Todos los
puntos se pasan en sentido radial desde el donante al receptor, y a un nivel
pre-descemético, aproximadamente a un 90% de profundidad en el estroma.
Punto de las 6 horas. Es el punto fundamental para el control del
astigmatismo, pues la córnea queda fijada sin posibilidad de rotación
ulterior. Se debe asegurar que su disposición es simétrica con respecto al
primero, dejando la misma cantidad de córnea donante a ambos lados y pasando
por la córnea receptora de modo que el donante se solape con el receptor por
igual en ambos lados también. El punto, como queda dicho, debe ser radial.
Resto de puntos cardinales y resto de la sutura. Se realiza alternando
simétricamente la colocación de los puntos con respecto al centro corneal. El
sistema recomendado es la reducción de los espacios no suturados a la mitad,
esto es, después de suturar los cuatro puntos cardinales se suturaría en el
eje 10:30-4:30 y en el eje 1:30-7:30, y así sucesivamente.
Una técnica rápida y segura para anudar es emplear 3 nudos simples. Los
dos primeros son deslizables y el tercero fija finalmente la sutura. El conjunto
ocupa un espacio mínimo, con lo que se facilita su enterramiento.
Los puntos se dejan enterrados en la córnea del receptor.
Se puede utilizar un queratómetro cualitativo tipo Mandel con el fin de
comprobar la esfericidad de la córnea y retirar las suturas más apretadas. El
ajuste de suturas intraoperatorio se suele realizar una vez que se ha retirado
el viscoelástico de la cámara anterior y el anillo de soporte escleral.
10. Procedimientos finales. Incluyen:
Retirada de anillo de soporte escleral.
Medicaciones: Inyectamos una mezcla de 20 mg de gentamicina y 20 mg de
metilprednisolona en el espacio subtenoniano posterior. Asimismo, si no existe
contraindicación médica y la cirugía ha conllevado procedimientos
complementarios (p.e. sinequiolisis o cirugía de la catarata), instilamos una
gota de maleato de timolol al 0,25%.
Procedimientos protectores corneales: En ciertos casos en los que se
anticipa un problema de epitelización porque la córnea padecía una
ulceración neurotrófica o se trata de un ojo seco severo, es preferible
realizar una tarsorrafia temporal profiláctica. Determinados autores
emplean lentes protectoras de colágeno de manera sistemática.
CUIDADOS POSTOPERATORIOS
A. Medicación: Se utilizan las siguientes categorías de fármacos:
Antibioterapia sistémica: Se emplea rutinariamente en el
postoperatorio de todos los casos, independientemente de la existencia de
infección en la córnea receptora. Creemos que su función principal es la
prevención de problemas legales. Utilizamos amoxicilina + clavulámico a las
dosis de 10 mg/kg cada 8 horas por vía oral durante 5 días. Si la QPP se
realiza sobre una queratitis bacteriana o fúngica el niño estará ya siendo
tratado con antibióticos sistémicos adecuados al antibiograma, y éstos se
mantendrán postoperatoriamente según la evolución.
Antibioterapia tópica: Se prescribe sistemáticamente una
fluoroquinolona tópica cada 4-6 horas, salvo en los raros casos de queratitis
bacteriana o fúngica, en los que utilizan los colirios reforzados adecuados al
antibiograma, cada 1-2 horas.
Corticoterapia tópica: Es el punto fundamental del tratamiento
postoperatorio. Normalmente se utilizan corticoides tópicos a altas dosis, cada
2 horas durante el tiempo de vigilia, aunque en determinados casos de reacciones
fibrinoides severas o rechazo agudo se aplicarán cada hora. Durante la noche se
emplean coincidiendo con las tomas en los niños menores de 1 año, y en el
resto se aplica una pomada al inicio del descanso, aunque en los casos con mayor
inflamación se utilizan los colirios cada 4 horas. El descenso de la
corticoterapia tópica viene marcado por la evolución. En los casos no
complicados, se pautan cada 4 horas a partir del 5.º día y así se mantiene
una semana. Normalmente se elimina una instilación al día por cada semana de
evolución no complicada. La mayoría de los autores prefieren mantener una
instilación al día durante varios meses o indefinidamente en los afáquicos.
Se recomienda incrementar temporalmente la corticoterapia en los días
posteriores a una vacunación (10), por la hipotética influencia de una
inmunización sobre el proceso de rechazo. La corticoterapia sistémica sólo se
emplea en los casos con mayor inflamación o en el rechazo, y sólo por breves
períodos.
Ciclopléjicos tópicos: En niños menores de 1 año se utiliza el
ciclopentolato al 0,5% cada 6-8 horas, debido a la toxicidad de las
concentraciones mayores (24). Debe considerarse la toxicidad sistémica de la
atropina tópica, a la cual se atribuyen varias muertes (52). En los niños
mayores de 1 año se puede emplear la atropina al 0,5% dos veces al día o el
ciclopentolato al 1% cada 6-8 horas. No se debe emplear la atropina en los casos
de queratoplastia por queratocono (53,54), debido al riesgo de originar una
pupila dilatada y fija por atrofia isquémica del esfínter.
Antivirales sistémicos: En los casos de queratoplastia
postherpética el aciclovir sistémico a dosis de 800-1.000 mg/día por vía
oral en adultos parece prevenir las recurrencias (55). En niños se indica a 5
mg/kg cada 8 horas. El aciclovir tópico posee también esta cualidad de
prevención, pero origina una importante toxicidad epitelial (56).
B. Tratamientos complementarios:
Deben practicarse refracciones y queratometrías frecuentes con el
fin de determinar el astigmatismo resultante y planificar la retirada de suturas
o bien la corrección óptica necesaria, generalmente por medio de lente de
contacto. Las suturas corneales en los niños tienden a aflojarse precozmente
por su capacidad de cicatrización y la vascularización presente en muchos
casos. De este modo, es necesario retirar todos los puntos, generalmente de
manera secuencial. La refracción «definitiva» se establecerá una vez
retirado el último punto. Afortunadamente, los niños más pequeños, los más
sensibles a la ambliopía deprivacional y refractiva, son los que presentan una
mayor velocidad de cicatrización de la herida corneal, permitiendo una precoz
retirada de suturas y planificación de la corrección óptica.
El tratamiento oclusor será fundamental en las QPP unilaterales y
en todos los casos en los que se sospeche o constate una ambliopía. El régimen
de oclusiones del ojo dominante se establece según la preferencia del
oftalmólogo pero es frecuente una oclusión del 50% del tiempo de vigilia,
incrementando hasta el 75% en los casos en los que no se obtiene mejoría con el
régimen normal. Es excepcional el recurso a la oclusión constante, que puede
plantearse en niños mayores de 6 meses cuando las oclusiones parciales no han
dado el resultado esperado o se advierte un retroceso funcional. Las oclusiones
parciales se mantienen hasta los 7-8 años en los niños en que se ha advertido
una recuperación visual. Si ésta no se produce debe establecerse el origen del
problema, que puede estar en una opacidad corneal clínicamente significativa,
en un astigmatismo irregular, en una ambliopía profunda o en una combinación
de causas. En cualquier caso, se debe intentar mejorar las condiciones
óptico-refractivas del ojo. Cuanto mayor sea el niño y mayor el déficit
visual más difícil resultará la oclusión.
C. Revisiones: Se pautan según la evolución, como es obvio. Como
norma general se revisan diariamente durante la primera semana y después cada
dos semanas durante un mes. Hasta un 85% de los rechazos se producen durante el
primer año postquirúrgico (7), por lo cual se recomienda una vigilancia
especial en este período. Si bien existen autores que recomiendan las
revisiones quincenales durante el primer año (10), creemos que una pauta
aceptable es la revisión mensual. A partir del primer año se pautan revisiones
cada 2-3 meses. En cada revisión se valorará:
Agudeza visual, en la medida de lo posible. Los padres pueden
referirnos el comportamiento y desenvolvimiento de los niños más pequeños
cuando tienen ocluido uno de los ojos. Interesa la comparación entre los ojos
para descartar la presencia de ambliopía o defecto refractivo.
Refracción y queratometría, en lo posible.
Estado del injerto: Transparencia, aposición, vascularización,
defectos epiteliales, puntos aflojados, secreciones, inyección.
Estado ocular en general. Es preciso buscar signos de rechazo:
Precipitados queráticos, Tyndall.
Tensión ocular. Una hipo o hipertensión severas pueden originar
un edema corneal por disfunción endotelial que nos haga sospechar un rechazo.
La hipertensión ocular puede condicionar el resultado funcional final de la
QPP.
Resultado de los procedimientos concomitantes (extracción de la
catarata, procedimientos sobre el iris, cirugía del desprendimiento
retiniano...).
Es fundamental que los padres evalúen al menos una vez al día el estado del
injerto, para lo cual se les enseña a usar una linterna de exploración
oftalmológica habitual y se les instruye sobre signos y síntomas de alarma:
dolor, fotofobia, blefarospasmo, edema palpebral, inyección, secreción,
cambios en el brillo o transparencia del injerto. En caso de producirse, deben
ponerse en contacto telefónico con el oftalmólogo y planificar una posible
revisión.
D. Retirada de suturas: Como hemos apuntado en el apartado B, las
suturas se aflojan más rápidamente en los niños pequeños y en las córneas
vascularizadas por la mayor velocidad de cicatrización de la herida quirúrgica
y el consecuente incremento en su resistencia a la tensión. En las córneas
vascularizadas es típica la irregularidad de la distribución vascular, por lo
que ciertos puntos se aflojarán antes que otros. Si una sutura se vasculariza,
se afloja. Si se afloja o está expuesta en toda o parte de su longitud (p.e,
los cabos) tiende a originar dolor, sensación de cuerpo extraño, fotofobia,
inflamación del segmento anterior, secreción, conjuntivitis papilares y, lo
que resulta más comprometido, defectos epiteliales (con la posibilidad de
queratitis infecciosas), vascularización y, por este mecanismo, rechazo. Por
tanto, toda sutura vascularizada, aflojada o rota debe retirarse lo antes
posible.
Se pueden establecer unas pautas de retirada de suturas según la edad, que
orientan de modo general, pero deben adecuarse a la peculiaridad de cada caso.
Serían éstas:
Niños menores de 1 año: Entre las 4 y 6 semanas post-quirúrgicas.
Entre 1 y 3 años: Entre las 8 y 10 semanas.
Entre 4 y 6 años: A partir del 3.er-4.º mes.
A partir de 7 años: A partir del 6.º mes.
COMPLICACIONES
Las complicaciones de la QPP son las mismas que presenta la queratoplastia
del adulto, con ciertas peculiaridades que por su naturaleza o frecuencia vamos
a comentar.
A. Dehiscencia de la herida quirúrgica: Como es lógico, esta
complicación puede verse en los niños debido a la debilidad de la córnea
receptora (infrecuente) o a la manipulación brusca que realizan sobre la
superficie ocular (fricción-compresión) los niños más pequeños que
presentan molestias (filamentosa, defectos epiteliales, suturas rotas o
expuestas). Requerirá reparación quirúrgica. En ciertos países es frecuente
dotar al niño con gafas de seguridad durante el día y un protector ocular
preferiblemente metálico durante el sueño los 3 primeros meses postoperatorios
(10).
B. Defectos epiteliales: Es una complicación particularmente
frecuente en QPP realizadas sobre córneas con inflamación herpética activa
(53). Deberá valorarse tratamiento antiviral o el empleo de protectores
corneales (oclusión, lentes terapéuticas, tarsorrafia). Un rasgo
característico de los niños es la forma de presentación de ciertos episodios
de rechazo como un defecto epitelial agudo unido a iridociclitis (4).
C. Inflamación postquirúrgica prolongada: Es una complicación
frecuente de la QPP y parece unida a la reactividad inmunológica del niño (7).
D. Endoftalmitis: Esta complicación se da aproximadamente en un 2% de
los casos (5,6,8,10), cifra muy superior a la sufrida por la queratoplastia del
adulto, y sin explicación satisfactoria. El manejo es idéntico al de la
endoftalmitis tras cirugía de la catarata en el adulto, obteniendo muestras
vítreas y empleando tratamiento antibiótico intravítreo.
E. Rechazo: El rechazo es considerado cuantitativamente el mayor
responsable del fallo del botón donante en la QPP que, como queda dicho, puede
alcanzar hasta al 25% de los casos durante el primer año (10). Normalmente se
presenta como una pérdida de transparencia del injerto con edema pero sin
signos inflamatorios típicos (4). Por otra parte, pueden darse los signos y
síntomas clásicos del rechazo (dolor, inyección, pérdida de transparencia
corneal unida a líneas endoteliales de Khodadoust, pérdida de agudeza
visual...). Se considera que sólo un 10% de los casos son reversibles (2,10).
El pronóstico será mejor si el diagnóstico y tratamiento son precoces (58).
El tratamiento se basa en la corticoterapia intensiva preferiblemente tópica
(generalmente horaria), aunque determinados autores utilizan la vía periocular
y sistémica (58,10). El niño es reevaluado tras una semana de tratamiento y la
pauta terapeútica se modifica según la respuesta obtenida.
F. Glaucoma: En un alto porcentaje de QPP por alteraciones congénitas
el glaucoma aparece bien previamente a la cirugía, bien posteriormente. Ello es
particularmente relevante en la anomalía de Peters (59) dada la disgenesia del
segmento anterior que la caracteriza (12). En series numéricamente importantes
el glaucoma complica la QPP hasta en un 30% de los casos (7), principalmente por
anomalías angulares congénitas y formación de sinequias anteriores
periféricas (10). El glaucoma puede comprometer a largo plazo la viabilidad
endotelial del injerto (4) así como producir las alteraciones del nervio
óptico ya conocidas. En la mayoría de los casos será necesario implantar una
VAG.
RESULTADOS EN LA LITERATURA
Los estudios realizados hasta la fecha tienen carácter retrospectivo. El
estudio multicéntrico llevado a cabo en los EE.UU. a comienzo de los años 90
ha proporcionado unas cifras de supervivencia del injerto cercanas al 55% a los
6 años —hasta un 75% en los casos de opacidades adquiridas: Dana, 1995 (7)—,
con una agudeza visual superior a 0,1 en un 33% de los casos en que se podía
determinar. Estos datos funcionales parecen concordar con los resultados
obtenidos por otras series (10). Quizá sea más interesante referirnos a las
medias de agudeza visual, con el fin de orientar el consentimiento informado de
la QPP que ofrecemos a los padres de los niños afectos. Integrando los datos de
5 de las series previas, Gloor (10) concluye que la agudeza visual
postoperatoria media en la QPP es de «contar dedos». En los casos adquiridos
la media es de 0,1, pero en los congénitos es de percepción de luz. Estamos de
acuerdo con estos datos en líneas generales que, repetimos, se ofrecen como
media orientativa, pudiendo obtenerse resultados mejores y, lamentablemente,
peores (pérdida de la percepción luminosa, calculada en un 10% de los casos).
NUESTROS RESULTADOS EN EL HOSPITAL INFANTIL «LA PAZ»
La queratoplastia penetrante en la infancia presenta peores resultados que en
adultos. Varios son los factores que ayudan a explicarlo: entre otros, la
necesidad de emplear técnicas quirúrgicas complejas (tabla 1) dependiendo de
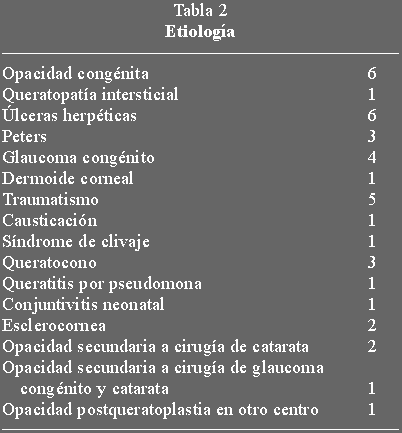
la patología asociada a la opacidad corneal (tabla 2), la mayor incidencia de
inflamación y rechazo, la menor colaboración por parte del paciente en el
postoperatorio, los errores refractivos y la am bliopía.

Presentamos aquí los casos operados en nuestro centro y sus resultados y
complicaciones.
Hemos intervenido un total de 39 ojos de 37 pacientes, 23 niños y 14 niñas,
19 ojos derechos (OD) y 20 izquierdos (OI), realizándose un total de 58
queratoplastias penetrantes (tabla 1) asociadas o no a otras técnicas
quirúrgicas. La edad de los pacientes osciló entre 1 mes y 14 años, siendo la
media de 6 años.


El tiempo de seguimiento osciló entre 1 mes y 105 meses siendo la media de
36,5 meses.


Presentamos la cirugía realizada (tabla 1), la etiología (tabla 2), las
complicaciones (tabla 3), los resultados «anatómicos» (tabla 4) y los
resultados funcionales (tabla 5). Se exponen los resultados anatómicos
(transparente u opaco) dado que la agudeza visual final de muchos niños no pudo
establecerse debido a su corta edad. Los resultados finales se relacionan con la
edad del paciente y la etiología . El resultado de Ptisis se produjo en dos
casos cuya etiología era glaucoma congénito, dos casos de esclerocórnea y dos
casos de traumatismo con patología asociada. El resultado de desprendimiento de
retina (D.R.) se produjo en 1 caso de glaucoma congénito y un caso de
etiología traumática.

La cirugía fue realizada por los Dres. J.M. Abelairas Gómez, J.M.
Fernández Guardiola, J. Peralta Calvo, E. Sánchez Jacob y A. Arbizu Duralde.
BIBLIOGRAFÍA
- Waring GO, Laibson PR. Keratoplasty in infants and children. Trans Am Acad
Ophthalmol Otolaryngol 1977; 83: 283-296.
- Beauchamp GR. Pediatric keratoplasty: problems in management. J Pediatr
Ophthalmol Strabismus 1979; 16: 388-394.
- Laibson PR, Waring GO. Disorders of the cornea. In: Nelson LB, Calhoun JH,
Harley RD eds: Pediatric ophthalmology, 3.ª ed. Philadelphia: WB Saunders;
1991: 191-233.
- Stulting RD. Penetrating keratoplasty in children. In: Brightbill FS
editor: Corneal surgery: theory, technique and tissue, 2ª ed. St Louis: Mosby;
1993: 374-385.
- Cowden JW. Penetrating keratoplasty in infants and children. Ophthalmology
1990; 97: 324-329.
- Erlich CM, Rootman DS, Morin JD. Corneal transplantation in infants,
children and young adults: experience of the Toronto Hospital for Sick Children,
1979-1988. Can J Ophthalmol 1991; 26: 206-210.
- Dana M-R, Moyes AL, Gomes JAP, Rosheim KM, Schaumberg DA, Laibson PR,
Holland EJ, Sugar A, Sugar J. The indications for and outcome in pediatric
keratoplasty. A multicenter study. Ophthalmology 1995; 102: 1.129-1.138.
- Stulting RD, Sumers KD, Cavanagh HD. Penetrating keratoplasty in children.
Ophthalmology 1984; 91: 1.222-1.230.
- Buxton JN, Buxton DF, Westphalen JA. Indications and contraindications (of
penetrating keratoplasty). In: Brightbill FS editor: Corneal surgery: theory,
technique and tissue, 2.ª ed. St Louis: Mosby; 1993; 77-88.
- Gloor P. Pediatric penetrating keratoplasty. In: Krachmer JH, Mannis MJ,
Holland EJ eds: Cornea. Surgery of the cornea and conjunctiva, vol III, St
Louis: Mosby-Year Book; 1997; 1.731-1.756.
- Wilson SE, Mc Donald MB, Kaufman HE. Bilateral penetrating keratoplasty
in infants. Ophthalmic Surg 1989; 20: 523-524.
- Yang LLH, Lambert SR, Lynn MJ, Stulting RD. Long-term results of corneal
graft survival in infants and children with Peters anomaly. Ophthalmology 1999;
106: 833-848.
- Dana MR, Schaumberg DA, Moyes AL, Gomes JAP for the Multicenter Pediatric
Keratoplasty Study. Corneal transplantation in children with Peters anomaly and
mesenchymal dysgenesis. Ophthalmology 1997; 104: 1.580-1.586.
- Kenyon KR, Starck T, Hersh PS. Anterior segment reconstruction after
trauma. In: Brightbill FS editor: Corneal surgery: theory, technique and tissue,
2.ª ed. St Louis: Mosby; 1993: 352-359.
- Lass JH, Pavan-Langston D. Timolol therapy in secondary angle-closure for
penetrating keratoplasty. Ophthalmology 1979; 86: 51-59.
- Rowsey JJ, Gaylor JR. Intraocular lens disasters, peripheral anterior
synechia. Ophthalmology 1980; 87: 646-664.
- Olson RJ, Kaufman HE. Prognostic factors of intraocular pressure after
aphakic keratoplasty. Am J Ophthalmol 1978; 86: 510-515.
- Goldstein JE, Cogan DG. Sclerocornea and associated congenital anomalies.
Arch Ophthalmol 1962; 67: 761-765.
- Bourne WM, Kaufman HE. Specular microscopy of human corneal endothelium
in vivo. Am J Ophthalmology 1976; 81: 319-323.
- Pfister RR, Breaud S. Aphakic refractive penetrating keratoplasty using
newborn donor corneas. Ophthalmology 1983; 90: 1.207-1.212.
- Koenig SB, Graul E, Kaufman E. Ocular refraction after penetrating
keratoplasty with infant donor corneas. Am J Ophthalmol 1982; 94: 534-539.
- Koenig SB. Myopic shift in refraction after penetrating keratoplasty with
pediatric donor tissue. Am J Ophthalmol 1986; 101: 740-741.
- Gloor P, Keech RV, Krachmer JH. Factors associated with high
postoperative myopia after penetrating keratoplasties in infants. Ophthalmology
1992; 99: 775-779.
- Bauer CR, Trottier MCT, Stern L. Systemic cyclopentolate (cy clo gyl)
toxicity in the new born infant. J Pediatr 1973; 82: 501-505.
- Borromeo-McGrail V, Bordiuk JM, Keitel H. Systemic hyperten sion
following ocular administration of 10% phenilephrine in the neo nate. J Pediatr
1973; 81: 1.032-1.036.
- Charlin R, Polack FM. The effect of elevated intraocular pressure on the
endothelium of corneal grafts. Cornea 1982; 1: 241-249.
- Verdier DV. Penetrating keratoplasty. In: Krachmer JH, Mannis MJ, Holland
EJ eds: Cornea. Surgery of the cornea and conjunctiva, vol III, St Louis:
Mosby-Year Book; 1997; 1.581-1.592.
- Duncalf D, Weitzner SW. Ventilation and hypercapnea on intraocular
pressure during anesthesia. Anesth Analg 1963; 42: 232-237.
- Kirch RE, Stenman W. Digital pressure, an important safeguard in cataract
surgery. Arch Ophthalmol 1955; 54: 697-703.
- Quist LH, Stapleton SS, Mc Pherson SD Jr. Preoperative use of the Honan
intraocular pressure reducer. Am J Ophthalmol 1983; 95: 536-538.
- Bourne WM. Reduction of endothelial cell loss during phakic penetrating
keratoplasty. Am J Ophthalmol 1980; 89: 787-790.
- Starr MB. Prophylactic antibiotics for ophthalmic surgery. Surv
Ophthalmol 1983; 27: 353-373.
- Speaker MG, Menikoff JA. Prophilaxis of endophthalmitis with topical
povidone-iodine. Ophthalmology 1991; 98: 1.769-1.775.
- Leveille AS, McMullan FD, Cananagh HD. Endophthalmitis following
penetrating keratoplasty. Ophthalmology 1983; 90: 38-39.
- Kloess PM, Stulting RD, Waring GO III, Wilson LA. Bacterial and fungal
endophthalmitis after penetrating keratoplasty. Am J Ophthalmol 1993; 115:
309-316.
- Gomes JAP, Dana M-R, Dua HS, Goren MB, Laibson PR, Cohen EJ. Positive
donor rim culture in penetrating keratoplasty. Cornea 1995;14: 457-462.
- Baer JC, Nirankari VS, Glaros DS. Survival of Streptococcus viridans in
gentamicin-supplemented Mc Carey-Kaufman medium. Cornea 1989; 8: 131-134.
- Varner AC, Rich LF, Crow BL, McRae S. Survival of streptococcus in
optisol-GS medium. J Refract Surg 1995; 11: 207-209.
- Baum J, Barza M, Kane A. Efficacy of penicillin G, cefazolin, and
gentamicin in M-K medium at 4º C. Arch Ophthalmol 1978; 96: 1.262-1.264.
- Stern GA, Buttross M. Use of corticosteroids in combination with
antimicrobial drugs in the treatment of infectious corneal disease.
Ophthalmology 1991; 98: 847-853.
- Van Meter W. Suturing techniques. In: Krachmer JH, Mannis MJ, Holland EJ
eds: Cornea. Surgery of the cornea and conjunctiva, vol III, St Louis:
Mosby-Year Book; 1997; 1.627-1.638.
- Foulks GN, Perry HD, Dohlman CH. Oversize corneal donor grafts in
penetrating keratoplasty. Ophthalmology 1979; 86: 490-494.
- Olson RJ, Kaufman HE. A mathematical description of causative factors and
prevention of elevated intraocular pressure after keratoplasty. Invest
Ophthalmol Vis Sci 1977; 16: 1.085-1.092.
- Olson RJ. Corneal transplantion techniques. In Kaufman HE, Barron BA, Mc
Donald, Waltman SR eds.The cornea. New York: Churchill Livingstone; 1988;
743-785.
- Vajpayee RB, Ramu M, Panda A, Sharma N, Tabin GT, Anand JR. Oversized
grafts in children. Ophthalmology 1999; 106: 829-832.
- Mandel MR. Instrumentation for corneal transplant surgery. In: Krachmer
JH, Mannis MJ, Holland EJ eds: Cornea. Surgery of the cornea and conjunctiva,
vol III, St Louis: Mosby-Year Book; 1997; 1.571-1.579.
- Gimbel HV. Posterior capsulorhexis with optic capture in pediatric
cataract and intraocular lens surgery. Ophthalmology 1996; 103: 1.871-1.875.
- Cohen EJ, Kenyon KR, Dohlman CH. Iridoplasty for prevention of
post-keratoplasty angle closure and glaucoma. Ophthalmic Surg 1982; 13: 994-996.
- Landers MB III, Foulks GN, Landers DM, Hickingbotham D, Hamilton RC.
Temporary keratoprosthesis for use during pars plana vitrectomy. Am J Ophthalmol
1981; 91: 615-619.
- Eckardt C. A new temporary keratoprosthesis for pars plana vitrectomy.
Retina 1987; 7: 34-37.
- Benner JD, Landers MB III. An infusion temporary keratoprosthesis for
pars plana vitrectomy. Am J Ophthalmol 1996; 122: 579-580.
- Palmer EA. How safe are ocular drugs in pediatrics? Ophthalmology 1986;
93: 1.038-1.040.
- Urrets-Zavalia A Jr. Fixed dilated pupil, iris atrophy and secondary
glaucoma, a distinct clinical entity following keratoplasty in keratoconus. Am J
Ophthalmol 1963; 56: 257-265.
- Gasset AR. Fixed dilated pupil following penetrating keratoplasty in
keratoconus (Castroviejo syndrome). Ann Ophthalmol 1977; 9: 623.
- Barney NP, Foster CS. A prospective randomized trial of oral acyclovir
after penetrating keratoplasty for herpes simplex keratitis. Cornea 1994; 13:
232-236.
- Foster CS, Dunkin J. Penetrating keratoplasty for herpes simplex
keratitis. Am J Ophthalmol 1981; 92: 336-343.
- Langston RHS, Pavan-Langston D, Dohlman CH. Penetrating keratoplasty for
herpetic keratitis- prognostic and therapeutic determinants. Trans Am Acad
Ophthalmol Otolaryngol 1975; 79: 577-583.
- Foulks GN. Clinical aspects of corneal allograft rejection. In: Krachmer
JH, Mannis MJ, Holland EJ eds: Cornea. Surgery of the cornea and conjunctiva,
vol III, St Louis: Mosby-Year Book; 1997; 1.687-1.696.
- Parmley VC, Stonecipher HG, Rowsey JJ. Peters' anomaly: a review of 26
penetrating keratoplasties in infants. Ophthalmic Surg 1993; 24: 31-35.
|