|
Introducción
A) Concepto: La RP puede definirse como una vitreorretinopatía fibro
y vasoproliferativa periférica que acontece en recién nacidos inmaduros,
generalmente sometidos a oxigenoterapia, y de etiopatogenia actualmente
desconocida (1,2). La prolife ración puede ser epirretiniana o intraví trea,
comienza en el extremo periférico de la retina madura del niño y en su evolu
ción puede producir trac ción sobre la retina con desplazamiento/ectopia de
sus estructuras y desprendimien to de reti na, en tre otras complicaciones.
B) Historia: Destacaremos los principales hitos en la historia de la
RP. Fue descrita inicialmente por Terry al comienzo de los años 40 (3-8), quien
sospechó que se trataba de una forma especial de Persistencia de la Vasculatura
Fetal (Persistencia e Hiperplasia del Vítreo Primario). En el estudio de la
etiología destacan los trabajos de Kinsey en los años 50 (9,10) que
relacionaron RP y oxígeno, dando origen a la primera medida terapeútica contra
esta enfermedad, la restricción de la oxigenoterapia en el cuidado neonatal. En
los años 80 se propondría una Clasificación Internacional (11,12), que ha
tenido un gran valor para uniformar criterios y estudios terapeúticos. Entre
estos destaca el Estudio Multicéntrico para la Crioterapia en la RP (13,14),
cuyos resultados definieron una nueva etapa en la prevención del
desprendimiento retiniano. Actualmente la crioterapia tiende a ser reemplazada
por el láser de diodo (15,16).
Clasificación
En 1984 se publicó la Clasificación Internacional de la RP (11), que vino a
poner cierto orden en el tema y que es la más empleada en la actualidad. En
1987 se publicó una segunda par te de la Clasifi cación, aplicada al
desprendimiento de retina (12).

Figura 1. Sistema de notación basado en la Clasificación
Internacional de la RP.
Se valoran 3 factores:
1. La localización de la enfermedad, según 3 zonas con céntricas
retinianas, y centradas en la papila (figura 1):
a) La zona I es la más interna, tiene un radio de 2 distancias papila-centro
de la mácula.
b) La zona II es concéntrica a la anterior y exter na, abarcando hasta la
ora serrata nasal.
c) La zona III comprende el creciente de retina temporal periférico a la
zona II.
2. La extensión de la enfermedad, contabilizada en sec tores horarios
de retina afecta o, lo que es lo mismo, en grados de circunferencia.
3. El momento evolutivo de la enfermedad, según una serie de grados
activos (tabla 1):

A. Grado 1 de la RP: Se caracteriza por una línea de demarcación
(figura 2). Corres ponde al engrosamiento de la lí nea de van guar dia de la
vascularización retiniana. La línea se compone de células fusi for mes
(«spindle-cells», angioblastos primitivos) que han sufri do una hiperplasia.
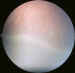
Figura 2. Grado 1 de RP (línea de demarcación). La línea separa
la retina inmadura (gris) de la madura y vascularizada. Hasta ella llegan los
vasos.
B. Grado 2, denominado cresta monticular (figura 3). Co rres pon de a
un engrosamiento de la línea de demarcación, apa re ciendo una línea fina
blanca posterior y otra brillante anterior donde antes se encontraba la línea
de demarcación. Todo ello se correlaciona con un incremento de la hiper pla sia
ca rac terística del grado 1, con proliferación de las célu las fusiformes en
la línea blanca y formación en algu nas oca siones de «shunts»
arteriovenosos en esta zona. Los va sos poste rio res a la cresta aparecen
congestivos.
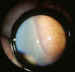
Figura 3. Grado 2 de la RP. Cresta monticular, hiperplasia de la
línea de demarcación.
C. En el grado 3 se produce una proliferación fibrovascular extra rreti
niana (figura 4). Esta neovascularización surge del borde más posterior de la
cresta (línea blanca), aunque en ocasiones se encuentra en su proximidad.
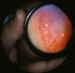
Figura 4. Grado 3 de la RP. Se desarrolla una proliferación fibro
vascular desde la cresta monticular, frecuentemente acompaña da de hemorragias
vítreas y/o retinianas.
D. El grado 4 se caracteriza por el desprendi miento de reti na subtotal,
bien sin afectación de la fóvea (grado 4A, figura 5) o bien con afectación de
ella (grado 4B, figura 6). Según la extensión puede ser segmental, cuando
afecta a un pequeño sector de la retina, o bien circunferencial (figura 6),
cuando alcanza 360°. El mecanismo fundamental del desprendimiento es
traccional, pero puede ser exudativo o mixto.

Figura 5. Grado 4A de la RP, con proliferación vitreorreti niana en
la periferia temporal y desprendimiento traccional aso ciado.

Figura 6. Grado 4B de la RP; el desprendimiento se ha extendido
hasta afectar la fóvea.
E. En el grado 5 el desprendimiento es completo (figuras 7 y 8), en forma de
embudo. Se clasifica según su apertura en la zona anterior y posterior. Los
embudos cerrados lo pueden ser, por tanto, en su zona anterior, en la posterior,
o bien en toda su longitud.

Figura 7. Grado 5 de RP. El desprendimiento retiniano traccional
desde la periferia temporal se ha extendido a toda la retina.
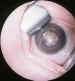
Figura 8. Leucocoria en un grado 5. Detrás del cristalino se
identifican los vasos retinianos. La retina está plegada por la tracción del
tejido fibrovascular retrolen tal.
F. Existe un grado aparte, denominado «enfermedad plus (+ )», que
puede combinarse con cualquiera de los otros. Consiste en una dilatación y
tortuosidad de la vasculatura en el polo poste rior (figura 9). Denota la
existencia de un «shunt» arteriovenoso im portan te, y viene a indicar la
presencia de una enfermedad activa y, por tan to, potencialmente peligrosa
(confiere gravedad al cua dro).
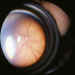
Figura 9. Enfermedad «plus». Dilatación y tortuosidad de los
vasos en el polo posterior.
Factores etiológicos
Se estudian a continuación los principales factores etiológicos que han
sido implicados en la patogenia de la RP, con el fin de comprender los intentos
realizados por prevenir la enfermedad y tratarla médicamente.
1. Oxigenoterapia:
La primera hipó tesis, y la más estudiada, acerca de la etiología de la RP
fue la hiperoxigenación re tiniana. Kinsey encontró una asociación entre RP y
duración de la oxigenoterapia (9) en un estudio multicéntrico y controlado
realizado durante los años 1953 y siguientes. Lanman publicó por separado los
resultados obtenidos en uno de los hospitales participantes, concluyendo que
existía una relación entre concentración de oxígeno inspirado e incidencia
de RP (17). Ello contribuyó a extender la creencia según la cual el oxígeno
es causa única de la reti nopa tía y la práctica de reducir la oxigenoterapia
para prevenir la RP, con un grave in cremento en la mortalidad neonatal.
A lo largo de los años varios autores describieron un aumento de la
incidencia de RP a pesar de la restricción en la oxigenoterapia (18-20). No se
ha podido demostrar una correlación entre presión arterial de oxígeno (PaO2)
e incidencia de RP (21-25). Incluso se ha descrito RP en neonatos a término no
sometidos a oxigenoterapia (26-28). La pulsioximetría aplicada a la RP ha
reflejado que la reducción de la PaO2 tiene un valor profiláctico sólo en los
niños de mayor peso (29).
Sin embargo, en la comunidad científica sigue extendida la creencia de que
el oxígeno está implicado de alguna manera en la RP, y los pediatras limitan
la oxigenoterapia a los niveles mínimos requeridos para la supervivencia del
niño.
El mecanismo patogénico del oxígeno podría ser la generación de radicales
libres: Se ha sugerido que el efecto positivo de la vitamina E en la profilaxis
de la RP se debe a su efecto antioxidativo, bloqueando la generación de
radicales libres a partir del oxígeno inspirado (30,31). Kretzer (32,33)
considera que los radicales li bres en la retina son capaces de promover la
creación de unio nes tipo «gap» entre las células fusiformes precursoras de
los an gio blas tos. Estas uniones desencadenarían la secre ción de factores
angio génicos y la proliferación fibrovascu lar.
Según otros investigadores el oxígeno no tiene un papel patogénico en la
RP, sino la isquemia retiniana periférica, que desencadenaría una liberación
de factores angiogénicos por parte de esa retina (34). El oxígeno podría
utilizarse para tratar la neovascularización (35-37).
2. Bajo peso/inmadurez:
Aunque ya Terry en 1948 (8) sugirió que la retinopatía del prematuro podía
deberse a la inmadurez del niño, sólo en los prime ros años 70 se comenzó a
relacionar la RP con el bajo peso, siendo una de las asociaciones más
estudiadas (38-47). El bajo peso parece estar ligado a la inmadurez reti niana
de una manera muy directa. Sin embar go, este factor no es una con dición
suficiente para el desarrollo de la RP, ya que enton ces todos los prematuros
desarrollarían la patología. Sería, por tan to, una condi ción necesaria,
que debería unirse a otro/s factor/es.
3. Iluminación retiniana:
Es la teoría más estudiada en los últimos años, a raíz del trabajo de
Glass (48). Estudió prospectivamente el efecto de la exposi ción a la luz en
las unidades de neonatología, en contrando que los niños menores de 1.000 gr.
expuestos a luz más bri llante desa rrolla ron más frecuentemente RP que los
expuestos a una luz más tenue. El mecanismo patogénico sería la generación
de radicales libres en la retina. Otros autores no han podi do demostrar un
daño reti nia no en los niños sometidos a una ilumi nación in tensa (49-50).
De igual forma diversos trabajos realizados no han podido correlacionar inten
sidad de luz con incidencia de RP (51-53).
Dos estudios multicéntricos recientes encuentran que la reducción de la
iluminación ambiental no tiene efecto en la prevención de la RP (54,55).
4. Otros factores: Se resumen en la tabla 2.
Exploración
La Academia Americana de Pediatría, la de Oftalmología y la Asociación
Americana de Oftalmología Pediátrica y Estrabismo (65) han elaborado un
protocolo de exploración para la RP. Propone que la pri mera exploración se
practique entre la 4.ª y la 6.ª semanas de vida o entre la 31 y 33 semanas de
edad postconcepcional. Los niños que deben ser explorados son:
• Los menores de 1.500 gramos ó 28 semanas de edad gestacional al
nacimiento.
• Los de peso superior, con inestabilidad clínica, a criterio del
pediatra.
El resto de exploraciones se pautan según los hallazgos oftalmoscópicos,
atendiendo a la localización del cuadro (más central, mayor riesgo) (11) y su
severidad (mayor grado, mayor riesgo) (11). Nosotros recomendamos las pautas
expuestas en la tabla 3. Si encontramos en la prime ra exploración una ausen
cia de vascularización en la retina llegando los vasos a la zona II periférica
(mitad periférica) o a la zona III, revi samos al niño cada 2-3 semanas. Si
los vasos sólo llegan a la zona II central o a la zona I las revisiones son
semana les. Si existe un grado 1 o 2 sin plus en zona II o III revisamos cada 2
semanas. Las revi siones se hacen semana les si existe cual quier grado de RP en
zona I o un grado 2+ ó 3+ en las otras zonas (es raro el grado 3 en zona III).

La midriasis exploratoria se consigue mediante ins tila ción una hora antes
del examen de una gota de fenilefrina al 2,5% y otra de ciclo pen tolato al
0,5%, repetidas a los 10 mi nutos. Estas concen tracio nes farma cológicas son
consideradas se guras en la práctica neo nato lógica (66,67). Otros datos a
considerar en la exploración de los prematuros se reflejan en la tabla 4.

Profilaxis y tratamientos médicos
1. Oxigenoterapia: Ya se ha comentado in extenso la práctica de
reducir la oxigenoterapia en el cuidado neonatal como medio de prevenir la RP.
Sobre el papel de la terapia contraria, esto es, el aporte de oxígeno
suplementario en el tratamiento de la RP, existe actualmente cierto entusiasmo.
Estudios recientes demuestran un descenso de la progresión a la enfermedad
«umbral» si los niveles de PaO2 en el niño determinados por pulsioximetría
se mantienen entre el 96% y el 99% (68,69). El efecto parece poco significativo
(70), pero puede merecer consideración en un futuro (71).

2. Vitamina E: El uso de la vitamina E en la profilaxis de la RP data
ya de los años 50, a raíz de los trabajos de Owens y Owens (72). Sugirieron
que la vitamina E, por su ac ción antioxidante, podría prevenir esta enfer me
dad que sospechaban causada por el oxígeno. Phelps y Rosenbaum confirmaron en
el modelo felino de RP que la vitamina E podía inhibir la neovascularización
vítrea (73-75).
El grupo que más ha destacado en el estudio de la influencia de la vitamina
E en la RP es el de Kretzer (31-33,76), que encontró un efecto beneficioso
sobre la severidad de la RP, dando lugar a su teoría patogénica basada en las
células fusiformes (angioblastos primitivos) (32). Otros autores confirmaron
este efecto sobre la severidad (77). Sin embargo otras publicaciones niegan
cualquier efecto de la vitamina E sobre la RP (78,79).
La administración de vitamina E se ha puesto en relación con aumento de la
incidencia de enterocolitis necrotizante (80,81), sepsis (81) y hemorragia
periventricular (82,83). Este último efecto se debería a su competición con
la vitamina K, imprescindible para la biosíntesis de ciertos factores de la
coagulación (84-85). Sin embargo, otros estudios no han encontrado incremento
de hemorragias en los niños tratados con vitamina E (86,87).
En las revisiones más recientes se recomienda el uso de la vitamina E en la
profilaxis de los grados más severos de RP y se sugiere un estudio controlado y
randomizado a gran escala que clarifique la situación (88).
3. Maduradores pulmonares:
A) Surfactante pulmonar:
El surfactante pulmonar exógeno pretende mejorar las condiciones
ventilatorias del prematuro, cuyo surfactante inmaduro no consigue impedir la
atelectasia alveolar. Ciertos estudios no han encontrado una disminución de la
RP con el empleo de surfactante (89-93), si bien tampoco un incremento de la
incidencia o severidad.
Por el contrario, otros estudios han mostrado un efecto beneficioso, aunque
discreto, sobre la severidad de la RP desarrollada (94-97). Los últimos
estudios de larga evolución (8 años) parecen optimistas al respecto (97),
encontrando una disminución de la incidencia y severidad de la RP durante esta
corta era de la terapia con surfactante.
B) Corticoides prenatales:
Dos estudios recientes coinciden en señalar que la administración de
corticoides previos al nacimiento del prematuro se acompaña de una disminución
en la incidencia y severidad de la RP (98,99). La finalidad inicial de este
tratamiento es lograr una mayor madurez del surfactante pulmo-nar para mejorar
la ventilación del niño, pero podría asimismo contribuir a la maduración
retiniana o a la inhibición de la neovascularización propia de la RP (99).
C) Inositol:
El inositol acelera la maduración del surfactante pulmonar y por este motivo
se emplea en el tratamiento del niño pretérmino. Sus efectos sobre la RP
parecen ser beneficiosos, disminuyendo su incidencia (100) y severidad (101).
BIBLIOGRAFÍA
- Flynn JT. Retinopathy of prematurity. In Eichenbaum JW, Mamelock A, Mittle
RN, Orellana J, eds. Treatment of retinopathy of prematurity. Chicago,
Mosby-Year Book. 1990; 81-117.
- Peralta Calvo J. Retinopatía del prematuro: Factores etiológicos y
tratamiento mediante crioterapia sectorial. Madrid: Universidad Autónoma de
Madrid. 1992; 175 pp. Thesis doctoralis.
- Terry TL. Extreme prematurity and fibroplastic overgrowth of persistent
vascular sheath behind each cristalline lens. Prelimi nary report. Am J
Ophthalmol 1942; 25: 203-204.
- Terry TL. Fibroplastic overgrowth of persistent tunica vascu losa lentis
in infants born prematurely. Studies in development and regression of hyaloid
artery and tunica vasculosa lentis. Am J Ophthalmol 1942; 25: 1.409-1.423.
- Terry TL. Fibroplastic overgrowth of persistent tunica vascu losa lentis
in premature infants. Report of cases-clinical as pects. Arch Ophthalmol 1943;
29: 36-53.
- Terry TL. Fibroplastic overgrowth of persistent tunica vascu losa lentis
in premature infants. Etiologic factors. Arch Ophthal mol 1943; 29: 54-68.
- Terry TL. Retrolental fibroplasia in premature in fants. Fur ther studies
on fibroplastic overgrowth of persistent tunica vasculo sa lentis. Arch
Ophthalmol 1945; 33: 203-208.
- Terry TL. Ocular maldevelopment in extremely premature in fants:
Retrolental fibroplasia. General considerations. JAMA 1945; 128: 582-585.
- Kinsey VE, Hemphill FM. Etiology of retrolental fibroplasia and
preliminary report of the Cooperative Study of Retrolental Fibro plasia. Trans
Am Acad Ophthalmol 1955; 59: 15-24.
- Kinsey VE. Cooperative study of retrolental fibroplasia and the use of
oxygen. Arch Ophthalmol 1956; 56: 481-543.
- The International Committee for the Classification of Retino pathy of
Prematurity. An international clas sifica tion of retino pathy of prematurity.
Arch Ophthalmol 1984; 102: 1.130-1.134.
- The International Committee for the Classification of the Late Stages of
Retinopathy of Prematurity: II. The classification of retinal detachment. Arch
Ophthalmol 1987; 105: 906-912.
- Cryothe rapy for Retinopathy of Prematurity Cooperative Gr oup.
Multicenter T rial of Cryotherapy for Retinopathy of Prematu rity: preliminary
re sults. Arch Ophthalmol 1988; 106: 471-479.
- Cryotherapy for Retinopathy of Prematurity Cooperative Gr oup.
Multicenter Trial of Cryotherapy for Retinopathy of Prematu rity: Snellen visual
acuity and structural outcome at 51/2 years after randomization. Arch Ophthalmol
1996; 114: 417-424.
- Noonan CP, Clark DI. Trends in the management of stage 3 reti nopathy of
prematurity. Br J Ophthalmol 1996; 80: 278-281.
- White JE, Repka MX. Randomized comparison of diode laser photocoagulation
versus cryotherapy for threshold retinopathy of prematurity: 3-year outcome. J
Pediatr Ophthalmol Strabismus 1997; 34: 83-87.
- Lanman JT. Retrolental fibroplasia and oxygen the rapy. JAMA 1954; 155:
223-225.
- De Leon AS, Elliot JW, Jones DB. The resurgence of retrolental
fibroplasia. Pediatr Clin North Am 1970; 17: 309-322.
- Mushin AS. Retinopathy of prematurity: A disease of increasing incidence.
Trans Ophthalmol Soc UK 1974; 94: 251-257.
- Phelps DL. Retinopathy of prematurity: An estimate of vision loss in the
United States-1979. Pediatrics 1981; 67: 924-926.
- Aranda JV, Sweet AY. Sustained hyperoxemia without cicatricial
retrolental fibroplasia. Pediatrics 1974; 54: 434-437.
- Gunn TR, Easdown J, Outerbridge EW, et al. Risk factors in retrolental
fibroplasia. Pediatrics 1980; 65: 1.096-1.100.
- Kinsey VE, Arnold HJ, Kalina RE, et al. PaO2 levels and RLF: A report of
the cooperative study. Pediatrics 1973; 60: 655-667.
- Aranda JV, Clark TE, Mamiello R, et al. Blood transfusion: Possible
potentiating risk factor in retrolental fibroplasia. Pediatr Res 1975; 9: 633.
- Biglan AW, Brown DR, Reynolds JD, et al. The interrelationship of blood
oxygen, carbon dioxide and ph level and the production of retrolental
fibroplasia. Ophthalmology 1984; 91: 1.504-1.511.
- Stefani FH, Ehalt H. Non-oxygen induced retinitis proliferans and retinal
detachment in full term infants. Br J Ophthalmol 1974; 58: 490-513.
- Schulman J, Jampol LM, Schwartz H. Peripheral proliferative retinopathy
without oxygen therapy in a full term infant. Am J Ophthalmol 1980; 90: 509-514.
- Kushner BJ, Gloeckner E. Retrolental fibroplasia in full term infants
without exposure to supplemental oxygen. Am J Ophthalmol 1984; 97: 148-158.
- Flynn JT, Bancalari E. Retinopathy of prematurity: a randomized,
prospective trial of transcutaneous oxygen monitoring. Ophthalmology 1987; 94:
630-637.
- Hittner HM, Rudolph AJ, Kretzer FL. Suppression of severe retinopathy of
prematurity with vitamin E supplementation. Ophthalmology 1984; 91: 1.512-1.523.
- Hittner HM, Speer ME, Rudolph AJ, et al. Retrolental fibroplasia and
vitamin E in preterm infants: Comparision of oral versus intramuscular
administration. Pediatrics 1984; 73: 238-249.
- Kretzer FL, Mehta RS, Johnson AT. Vitamin E protects against retinopathy
of prematurity through action on spindle cells. Nature 1984; 309: 793-795.
- Kretzer FL, Mc Pherson, Rudolph AJ, et al. Pathogenic mechanism of
retinopathy of prematurity: A controversial explanation for the efficacy of oral
and intramuscular vitamin E supplementation and cryotherapy. Bull NY Acad Med
1985; 61: 883-900.
- Michaelson IC. The mode of development of the vascular system of the
retina, with some observations on its significance for certain retinal diseases.
Trans Ophthalmol Soc UK 1948; 68: 137-180.
- Szewczyk TS. Retrolental fibroplasia and related ocular diseases:
Classification, etiology, and prophylaxis. Am J Ophthalmol 1953; 36:
1.336-1.361.
- Bedrossian RH, Carmichael P, Richter A. Retinopathy of prematurity
(retrolental fibroplasia) and oxygen: part I. Clinical study: part II. Further
observations on the disease. Am J Ophthalmol 1954; 37: 78-86.
- Bedrossian RH, Carmichael P, Richter A. Effect of oxygen weaning in
retrolental fibroplasia. Arch Ophthalmol 1955: 53: 514-518.
- Phelps DL. Vitamin E and RLF in 1982. Pediatrics 1982; 70: 420-425.
- Mc Cormick AQ. RLF: The future. Can J Ophthalmol 1976; 11 (suppl): 13-15.
- Shohat M, Reisner SH, Krikler R, et al. ROP: Incidence and risk factors.
Pediatrics 1983; 72: 159-163.
- Mc Cormick AQ. Retinopathy of prematurity. Curr Probl Pediatr 1977; 7:
3-28.
- Zak TA. Retinopathy of prematurity: An update on retrolental fibroplasia.
NY State J Med 1982; 82: 1.795-1.796.
- Tasman W. The natural history of active retinopathy of prematurity.
Ophthalmology 1984; 91: 1.499-1.502.
- Merrit JC, Kraybill EN. A five year experience in a tertiary perinatal
center. Ann Ophthalmol 1986;18: 65-67.
- Harden AF. Retinopathy of prematurity.-A long term follow-up. Trans
Ophthalmol Soc UK 1986; 105: 717-719.
- Flynn JT, Bancalari E, Bachinski BN, et al. Retinopathy of prematurity:
Diagnosis, severity and natural history. Ophthalmology 1987; 94: 620-629.
- Prendville A, Schulenburg WE. Clinical factors associated with
retinopathy of prematurity. Arch Dis Child 1988; 63: 522-527.
- Glass P, Avery GB, Subramanian KNS, et al. Effect of bright light in
hospital nursery on the incidence of retinopathy of prematurity. N Engl J Med
1985; 313: 401-404.
- Dobson V, Riggs LA, Signeland ER. Electroretinographic determination of
dark adaptation functions of children exposed to phototherapy. J Pediatr 1974;
85: 25-29.
- Hamer R, Dobson V, Mayer M. Absolute thresholds in human infants exposed
to continuous illumination. Invest Ophthalmol Vis Sci 1974; 25: 381-388.
- Hepner WR, Kraus AC, Davis ME. Retrolental fibroplasia and light.
Pediatrics 1949; 3: 824-828.
- Locke JC, Reese AB. RLF: The negative role of light, mydriatics and the
ophthalmoscope exam in its etiology. Arch Ophthalmol 1952; 48: 44-47.
- Ackerman B, Sherwonit E, Williams J. Reduced incidental light exposure:
effect on the development of retinopathy of prematurity in low birth weight
infants. Pediatrics 1989; 83: 958-962.
- Seiberth V, Linderkamp O, Knorz MC, Liesenhoffh. A controlled clinical
trial of light and retinopathy of prematurity. Am J Ophthalmol 1994; 118:
492-495.
- Reynolds JD, Hardy RJ, Kennedy KA, Spencer R, Van Heuven WAJ, Fielder AR.
Lack of efficacy of light reduction in preventing retinopathy of prematurity. N
Engl J Med 1998; 338: 1.572-1.576.
- Bard H, Cornet A, Orquin J, et al. Retrolental fibroplasia and exchange
transfusions. Pediatr Res 1975; 9: 634-640.
- Sacks LJ, Schaffer DB, Anday EK, et al. Retrolental fibroplasia and blood
transfusion in very low birth weight infants. Pediatrics 1981; 68: 770-774.
- Clark C, Gibbs JH, Maniello R, et al. Blood transfusions: a possible risk
factor in retrolental fibroplasia. Acta Paediatr Scan 1971; 70: 535-543
- Majima A. Problems on retinopathy of prematurity: statistical analysis of
factors related to occurrence and progression of retinopathy and fundus
appearance and ocular functions in prematurely born subjects. Jpn J Ophthalmol
1977; 21: 404-420.
- Bauer CR, Widmayer SM. A relationship between PaCO2 and retrolental
fibroplasia (RLF). Pediatr Res 1981; 15: 649-656.
- Puklin JE, Simon RM, Ehkrenkrantz RA. Influence on retrolental
fibroplasia of intramuscular vitamin E during respiratory distress syndrome.
Ophthalmology 1982; 89: 96-103.
- Cotton RB, Stahlman MJ, Kovar I, et al. Medical management of small
preterm infants with symptomatic ductus arteriosus. J Pediatr 1978; 92: 467-473.
- Procianoy RS, Garcia Pratis JA, Hittner HM, et al. An association between
retinopathy of prematurity and intraventricular hemorrhage in very low
birthweight infants. Acta Pediatr Scand 1981; 70: 473-477.
- Hungerford J, Stewart A, Hope P. Ocular sequelae of preterm birth and
their relation to ultrasound evidence of cerebral damage. Br J Ophthalmol 1986;
70: 463-468.
- A Joint Statement of the American Academy of Pediatrics, the American
Association for Pediatric Ophthalmology and Strabismus, and the American Academy
of Ophthalmology. Screening examination of premature infants for retinopathy of
prematurity. Ophthalmology 1997; 104: 888-889.
- Bauer CR, Trottier MCT, Stern L. Systemic cyclopentolate (cyclogyl)
toxicity in the new born infant. J Pediatr 1973; 82: 501-505.
- Borromeo-McGrail V, Bordiuk JM, Keitel H. Systemic hypertension following
ocular administration of 10% phenilephrine in the neonate. J Pediatr 1973; 81:
1.032-1.036.
- Gaynon MW, Stevenson DK, Sunshine P, Fleisher BE, Landers MB.
Supplemental oxygen may decrease progression of prethreshold disease to
threshold retinopathy of prematurity. J Perinatol 1997; 17: 434-438.
- Seiberth V, Linderkamp O, Akkoyun-Vardarli I, Jendritza W, Voegele C.
Oxygen therapy in acute retinopathy of prematurity stage 3. Invest Ophthalmol
Vis Sci 1998; 39: S820.
- The Stop-Rop Multicenter Study Group. Supplemental oxygen for pretheshold
retinopathy of prematurity (STOP-ROP), a randomized, controlled trial. I.
Primary outcomes. Pediatrics 2000; 105: 295-310.
- Gaynon MW, Stevenson DK. What can we learn from STOP-ROP and earlier
studies? Pediatrics 2000; 105: 420-422.
- Owens WC, Owens EV. Retrolental fibroplasia in premature infants: studies
on the prophylaxis of the disease. Am J Ophthalmol 1949; 32: 1.631-1.637.
- Phelps DL, Rosenbaum AL. The role of tocopherol in oxygen induced
retinopathy. Pediatrics 1977; 59: 998-1005.
- Phelps DL, Rosenbaum AL. Vitamin E in kitten oxygen-induced retinopathy
II. Blockage of vitreal neovascularization. Arch Ophthalmol 1979; 97:
1.522-1.526.
- Phelps DL, Rosenbaum AL. Effects of marginal hypoxemia on recovery from
oxygen-induced retinopathy in the kitten model. Pediatrics 1984; 73: 1-6.
- Monaco W, Kretzer F, Hittner H. Evidence that vitamin E suppresses the
development of grade III retinopathy of prematurity. Invest Ophthalmol Vis Sci
1981; 20 (suppl): 58-68.
- Schaffer DB, Johnson L, Quinn GE. Vitamin E and retinopathy of
prematurity: Follow up at one year. Ophthalmology 1985; 92: 1.005-1.011.
- Milner RA, Watts JL, Paes B. RLF in 1500 gram neonates. Part of a
randomized clinical trial of the effectiveness of vitamin E. Retinopathy
Prematurity Conference, Washington DC, Dic 1981; 2.703-2.716.
- Vitamin E and Retinopathy of Prematurity. Report of a Study from the
Institute of Medicine, Division of Health Sciences Policy, National Academy
Press, Washington DC, Junio, 1986.
- Sobel S, Guerigian J, Troendle G. Vitamin E in retrolental fibroplasia
(letter). N Engl J Med 1982; 96: 867.
- Johnson L, Bowen FW, Abbasi S. Relationship of prolonged pharmacologic
serum levels of vitamin E to incidence of sepsis and necrotizing enterocolitis
in infants with birth weight 1500 grams or less. Pediatrics 1985; 75: 619-638.
- Phelps DL. Local and systemic reactions to parenteral administration of
vitamin E. Dev Pharmacol Ther 1981; 2: 156-171.
- Phelps DL, Rosenbaum AL, Isenberg SJ. Tocopherol efficacy and safety for
preventing retinopathy of prematurity: A randomized, controlled, double masked
trial. Pediatrics 1987; 79: 489-500.
- Helson L. The effect of intravenous vitamin E and menadiol sodium
diphosphate on vitamin K dependent clotting factors. Thromb Res 1984; 35: 11-18.
- Shapiro AD, Jacobson LJ, Armon ME. Vitamin K deficiency in the newborn
infant: Prevalence and perinatal risk factors. J Pediatr 1986; 109: 675-680.
- Speer ME, Blifeld C, Rudolph AJ. Intraventricular hemorrhage and vitamin
E in the very low-birth-weight infant: Evidence for efficacy of early
intramuscular vitamin E administration. Pediatrics 1984; 74: 1.107-1.115.
- Sinha S, Davies J, Toner N. Vitamin E supplementation reduces frequency
of periventricular haemorhage in very preterm babies. Lancet 1987; 1: 466-470.
- Raju TN, Langenberg P, Bhutahi V, Quinn GE. Vitamin E prophylaxis to
reduce retinopathy of prematurity: a reappraisal of published trials. J Pediatr
1997; 131: 844-850.
- Rankin SJA, Tubman TRJ, Halliday HL, Johnston SS. Retinopathy of
prematurity in surfactanct treated infants. Br J Opthalmol 1992; 76: 202-204.
- Gerdes J, Gerdes M, Beaumont E, Cook L, Dhanireddy R, Kopleman A, Jarret
R, Long W. Health and neurodevelopmental outcome at 1-year adjusted age 508
infants weighing 700 to 1100 grams who received prophylaxis with one versus
three doses of synthetic surfactant. American Exosurf Neonatal Study Groups I
and II. J Pediatr 1995; 126: S 26-32.
- Kraybill EN, Bose CL, Corbet AJ, Garcia-Prats J, Asbill D, Edwards K,
Long W. Double-blind evaluation of developmental and health status to age 2
years of infants weighing 700 to 1350 grams treated prophylactically at birth
with a single dose of synthetic surfactant or air placebo. J Pediatr 1995; 126:
S 33-42.
- Axer-Siegel R, Snir M, Ma’ayan A, Na’or N, Davidson S, Weinberger D,
Yassur Y. Retinopathy of prematurity and surfactant treatment. J Pediatr
Ophthalmol Strabismus 1996; 33: 171-174.
- Kennedy J, Todd DA, Watts J, John E. Retinopathy of prematurity in
infants less than 29 weeks’gestation: 31/2 years pre and postsurfactant. J
Pediatr Ophthalmol Strabismus 1997; 34: 289-292.
- Repka MX, Hudak ML, Parsa CF, Tielsch JM. Calf lung surfactant extract
prophylaxis and retinopathy of prematurity. Ophthalmology 1992; 99: 531-536.
- Walti H, Paris-Llado J, Breart G, Couchard M. Porcine surfactant
replacement therapy in newborns of 25-31 weeks’ gestation: a randomized,
multicenter trial of prophylaxis versus rescue with multiple low doses. The
French Collaborative Multicenter Study Group. Acta Paediatr 1995; 84: 913-921.
- Pennefather PM, Tin W, Clarke MP, Fritz S, Strong NP. Retinopathy of
prematurity in a controlled trial of prophylactic surfactant treatment. Br J
Opthalmol 1996; 80: 420-424.
- Hussain N, Clive J, Bhandari V. Current incidence of retinopathy of
prematurity, 1989-1997. Pediatrics 1999; 104: e26.
- Console V, Gagliardi L, De Giorgi A, De Ponti E. Retinopathy of
prematurity and antenatal corticosteroids. The Italian ROP Study Group. Acta
Biomed Ateneo Parmense 1997; 68: s 75-79.
- Higgins RD, Mendelsohn AL, DeFeo MJ, Ucsel R, Hendricks-Munoz KD.
Antenatal dexamethasone and decreased severity of retinopathy of prematurity.
Arch Ophthalmol 1998; 116: 601-605.
- Hallman M, Bry K, Hoppu K, Lappi M, Pohjavuori M. Inositol
supplementation in premature infants with respiratory distress syndrome. N Engl
J Med 1992; 326: 1233-1239.
- Friedman CA, Mc Vey J, Borne MJ, James M, May WL, Temple DM, Robbins KK,
Miller CJ, Rawson JE. Relationship between serum inositol concentration and
development of retinopathy of prematurity. A prospective study. J Pediatr
Ophthalmol Strabismus 2000; 37: 79-86.
|