|
Introducción
A) Finalidad
El tratamiento de los grados de la RP asociados a un desprendimiento
retiniano (grados 4 y 5) (1) tiene como fin lograr la reaplicación retiniana
obteniendo la máxima funcionalidad posible de ésta, lo cual implica que el
procedimiento debe ser previo a la degeneración de la retina inherente a todo
desprendimiento prolongado. Asimismo la cirugía intenta minimizar las
complicaciones secundarias a los grados avanzados de RP (glaucoma (2), phthisis
bulbi).
B) Historia
1. Cerclajes esclerales: El empleo de cerclajes en el tratamiento de
la RP es antiguo (3) y siempre ha tenido sus defensores (4-8). Ciertos autores
recomendaron su uso sistemático en el tratamiento de los grados 3 (9),
especialmente en los casos avanzados (10). Si bien se han utilizado tanto en los
grados 4 como 5 (7,8,11), existe una tendencia a limitarlos a los grados 4
(12,13), particularmente si el desprendimiento no es de predominio traccional
(8). Determinados autores (14,15) asocian un cerclaje a la vitrectomía en la
RP.
2. Vitrectomía: Parece acreditado que fue Machemer en 1972 (16,17)
quien realizó la primera vitrectomía en esta patología. Desde el principio se
invocaron dos tipos de abordaje, cada uno defendido por diversas autoridades:
* La vitrectomía «cerrada» a través de la pars plicata (18-20).
* La vitrectomía a través de una trepanación corneal, «a cielo abierto»
(21-24).
Si bien los resultados de ambas técnicas fueron comparables inicialmente, no
existen publicaciones recientes sobre la vitrectomía «a cielo abierto».
Parece existir una tendencia hacia la vitrectomía vía pars plicata (25,26).
Trese preconiza una variante que denomina «vitrectomía con preservación del
cristalino» (8), y que emplea en el tratamiento inicial de los casos con
desprendimiento traccional posterior de la retina.
Indicaciones
1. Consideraciones generales: En principio todo ojo afecto de un
desprendimiento retiniano por RP puede ser tributario de cirugía. Sin embargo
es necesario considerar ciertos factores antes de indicarla:
A) Severidad del cuadro: Los grados 4 generalmente pueden tratarse con
cerclajes o vitrectomías poco agresivas. En los grados 5 (mucho más
frecuentes) el pronóstico tanto anatómico como funcional es generalmente pobre
(27,28), destacando el número de redesprendimientos tras una cirugía exitosa
(28). En el resultado funcional influyen de manera decisiva la precocidad de la
cirugía (25,26,29) y el grado de apertura del embudo retiniano (26,29). La
cirugía puede evitar el desarrollo de complicaciones, pero también las puede
desencadenar. Por este motivo los padres deberán tomar la decisión acerca de
la cirugía del niño tras una información meticulosa, asumiendo la
responsabilidad pertinente.
B) Factores parentales:
Debe considerarse la importancia que tiene para
la salud psicológica de los padres el intentar un tratamiento para su hijo. En
ciertos casos se puede indicar una cirugía en un ojo de mal pronóstico por
este tipo de motivos: Podría llegar a hablarse de «vitrectomías
psicológicas». Es muy frecuente apreciar un sentimiento de culpa entre los
padres por no intentar un tratamiento para la enfermedad del niño, aunque sea
dificultoso o peligroso.
C) Uni o bilateralidad:
• En los casos unilaterales puede ser una opción válida la abstención
terapéutica si existe seguridad acerca de la viabilidad funcional del
ojo adelfo y el desprendimiento tiene una configuración cerrada. Si se decide
intervenir, debe considerarse:
— Que la visión del ojo intervenido será con gran probabilidad inferior a
0,1; puede ser útil para deambular y reconocer objetos. En el mejor de los
casos se trataría de conservar un ojo «de reserva», por si el dominante
perdiera toda la visión en un futuro.
— Que puede perderse toda la visión e incluso el ojo, siendo esto más
probable cuanto más cerrado sea el embudo retiniano.
• En los casos bilaterales parece indicada la cirugía siempre, que
puede realizarse bilateralmente durante el mismo acto quirúrgico si por motivos
anestésicos no se contraindica.
— Si sólo se interviene un ojo dada la complejidad del caso el otro ojo se
puede intervenir al poco tiempo, tanto si el resultado ha sido favorable (para
asegurar la visión con otro ojo funcionalmente válido), como pobre (para
intentar obtener algún grado de visión para el paciente).
— La configuración de los embudos retinianos determinará decisivamente la
dificultad quirúrgica y el pronóstico visual.
2. Indicaciones según grado evolutivo (tabla 1): En todos los casos
se intentará la destrucción de la retina periférica avascular si la
enfermedad está activa (enfermedad «plus») y no se ha realizado antes.
Proponemos la siguiente aproximación:
a) Grado 3+ con falta de respuesta al tratamiento convencional
(fotocoagulación o/y crioterapia): Según queda reflejado en el capítulo
previo, puede asociarse un cerclaje escleral, frecuentemente acompañado de un
retratamiento (pudiendo incluir fotocoagulación de la retina madura).
b) Grado 4A:
* Puede asociarse un cerclaje escleral (13), particularmente si existe un
desprendimiento exudativo.
* Si existe un componente traccional importante puede observarse antes
de indicar vitrectomía.
c) Grado 4B:
* Si existe un desprendimiento exudativo, cerclaje.
* Si existe un desprendimiento de predominio traccional, vitrectomía.
d) Grado 5: Vitrectomía según las consideraciones previamente
expuestas. Actualmente nos inclinamos a favor del procedimiento vía pars
plicata. En nuestra opinión no existen grados 5 puramente exudativos que puedan
ser tratados exclusivamente con cerclaje.
e) Glaucoma de ángulo cerrado: Puede tratarse según los principios
expuestos si se decide intentar la reaplicación retiniana. Si se decide un
tratamiento paliativo, se practica lensectomía e iridectomía periférica.
Puede asociarse goniosinequialisis si se cree conveniente tras practicar
gonioscopia, o asociar una cirugía filtrante (rara vez es necesario).

Consideraciones preoperatorias
A) Examen ocular completo
Es necesario para detectar un posible glaucoma y clasificar la apertura del
embudo retiniano. Por tanto, debe practicarse tonometría y oftalmoscopía
binocular indirecta. Si el grado se presenta como un complejo retrolental denso
que impide la visualización retiniana (lo más frecuente en nuestro país con
los grados 5), es preciso realizar una ecografía.
B) Anestesia
Se emplea anestesia general en todos los casos. El anestesista considerará
si es posible un acto quirúrgico largo (cirugía bilateral) por el estado de
salud del niño.
C) Midriasis
Se aplica la metodología explicada en el capítulo previo (ciclopentolato al
0,5% y fenilefrina al 2,5% repetidas a los 10 minutos).
D) Momento de la cirugía
Como queda dicho, el pronóstico funcional es mejor cuanto más precoz es la
cirugía. Pero si existe enfermedad proliferativa activa («plus») el riesgo de
hemorragias postoperatorias y de reproliferación es muy elevado (30,31). De
ahí la importancia de la destrucción de la retina avascular, si es posible. Si
se intervienen ojos con enfermedad activa debe informarse a los padres acerca de
posibles múltiples cirugías.
Metodología del cerclaje
A) Instrumental
Se emplea una banda de silicona dura del n.º 240 (2,5 mm de anchura) que se
sutura a la esclera con puntos de Dacron® de 5/0 y se tensa mediante un
manguito de Watzke. Por lo demás, puede usarse el instrumental normalmente
empleado en cirugía del desprendimiento retiniano o vitrectomía.

Figura 1. Posicionamiento de la banda de silicona dura.
B) Técnica
1. Peritomía: Se realiza en el limbo, se extiende los 360º, y se
añaden dos incisiones radiales de descarga, del modo habitual.
2. Aislamiento muscular: Se practica con los ganchos de estrabismo
habituales, pero cuidando de no dañar los músculos, frágiles debido a la
inmadurez del niño. Del mismo modo se colocan las suturas de tracción
alrededor de las inserciones de los cuatro rectos. Preferimos una seda de 4/0:
Un calibre inferior puede seccionar estos músculos al ejercer tracción; un
calibre superior es innecesario.
3. Identificación del ecuador anatómico del globo: Lugar donde se
asentará el cerclaje. Se determina su localización visualmente, y se
cuantifica con un compás de Castroviejo su distancia al limbo.
4. Posicionamiento de la banda de silicona dura del n.º 240 y
fijación con suturas de anclaje intraesclerales de Dacron® 5/0 en cada
cuadrante (figura 1): El lugar de la sutura se determina con ayuda del compás;
los pasos esclerales deben separarse aproximadamente la anchura de la banda (2,5
mm) para que la banda no tenga holgura dentro de la sutura y no se desplace en
sentido anteroposterior.
5. Colocación del manguito de Watzke (figura 2): Normalmente se
realiza en el cuadrante temporal inferior. Como es sabido, se trata de un
pequeño tubo de silicona blanda (Silastic) que abraza en su interior los dos
extremos de la banda de silicona dura.
6. Drenaje del líquido subretiniano: Puede realizarse con el fin de
ayudar a la reaplicación de la retina y disminuir la presión intraocular,
permitiendo así una mayor indentación del cerclaje sin comprometer la
perfusión del globo.
• Se realiza en la región donde el desprendimiento esté más elevado.
• Primeramente se dobla la punta de una aguja de 25-G de modo que sus 1-1,5
mm finales queden en ángulo recto con el resto de la aguja.
• Se coloca la punta de la aguja doblada sobre la esclera en el lugar
elegido.
• Simultáneamente se aplica sobre la aguja diatermia hasta obtener una
mínima perforación escleral y coroidea, con la consiguiente salida del
líquido subretiniano.

Figura 2. Colocación del manguito de Watzke.
7. Paracentesis: Su finalidad es disminuir la presión intraocular.
Ciertos autores la practican de modo sistemático (7). No es estrictamente
necesaria. Puede reservarse como medida de emergencia hipotensora para el caso
de no registrar perfusión de la arteria central de la retina tras apretar el
cerclaje.
• Se punciona la córnea yuxtalímbica con una aguja de 30-G unida a una
jeringa de insulina, penetrando 1 mm en cámara anterior, aproximadamente.
• Se extraen entre 0,1 y 0,2 cc de humor acuoso.
8. Tensión del cerclaje: Se tensa el cerclaje traccionando de sus
extremos; el manguito los retiene. Se busca una indentación evidente sobre la
esclera, pero no excesiva.
9. Oftalmoscopia indirecta: Tiene dos finalidades:
A) Es imprescindible comprobar la perfusión de la arteria central de
la retina:
* Si existe pulsación la presión intraocular se encuentra entre la
sistólica y la diastólica de la arteria: No es preciso actuar.
* Si no existe pulsación se presiona levemente sobre el globo:
a) Si entonces hay pulsación, la presión intraocular está por debajo de la
diastólica: No es preciso actuar.
b) Si no la hay, se encuentra por encima de la sistólica: Es necesario
aflojar el cerclaje o practicar paracentesis.
B) Se comprueba la correcta colocación del cerclaje y la altura que alcanza,
actuando en consecuencia.
10. Cierre de la peritomía y finalización de la intervención: La
peritomía se cierra mediante suturas reabsorbibles de 7/0 colocadas en el borde
límbico de las incisiones de descarga, obteniendo una aproximación adecuada de
la conjuntiva al limbo, sin invadir la córnea. Se pueden inyectar antibióticos
y corticoides subconjuntivales, a mitad de la dosis de un adulto.
11. Retirada del cerclaje: Se realiza entre el 3.er y 6.º mes tras la
cirugía. Normalmente el cerclaje está incluido en un tejido epiescleral denso
que hace difícil su retirada: En este caso basta con seccionar la banda. Si es
posible, se retiran la banda y las suturas.
Metodología de la vitrectomía vía pars plicata
A) Instrumental
Se emplean los mismos instrumentos para vitrectomía que en los adultos, con
la salvedad de las lentes precorneales, que deben ser de un tamaño reducido
(para neonatos), así como, obviamente, los anillos de soporte de las mismas. No
se emplean si el procedimiento va a ser exclusivamente retrolental.
B) Técnica
El hecho de utilizar un acceso por la pars plicata se debe a que en la RP la
retina desprendida sufre un desplazamiento anterior por tracción, llegando a
colocarse en los casos más extremos en contigüidad con la cristaloides
posterior. La entrada por pars plana implicaría el acceso al espacio subretinia
no y la perforación retiniana consiguiente. La entrada por pars plicata permite
un acceso más seguro al tejido retro lental, que está unido a la retina en
menor o mayor extensión. Alternativamente se puede acceder por vía corneal o
límbica, pero se produce una mayor deformación corneal, con dificultad en la
visualización del procedimiento.
1. Incisiones conjuntivales: Puede hacerse una peritomía completa o
unas pequeñas incisiones en el limbo, correspondientes a la localización de
las esclerotomías (normalmente 3).
2. Colocación de un anillo de soporte para las lentes (si son
necesarias): Se sutura a la esclera del modo habitual.
3. Esclerotomías (figura 3): Se utilizan normalmente las 3 clásicas
(una para infusión y las dos restantes para introducir material). No suele ser
necesaria la endoiluminación, al menos en los momentos iniciales.
• Se emplea un miringotomo de 20-G.
• La punción se realiza en la esclera a 0.5 mm del limbo controlando
visualmente la entrada del miringotomo, que se realiza casi paralela al plano
del iris. Generalmente se atraviesa su raíz, permitiendo el acceso a cámara
posterior desde un plano profundo.
• Se realizan convencionalmente en el cuadrante temporal inferior y en los
dos superiores.

Figura 3. Esclerotomías en la vitrectomía vía pars plicata.
4. Colocación de una sutura tipo colchonero de Vicryl® de 7/0 alrededor
de la esclerotomía temporal inferior, que abrazará la infusión (figura
4). Acto seguido se inserta el pivote de la infusión de menor tamaño (2 mm)
con el flujo purgado de aire y cerrada la infusión temporalmente, hasta que
pueda visualizarse el lugar de colocación. El control de la presión de
infusión se realiza modificando la altura de la botella de infusión, como es
conocido.

Figura 4. Colocación de la infusión.
5. Manejo del iris: Es imprescindible que el iris no dificulte la
visualización. Normalmente se prefiere una iridectomía subtotal, que se
practica con el vitrectomo. Alternativamente, en casos favorables se pueden
realizar esfinterotomías para incrementar la midriasis o bien utilizar
dilatadores de iris insertados por vía límbica.
6. Lensectomía (figura 5): Se realiza con el vitrectomo procurando no
dañar la cristaloides posterior, que puede tener muy próxima la retina
desprendida.
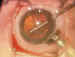
Figura 5. Lensectomía.
7. Disección de las membranas epirretinianas: Las membranas están
fuertemente adheridas a la retina y generalmente están vascularizadas (según
el grado de actividad de la RP). La retina tiene un color amarillento pálido y
es más brillante que las membranas proliferativas.
• Si existen zonas retinianas no afectadas por las membranas se comienza la
disección de éstas por esas zonas libres (figura 6), intentando delaminarlas
con una técnica bimanual y eliminarlas con tijera o vitrectomo.

Figura 6. Utilización del vitrectomo para la eliminación de
membranas no adheridas a la retina.
• Si, como es lo más frecuente, existe un complejo retrolental denso que
engloba la mayor parte de la retina, el abordaje se realiza a partir de una
mínima incisión practicada en la membrana retrolental con miringotomo o tijera
de Sutherland (figura 7) en la zona donde se intuye el comienzo del embudo
retiniano, ya que en ese punto existe una mayor separación entre la membrana y
la retina.
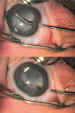
Figura 7. Incisión inicial del complejo retrolental con tijera de
Sutherland.
• A partir de esta incisión se practican cortes radiales hacia la
periferia, en forma de estrella (segmentación) (figura 8).

Figura 8. Segmentación del complejo retrolental.
• Se procede a la delaminación de la membrana epirretiniana con extremado
cuidado y bajo técnica bimanual (figura 9).

Figura 9. Delaminación de las membranas con técnica bimanual.
• Las membranas liberadas pueden ser eliminadas con vitrectomo.
• Se intentan liberar los pliegues retinianos periféricos, quizá la parte
más dificultosa de la cirugía, ya que se pueden producir diálisis retinianas
al traccionar en su periferia. Se emplea la delaminación bimanual en sentido
circunferencial. Se segmentan posibles uniones entre la membrana y los procesos
ciliares.
Notas:
* Alternativamente la incisión inicial puede ser periférica,
circunferencial, con delaminación posterior en sentido centrípeto.
* El control de las hemorragias, inevitables, se logra principalmente
elevando la botella de infusión.
8. Expansión del embudo retinano (figura 10): Una vez liberada de la
tracción, la retina tiende a replicarse. No obstante, es frecuente intentar su
expansión:

Figura 10. Expansión del embudo retiniano.
• Mediante la infusión de viscoelástico o aceite de silicona. Los gases
expansivos pueden producir desgarros retinianos al actuar sobre una retina no
completamente móvil.
• Mediante drenaje de líquido subretiniano (ver apartado anterior).
9. Cierre de las esclerotomías con Vicryl® de 7/0.
10. Cierre de la peritomía e inyecciones subconjuntivales (ver
apartado anterior).
Metodología de la vitrectomía «a cielo abierto»
A) Instrumental
La vitrectomía «a cielo abierto» requiere un instrumental más relacionado
con la queratoplastia que con la cirugía del desprendimiento. Concretamente:
• Líquido de conservación corneal: Actualmente el más empleado es
Optisol®.
• Trépano corneal para receptor: Preferimos los equipados con sistema de
vacío para la fijación corneal, como el tipo Hessburg-Barron. Se elige un
trépano que permita conservar 1,5- 2 mm de córnea yuxtalímbica:
— Un tamaño menor puede dificultar la manipulación.
— Uno mayor desplaza el corte hacia el limbo, incitando la vascularización
(incluso tratándose de la córnea propia).
• Anillos de soporte escleral tipo Flieringa, con diámetros pequeños para
queratoplastia en neonatos (12-16 mm). Impiden el colapso escleral durante la
manipulación retiniana.
• Criodo para extracción cristaliniana intracapsular.
• Instrumental para queratoplastia o cirugía de la catarata.
B) Técnica
1. Colocación del anillo de soporte escleral entre el limbo y las
inserciones de los rectos, mediante 4-6 suturas intraesclerales de seda de 6/0
con aguja espatulada.
2. Determinación del diámetro corneal y selección del trépano,
según lo indicado en el apartado previo.
3. Trepanación corneal (figura 11) y colocación del botón en el
líquido de conservación. Preferimos dejar el líquido y el botón en una placa
de Petri con el fin de que sea más sencilla la visualización y manipulación
del botón corneal sin dañar su endotelio.

Figura 11. Trepanación corneal en la vitrectomía «a cielo
abierto».
4. Manejo del iris (figura 12): Se practican dos iridotomías radiales
diametralmente opuestas y que abarquen toda la distancia pupila-raíz, con el
fin de retraer el iris y mejorar la visualización y el manejo quirúrgico.

Figura 12. Manejo del iris: en este caso se ha elegido una
iridectomía subtotal.
5. Extracción del cristalino «in toto», mediante criodo, procurando
no congelar el iris.
6. Disección de las membranas epirretinianas: La técnica es análoga
a la empleada en la vitrectomía vía pars plicata, aunque la manipulación
tisular es diferente:
• El complejo retrolental se incide en el lugar donde se intuye el comienzo
del embudo retiniano utilizando una pinza fina con dientes, tipo colibrí, y una
tijera de Vannas. Esta manipulación bimanual se utilizará durante toda la
disección del complejo. ES FUNDAMENTAL NO TRACCIONAR LA MEMBRANA EXCESIVAMENTE,
PUES SE PRODUCIRÁ UNA DIÁLISIS RETINIANA. Alternativamente, la disección
puede comenzar en la periferia.
• A partir de la primera incisión se alternan cortes de la membrana con
disección roma, obteniendo pequeños fragmentos de la misma que pueden
extraerse sin riesgo (figura 13).

Figura 13. Segmentación y delaminación del complejo retrolental
con técnica bimanual.
• La disección se continúa hasta la periferia, abarcando los pliegues
retinianos periféricos ya descritos. Si no se liberan estos pliegues la retina
no se desplazará posteriormente y no se aplicará. Durante la disección
periférica el riesgo de diálisis retiniana es máximo.
• La inyección de viscoelástico expande el embudo (figura 14), ayudando a
la disección de la membrana, y además controla la hemorragia. Es importante
realizar la inyección ciudadosamente, ya que una retina fija sometida a una
presión de viscoelástico elevada se desgarrará o desinsertará.

Figura 14. Expansión del embudo retiniano con viscoelástico.
• Se intentará disecar las membranas que se extienden en profundidad hacia
la papila.
7. Reconstrucción iridiana con suturas de Prolene 10/0.
8. Reposición del botón corneal y sutura con puntos sueltos de nylon
10/0 (normalmente se emplean 16). Para más detalles, véase el capítulo sobre
queratoplastia pediátrica.
9. Expansión del embudo retiniano (figura 15): Esta parte final
varía con los diversos autores, omitiéndose en gran número de publicaciones.
Existen dos métodos principales:

Figura 15. Expansión final del embudo con viscoelástico.
• Inyección de viscoelástico. Deben tomarse las precauciones descritas
con el fin de no provocar una rotura retiniana.
• Drenaje del líquido subretiniano (ver apartado sobre cerclaje).
Cuidados postoperatorios
A) Medicación
En todos los casos se prescribe una medicación tópica adecuada al grado de
traumatismo quirúrgico ocasionado y, por tanto, proporcional a la intensidad de
la inflamación esperada. Se emplea ciclopentolato al 0,5% cada 6-8 horas y una
combinación antibiótico-corticoide que inicialmente se prescribe cada 2 horas
para después ir reduciendo su frecuencia según el grado de respuesta.
B) Revisiones
Se pautan inicialmente diarias los 3 primeros días, con el fin de descubrir
posibles complicaciones. Posteriormente se pautan bisemanales hasta constatar
una evolución concreta: favorable o desfavorable.
• La evolución se considera desfavorable si no se reaplica el polo
posterior. Si la evolución es desfavorable se puede plantear una nueva cirugía
o desistir. Esta indicación se realiza según las complicaciones del caso
concreto, el pronóstico que cabe esperar de una nueva intervención, y la
decisión final de los padres.
C) Tratamientos complementarios
• En todos los casos se practicará una esquiascopia tan pronto como los
medios refractivos lo permitan y se prescribirá una graduación acorde. Los
ojos afáquicos y poco desarrollados a causa de una RP severa fre cuentemente
presentan refracciones entre +20 y +30 dioptrías esféricas.
• Se establecerá una pauta de oclusiones para combatir la ambliopía si
existe un ojo dominante.
• Estos niños requieren una educación especial y una rehabilitación
visual según el potencial obtenido tras la cirugía.
Complicaciones
A) Cerclajes
Es infrecuente que el cerclaje tenga complicaciones severas, pero pueden
ocurrir las siguientes complicaciones principales:
• Fracaso de la indentación por localización inadecuada o presión
insuficiente.
• Migración del cerclaje por deficiente anclaje.
— Si migra en sentido posterior puede interferir el drenaje venoso por las
vorticosas y desencadenar una isquemia ocular.
— Si migra anteriormente seccionará los músculos rectos, pudiendo
ocasionar isquemia ocular y cualquier problema de motilidad.
• Migración transescleral del cerclaje (intrusión) por estar
excesivamente apretado y/o ser la esclera especialmente delgada. No suele
producirse si la sección de la banda se realiza en el tiempo recomendado.
B) Vitrectomía vía pars plicata
• Roturas retinianas yatrógenas: Tienden a producirse en la retina
periférica, más delgada y susceptible de desgarros al traccionar sobre ella.
También se producen por cortes accidentales. Están unidas a una elevada
probabilidad de fracaso anatómico (17), debido a la dificultad para cerrar la
rotura tanto externamente como mediante taponamiento interno. Trese ha tratado
con éxito desprendimientos regmatógenos primarios en la RP (10) empleando
procedimientos esclerales exclusivamente.
• Hemorragias: Son inevitables durante la cirugía, pero pueden
controlarse según los principios expuestos. El sangrado postquirúrgico
conlleva un alto índice de reproliferación (18).
• Reproliferación: Alcanza cifras cercanas al 40% de los casos
(18), según las series y se relaciona con el grado de actividad (31) y el
traumatismo quirúrgico ocasionado. Como peculiaridad, en las reproliferaciones
pueden aparecer sinequias irido-retinianas.
• Fracaso: Frecuentemente unido a roturas yatrógenas y/o
reproliferación.
C) Vitrectomía «a cielo abierto»
Además de las anteriores, presenta ciertas complicaciones específicas:
• Hemorragias supracoroideas intraoperatorias (expulsivas), cuyo
pronóstico para la conservación del globo es muy desfavorable. Obviamente se
relaciona con el largo período en que el ojo se encuentra sin cobertura
corneal.
• Opacificación corneal: Puede derivar de un daño endotelial
yatrógeno o de la reacción inflamatoria que acompaña al procedimiento.
• Membranas ciclíticas extensas: Parecen ser más extensas y
severas en este tipo de vitrectomía (23).
Resultados
Los mejores reultados con el empleo del cerclaje en los grados avanzados de
la RP los ha consignado Trese (8): un 70% de reaplicaciones en los grados 4 y un
40% en los 5, habiendo tratado entre ellos 5 ojos con desprendimiento
regmatógeno, todos ellos con éxito. Parece ser que la clave de estos
resultados está en la selección de los casos, ya que si existe un componente
traccional predominante se indica vitrectomía inicialmente.
En la década de los 80, Char les (18) aporta la serie más larga de
vitrectomías practicadas vía pars plicata (586 casos) y de mejores resultados
anatómicos, con un 46% de reaplicaciones, aunque sólo el 36% alcanza ron
algún resultado fun cional. Debemos remarcar las siguientes cuestiones a la luz
de los resultados acumulados hasta ahora:
• Los resultados anatómicos precoces tras la vitrectomía vía pars
plicata se encuentran actualmente entre el 60% de reaplicaciones (Fuchino) (25)
y el 75% [Trese (8) y Mintz-Hittner (26); parte de los casos de Trese fueron
tratados con cerclajes, así como la totalidad de los referidos por
Mintz-Hittner], y parecen superiores a los de la vitrectomía «a cielo
abierto» [Hirose (32), un 40% sobre 524 casos].
• Los resultados anatómicos a largo plazo parecen inferiores [entre el 25%
de retinas aplicadas completamente a los 51/2 años (Seaber, 28) y el 21% de
reaplicaciones parciales en el mismo período (Quinn, 27)]. Parece existir una
elevada tasa de redesprendimiento (28).
• Los resultados funcionales son muy discrepantes: Oscilan entre el 0,01%
de ojos capaces de percibir los estímulos mayores en la visión preferencial
(27) y el 60% de ojos con resultado anatómico favorable reteniendo una visión
ambulatoria (29). Muy pocos ojos alcanzan una visión superior a 0,1 (25).
Curiosamente, los resultados funcionales más favorables se han publicado tras
vitrectomías «a cielo abierto» (Hirose) (29). En casi todos los estudios
recientes se comprueba una correlación entre precocidad del tratamiento y
agudeza visual (8,25,26,29). La serie más exitosa correlaciona también
apertura del embudo y agudeza visual (29).
Perspectivas
Los resultados quirúrgicos más favorables obtenidos en el tratamiento del
desprendimiento retiniano asociado a la RP ofrecen una agudeza visual final muy
limitada en la mayoría de los casos, por lo que es necesario resaltar la
importancia de la prevención. Ello implica actualmenten identificar y tratar
convenientemente el grado 3+, tal como se expone en el capítulo previo.
BIBLIOGRAFÍA
- The International Committee for the Classification of the Late Stages of
Retinopathy of Prematurity: II. The classification of retinal detachment. Arch
Ophthalmol 1987; 105: 906-912.
- Kushner BJ. Ciliary block glaucoma in retinopathy of prematu rity. Arch
Ophthalmol 1982; 100: 1.078-1.079.
- Tasman W, Annesley WJr. Retinal detachment in the retinopathy of
prematurity. Arch Ophthalmol 1966; 75: 608-614.
- Mc Pherson AR, Hittner HM. Scleral buckling in 21/2 to 11 month old
premature infants with retinal detachment associated with acute retrolental
fibroplasia. Ophthalmology 1979; 86: 819-835.
- Mc Pherson A, Hittner HM, Lemos R. Retinal detachment in young premature
infants with acute retrolental fibroplasia: thirty-two new cases. Ophthalmology
1982; 89: 1.160-1.169.
- Grunwald E, Yassur Y, Ben-Sira I. Buckling procedures for retinal
detachment caused by retrolental fibroplasia in premature babies. Br J Opthalmol
1980; 64: 98-101.
- Trese MT. Scleral buckling for retinopathy of prematurity. Ophthalmology
1994; 101: 23-26.
- Trese MT, Droste PJ. Long-term postoperative results of a consecutive
series of stages 4 and 5 retinopathy of prematurity. Ophthalmology 1998; 105:
992-997.
- Bert MD, Friedman MW, Ballard R. Combined cryosurgery and s cle ral
buckling in acute proliferative retrolental fibroplasia. J Pediatr Ophthalmol
Strabismus 1981; 18: 9-12.
- Topillow HW, Ackerman AL, Wang FM. The treatment of advanced retinopathy
of prematurity by cryotherapy and scleral buckling surgery. Ophthalmology 1985;
92: 379-387.
- Greven C, Tasman W. Scleral buckling in stages 4B and 5 retinopathy of
prematurity. Ophthalmology 1990; 97: 817-820.
- Noorily SW, Small K, De Juan E Jr, Machemer R. Scleral buckling surgery
for stage 4B retinopathy of prematurity. Ophthalmology 1992; 99: 263-268.
- Hinz BJ, De Juan E Jr, Repka MX. Scleral buckling surgery for active
stage 4A retinopathy of prematurity. Ophthalmology 1998; 105: 1827-1830.
- Lightfoot D, Irvine AR. Vitrectomy in infants and children with retinal
detachments caused by cicatricial retrolental fibroplasia. Am J Ophthalmol 1982;
94: 305-312.
- Merritt JC, Lawson EE, Sprague DH, Eifrig DE. Lensectomy-vitrectomy for
stage V cicatricial retrolental fibroplasia. Ophthalmic Surg 1982; 13: 300-306.
- Treister G, Machemer R. Results of vitrectomy for rare proliferative and
hemorrhagic diseases. Am J Ophthalmol 1977; 84: 304-412.
- Machemer R. Closed vitrectomy for severe retrolental fibroplasia in the
infant. Ophthalmology 1983; 90: 436-441.
- Charles S. Vitrectomy with ciliary body entry for retrolental
fibroplasia. In: Mc Pherson AR, Hittner HM, Kretzer FL (eds). Retinopathy of
Prematurity: Current concepts and controversies. Toronto: BC Decker Inc, 1986:
225-234.
- Chong LP, Machemer R, De Juan E Jr. Vitrectomy for advanced stages of
retinopathy of prematurity. Am J Ophthalmol 1986; 102: 710-716.
- De Juan E Jr, Machemer R. Retinopathy of prematurity. Surgical technique.
Retina 1987; 7: 63-69.
- Hirose T, Schepens CL. Complications in open-sky vitrectomy. In: Freeman
HM, Hirose T, Schepens CL (eds). Vitreous surgery and advances in fundus
diagnosis and treatment. New York: Appleton-Century-Crofts, 1977; 479-495.
- Mc Pherson AR, Hittner HM, Moura RA, et al. Treatment of retrolental
fibroplasia with open-sky vitrectomy. In: Mc Pherson AR, Hittner HM, Kretzer FL
(eds). Retinopathy of Prematurity. Current concepts and controversies. Toronto:
BC Decker Inc, 1986; 193-208.
- Schepens CL. Clinical and research aspects of subtotal open-sky
vitrectomy. Am J Ophthalmol 1981; 91: 143-171.
- Tasman W, Borrone RN, Bolling J. Open sky vitrectomy for total retinal
detachment in retinopathy of prematurity. Ophthalmology 1987; 94: 449-452.
- Fuchino Y, Hayashi H, Kono T, Ohshima K. Long-term follow-up of visual
acuity in eyes with stage 5 retinopathy of prematurity after closed vitrectomy.
Am J Ophthalmol 1995; 120: 308-316.
- Mintz-Hittner HA, O’Malley RE, Kretzer FL. Long-term form
identification vision after early, closed, lensectomy-vitrectomy for stage 5
retinopathy of prematurity. Ophthalmology 1997; 104: 454-459.
- Quinn GE, Dobson V, Barr CC, Davis BR, Palmer EA, Robertson R, et al.
Visual acuity of eyes after vitrectomy for retinopathy of prematurity. Follow-up
at 51/2 years. Ophthalmology 1996; 103: 595-600.
- Seaber JH, Machemer R, Elliot D, Buckley EG, De Juan E, Martin DF.
Long-term visual results of children after initially successful vitrectomy for
stage V retinopathy of prematurity. Ophthalmology 1995; 102: 199-204.
- Hirose T, Katsumi O, Mehta M, Schepens CL. Vision in stage 5 retinopathy
of prematurity after retinal detachment by open-sky vitrectomy. Arch Ophthalmol
1993; 111: 345-349.
- Trese MT. Surgical results of stage V retrolental fibroplasia and timing
of surgical repair. Ophthalmology 1984; 91: 461-466.
- Trese MT. Visual results and prognostic factors of vision following
surgery for stage V retinopathy of prematurity. Ophthalmology 1986; 93: 574-579.
- Hirose T, Schepens CL, Katsumi O, Mehta M. Open-sky vitrectomy in severe
retinal detachment caused by advanced retinopathy of prematurity. In: Flynn JT,
Tasman W,eds. Retinopathy of prematurity. New York: Springer-Verlag; 1992;
95-114.
|