|
La frecuencia de uveítis es relativamente baja en niños menores de 16 años
de edad. Aunque estimar la frecuencia real de esta patología es ciertamente
difícil al no existir estudios dentro de este grupo de edad, una incidencia
aproximada de un 8% puede extrapolarse de los datos habidos en la literatura
mundial (1).
Dentro de los patrones de uveítis en la población pediátrica, Tugal-Tutkun
y Havrilkova revisaron 130 pacientes con uveítis de debut antes de los 16 años
de edad, encontrando como más prevalente dentro de este grupo la uveítis
asociada a artritis reumatoide juvenil (41,5%), seguida de la uveítis
idiopática (21,5%) y, por último, pars planitis (15,3%) (2).
La pars planitis o uveítis intermedia idiopática es asintomática, en
ocasiones, hasta que una progresión avanzada de la enfermedad provoca
disminución en la agudeza visual. En otras ocasiones, la actividad inflamatoria
en tan importante que provoca alteraciones visuales tempranas, frecuentemente
miodesopsias, que son referidas por niños con edad suficiente para ello.
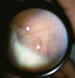
Figura 1. Banco de nieve característico de las parsplanitis.
Dado que el ojo se mantiene característicamente no inyectado, existen pocos
datos que llamen la atención de los padres hasta que el niño aqueje
alteración visual o presente un estrabismo secundario a ésta si es muy
pequeño.

Figura 2. Imagen transcristaliniana del banco de nieve.
Un diagnóstico, por tanto, temprano, está basado en los hallazgos
exploratorios oftalmológicos.
Puede coexistir con afectación de polo anterior y ser diagnosticada a la vez
que ésta, lo cual ocurre sólo en un 10% de los casos de pars planitis. Lo más
frecuente es, por otro lado, que en fases iniciales de la enfermedad, la
presencia de células en vítreo anterior y espacio de Berger sea el único
signo apreciable en la exploración rutinaria. Inicialmente esta celularidad es
fina, pero durante el transcurso de la enfermedad puede existir agregación
celular pudiendo adquirir un estado fibrilar en el tercio anterior de la cavidad
vítrea.
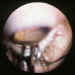
Figura 3. Retinosquisis asociada a pars planitis.
Posiblemente el signo oftalmoscópico más característico de la pars
planitis sean los bancos de nieve o «snowbanks» localizados a nivel de pars
plana y visibles en ocasiones desde fases muy tempranas de la enfermedad
mediante indentación escleral. Estos bancos de nieve consisten en una malla
fibroglial que parece originarse de fibras de colágeno de la base del vítreo y
astrocitos fibrosos provenientes de la retina, y vascular, que contienen
fibrocitos, células inflamatorias mononucleares y células hiperplásicas del
EPR de la pars plana (3). Estos cambios, en definitiva, reflejan un proceso
inflamatorio que afecta conjuntamente tanto a la retina periférica como a la
base del vítreo.
Otros signos oftalmoscópicos apreciables de este proceso son la vasculitis
retiniana periférica con envainamiento tanto de arteriolas como de vénulas,
edema peripapilar y edema macular quístico.
Cuando la agudeza visual es de 20/30 o menor, un edema macular cistoide es
oftalmológicamente visible con frecuencia. En el curso más tardío de la pars
planitis, estos cambios cistoides pueden lobularse y llegar a provocar
hemorragias maculares.
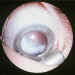
Figura 4. Catarata secundaria en este tipo de patología.
Un hallazgo inconstante en esta patología es la neovascularización de la
retina periférica y hemorragia vítrea.
La retinosquisis, por otro lado, es un hallazgo frecuente, al contrario que
otros como desprendimientos retinianos (regmatógenos, traccionales o
exudativos), hemangiomas o aneurismas periféricos similares a los que aparecen
en la enfermedad de Coats, neuritis óptica o neovascularización del nervio
óptico (5).
Respecto a los desprendimientos de retina, Brockhurst y Schepens los
clasificaron en función a su gravedad y respuesta al tratamiento quirúrgico,
proporcionales ambos a la severidad y duración de la uveítis. Las categorías
establecidas por estos autores incluyen: desprendimientos asociados a uveítis
periféricas leves, con pequeños desgarros en la ora serrata vecina a un foco
inflamatorio; los asociados a uveítis crónica moderada, con desgarros mayores
habitualmente en el borde posterior de un foco de exudado masivo, causando un
desprendimiento progresivo con una retina quística adelgazada que recuerda a la
retinosquisis; los asociados a uveítis crónica severa, con grandes desgarros
retinianos, proliferación celular y vascularización moderada de la cavidad
vítrea; y los asociados, por último, a uveí tis con marcada vascularización
y organización vítrea que provoca una membrana ciclítica y un desprendimiento
total y organizado (6).
En fases más avanzadas de la pars planitis es habitual el desarrollo de una
catarata subcapsular posterior, que además de contribuir a un empeoramiento de
la agudeza visual, hace más difícil el control oftalmoscópico del ojo. El
desarrollo de esta opacidad de cristalino también se ha descrito como clínica
inicial, llegándose a un diagnóstico correcto mediante la identificación de
los bancos de nieve por medio de biomicroscopia ultrasónica, de incuestionable
valor en una situación como ésta (7,8). También se ha asociado la
opacificación del cristalino a un riesgo mayor de sufrir un desprendimiento de
retina, riesgo estadísticamente significativo en la serie estudiada por
Malinowski y Pulido (9).
Existen ciertas patologías que se asocian a pars planitis y que hay que
descartar ante cualquier niño en el que llegue a este diagnóstico.
Estas son: esclerosis múltiple, frecuentemente con historia familiar (11% de
los pacientes con EM de la serie de Malinowski y Pulido (9) tenían historia
positiva de EM dentro de los familiares de primer grado) (5,10), toxocariasis,
sarcoidosis (oscila entre 10 y 22% según las series) (5) y enfermedad de
Whipple (2,5%), esta última con una forma de presentación análoga a la pars
planitis (5).
En los niños, otras asociaciones como son la enfermedad de Behçet o la
enfermedad de Lyme, son extremadamente raras.
Con todo, las pars planitis de causa desconocida son las más frecuentes
tanto en la población adulta como en la pediátrica.
Malinowski, Pulido et al. correlacionan el HLA DR-2 con pars planitis en un
70%, siempre que se asocie en el momento del diagnóstico o posteriormente a
esclerosis múltiple (11). Esta asociación está ampliamente corroborada por
otros como Raja et al (12) y Tang (13), que encuentran una asociación
significativa entre visualización en el fondo de ojo de periflebitis,
positividad para HLA-DR 15 (que codifica para uno de los dos subtipos de HLA-DR
2) y coexistencia o posterior desarrollo de esclerosis múltiple.
Respecto al abordaje terapéutico de las pars planitis, a pesar de los
ensayos con diferentes sustancias como Tacrolimus (FK506) (14) con buenos
resultados, mundialmente se sigue respetando el algoritmo terapéutico descrito
por Conrad en el capítulo 56 del volumen 4 del Duane’s Ophthalmology Textbook
(1), que aconseja iniciar tratamiento corticoideo tópico asociado a
cicloplegía cuando la agudeza visual sea 20/40 o mayor. Si la visión es menor
a 20/40, existen condensaciones vítreas o exudación subretiniana, es
aconsejable iniciar tratamiento corticoideo periocular, que mejora la agudeza
visual y la actividad inflamatoria con pocas complicaciones secundarias como
aumento transitorio de presión intraocular o ptosis media (15,16), y que se
puede repetir semanalmente hasta 6 dosiss (1). De no ser suficiente, se puede
intentar tratamiento esteroideo sistémico (17), asociado o no a ciclospori na A
(18) así como la posibilidad de utilizar ciclosporina como tratamiento único
(19,20).
Las opciones quirúrgicas de cara a tratar una pars planitis incontrolable
médicamente, incluyen, como más extendida, la crioterapia (21-23), con mejoras
en la agudeza visual que varían entre un 25 y un 61% según la publicación.
Otra opción para tratar complicaciones asociadas a pars planitis y mejorar la
visión, de relativamente reciente incorporación es la fotocoagulación
periférica (24,25), con buenos resultados, ya sea asociada o no a vitrectomía.
Existe una referencia en la literatura en relación al beneficio de una
vitrectomía posterior en niños con uveítis intermedia crónica,
considerándose ésta como un método relativamente seguro y exitoso, que de
realizarse en estadios tempranos de la enfermedad, previene complicaciones
irreversibles y posibles ambliopías (26).
Por último, como sabemos, las pars planitis pueden asociar complicaciones
que requieran una actitud quirúrgica concreta destinada a intentar resolverlas,
entre las que cabe destacar el glaucoma secundario (en 4% aproximadamente) (6),
cataratas visualmente significativas (14,8%) (9), los desprendimientos de retina
o membranas epirretinianas (27), que pueden ser abordadas quirúrgicamente a
estas edades con un éxito y beneficio considerables (28).
Respecto al glaucoma secundario a uveítis, Merayo-Lloves et al, en su
revisión publicada en 1999 tras un seguimiento de los enfermos estudiados
durante 10 años, destacan que del 9,6% de enfermos con uveítis que desarrollan
un glaucoma secundario, sólo un 4% se deben a pars planitis y que dentro de la
población pediátrica, la uveí tis más relacionada a esta complicación es
aquella asociada con la artritis reumatoidea juvenil, un 16% de sus casos (29).
Ya en 1964, Kimura y Hogan describieron los signos clínicos propios de este
tipo de uveítis y sus complicaciones, revisando una serie de 136 casos y su
evolución clínica. Concluyeron que un 50% de sus casos sufrió un
empeoramiemto clínico dentro de todo el tiempo de seguimiento (20 años),
ocurriendo la mayoría de éstos durante los primeros 5 años de evolución de
la enfermedad. De similar modo concluyen que el empeoramiento es mayor y más
temprano cuanto mayor sea la severidad del cuadro inicial. Estos autores
refieren su impresión clínica respecto a que la enfermedad tiene una
evolución más lenta en la población infantil (4).
NUESTRA EXPERIENCIA
Hemos revisado 10 niños (17 ojos) diagnosticados en nuestro servicio de
oftalmología infantil desde 1992 a febrero de 2000.
La edad media de presentación de síntomas fue de 10 años y 1 mes (con el
paciente más joven de 7 años y el mayor de 11 años y 9 meses). Todos ellos
son de raza blanca, 60% de los pacientes son varones y 40% mujeres.
Encontramos afectación bilateral en un 60% de los casos, menor al 77,5% de
Henderly u 80% de Rodríguez, según refleja la revisión que en 1998 presenta
la Asociación Americana de Retina en un apartado dedicado a pars planitis.
Los síntomas de debut de la enfermedad fueron: visión borrosa y/o
disminución de agudeza visual (4/10 niños) y dolor (1/10). 3/10 niños fueron
remitidos a la consulta con un diagnóstico ya establecido, por mostrar
resistencia al tratamiento intentado. En 1 de los 10 niños se hizo un
diagnóstico casual durante una revisión oftalmológica de rutina y en uno de
los casos no está registrada la forma de debut.
En uno de los niños que debutó con disminución de agudeza visual, el
origen de éste fue una hemorragia vítrea, forma no frecuente de debut de una
pars planitis, pero ya descrita en la literatura (30).
En cuanto a los signos oftalmológicos, existe un paralelismo a los descritos
por Pulido en la revisión mencionada con anterioridad, encontrando: hiperemia
conjuntivo-ciliar en 1/10 casos; precipitados queráticos finos no pigmentados
en 1/10; Tyndall positivo en cámara anterior en 3/10 niños; fibrina en cámara
anterior en 1/10 de manera espontánea y en otro niño secundariamente a
cirugía de cataratas; sinequias posteriores en 2/10 pacientes; glaucoma
presumiblemente inducido por corticoides en 1/10 (2 ojos, uno de ellos en
tratamiento actualmente con betabloqueante tópico cada 12 h), sin presentarse
ningún otro tipo de glaucoma en toda la serie; catarata secundaria a
inflamación y/o tratamiento corticoideo en 1/10.

Figura 5. Flóculos vítreos, corticoterapia suptenoniana, bancos de
nieve e inicio de edema macular quístico.
Respecto al polo posterior, observamos: Tyndall vítreo positivo en 4/10
niños, bancos de nieve en 8/10 y hemorragia vítrea únicamente en un caso,
aunque de repetición (y un solo ojo). Ha aparecido por el momento, un único
caso de edema macular cistoide, y sólo 2 casos de periflebitis. En cuanto a la
retina, apreciamos DR en un caso (que podríamos englobar en le tercera
categoría de acuerdo a la clasificación descrita por Brockhurst y Schepens, y
a la que ya se ha hecho referencia anteriormente) (6), tracciones fibrosas en
otro, atrofia retiniana en otro y retinosquisis en 2 ojos de dos niños. En
ningún caso hemos apreciado afectación del nervio óptico, ni en forma de
neuritis ni de vascularización anormal del mismo.
En ninguno de los niños, tras amplio estudio sistémico en combinación con
el servicio de Pediatría, se llegó a un diagnóstico de enfermedad de base o
asociada a la alteración ocular, sin existir en ninguno de ellos asociación
con HLA más prevalente según otras series (11-13).
Siguiendo la pauta terapéutica más extendida, la actitud con los pacientes
en función de su respuesta al tratamiento y mejoría sintomática y funcional,
fue la siguiente:
— Sin tratamiento: 2 niños (uno por ser hallazgo casual sin clínica en AO
y otro por presentar edema macular cistoide en OI sin posibilidad de actuación
y OD normal).
— Corticoides tópicos: 1 niño (1 ojo).
— Corticoides tópicos+peribulbares: 4 niños (6 ojos).
— Corticoides tópicos+sistémicos: 2 niños (4 ojos).
Estos dos últimos grupos sufrieron un tratamiento combinado al ser la pars
planitis resistente a una primera aproximación terapéutica con corticoides
tópicos.
La terapia sistémica se utilizó temporalmente (durante cinco meses) en un
niño que presentaba bancos de nieve y retinosquisis de localización inferior
en AO y de manera mantenida aún en la actualidad en una niña con bancos de
nieve y hemovítreos de repetición. Ninguno de los niños recibió tratamiento
con ciclosporina A.
Cirugía de las complicaciones:
— VTC posterior con cerclaje y endoláser: 1 niño (DR en un ojo con
retinosquisis).
— Colocación de válvula de Ahmed: 1 niño (1 ojo con aumento PIO
secundaria a corticoterapia y refractiva a tratamiento médico).
— Cirugía de cataratas: 2 niños (2 ojos). En uno de ellos se procedió al
implante de LIO en el mismo acto quirúrgico, mientras que en otro niño esto se
hizo en un segundo tiempo, dado que la intervención en la que se extrajo el
cristalino se combinó con cirugía de polo posterior y se esperó la
resolución de la lógica inflamación postquirúrgica antes de la colocación
de la LIO.
La implantación de una LIO en la cirugía de cataratas en pacientes con
uveítis intermedias es un aspecto ampliamente discutido, sin embargo, la
revisión de la literatura de los últimos años ofrece la esperanza de una
buena recuperación visual en este tipo de cirugía en ciertos casos
seleccionados, con un buen manejo del período postquirúrgico con esteroides
locales, teniendo que recurrir en ciertos casos a su uso vía sistémica o
incluso a otro tipo de inmunosupresión en casos esporádicos. No fue éste el
caso en nuestros dos pacientes, donde el tratamiento tópico fue suficiente tras
la cirugía, y donde no se produjeron otras complicaciones. Los factores
realmente limitantes en cuanto a recuperación visual tras la cirugía de la
catarata en estos pacientes viene determinada por otras complicaciones asociadas
a las uveítis intermedias, como el edema macular quístico, la formación de
membranas epirretinianas o los desprendimientos de retina (31-33).
— Fotocoagulación periférica: 1 niño.
Tras un tiempo de seguimiento medio de 26,33 meses (desviación estándar de
10,55 meses; con un mínimo de 6 meses y un máximo de 34 meses), podemos
concluir que las medidas terapéuticas decididas en función del estado
anatómico y funcional de cada ojo, han resultado beneficiosas, ya que la
agudeza visual media inicial de los ojos afectados fue de 0,6 de Snellen y
mejoró postratamiento a una media de 0,8 de Snellen.

Figura 6. Cirugía vítrea, iluminación del banco de nieve,
tratamiento con crioterapia y retinosquisis por transiluminación.
BIBLIOGRAFÍA
- Conrad LG. Uveitis in childhood. Duane s Ophthalmology . Chapter 56, Vol
4. 1998 Edition. Lippincot-Raven Publishers. Philadelphia.
- Tugal-Tutkun I, Havrlikova K, Power WJ, Foster CS. Changing patterns in
uveitis of childhood. Ophthalmology 1996; 103: 375-83.
- Pederson JE, Kenyon KR, Green WR, Maumenee AE. Pathology of pars planitis.
Am J Ophthalmology 1978; 86: 762-74
- Kimura SJ, Hogan MJ. Chronic Cyclitis. Arch Ophthalmol 1964; 71: 193-201.
- Pulido JS. Pars Planitis. Idiopathic Intermediate uveitis/Pars Planitis.
1998 Update on Retinitis/uveitis. Annual Meeting of MO, 1998, New Orleans.
- Brockhurst J, Schepens L. Peripheral uveitis: The Complication of Retinal
Detachment. Arch Ophthalmol 1968; 80: 747-53.
- García Feijoo J, Martín Carbajo M, Benítez del Castillo JM, García
Sánchez J. Ultrasound biomicriscopy in pars planitis. Am J Ophthalmol 1996;
121: 214-5.
- Gentile RC, Berinstein DM, Liebmann J, Rosen R, Stegman Z, Tello C, Walsh
JB, Ritch R. High-resolution ultrasound biomicroscopy of the pars plana and
peripheral retina. Ophthalmology 1999; 105: 478-84.
- Malinowski SM, Pulido JS, Folk JC. Long-term visual outcome and
complications associated with pars planitis. Ophthalmology 1993; 100: 818-24.
- Lee AG . Familial pars planitis. Ophthalmic Genet. 1995; 16: 17-9.
- Malinowski SM, Pulido JS, Goeken NE, Brown CK, Folk JC. The association
of HLA-B8 B51, DR2, and multiple sclerosis in pars planitis. Ophthalmology 1993;
100: 1199-205.
- Raja SC, Jabs DA, Dunn JP, Fekrat S, Machan CH, Marsh MJ, Bressler NM.
Pars planitis: clinical features and class II HLA associations. Ophthalmology
1999; 106: 594-9.
- Tang WM, Pulido JS, Eckels DD, Han DP, Mieler WF, Pierce K. The
association of HLA DR15 and intermediate uveitis. Am J Ophthalmol 1997; 123:
70-5.
- Sloper CM, Powell RJ, Dua HS. Tacrolimus (FK506) in the treatment of
posterior uveitis refractory to cyclosporine. Ophthalmology 1999; 106: 723-8.
- Tanner V, Kanski JJ, Frith PA. Posterior sub-Tenon vs triamcinolone
injections in the treatment of uveitis. Eye 1998; 12: 679-85.
- Riordan-Eva P, Lightman S. Orbital floor steroid injections in the
treatment of uveitis. Eye 1994; 8: 66-9.
- Wakefield D, McCluskey P, Penny R. Intravenous pulse methylprednisolone
therapy in severe inflammatory eye disease. Arch Ophthalmol 1986; 104: 847-51.
- Towler HM, Whiting PH, Forrester JV. Combination of low dose cyclosporine
A and steroid therapy in chronic intraocular inflammation. Eye 1990; 4: 514-20.
- Nussenblatt RB, Palestine AG, Chan CC. Cyclosporine therapy for uveitis:
long-term followup. J Ocul Pharmacol 1985; 1: 369-78.
- Walton RC, Nussenblatt RB, Whitcup SM. Cyclosporine therapy for severe
sight-threatening uveitis in children and adolescents. Ophthalmology 1998; 105:
2028-34.
- Verma L, Kumar A, Garg S, Khosla PK, Tewari HK. Cryopexy in pars
planitis. Can J Ophthalmology 1991; 26: 313-5.
- Okinami S, Sunawaka M, Nihira M. Treatment of pars planitis with
cryotheraphy. Ophthalmologica 1991; 202: 180-6.
- Josephberg RG, Kanter ED, Jaffee RM. A fluorescein angiographic study of
patients with pars planitis and peripheral exudation (snowbanking) before and
after cryopexy. Ophthalmology 1994; 101: 1262-6.
- Pulido JS, Mieler WF, Walton D et al. Results of peripheral laser
photocoagulation in pars planitis. Trans Am Ophthalmol Soc 1998; 96: 127-37.
- Park SE, Mieler WF, Pulido JS. Peripheral scatter photocoagulation for
neovascularization associated with pars planitis. Arch Ophthalmol 1995; 113:
1277-80.
- Bacskulin A, Eckardt C. Results of pars plana vitrectomy in chronic
uveitis in childhood. Ophthalmologe 1993; 90: 424-9.
- Dev S, Mieler WF, Pulido JS, Mittra RA. Visual outcomes after pars plana
vitrectomy for epiretinal membranes associated with pars planitis. Ophthalmology
1999; 106: 1086-90.
- Desai UR, Blinder KJ, Dennehy PJ. Vitrectomy and juvenile epiretinal
membrane. Ophthalmic Surg Lasers 1996; 27: 137-9.
- Merayo-Lloves J, Power WJ, Rodríguez A, Pedroza.Seres M, Foster CS.
Secondary glaucoma in patients with uveitis. Ophthalmologica 1999; 213: 300-4.
- Philips WB 2d; Bergren RL, McNamara JA. Pars planitis with vitreous
hemorrhage. Ophthalmic Surg 1993; 24: 630-1.
- Fogla R, Biswas J, Ganesh SK, Ravishankar K. Evaluation of cataract
surgery in intermediate uveitis. Ophthalmic Surg Lasers 1999; 30: 191-8.
- Kaufman AH, Foster CS. Cataract extraction in patients with pars
planitis. Ophthalmology 1993; 100: 1210-7.
- Tessler HH, Farber MD. Intraocular lens implantation versus no
intraocular lens implantation in patients with chronic iridocyclitis and pars
planitis. A randomized prospective study. Ophthalmology 1993; 100: 1206-9.
|