|
Introducción
El retinoblastoma es un paradigma de predisposición genética al cáncer. Ya
en 1971 Knudson anticipó, basándose en la distribución de retinoblastomas
bilaterales y unilaterales en virtud de su edad de presentación, que el tumor
debería ser causado por la inactivación de un gen por dos eventos mutacionales
independientes (1). En 1986 se identificó y clonó el gen responsable de este
tumor (denominado RB1), demostrándose que se encontraba mutado en estos
tumores, y en consecuencia la hipótesis inicial de Knudson (2).
En condiciones normales, la proteína codificada por este gen es un regulador
negativo de la proliferación celular. Su inactivación conduce, por tanto, a la
eliminación de esta barrera produciéndose un crecimiento celular desordenado
que finalmente desemboca en la formación del tumor. A estos genes que
desempeñan una regulación negativa sobre el ciclo celular se les denomina
genéricamente genes supresores de tumores, ya que su inactivación aumenta la
probabilidad de desarrollar un cáncer. RB1 también está implicado en el
desarrollo de otros tumores, como osteosarcomas, sarcomas de tejidos blandos y
cáncer de pulmón microcítico, entre otros (3-5).
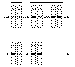
Figura 1. Hipótesis de Knudson de los dos eventos mutacionales. En los
retinoblastomas no hereditarios (A), el ADN constitucional presenta dos
alelos normales del gen del retinoblastoma (RB1). Durante la embriogénesis, una
célula de la retina adquiere la primera mutación en una de las dos copias del
gen (rectángulo negro). Posteriormente, la otra copia del gen es inactivada en
la misma célula por una segunda mutación. Por el contrario, en los
retinoblastomas hereditarios (B), la primera mutación está presente en
el ADN constitucional (heredada a través de la línea germinal), y por lo
tanto, todas las células de la retina contienen solo una copia normal del gen.
La inactivación de esta copia en cualquier célula de la retina conduce a la
formación del tumor.
El modelo genético aceptado actualmente sugiere que dos mutaciones,
afectando a cada una de las dos copias del gen del retinoblastoma, son
suficientes y necesarias para el desarrollo del tumor (figura 1). La primera de
estas mutaciones puede aparecer en los precursores de las células de la retina
y en consecuencia estar presente únicamente en las células tumorales
(retinoblastomas denominados no hereditarios) o estar presente en todas o la
mayoría de las células del organismo (retinoblastomas hereditarios). La
segunda de las mutaciones, que inactiva la copia restante del gen, ocurre
siempre en las células de la retina, conduciendo a la formación de un tumor
con ambas copias del gen inactivadas.
Aproximadamente el 60% de los retinoblastomas son no hereditarios,
correspondiendo el 40% restante a retinoblastomas hereditarios. Todos los
retinoblastomas no hereditarios son unilaterales y en ellos no hay posibilidad
de transmitir la enfermedad a la descendencia, ya que las mutaciones en el gen
RB1 están presentes únicamente en las células que forman el tumor. De los
retinoblastomas hereditarios, es decir, aquellos en los que las células
constitutivas del organismo son portadoras de una mutación, un 70% son
bilaterales. El 30% restante son tumores unilaterales (figura 2).
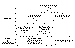
Figura 2. Genética del retinoblastoma y formas de presentación.
Ya que los pacientes con retinoblastoma hereditario son portadores de
mutaciones constitucionales, estos pueden transmitir la enfermedad a la
descendencia. Los niños que han heredado de sus padres una copia mutada del gen
del retinoblastoma tienen una probabilidad del 90% de desarrollar el tumor, que
en la mayoría de los casos será bilateral. La cuarta parte de los
retinoblastomas hereditarios tienen una historia familiar de la enfermedad. El
resto de los casos de retinoblastoma hereditario corresponden a la aparición de
nuevas mutaciones en línea germinal en el paciente, las cuales no estaban
presentes en sus progenitores, pero que si pueden ser transmitidos a su
descendencia en el futuro (figura 2). Sin embargo, la ausencia de mutaciones en
el ADN constitucional de sangre periférica de los progenitores —criterio
habitual de no heredabilidad de la enfermedad— debe revisarse a la luz de la
existencia de casos de mosaicismo. En estos, la mutación puede estar presente
en las células germinales de los progenitores (p. ej. en los espermatocitos del
padre), y en consecuencia pueden transmitir la mutación a sus descendientes
(6).

Mutaciones en el gen RB1 que predisponen a padecer retinoblastoma
La mayoría, si no todas las mutaciones que predisponen al retinoblastoma,
son el resultado de cambios genéticos que interfieren con la función normal
del gen. En la tabla 1 se resumen los tipos de mutaciones identificadas.
Aproximadamente un 5% de las mutaciones son alteraciones cromosómicas
extensas tales como deleciones, translocaciones o inversiones cromosómicas,
muchas veces asociadas al denominado síndrome de 13q [retraso mental,
microcefalia y otras anormalidades sistémicas (7)] que pueden ser detectadas
mediante técnicas de citogenética con microscopía convencional o mediante
hibridación in situ con sondas fluorescentes (FISH) (mutaciones
microscópicas).
Otros tipos de mutaciones son deleciones de relativamente grandes fragmentos
de ADN, presentes en el 15%-20% de los casos, pero que son lo bastante pequeñas
para no poder ser detectadas mediante las técnicas citogenéticas habituales
(mutaciones submicroscópicas). Estas alteraciones son frecuentemente detectadas
mediante técnicas de hibridación de ADN (Southern-blot) (8).
Sin embargo, la mayoría de las mutaciones corresponden a cambios sutiles en
la secuencia del ADN, ésto es, a sustituciones o pequeñas inserciones o
deleciones de unos pocos nucleótidos. Estas alteraciones sólo pueden ser
detectadas mediante técnicas de biología molecular complejas tales como el
análisis de polimorfismos conformacionales de ADN de cadena sencilla (PCR-SSCP)
y secuenciación (9-14). La consecuencia mas habitual de estas mutaciones es la
formación de proteínas truncadas no funcionales debido a la aparición de
codones de parada prematuros (15).
Diagnóstico molecular y consejo genético
Los pacientes con antecedentes familiares de la enfermedad, retinoblastoma
bilateral, y aproximadamente un 15% de los pacientes con retinoblastoma
unilateral son portadores de mutaciones constitutivas en uno de los alelos del
gen del retinoblastoma que les predispone a desarrollar retino blastoma.
Hasta la llegada de las modernas técnicas de análisis del ADN, solamente
era posible determinar de manera empírica la probabilidad de tener descendencia
con riesgo de desarrollar retinoblastoma, basándose en grandes estudios
poblacionales (16). Por el contrario, los estudios moleculares permiten
determinar el genotipo de cada uno de los miembros de una familia, permitiendo
evaluar el riesgo real de desarrollar la enfermedad. Por tanto, el diagnóstico
molecular en pacientes con retinoblastoma y en sus familiares es de inestimable
valor, especialmente en lo referente al consejo genético.
A continuación se comentan brevemente los tres tipos de retinoblastoma
hereditario en los que está indicado la realización de un estudio molecular.
Retinoblastoma familiar (más de un miembro de la familia afectado con
retinoblastoma bilateral o unilateral).
El diagnóstico molecular en pacientes con retinoblastoma familiar y en todos
los familiares en primer grado (padres, hermanos y descendientes) es altamente
recomendable e informativo, ya que es posible identificar que miembros de la
familia son portadores de la mutación que predispone a desarrollar
retinoblastoma y cuales no (17). En estos casos, el análisis molecular consiste
en un estudio de ligamiento —una técnica que permite determinar que alelo
segrega con la enfermedad y es portador de la mutación— realizado a partir
del ADN de muestras de sangre periférica de los diferentes miembros de la
familia (sanos o no) (figura 3).
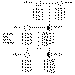
figura 3. Estudio de ligamiento en un caso de retinoblastoma
familiar. En este familia, tanto la madre (RB122) como la paciente (RB123)
fueron diagnosticadas de retinoblastoma unilateral. El análisis de cuatro
marcadores genéticos próximos al gen del retinoblastoma permitió determinar
el alelo que segregaba con la enfermedad y en consecuencia, el que portaba la
mutación que predisponía a desarrollar el tumor en esta familia (recuadro). La
hermana menor de la paciente (RB124) heredó el alelo no mutado de la madre, y
por lo tanto no tiene riesgo de desarrollar retinoblastoma.
Retinoblastoma bilateral esporádico (sin historia familiar de la enfermedad)
Por definición, un retinoblastoma bilateral indica la presencia de una
mutación germinal. El estudio del ADN constitucional de pacientes con
retinoblastoma bilateral esporádico permite, en más del 75% de los casos,
identificar la mutación causante de la enfermedad (figura 4).
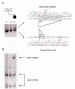
Figura 4. Estudio molecular en un retinoblastoma bilateral
esporádico. (A) Electroforesis del exón 8 del gen del retinoblastoma
amplificado mediante la reacción en cadena de la polimerasa (PCR) (padre,
carril 1; madre, carril 2; paciente, carril 3). Obsérvese que el paciente
presenta dos bandas, la mayor de las cuales corresponde al alelo mutado. El
aislamiento de estas bandas y su secuenciación posterior (derecha) permitió
caracterizar con exactitud la mutación, formada por una deleción de 5
nucleótidos y una inserción de 18. (B) Como consecuencia de la
mutación se destruyó la secuencia específica reconocida por una enzima de
restricción de ADN. Obsérvese que la enzima corta el alelo normal en dos
fragmentos (bandas inferiores), pero no el alelo mutado presente únicamente en
el paciente (banda superior). Ambos progenitores fueron portadores
exclusivamente de alelos normales, por lo que la probabilidad de tener otro hijo
con retinoblastoma era la misma que la incidencia de la enfermedad en la
población normal.
Estos estudios se realizan a partir de una muestra de sangre periférica del
paciente, utilizando un conjunto de técnicas más o menos complejas de
análisis de ADN (Southern-blot, polimorfismos en el tamaño de los
fragmentos de restricción o RFLP, reacción en cadena de la polimerasa o PCR,
secuenciación, etc.) con el fin de abarcar todas las formas diferentes de
mutaciones (8-15). El interés de estos estudios estriba en la caracterización
de la mutación y en la presencia o ausencia de esta en el ADN constitucional de
los progenitores, ya que se pueden dar casos de portadores asintomáticos
(retinoblastomas de baja penetrancia) (18-19). Sin embargo, la ausencia de la
mutación en el ADN de sangre periférica de los progenitores no permite
descartar totalmente la posibilidad de transmisión de la mutación a la
descendencia debido a la existencia de casos de mosaicismos (individuos en los
que la mutación, por ejemplo, no está presente en las células sanguíneas
pero si en las células germinales). En estos casos puede ser de interés el
estudio de una muestra de semen para determinar si la mutación está presente
en los espermatocitos (6).
Retinoblastoma unilateral esporádico
En ausencia de historia familiar de la enfermedad, sólo un 15% de los
retinoblastomas unilaterales son portadores de mutaciones en el ADN
constitucional. En estos casos, el análisis molecular debe ser realizado
inicialmente en una muestra congelada del tumor, para caracterizar las
mutaciones presentes en este, y posteriormente comprobar su presencia o ausencia
en el ADN de sangre periférica (20).
Si una de las mutaciones del tumor es identificada en el ADN constitucional,
entonces el retinoblastoma es hereditario. Como en el caso anterior, la
mutación puede también ser estudiada en los progenitores, y determinar si se
trata de una mutación de novo. Sin embargo, como consecuencia de una
mejoría sustancial en los métodos de detección y tratamiento, el número de
enucleaciones está disminuyendo progresivamente, haciendo cada vez mas difícil
la obtención de tejido tumoral para este tipo de estudios.
Conclusiones
La realización de los análisis genéticos en pacientes con retinoblastoma
hereditario presenta varias ventajas. Primero, al caracterizar las mutaciones
causantes de la enfermedad, es posible identificar que miembros de una familia
son portadores de la mutación y tienen riesgo de desarrollar el tumor. Así,
los niños no portadores de un gen mutado pueden librarse de los frecuentes e
incómodos exámenes oftalmológicos, mientras que puede incrementarse la
vigilancia en aquellos que son portadores, aumentando las probabilidades de
detección precoz y en consecuencia de conservar la visión (21). Segundo, la
estrategia molecular, no solo aporta resultados de valor clínico, sino que
también resulta menos costosa al seleccionar los pacientes de alto riesgo
susceptibles de monitorización convencional. En un trabajo reciente, el estudio
molecular resultó hasta cuatro veces menos costoso que los protocolos
convencionales al uso (22). Por último, el diagnóstico molecular es la base
imprescindible para llevar a cabo un consejo genético documentado, el cual
comienza a ser demandado por los padres, cada vez con mas insistencia.
En resumen, el diagnóstico molecular en pacientes con retinoblastoma
hereditario debe ser una parte integral de su tratamiento. Sin duda, su
incorporación a la práctica clínica debe incrementar la eficacia de los
tratamientos y la calidad de vida de los pacientes y sus familiares.
AGRADECIMIENTOS
Este trabajo ha sido financiado con ayudas del Fondo de Investigaciones
Sanitarias (FIS98/1349), Comunidad Autónoma de Madrid (081/0024/1998) y
Rhône-Poulenc-Rorer. Agradecemos también a P. Nebrada y a N. Gómez por la
asistencia técnica prestada.
Igualmente a la Dra. García de Miguel y al Dr. Abelairas del Hospital
Infantil La Paz por integrarnos dentro de la Unidad de Retinoblastomas de La
Paz.
BIBLIOGRAFÍA
- Knudson AG (1971). Mutation and cancer: statistical study of
retinoblastoma. Proc. Natl. Acad. Sci. USA. 68: 820-823.
- Friend S H, Bernards R, Rogel JS, Weinberg RA, Rapaport J M, Albert D M,
Dryja TP (1986). A human DNA segment with properties of the gene that
predisposes to retinoblastoma and osteosarcoma. Nature 323: 643-646.
- Weinberg RA (1995). The retinoblastoma protein and cell cycle control.
Cell, 81: 323-330
- Sellers W R, Kaelin WG (1997). Role of the retinoblastoma protein in the
pathogenesis of human cancer. J. Clin. Oncol. 15:3301-3312.
- Newsham IF, Hadjistilianou T, Cavenee WK (1998). Retinoblastoma. En: Mc
Graw-Hill (ed) The genetic basis of human cancer. B. Vogelstein, K.W. Kinzler,
New York, pp 363-392.
- Sippel KC, Fraioli RE, Smith GD, Schalkoff ME, Sutherland J, Gallie BL,
Dryja TD (1998). Frequency of somatic and germ-line mosaicism in retinoblastoma:
implications for genetic counseling. Am. J. Hum. Genet. 62: 610-619.
- Francke U, Kong F (1976). Sporadic bilateral retinoblastoma and the
13q-chromosome deletion. Med. Pediatr. Oncol. 2: 379-384.
- Kloss K, Währisch P, Greger V, Messmer E, Fritze H, Höpping W, Passarge
E, Horsthemke B (1991). Characterization of deletions at the retinobalstoma
locus in patients with bilateral retinoblastoma. Am. J. Med. Genet. 39:196-200.
- Blanquet V, Turleau C, Gross-Morand M S, Sénamaud-Beaufort C, Doz F,
Besmond C (1995). Spectrum of germline mutations in the RB1 gene: a study of 232
patients with hereditary and non hereditary retinoblastoma. Hum. Mol. Genet. 4:
383-388.
- Hogg A, Onadim Z, Baird P, Cowell JK (1992). Detection of heterozigous
mutations in the RB1 gene in retinoblastoma patients using single-strand
conformation polymorfism analysis and polymerase chain reaction sequencing.
Oncogene 7: 1445-1451.
- Lohmann D, Brandt B, Höpping W, Passarge E, Horsthemke B (1994).
Spectrum of small length germline mutations in the RB1 gene. Hum Mol Genet. 3:
5187-2193.
- Lohmann DR, Brandt B, Höpping W, Passarge E, Horsthemke B (1996). The
spectrum of RB1 germ-line in hereditary retinoblastoma. Am. J. Hum. Genet. 58:
940-949.
- Shimizu T, Toguchida J, Kato MV, Kaneko A, Ishizaki K, Sasaki MS (1994).
Detection of mutations of the RB1 gene in retinoblastoma patients by using
exon-by-exon PCR-SSCP analysis. Am. J. Hum. Genet. 54: 793-800.
- Lohmann D, Horsthemke B, Gillesen-Kaesbach G, Stefam FH, Höfler H
(1992). Detection of small RB1 gene detions in retinoblastoma by myltiplex and
high-resolution gel electrophoresis. Hum. Genet. 89: 49-53.
- Cowell JK, Smith T, Bia B (1994). Frequent constitutional C to T
mutations in CGA-arginine codons in the RB1 gene produce premature stop codons
in patients with bilateral (hereditary) retinoblastoma. Eur. J. Hum. Genet. 2:
281-290.
- Draper GJ, Sanders BM, Brownbill PA, Hawkings MM (1992). Patterns of risk
of hereditary retinoblastoma and applications to genetic counselling. Br. J.
Cancer. 66: 211-219.
- Greger V, Kerst S, Messmer E, Höpping W, Passarge E, Horsthemke B
(1988). Application of linkage analysis to genetic counselling in families with
hereditary retinoblastoma. J. Med. Genet. 25: 217-221.
- Lohmann DR, Brandt B, Höpping W, Passarge E, Horsthemke B (1994).
Distinct RB1 gene mutations with low penetrance in hereditary retinoblastoma.
Hum Genet. 94: 349-354.
- Schubert EL, Strong LC, Hansen MF (1997). A splicing mutation in RB1 in
low penetrance retinoblastoma. Hum. Genet. 100: 557-563.
- Lohmann DR, Gerick M, Brandt B, Oelschläger U, Lorenz B, Passarge E,
Horsthemke B (1997). Constitutional RB1-gene mutetions in patients with isolated
unilateral retinoblastoma. Am. J. Hum. Genet. 61: 282-294
- Yandell DW, Campbell TA, Dayton SH, Petersen R, Walton D, Little JB,
McConkie-Rossel A, Buckley EG, Dryja TP (1989). Oncogenic point mutations in the
human retinoblastoma gene: their application to genetic counseling. New Emgl. J.
Med. 321: 1689-1695.
- Noorani HZ, Khan HN, Gallie BL, Detsky AS (1996). Cost comparison of
molecular versus conventional screening of relatives at risk for retinoblastoma.
Am. J. Hum. Genet. 59: 301-307.
|