|
El retinoblastoma es una neoplasia de la infancia que es capaz de producir la
muerte del paciente. Tradicionalmente, el tratamiento del retinoblastoma ha
estado fundamentalmente en manos de los oftalmólogos y radioterapeutas casi de
forma exclusiva. En la mayoría de los casos el control de la enfermedad se
conseguía con la enucleación, y el intento de conservación del globo ocular
se realizaba con la administración de radioterapia. Si bien con ambos
procedimientos se consigue una supervivencia superior al 90%, las secuelas son
muy importantes y afectan de una forma substancial a la calidad de vida del
paciente. La enucleación es mal aceptada por la mayoría de los padres, e
implica la necesidad de implantar una prótesis ocular; se producen problemas
como deformaciones orbitarias, extrusión del implante y contracciones de la
órbita (1). La radioterapia externa, dada la juventud de los pacientes, produce
complicaciones severas en un número importante de casos, como son cataratas
(27%), retinopatía (25%), hemorragia vítrea (19%), deformaciones orbitarias
(11%) (1,2); además se incrementa considerablemente la posibilidad de
aparición de segundos tumores en la zona radiada, y en pocos casos se consigue
preservar la visión del ojo afecto.
La quimioterapia, arma fundamental en el control de la mayoría de las
neoplasias infantiles, en el caso del retinoblastoma era excluida del
tratamiento inicial del tumor, quedando reservada para el tratamiento de la
enfermedad extraocular regional o con metástasis a distancia. Se ensayaron
varios agentes que son capaces de producir una respuesta favorable en un
porcentaje significativo de pacientes, como la ciclofosfamida, con una tasa de
respuesta del 47%, ó la doxorrubicina, con el 33%. Las combinaciones de drogas
son aún más eficaces, demostrándose la asociación de etopósido y
carboplatino como la más efectiva, consiguiendo hasta un 85% de respuestas en
niños con enfermedad extraocular (3).
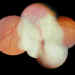
Figura 1. Retinoblastoma susceptible de quimiorreducción.
En el retinoblastoma intraocular el papel de la quimioterapia se encuentra,
en principio, limitado, porque la penetración de las drogas administradas vía
sistémica en los tejidos intraoculares es pobre. Además las células tumorales
expresan con frecuencia en su membrana la p-glicoproteína p170, lo cual les
confiere una especial resistencia a muchos de los agentes antineoplásicos (4).
A pesar de todo, la necesidad de encontrar opciones terapeúticas que
permitan conservar el globo ocular y la mayor cantidad de visión posible ha
llevado a reconsiderar la utilidad de la quimioterapia sistémica. De hecho se
ha comprobado que sí es capaz de inducir una regresión tumoral. Greenwald
administró quimioterapia como tratamiento inicial en 6 pacientes con 11 ojos
afectos. La asociación de Carboplatino y Etopósido consiguió en todos los
tumores de diámetro mayor de 10 mm una llamativa regresión, con reducciones
importantes en el tamaño de los tumores, calcificación de los focos tumorales,
e incluso disminución significativa de las siembras vítreas. Se consiguió
evitar la enucleación en 8 de 11 ojos afectos, y 6 ojos conservaron una buena
visión (5). Los patrones de regresión observados con la quimioterapia se
confirman con el examen histopatológico del tejido tumoral en ojos enucleados
tras recibir quimioterapia, llegando en algunos casos a observarse una necrosis
total del tumor (6).
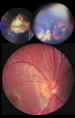
Figura 2. Diversos grados de cicatrización tras quimioterapia y
técnicas de consolidación.
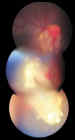
Figura 3. Cicatrización grado 3 en un retinoblastoma tratado con
quimioterapia.
La quimioterapia adquiere así una nueva dimensión como tratamiento
neoadyuvante en el retinoblastoma, permitiendo la reducción de focos tumorales
de tamaño grande o mediano imposibles de controlar con técnicas tales como
láser o crioterapia. La finalidad es pues reducir los focos de tumor
intraocular y de esta manera evitar la enucleación, preservar la visión y
retrasar o evitar el uso de radioterapia con fuente externa. En numerosos
centros se ha comenzado a aplicar diferentes combinaciones de citostáticos en
los tumores grandes antes de considerar la enucleación. En la mayoría de
protocolos se administran ciclos de quimioterapia que incluyen la asociación de
Carboplatino, Etopósido y Vincristina en diferentes pautas de administración
(7,-11), seguidos de tratamientos locales como crioterapia, termoterapia, placas
de radioterapia, etc, para «consolidar» la tumoración consiguiendo preservar
muchos globos oculares que de otra forma hubieran debido ser enu cleados.
El número de ciclos administrados también parece tener importancia en el
grado de respuesta del tumor (12), observando mayor regresión tumoral cuando se
administran más de dos ciclos. Pero de todas formas no todos los tumores
responden igual. La evidencia de la expresión de la P-glicoproteína en las
células tumorales del retinoblastoma puede explicar la «resistencia» del
tumor a los citostáticos, ya que actúa como una bomba de flujo impidiendo la
entrada de las drogas al interior de las células. Con el fin de revertir la
acción de la P-glicoproteína se está ensayando la adicción de ciclosporina a
la administración de los quimioterápicos, en un intento de inhibir la función
excretora de la P-glicoproteína, y los resultados son alentadores (4,14).
Desde enero de 1996 a mayo de 1999, en el Hospital Infantil «La Paz» hemos
tratado un total de 31 pacientes con quimioterapia como terapéutica
neoadyuvante. El tratamiento consistió en la asociación de Carboplatino 500
mg/m2 IV en 1 hora y Etopósido 150 mg/m2 IV en 2 horas en el mismo día. Se
administraron cada 3 semanas. Desde los 3 últimos meses, se asoció
ciclosporina a una dosis de 33 mg/kg IV en 3 horas previamente a la infusión de
los citostáticos. Como antiemético, se empleó Granisetrón vía IV, una dosis
antes de la quimioterapia y otra al finalizar la misma. En los pacientes de peso
inferior a los 10 kg, el cálculo de la dosis de citostáticos se realizó de
acuerdo al peso en vez de la superficie corporal. El número de ciclos a
administrar varió según la respuesta observada.
En los 31 pacientes se administraron un total de 172 ciclos, 162 con
Carboplatino y Etopósido, y 10 asociando ciclosporina. En ningún paciente se
registraron efectos adversos durante la infusión de las drogas. Como efecto
secundario a medio plazo se observó toxicidad hematológica en 14 pacientes
(45%), los cuales habían recibido en total 88 ciclos de quimioterapia. En 21
ocasiones dicha toxicidad sólo alcanzó los grados 1 ó 2 (según escala de la
OMS); tras 8 ciclos fue de grado 3 y únicamente en 3 ocasiones se alcanzó el
grado 4. Hay que destacar que la mayor toxicidad se acumuló en 3 pacientes,
todos menores de 6 meses, que precisaron tratamiento de soporte con
administración de G-CSF y Eritropoyetina, y uno de ellos requirió, en una
ocasión, una transfusión de concentrado de hematíes. No se registró ningún
proceso infeccioso severo, ni otro tipo de toxicidad. En definitiva, se trata de
una quimioterapia de fácil administración con carácter ambulatorio, con buena
tolerancia y con leves-moderados efectos secundarios.
Parece pues, que el tratamiento combinado de quimioterapia con técnicas como
termoterapia, crioterapia, fotocoagulación, o placas de radiación ofrece una
alternativa a las terapéuticas convencionales de enucleación y radioterapia
externa, aunque no por ello hay que prescindir de ellas, pues se mantienen sus
indicaciones en determinados casos (15). Quedan aún muchas incógnitas por
resolver, como la preocupación por los posibles efectos del Etopósido en la
generación de segundas neoplasias, tal como se ha observado en otro tipo de
tumores (16). De momento no se han comunicado casos de segunda neoplasia en
niños con retinoblastoma que hayan recibido etopósido.
BIBLIOGRAFÍA
- Anteby I, Ramu N, Gradstein L, Miskin H, Peter J, Benezra D. Ocular and
orbital complications following the treatment of retinoblastoma. Eur J
Ophthalmol 1998; 8: 106-11.
- Pradhan DG, Sandridge AL, Mullaney P, Abboud E, Karcioglu ZA, Kandil A.
Radiation therapy for retinoblastoma: a retrospective review of 120 patients.
Int J Radiat Oncol Biol Phys 1997; 39: 3-13.
- Doz F, Neuenschwander S, Plantaz D, Courbon B, Gentet JC, Bouffet E.
Etoposide and carboplatin in extraocular retinoblastoma: a study by the Societe
Francaise d´Oncologie Pediatrique. J Clin Oncol 1995; 4: 902-9.
- Chan HS, Lu Y, Grogan TM, Haddad G, Hipfner DR, Cole SP, Deeley RG.
Multidrug resistance protein (MRP) expression in retinoblastoma correlates with
the rare failure of chemotherapy despite cyclosporine for reversal of
P-glycoprotein. Cancer Res 1997; 57: 2325-30.
- Greenwald MJ, Strauss LC. Treatment of intraocular retinoblastoma with
carboplatin and etoposide chemotherapy. Ophthalmology 1996; 103: 1989-97.
- Bechrakis NE, Bornfeld N, Schueler A, Coupland SE, Henze G, Foerster MH.
Clinicopathologic features of retinoblastoma after primary chemoreduction. Arch
Ophthalmol 1998; 116: 887-93.
- Kingston JE, Hungerford JL, Madreperla SA, Plowman PN. Results of combined
chemotherapy and radiotherapy for advanced intraocular retinoblastoma. Arch
Ophthalmol 1996; 114: 1339-43.
- Levy C, Doz F, Quintana E, Pacquement H, Michon J, Schlienger P. Role of
chemotherapy alone or in combination with hyperthermia in the primary treatment
of intraocular retinoblastoma: preliminary results. Br J Ophthalmol, 1998;
82:1154-8.
- Murphree AL, Villablanca JG, Deegan WF III, Sato JK, Malogolowkin M,
Fisher A. Chemotherapy plus local treatment in the management of intraocular
retinoblastoma. Arch Ophthalmol 1996; 114: 1348-56.
- Shields CL, De Potter P, Himelstein BP, Shields JA, Meadows AT, Maris JM.
Chemoreduction in the initial management of intraocular retinoblastoma. Arch
Ophthalmol 1996; 114: 1330-8.
- Shields CL, Shields JA, Needle M, de Potter P, Kheterpal S, Hamada A:
Combined chemoreduction and adjuvant treatment for intraocular retinoblastoma
Ophthalmology 1997; 104: 2101-11.
- Gunduz K, Shields CL, Shields JA, Meadows AT, Gross N, Cater J. The
outcome of chemoreduction treatment in patients with Reese-Ellsworth group V
retinoblastoma. Arch Ophthalmol 1998;116: 1613-7.
- Chan HSL, DeBoer G, Thiessen JJ, Budning A, Kingston JE, O’Brien JM.
Combining cyclosporin with chemotherapy controls intraocular retinoblastoma
without requiring radiation. Clin Cancer Res 1996; 2: 1499-508.
- Gallie BL, Budning A, DeBoer G, Thiessen JJ, Koren G, Verjee Z.
Chemotherapy with focal therapy can cure intraocular retinoblastoma without
radiotherapy. Arch Ophthalmol 1996; 114: 1321-8.
- Shields CL, Shields JA. Recent developments in the management of
retinoblastoma. J Pediatr Ophthalmol Strabismus 1999; 36: 8-18.
- Pui CH, Ribeiro RC, Hancock ML. Acute myeloid leukemia in children
treated with epipodophyllotoxins for acute lymphoblastic leukemia. N Engl J Med
1991; 325: 1682-7.
|