|
Hasta hace poco, siguiendo los postulados de Verhoeff (1,2), el tratamiento
habitual del retinoblastoma consistía en la enucleación del ojo afecto en los
casos unilaterales o bien la enucleación del ojo con el tumor más avanzado y
radioterapia de fuente externa del ojo menos afectado en los casos bilaterales;
con estas técnicas se consiguen supervivencias superiores al 90% (3). La
quimioterapia tenía un papel secundario en el tratamiento del retinoblastoma, a
diferencia de otras neoplasias infantiles, reservándose para la invasión
extraocular regional o las metástasis a distancia (4-6).
En la pasada década, tomando como ejemplo el uso de la quimioterapia en
ciertos tumores pediátricos del sistema nervioso central, se comienza a
especular con el uso de la quimioterapia en retinoblastomas con el fin de
aumentar la eficacia de otros tratamientos locales (7). Se inicia así una nueva
perspectiva terapéutica en el manejo del retinoblastoma intraocular, que
pretende evitar la enucleación y radioterapia de fuente externa mediante el
empleo de quimioterapia sistémica o periocular como tratamiento primario del
retinoblastoma con el fin de reducir su tamaño y conseguir su control final con
métodos locales conservadores como la fotocoagulación con láser, crioterapia,
termoterapia o braquiterapia (8-13). Este nuevo enfoque terapéutico se
conoce como Quimiorreducción y su objetivo es la conservación del globo ocular
y de una agudeza visual útil, evitando en lo posible complicaciones asociadas a
la radioterapia externa tales como catarata, ojo seco, retinopatía por
radiación, alteraciones del desarrollo óseo orbitario (14) y riesgo de
neoplasias secundarias en el campo de irradiación (15), especialmente en niños
menores de 12 meses (16).
En 1995, Greenwald y Strauss presentan en Atlanta (AAO, póster 239) sus
primeros resultados en el tratamiento del retinoblastoma intraocular con una
combinación de carboplatino y etopósido (11). Esta asociación de fármacos ya
se había demostrado efectiva para la enfermedad extraocular, consiguiendo un
85% de respuestas (6). En enero de 1996 comenzamos a utilizar esta pauta en el
Servicio de Oftalmología Infantil del Hospital La Paz: carboplatino (500 mg/m2
viv en 1 hora) y etopósido (150 mg/m2 viv en 2 horas), administrados en 6
ciclos (en el mismo día) a intervalos de 3 semanas. En la mayoría de centros
se utilizan distintas combinaciones de carboplatino, etopósido y vincristina.
La expresión de una P-glicoproteína en la membrana de las células tumorales
confiere a éstas resistencia a diversos citostáticos (17,18), lo que ha
llevado a asociar ciclosporina A en algunos protocolos para inhibir esta
P-glicoproteína (8,19).
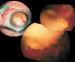
Figura 1. Quimiorreducción con enorme calcificación del
retinoblastoma.
No se registraron efectos adversos importantes durante la infusión de los
fármacos, siendo la toxicidad hematológica el efecto adverso más frecuente a
medio plazo (20); en ningún caso obligaron a suspender el tratamiento.
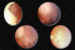
Figura 2. Quimiorreducción en el tumor peripapilar y aparición de
nuevos focos de retinoblastoma.
Quimiorreducción en Retinoblastomas. Hospital INFANTIL «La Paz»
El período de estudio de este artículo abarca desde enero de 1996 a mayo de
2000, siendo de inclusión en él los pacientes con retinoblastoma
diagnosticados entre enero de 1996 y mayo de 1999 (ambos inclusive). En este
período hemos tratado a 32 pacientes; en 6 de ellos fue preciso añadir más
ciclos de quimioterapia y en 12 pacientes se asoció ciclosporina (33 mg/Kg en 3
horas). En 3 casos se asociaron otros fármacos.
La forma de presentación es unilateral en 15 pacientes y bilateral en 17 (3
de estos ojos se enuclearon de forma previa a la quimioterapia). En 5 pacientes
hay antecedentes familiares; en los 27 restantes la presentación es
esporádica.
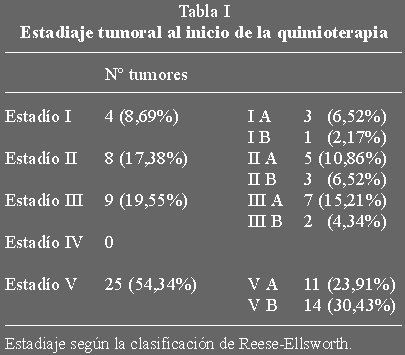
En total se han tratado 46 ojos, con un total de 80 tumores al momento del
diagnóstico. La distribución de los ojos según el estadiaje de
Reese-Ellsworth aparece en la tabla I. En 24 ojos (52,17%) se asocia
desprendimiento de retina al inicio del tratamiento; en 10 ojos (21,73%) se
asocia una siembra subretiniana extensa.
El tiempo de seguimiento oscila de 13 a 52 meses (tiempo medio: 30,6 meses) y
la edad de diagnóstico entre 1,5 y 92 meses (edad media: 17,6 meses). La edad
media de diagnóstico en los casos unilaterales es de 25,7 meses, siendo de 10,4
meses en los bilaterales.
La quimioterapia fue el tratamiento inicial en 42 ojos, en los 4 restantes el
tratamiento inicial fue radioterapia externa en 1 ojo (3 tumores), crioterapia
en 2 ojos (8 tumores) y radioterapia externa asociada a crioterapia en 1 ojo (2
tumores).
Son criterios excluyentes para iniciar la quimiorreducción la presencia de
neovasos iridianos, glaucoma neovascular y la invasión tumoral de cámara
anterior, iris, cuerpo ciliar, nervio óptico, coroides o tejidos extraoculares.
Con cada ciclo de quimioterapia se analiza la respuesta tumoral, grado de
calcificación, patrón de regresión, evolución del desprendimiento de retina
asociado (si estuviera presente) y aparición o no de nuevos tumores. Según la
respuesta tumoral se aplican los distintos tratamientos focales o bien
radioterapia externa; cuando estas medidas no consiguen la erradicación tumoral
se procede a la enucleación.
En todos los ojos tratados excepto en uno se observa una reducción inicial
del tamaño tumoral tras la quimioterapia; en este ojo (estadio Va con
desprendimiento de retina) apareció crecimiento tumoral tras el primer ciclo de
quimioterapia, con celulitis palpebral asociada. Otros 5 ojos presentaron una
reducción inicial del tamaño tumoral, con crecimiento posterior que requirió
su enucleación. Así pues, en 6 ojos (13,04%) no se obtuvo respuesta a la
quimioterapia; todos ellos eran estadio V de la clasificación de
Reese-Ellsworth (3 Va y 3 Vb).
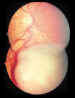
Figura 3. Retinoblastoma endofítico con gran congestión vascular
que remarca la tumoración.
En 10 ojos (21,74%) aparecen múltiples recidivas retinianas y/o siembra
vítrea tras la quimioterapia que obligan a su enucleación; en 2 casos estas
recidivas son secundarias a desprendimiento de retina post-crioterapia (uno de
ellos regmatógeno) y en otro caso aparece un desprendimiento exudativo con
siembras múltiples tras radioterapia externa. Las recidivas en el borde son
esperables y no se consideran fracaso del tratamiento (9); sólo han hecho
modificar el tratamiento en un ojo (estadio Vb con desprendimiento de retina y
siembra subretiniana) que tuvo que enuclearse por recidiva en el borde de un
tumor macular y con radioterapia externa previa cuando aún no disponíamos de
termoterapia. Las tres enucleaciones restantes corresponden a un estadio Vb con
hemovítreo que impedía su control oftalmoscópico y dudosa disminución
tumoral por ecografía, un estadio Va con catarata total (post-radioterapia
externa) y persistencia de DR y un estadio Va con persistencia de DR y realce de
contraste en la RMN.
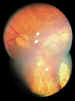
Figura 4. Regresión de retinoblastoma tras quimioterapia y
técnicas de consolidación.
En el resto de pacientes y tumores se observó disminución del tamaño
tumoral tras la quimioterapia y tratamientos de consolidación asociados. Todos
los tumores han presentado cierto grado de calcificación, así como la siembra
vítrea o subretiniana asociadas; no obstante, la presencia de calcificación
inicial no predice la respuesta posterior del tumor.

Figura 5. Aplicación de la termoterapia láser diodo transpupilar
sobre la masa tumoral cubriendo toda su extensión.

Figura 6. Placas de rutenio 106 empleadas en la consolidación tras
quimiorreducción de los retinoblastomas.
En cuanto al desprendimiento de retina asociado, observamos su resolución
total en 11 casos (45,83%) y parcial en 2 ojos (8,33%); en los 11 ojos restantes
el desprendimiento de retina persistió y fueron enucleados (5 por incremento de
la masa tumoral inicial, 3 por recidivas múltiples y los 3 restantes por
imposibilidad de un control oftalmoscópico adecuado). La siembra subretiniana,
presente en 10 ojos, se calcificó totalmente e inactivó en 8 (2 de ellos se
enuclearon por persistencia del desprendimiento de retina asociado); en otros 2
no se inactivó y se enuclearon por recurrencia masiva y no regresión.
El objetivo inicial de controlar el retinoblastoma con medidas locales,
evitando la enucleación o radiación orbitaria se ha conseguido en 18 (39,13%)
de los ojos tratados. Un total de 28 ojos (60,87%) no se han controlado sólo
con quimioterapia y tratamientos focales y han precisado radioterapia externa o
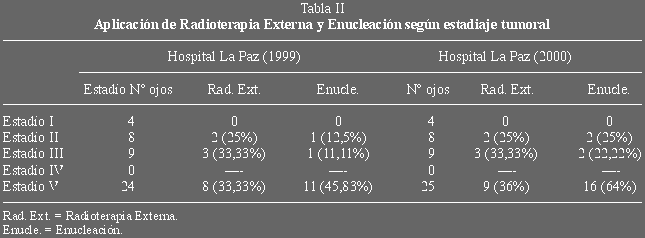
enucleación. En la tabla II aparece la aplicación de radioterapia externa y
enucleación según el estadiaje tumoral (Clasificación de Reese-Ellsworth). La
enucleación se ha evitado en el 56,53% de ojos, siendo necesaria en 20 ojos
(43,47%); en la tabla III se muestra el porcentaje de éxito alcanzado según el
estadiaje tumoral. Los peores resultados se obtienen en el estadio V (que supone
el 54,34% de nuestros casos), con un 72,72% de enucleaciones en el estadío Va y
un 57,14% en el estadio Vb. De todos modos pensamos que la clasificación de
Reese-Ellsworth, creada para valorar el pronóstico tras la radioterapia
externa, es poco práctica para valorar la respuesta a la quimiorreducción y
sería más útil una clasificación atendiendo al tamaño tumoral (21).

La comparación de los datos actuales con los presentados hace 1 año (22)
puede llevarnos a aceptar con reserva esta nueva opción en el manejo del
retinoblastoma. Sin embargo, debemos considerar que permite la conservación del
globo ocular y de una agudeza visual útil en numerosos casos en los que la
única opción anteriormente eran la enucleación o radioterapia de fuente
externa (especialmente los casos Vb), asociándose a un menor número de
complicaciones de las que aparecen tras la radioterapia externa (especialmente
en niños menores de 12 meses) (16). Por otro lado debemos recordar la posible
recurrencia tumoral meses después de finalizar la quimioterapia o bien durante
la misma, por lo que debemos asociar tratamientos de consolidación y mantener
controles periódicos. Estudios posteriores deben servirnos para definir mejor
los casos más idóneos para quimiorreducción.
BIBLIOGRAFÍA
- Verhoeff FH. Glioma retinae treated by x-rays with apparent destruction of
the tumor and preservation of vision. Arch Ophthalmol 1921; 50: 450-456.
- Verhoeff FH. Retinoblastoma successfully treated with x-rays: normal
vision retained after thirty-four years. Second report on a case. Arch
Ophthalmol 1952; 48: 720-722.
- Shields JA, Shields CL. Intraocular Tumors: A Text and Atlas.
Philadelphia: WB Saunders Co; 1992: 305-391.
- Pratt CB, Crom DB, Howarth C. The use of chemotherapy for extraocular
retinoblastoma. Med Pediatr Oncol 1985; 13: 330-333.
- Doz F, Khelfaoui F, Mosseri V et al. The role of chemotherapy in orbital
involvement of retinoblastoma: the experience of a single institution with 33
patients. Cancer 1994; 74: 722-732.
- Doz F, Neusenschwander S, Plantaz D et al. Etoposide and carboplatin in
extraocular retinoblastoma: a study by the Societé Francaise d´Oncologie
Pediatrique. J Clin Oncol 1995; 13: 902-909.
- White L. Chemotherapy in retinoblastoma: current status and future
directions. Am J Pediatr Hematol Oncol 1991; 13: 189-201.
- Gallie BL, Budning A, DeBoer G et al. Chemotherapy with focal therapy can
cure intraocular retinoblastoma without radiotherapy. Arch Ophthalmol 1996; 114:
1.321-1.328.
- Murphree AL, Villablanca JG, Deegan WF III et al. Chemotherapy plus local
therapy in the treatment of intraocular retinoblastoma. Arch Ophthalmol 1996;
114: 1.348-1.356.
- Shields CL, De Potter P, Himelstein BP et al. Chemoreduction in the
initial management of intraocular retinoblastoma. Arch Ophthalmol 1996; 114:
1.330-1.338.
- Greenwald MJ, Strauss LC. Treatment of intraocular retinoblastoma with
carboplatin and etoposide chemotherapy. Ophthalmology 1996; 103: 1.989-1.997.
- Kingston JE, Hungerford JL, Madreperla SA, Plowman PN. Results of
combined chemotherapy and radiotherapy for advanced intraocular retinoblastoma.
Arch Ophthalmol 1996; 114: 1.339-1.343.
- Shields CL, Shields JA, Needle M, et al. Combined chemoreduction and
adjuvant treatment for intraocular retinoblastoma. Ophthalmology 1997; 104:
2.101-2.111.
- Imhof SM, Mourits MP, Hofman P, et al. Quantification of orbital and
midfacial growth retardation after megavoltage external beam irradiation in
children with retinoblastoma. Ophthalmology 1996; 103: 263-268.
- Eng C, Lin FP, Abramson DH, et al. Mortality from second tumors among
long-terms survivors of retinoblastoma. J Natl Cancer Inst 1993; 85:
1.121-1.128.
- Abramson DH, Frank CM. Second nonocular tumors in survivors of bilateral
retinoblastoma; a possible age effect on radiation-related risk. Ophthalmology
1998; 105: 573-580.
- Chan HS, Thorner PS, Haddad G, Gallie BL. Multidrug-resistant phenotype
in retinoblastoma correlates with P-glycoprotein expression. Ophthalmology 1991;
98: 1.425-1.431.
- Chan HS, Lu Y, Grogan TM, Haddad G, Hipfner DR, Cole SP, Deeley RG.
Multidrug resistance protein (MRP) expression in retinoblastoma correlates with
the rare failure of chemotherapy despite cyclosporine for reversal of
P-glycoprotein. Cancer Res 1997; 57: 2.325-2.330.
- Chan HS, DeBoer G, Thiessen JJ, et al. Combining cyclosporin with
chemotherapy controls intraocular retinoblastoma without requiring radiation.
Clin Cancer Res 1996; 2(9): 1.499-1.508.
- Sastre A, García de Miguel P. Papel de la Quimioterapia en el
Tratamiento del Retinoblastoma. En: Actualización en Tumores Intraoculares.
Mesa Redonda Oficial del 75 Congreso de la S.E.O. Tecnimedia Editorial S.L.
Madrid, 1999; 193-196.
- Abelairas Gómez JM, Peralta Calvo J, De las Heras Martín A, Sánchez
Orgaz M. Manejo actual del Retinoblastoma. En: Actualización en tumores
intraoculares. Mesa Redonda Oficial del 75 Congreso de la S.E.O. Tecnimedia
Editorial S.L. Madrid, 1999; 187-192.
- De las Heras Martín, A, Gayá Moreno F, Boto de los Bueis A, Abelairas
Gómez JM. Quimiorreducción en el Retinoblastoma. En: Actualización en tumores
intraoculares. Mesa Redonda Oficial del 75 Congreso de la S.E.O. Tecnimedia
Editorial S.L. Madrid, 1999; 197-202.
|